恒河猴超声乳化角膜内皮失代偿动物模型的活体共聚焦显微镜观察
2016-03-23胡竹林孙晓梅代解杰
吴 敏,胡竹林,孙晓梅,代解杰
1 昆明医科大学第四附属医院眼科,昆明 650021 2中国医学科学院 北京协和医学院 医学生物学研究所树鼩种属资源中心,昆明 650118
·论著·
恒河猴超声乳化角膜内皮失代偿动物模型的活体共聚焦显微镜观察
吴敏1,胡竹林1,孙晓梅2,代解杰2
1昆明医科大学第四附属医院眼科,昆明 6500212中国医学科学院北京协和医学院医学生物学研究所树鼩种属资源中心,昆明 650118
摘要:目的观察恒河猴超声乳化角膜内皮失代偿动物模型在共聚焦显微镜下的角膜特征性变化。方法健康恒河猴4只,以右眼为实验组,通过超声乳化能量破坏角膜中央直径7~9 mm处内表面制作角膜内皮失代偿模型;以左眼为空白对照组。于术前,术后1、2、3、4周应用裂隙灯显微镜和活体共聚焦显微镜观察角膜各层结构变化。采用SPSS 19.0统计软件进行数据分析,基底层下神经丛数量、内皮细胞密度的比较采用配对t检验,角膜厚度采用重复测量方差分析。结果在超声乳化损伤角膜内皮后,角膜改变逐渐出现在内皮层、基质层、前弹力层和基底上皮层。早期主要改变是角膜内皮细胞间隙增宽、细胞轻度水肿,基质层出现活化的基质细胞和细胞形态改变,基质厚度增加;术后2周开始出现前弹力层上皮状神经纤维减少,同时伴有基质层和内皮水肿加重;术后3周基底上皮细胞间隙增宽,少量朗汉细胞浸润,基质层和内皮水肿加重;术后4周基底上皮层大量朗汉细胞浸润,前弹力层仅见少量上皮状神经纤维,基质层大量活化的基质细胞,内皮层严重水肿。术后2周实验组基底膜下神经丛数量(t=6.9192,P=0.002)和内皮细胞密度(t=7.8936,P<0.0001)明显低于对照组。实验组术后1(t=28.31,P<0.0001)、2(t=63.56,P<0.0001)、3(t=123.22,P<0.0001)、4周(t=180.80,P<0.0001)的角膜厚度明显高于对照组。结论活体共聚焦显微镜可清晰显示超声乳化后恒河猴角膜的变化,主要特征是逐渐加重的内皮细胞间隙增宽、基质细胞活化、朗汉细胞增多和基底上皮层下神经丛减少。
关键词:恒河猴;角膜内皮失代偿;活体共聚焦显微镜;动物模型
ActaAcadMedSin,2016,38(1):42-48
由于炎症、外伤、机械性损伤、遗传等因素引起的角膜内皮功能失代偿是致盲性眼病,也是临床上的难题,随着超声乳化手术的广泛开展后,由超声乳化手术引发的角膜内皮功能失代偿病例不断增多。角膜内皮功能失代偿动物模型的建立可模拟人类角膜内皮功能障碍的病理状态,有助于开展角膜内皮细胞方面的研究。常用的角膜内皮功能失代偿模型建立方法包括冷冻法、化学物质损伤法、角膜内皮撕除等,实验动物包括兔、猫和鼠,兔的角膜内皮有一定的再生能力,模型建立较短时间后就会出现内皮修复过程;猫和鼠等动物角膜内皮细胞与人类差异较大。恒河猴是与人类在生物遗传学上具有高度相似性的灵长类动物,本研究拟采用超声乳化损伤法建立恒河猴角膜内皮功能失代偿的动物模型,模拟人眼超声乳化手术后角膜内皮损伤的过程,并在活体共聚焦显微镜(invivoconfocal microscopy,IVCM)下观察角膜各层组织的变化情况,以期为开展角膜内皮功能失代偿相关研究提供帮助。
材料和方法
实验动物及模型建立健康恒河猴4只,雌雄各半,平均年龄(46.2±12.5)周(36~60周),平均体质量(4.6±0.5)kg,由中国医学科学院医学生物学研究所提供[实验动物生产许可证号:SCXK(滇)2010- 0006]。检查排除眼部疾病,20 mg/kg氯胺酮肌肉注射麻醉后,将恒河猴固定于手术台上,盐酸奥布卡因滴眼液表面麻醉,消毒铺巾后开睑器开睑,聚维酮碘冲洗术眼(右眼),沿11点角膜缘穿刺前房,将超声乳化(Universe Ⅱ超声乳化仪,美国ALCON公司)头斜面朝向中央7~9 mm范围角膜内表面,距离0.1~0.2 mm不断摆动超声乳化头,持续释放超声能量5 min。参数设置:负压150 mmHg(1 mmHg=0.133 kPa)、流量25 ml·min-1、能量80%。累计释放能量(cumulative dissipated energy,CDE;CDE=超声能量%×超声时间)为4 s,前房灌注时间为5 min,灌注液为无糖型复方Linger平衡盐水,灌注液的消耗量为125 ml。水密切口,注入消毒空气形成前房,妥布霉素地塞米松眼膏涂眼。从做切口开始到切口封闭计算,平均手术耗时(11.3±1.4)min。术后妥布霉素地塞米松滴眼液点眼。以所有实验动物的右眼为实验组;左眼为空白对照组,不实施任何干预。
裂隙灯显微镜和IVCM观察在制作动物模型前1 d,造模后1、2、3、4周分别进行检查。肌肉注射氯胺酮麻醉恒河猴后,盐酸奥布卡因滴眼液滴眼,开睑器开睑,滴用Vidisic眼用凝胶。进行裂隙灯显微镜观察及拍照,并根据以下标准对角膜混浊程度进行评分:(1)0分:完全透明;(2)1分:部分混浊,尤其在角膜的中央区;(3)2分:轻度云雾状混浊,可以看清虹膜血管和瞳孔;(4)3分:混浊严重,大部分虹膜血管不能分辨;(5)4分:混浊进一步严重,仅能模糊看到瞳孔边缘;(6)5分:严重混浊,虹膜和瞳孔完全看不到。
采用德国海德堡视网膜激光断层扫描系统Ⅱ代(Heldelberg Retina Tomograph Ⅱ,HRT-Ⅱ)对恒河猴进行IVCM检查,将恒河猴下颌置于下颌托架上,调整操纵台高度和CCD摄像头位置,盖上一次性无菌角膜接触帽。参数设置:激光光源波长670 nm,视野为400 μm×400 μm,分辨率为1 μm,放大倍数为800,图像采集模式为自动获得模式。将显微镜调整聚焦于中央角膜区,从表层上皮细胞逐层扫描到内皮细胞层,观察角膜各层细胞的数量和形态,每一层次各采集图片,用于图像分析。角膜厚度计算是角膜中央从接触帽到内皮细胞层之间的距离。所有检查均由同一名技师完成。分析角膜基底层下神经数量,对图像采集部位进行匹配,选取5幅清晰图像分析,以每幅图像中可见的神经数量支数计算平均值;利用HRT-Ⅱ/RCM软件分析系统,计算角膜内皮细胞密度。
统计学处理采用SPSS 19.0统计软件,计量资料以均数±标准差表示,基底层下神经丛数量和内皮细胞密度组间比较采用配对t检验,角膜厚度的不同时间点比较用重复测量方差分析,P<0.05为差异有统计学意义。
结果
裂隙灯显微镜观察结果实验组术后角膜水肿程度不断加重(图1),术后4周角膜混浊程度评分均达到5分(表1)。超声乳化手术结束时,恒河猴角膜中央轻度水肿,之后角膜水肿和混浊进行性加重,术后4周时实验组中1眼可见手术切口处见少量新生血管和角膜混浊,其余3眼角膜周边透明,中央明显混浊水肿。

表 1 实验组角膜混浊程度评分情况(n)
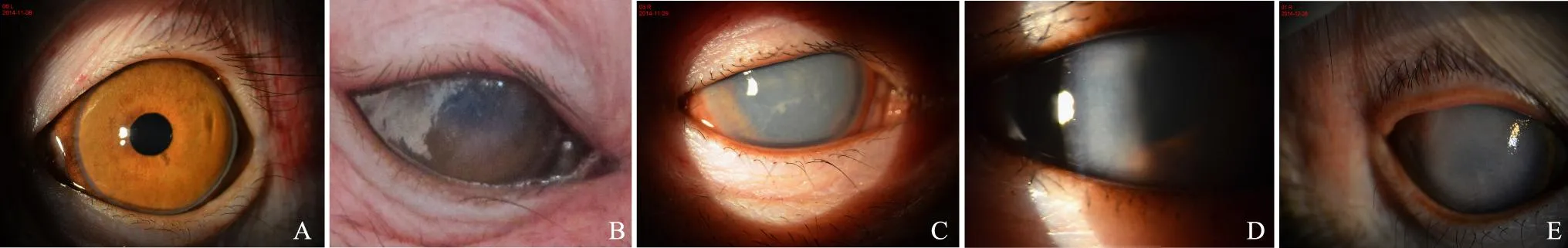
A.正常角膜;B.术后1周;C.术后2周;D. 术后3周;E.术后4周
A. normal cornea;B.1 week after surgery; C.2 weeks after surgery;D. 3 weeks after surgery; E.4 weeks after surgery
图1裂隙灯检查
Fig1Slit-lamp examination in the modeling group
IVCM观察结果
对照组IVCM观察结果:(1)角膜表层上皮细胞边界清晰,呈现以六边形为主的多角形,可见细胞核(图2A);(2)Bowman膜看不到形态和结构,基底上皮层下可见排列规则、走形平行的神经纤维(图2B);(3)基质层可见发亮的细胞核,核呈现出纺锤状、椭圆形等形态,胞浆和细胞边缘看不清(图2C);(4)内皮细胞层由六边形排列整齐、形态规则的细胞构成,看不到细胞核(图2D)。
实验组IVCM结果:(1)表层上皮:超声乳化法造模后直到术后4周,表层上皮层没有明显变化。(2)基底上皮层:基底上皮细胞层术后1、2周表现与对照组相似;术后3周开始出现上皮细胞间隙增宽,少量朗汉细胞浸润(图3A);术后4周见大量朗汉细胞浸润(图3B)。(3)基底层下神经丛:术后1周正常;术后2周基底层下神经丛数量减少、变细、连续性差(图4A);术后3周神经丛数量进一步减少;术后4周神经丛数量显著减少,可见大量分化的树突细胞(图4B)。(4)基质层:术后1周,深基质层开始出现少量处于激活状态的基质细胞,细胞形态改变(图5A);术后2周,浅基质层少量处于激活状态的基质细胞,深基质层活化的基质细胞数量增多(图5B);术后3周,活化的基质细胞增多(图5C);术后4周,深浅基质层均可见大量处于激活状态的基质细胞,细胞胞浆反光增强,细胞核减少,细胞结构模糊,排列紊乱(图5D)。(5)内皮层:术后1周,内皮细胞层出现内皮细胞间隙扩大,细胞轻度水肿;术后2、3、4周,内皮细胞水肿不断加重(图6)。
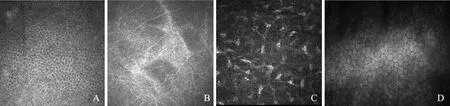
A.上皮细胞层;B.基底上皮层;C.基质层;D.内皮细胞层
A. epithelial layer;B. basal epithelial layer;C. stromal layer;D. endothelial cell layer
图2对照组活体共聚焦显微镜观测结果(×800)
Fig2Results ofinvivoconfocal microscopy in control group(×800)

A.术后3周;B.术后4周
A.3 weeks after surgery;B. 4 weeks after surgery
图3基底上皮层改变(×800)
Fig3Changes in basal epithelial layer(×800)
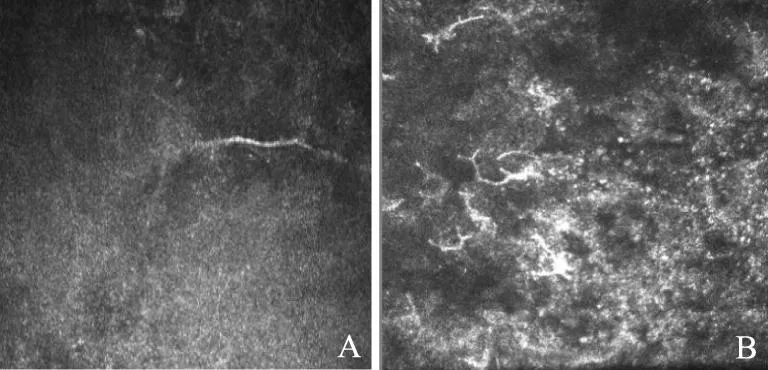
A.术后2周;B.术后4周
A.2 weeks after surgery;B. 4 weeks after surgery
图4基底下神经丛改变(×800)
Fig4Changes of nerve plexus in Bowman’s layer(×800)
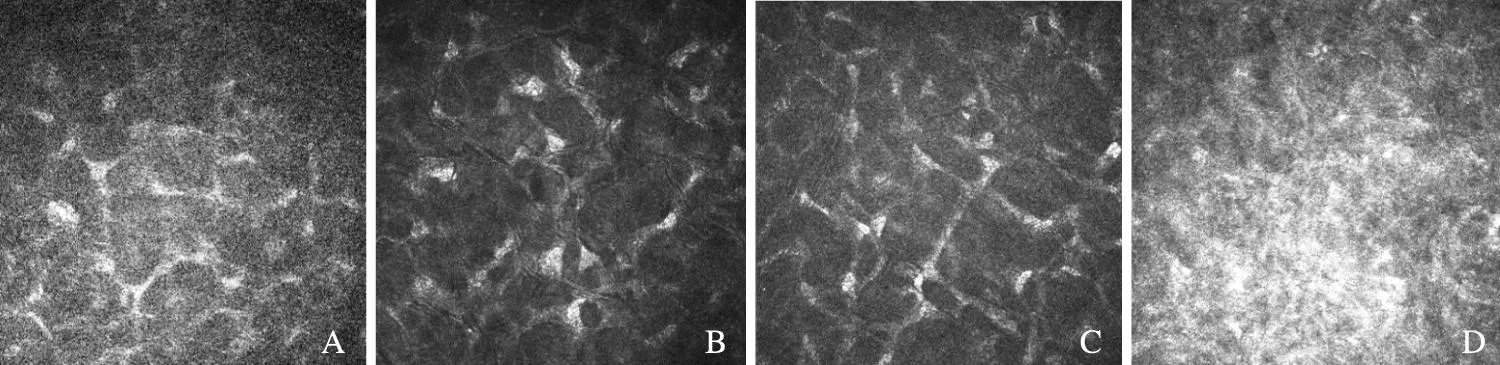
A.术后1周;B.术后2周;C.术后3周;D.术后4周
A. 1 week after surgery;B. 2 weeks after surgery;C. 3 weeks after surgery;D. 4 weeks after surgery
图5基质层改变(×800)
Fig5Changes in stroma layer(×800)

A. 术后1周;B. 术后3周;C. 术后4周
A. 1 week after surgery;B. 3 weeks after surgery;C.4 weeks after surgery
图6角膜内皮层改变(×800)
Fig6Changes in corneal endothelial layer(×800)
基底膜下神经丛和内皮细胞密度的变化情况由于2周后角膜透明度严重下降导致IVCM图像清晰度不足,选取术后2周图像进行对比分析,结果显示,实验组的基底膜下神经丛数量和内皮细胞密度分别为(1.6±0.8)支/幅和(1231.5±391.7)细胞/mm2,显著低于对照组的(8.1±1.7)支/幅和(t=6.9192,P=0.002)和(2974.2±203.8)细胞/mm2(t=7.8936,P<0.0001)。Pearson检验结果显示,角膜厚度与基底膜下神经丛数量没有相关关系(相关性=-0.303,P=0.697)。
角膜厚度变化情况实验组术后1、2、3、4周的角膜厚度分别为(532±5.1)、(619.5±5.9)、(768±3.7)、(911±5.2)μm;对照组分别为(461.8±6.8)、(461.2±6.2)、(461.5±6.6)、(461.5±6.5)μm;实验组术后1(t=28.31,P<0.0001)、2(t=63.56,P<0.0001)、3(t=123.22,P<0.0001)、4周(t=180.80,P<0.0001)的角膜厚度均明显高于对照组。
讨论
角膜内皮细胞层的紧密连接是维持角膜透明性的重要结构,紧密连接受到破坏、角膜内皮密度过低时,会导致内皮功能失代偿,引起角膜水肿混浊和失明,视力严重受损。角膜内皮功能失代偿动物模型的建立是开展角膜内皮细胞相关研究的重要步骤。以往朱勤等[1]曾采用超声乳化法建立恒河猴角膜内皮失代偿模型,具体为摘除恒河猴晶状体后再用超声乳化破坏角膜内皮,达到损伤角膜内皮细胞的目的,经扫描电镜显示造模后早期角膜就出现细胞内部超微结构及功能的改变,随时间推移受损的角膜内皮细胞水肿、坏死、内皮细胞脱落。本研究则简化了手术方法,省略了摘除晶状体的步骤,直接利用超声乳化针头靠近角膜内皮释放超声能量的方法,制造角膜内皮失代偿模型,手术步骤更为简单,耗时更短。
IVCM是非侵入性的成像技术,1990年首次用于人角膜的影像分析,主要原理是通过共聚焦探测器接受聚焦后的光源信号,校准后再传入光学显微镜进行成像,可以获得活体角膜光学切面图像,观察角膜所有层面结构及病理生理变化,实现对细胞结构的动态观察[2- 4]。临床上用于感染性角膜炎、异物、翼状胬肉、角膜变性、营养不良、干眼,包括屈光手术、白内障手术、角膜移植术后的角膜分析[2- 13]。IVCM能提供清晰的角膜内层结构图像,且可同时进行角膜厚度、角膜内皮细胞密度等生物学参数的测量。有文献报道用IVCM测量中央角膜厚度有较好的可重复性[14],与OrbscanⅡ方法测量中央角膜厚度相比没有统计学差异[15]。而庞辰久等[16]对比了IVCM、光学相干断层扫描(optical coherence tomography,OCT)、OrscanⅡ和超声角膜测厚仪4种方法测量近视眼角膜厚度的差异性,认为IVCM测量结果偏薄。
本研究采用超声乳化法建立模型后,实验组恒河猴角膜出现不断加重的混浊和水肿,其中1眼手术切口处出现新生血管和角膜混浊,推测可能是超声乳化手术结束时切口封闭不理想造成了切口局部虹膜黏连导致。应用IVCM对角膜进行活体动态观察,与正常对照组的恒河猴角膜组织相比,在超声乳化损伤后,早期角膜改变主要出现在内皮层和深基质层,表现为内皮细胞间隙增宽、细胞轻度水肿,基质层出现活化的基质细胞、细胞形态发生改变,变得不规则。术后2周与对照组相比基底膜下神经丛数量和角膜内皮细胞计数显著降低。术后3周基底上皮层可见少量朗汉细胞浸润。术后4周从基底上皮层到内皮层各个层次的病变均较严重。随着时间推移,角膜病理改变逐渐从内皮和深基质层蔓延到基底上皮层,病变的程度不断加重,术后各时间点角膜厚度与对照组和术前基线值对比显著增加,这与裂隙灯显微镜观察到的角膜水肿程度不断加重相吻合。朗汉细胞虽在正常角膜中也存在,但不断增多的朗汉细胞提示有免疫和炎症反应存在[17- 18]。IVCM观察在实验组角膜基底上皮层中出现朗汉细胞并且不断增多,提示可能在角膜内皮失代偿过程中有免疫和炎症反应参与。Bowman’s膜中基底下神经丛主要作用是维持角膜营养、完整性及加快角膜创伤修复[7],在IVCM下可以清晰显示。神经丛的减少常见于糖尿病患者[18]、角膜手术,尤其是LASIK手术[8- 9]和眼钝挫伤后[7]。本研究观察到超声乳化损伤2周基底下神经丛较对照组显著减少,推测可能与灌注液流对角膜的冲击造成神经纤维的断裂有关,也可能是因为角膜水肿影响了对神经丛的观察,其确切的机制尚不清楚,需进一步研究证实。而超声乳化损伤后神经丛显著减少,将引起角膜营养供应减少,角膜水肿加重。结合IVCM动态观察结果,笔者分析超声乳化法损伤角膜内皮的机制可能为:(1)实验中采用连续的超声能量释放模式,CDE为4,超声乳化针头以40~45 kHz做纵向振动,高振动频率释放出的高热量造成热灼伤[19];(2)灌注液对角膜内皮的机械性冲击力[19];(3)角膜内皮细胞损伤后的免疫和炎症反应。
本研究存在以下不足:(1)仅设立了空白对照组和单一实验组,通过裂隙灯显微镜和IVCM观察到超声乳化角膜内皮损伤模型的成功建立。但未设置实验对照组,即利用不同能量、不同超声能量释放时间、不同能量释放模式的其他实验组,无法了解超声能量与角膜内皮损伤是否具有线性关系。(2)由于恒河猴的来源及实验成本限制,样本量较小。但本研究中所有实验眼均成功建立了模型,且IVCM观察到的改变是稳定的。(3)由于实验观察后期,角膜水肿严重,IVCM图像清晰度欠佳,无法进行基底膜下神经丛数量的观察分析。而且IVCM的原理是光学测量,角膜清晰度下降可能会导致角膜厚度测量的准确性受到影响。
综上,本研究结果显示,IVCM可清晰、动态地显示超声乳化后恒河猴角膜内皮失代偿的病理生理过程,在超声乳化后主要变化是内皮细胞紧密连接受到破坏、细胞水肿,逐渐引起基质层水肿、基底膜下神经纤维减少和免疫及炎症反应,最终引发角膜完全混浊水肿。对于应用来源有限、成本较高的实验动物进行实验研究时,IVCM可实现对同一实验个体角膜的动态连续观察和相关生物学参数测量分析,是一种经济有效的方法。随着IVCM影像技术的不断发展,图像精度、分辨率和可分析参数进一步增加,IVCM将有望部分替代角膜病理组织检查和电镜检查的作用。
参考文献
[1]朱勤,胡敏,刘海,等. 超声乳化致恒河猴角膜内皮损伤动物模型的建立[J].眼科新进展,2013,33(2):110- 112.
[2]熊健,周文天. 活体共聚焦显微镜在感染性角膜炎诊断应用进展[J].中国实用眼科杂志,2014,32(8):934- 938.
[3]Niederer RL,McGhee CN. Clinicalinvivofocal microscopy of the human cornea in health and disease[J].Prog Retin Eye Res,2010,29(1):30- 58.
[4]梁庆丰,孙旭光,LABBE Antoine. 活体共聚焦显微镜在感染性角膜炎诊治中的应用[J].中华眼科杂志,2013,49(10):951- 955.
[5]石尧,吴艳,薛春燕,等. 激光角膜共焦显微镜观察真菌性角膜炎的研究[J]. 医学研究生学报,2009,22(4):380- 382.
[6]何静,姚晓明,黎明. 角膜激光共聚焦显微镜检查在角膜深层异物诊断中应用[J]. 中国实用眼科杂志,2013,31(10):1249- 1252.
[7]郑斌,毕延峰,陈岩,等. 共聚焦显微镜观察眼钝挫伤患者角膜基底下神经丛组织形态学变化[J]. 中华眼科杂志,2014,50(8):584- 588.
[8]吴艳,杨丽萍,薛春燕,等.激光共焦显微镜对近视激光术后haze结构的研究[J].眼科新进展,2013,33(3):240- 242.
[9]程燕,吴洁,高伟,等.共焦显微镜观察真菌性角膜溃疡多层羊膜移植术后的转归[J].眼科新进展,2012,32(10):972- 975.
[10]杨浩江,吕秀芳,窦晓燕,等.激光原位角膜磨镶术后角膜的共焦显微镜研究[J].眼科新进展,2008,28(7):538- 541.
[11]Zuo J,Zhang CW,Zhou X,et al. Characterization of abnormal epithelium after laser-assisted subepithelial keratectomy usinginvivoconfocal microscopy[J]. Genet Mol Res,2015,14(2):4749- 4756.
[12]Zhivov A,Stave J,Vollmar B,et al.Invivoconfocal microscopic evaluation of Langerhans cell density and distribution in the normal human corneal epithelium[J]. Graefes Arch Clin Exp Ophthalmol,2005,243(10):1056- 1061.
[13]薛春燕,程莹莹,吴艳,等. 翼状胬肉的激光共聚焦显微镜观察[J]. 医学研究生学报,2011,24(12):1254- 1257.
[14]Cavanagh HD,Petroll WM,Alizadeh H,et a1.Clinical and diagnostic use ofinvivoconfocal microscopy in patients with corneal disease[J].Ophthalmology,1993,100(10):1444- 1454.
[15]罗丽辉,刘祖国,陈家祺,等.共焦显微镜与OrbscanⅡ角膜地形系统在角膜厚度测量中的差异[J]. 眼科新进展,2004,24(5):407- 408.
[16]庞辰久,李舒茵,牛超,等. 四种方法测量近视眼角膜中央厚度结果对比研究[J]. 中国实用眼科杂志,2010,28(7):717- 720.
[17]刘靖,肖启国,刘祖国. 朗格汉斯细胞与角膜病[J]. 国际眼科纵览,2008,32(6):404- 408.
[18]Malik RA,Kallinikos P,Abbott CA,et al. Corneal confocal microscopy:a non-invasive surrogate of nerve fibre damage and repair in diabetic patients[J]. Diabetologia,2003,46(5):683- 688.
[19]Walkow T,Anders N,Klebe S. Endothelial cell loss after phacoemulsification:relation to preoperative and intraoperative parameters[J]. J Cataract Refract Surg,2000,26(5):727- 732.
In Vivo Confocal Microscopic Evaluation of Corneal Endothelial Dysfunction Induced by Phacoemulcification in Rhesus Monkey Models
WU Min1,HU Zhu-lin1,SUN Xiao-mei2,DAI Jie-jie2
1Department of Ophthalmology,the 4th Affiliated Hospital of Kunming Medical University,Kunming 650021,China2Tree Shrew Species Resource Center,Institute of Medical Biology,CAMS and PUMC,Kunming 650118,China Corresponding author:HU Zhu-linTel:0871- 65156650- 2880,E-mail:hzl77@263.net
ABSTRACT:ObjectiveTo observe the characteristic morphological changes of corneal endothelial dysfunction induced by phacoemulcification in rhesus monkey models under confocal microscope. MethodsThe corneal endothelial dysfunction models were established by phacoemulcification power on the central corneal of 7 to 9 mm diameter in the right eyes of 4 rhesus monkeys(the modeling group). The left eyes of 4 rhesus monkeys were set as blank control group. The structural changes in different corneal layers were evaluated by slit lamp microscope and in vivo confocal microscope before surgery and 1,2,3,and 4 weeks after surgery. SPSS 19.0 software was applied to analyze data. Paired-t test was used to compare the number of nerve plexus in Bowman’s layer and corneal endothelial cell density. Analysis of variance(ANOVA) was used to analyze corneal thickness. ResultsAfter phacoemulcification,the changes of cornea occurred gradually in the endothelial layer,stroma,Bowman’s membrane,and basal epithelial layer. In the early stage,the interspace of corneal endothelial cells enlarged and few activated stromal cells were detected in the stroma. The cell morphology of stroma altered. The thickness of stroma increased. Two weeks after surgery,the nerve plexus in Bowman’s layer decreased and edema of stroma and endothelial layer increased. Three weeks after surgery,the interspace of basal epithelial cells increased with a few Langerhans’ cells infiltration and edema of stroma and endothelial layer increased. Four weeks after the surgery,a large amount of Langerhans’ cells presented in basal epithelial layer. Only a few nerve lexus could be seen in Bowman’s layer. The stroma and endothelial cells had severe edema. A large number of activated stromal cells could be found in stromal layer. Two weeks after the surgery,the number of nerve plexus in Bowman’s layer(t=6.9192,P=0.002) and corneal endothelial cell density(t=7.8936,P<0.0001)in the modeling group were significantly lower than that in control group. Compared with corneal thickness in control group,it was significantly larger in the modeling group at 1(t=28.31,P<0.0001),2(t=63.56,P<0.0001),3(t=123.22,P<0.0001),and 4 weeks(t=180.80,P<0.0001) after the surgery. ConclusionsThe changes in corneal endothelial dysfunction induced by phacoemulcification in rhesus monkey models can be clearly shown under in vivo confocal microscope. Gradual increase of endothelial cells interspace,activated stromal cells,increase of Langerhans’ cells,and decrease of plexus in Bowman’s layer are the main changes.
Key words:rhesus monkey;corneal endothelial dysfunction;in vivo confocal microscope;animal model
(收稿日期:2015- 07- 10)
DOI:10.3881/j.issn.1000- 503X.2016.01.008
中图分类号:R770.43
文献标志码:A
文章编号:1000- 503X(2016)01- 0042- 07
通信作者:胡竹林电话:0871- 65156650- 2880,电子邮件:hzl77@263.net
基金项目:云南省应用基础研究项目(昆医联合专项)(2013FB109、2014FB074)Supported by the Applied Basic Research Programs of Science and Technology Commission Foundation of Yunnan Province(Kunming Medical University Special Program)(2013FB109,2014FB074)
