间充质干细胞来源的Exosome对神经损伤的保护作用
2016-03-23魏俊吉陈云飞薛春玲马百涛沈雅梅包新杰王任直赵春华
魏俊吉,陈云飞,薛春玲,马百涛,沈雅梅,关 健,包新杰,吴 昊,韩 钦,王任直,赵春华
1中国医学科学院 北京协和医学院 北京协和医院神经外科,北京 100730 2中国医学科学院 北京协和医学院 基础医学研究所组织工程中心,北京 100005
·论著·
间充质干细胞来源的Exosome对神经损伤的保护作用
魏俊吉1,陈云飞2,薛春玲2,马百涛1,沈雅梅2,关健1,包新杰1,吴昊1,韩钦2,王任直1,赵春华2
1中国医学科学院北京协和医学院北京协和医院神经外科,北京 1007302中国医学科学院北京协和医学院基础医学研究所组织工程中心,北京 100005
王任直电话:010- 69152532,电子邮件:wangrz@126.com
摘要:目的研究脂肪间充质干细胞(MSC)来源的Exosome对谷氨酸神经损伤的保护作用及可能机制。方法采用透射电镜和Western blot法检测人脂肪MSC来源的Exosome的特征,ELISA法检测Exosome中主要的细胞因子。用PC12细胞建立谷氨酸神经细胞损伤模型,并分为对照组(未经谷氨酸损伤的细胞)、Glu组(谷氨酸损伤未经其他处理的细胞)、Glu+Exo组(谷氨酸损伤后用100 ng/ml MSC Exosome 处理的细胞)、Glu+Exo+Akt组(谷氨酸损伤后用MSC Exosome同时加10 μmol/L Akt 抑制剂LY294002处理的细胞)、Glu+Exo+Erk组(谷氨酸损伤后用MSC Exosome 同时加10 μmol/L Erk抑制剂U0126处理的细胞)和Glu+Exo+TrkB组(谷氨酸损伤后用MSC Exosome同时加10 μmol/L TrkB抑制剂K252a处理的细胞),MTS法检测各组细胞的存活率并进行比较。结果透射电镜下可见Exosome为40~100 nm的小囊泡结构,Western blot法检测结果显示其可表达CD63、CD81、HSP70和HSP90等特征性蛋白。ELISA检测结果显示Exosome中主要包含的细胞因子为肝细胞生长因子和胰岛素样生长因子,含量分别为9336.49±258.63和58645.50±16014.62;而脑源性神经营养因子、血管内皮生长因子和神经生长因子含量均较低,分别为1928.25±385.47、1136.94±5.99和33.34±9.43。MTS检测结果显示,对照组、Glu组、Glu+Exo组、Glu+Exo+Akt组、Glu+Exo+Erk组和Glu+Exo+TrkB组的PC12细胞存活率分别为0.842±0.047、0.306±0.024、0.566±0.026、0.461±0.016、0.497±0.003和0.515±0.034,其中,Glu组显著低于对照组(P=0.02),Glu+Exo组显著高于Glu组(P=0.01),Glu+Exo+Akt组显著低于Glu+Exo组(P=0.01)。结论人脂肪MSC来源的Exosome具有保护谷氨酸神经损伤的作用,这可能是通过激活磷脂酰基醇3激酶-丝氨酸/苏氨酸蛋白激酶信号通路来实现的。
关键词:间充质干细胞;Exosome;神经损伤;治疗机制
ActaAcadMedSin,2016,38(1):33-36
间充质干细胞(mesenchymal stem cell,MSC)是一种中胚层来源的多能干细胞,目前临床上已开始用于治疗脊髓损伤、外伤性脑损伤、心肌梗死等。在脑缺血损伤的体内模型中,MSC虽然有改善神经功能的作用,但检测后却发现其很少分化为神经细胞和血管内皮细胞,因此可能是通过促进内源性神经细胞和血管内皮生长来改善神经功能。Exosome是一种细胞分泌的小囊泡,可作为细胞间物质信息交换的载体,以往研究发现,MSC分泌的Exosome对肾损伤和肺损伤具有修复作用[1- 2]。本研究观察了脂肪MSC来源的Exosome对谷氨酸神经损伤的保护作用,探讨了其可能的机制。
材料和方法
人脂肪MSC来源的Exosome的提取和鉴定成人脂肪组织取自2014年10月至2015年4月在北京协和医院整形外科接受吸脂手术的25~35岁健康女性(本研究经中国医学科学院基础医学研究所伦理委员会批准,供者均签署知情同意书)。脂肪MSC培养方法参见文献[3]。将第8代培养的MSC继续培养48 h后更换为无血清的DMEM/F12培养基,培养24 h后收取上清,离心去细胞碎片,然后用相对分子质量为100 000的滤膜过滤后进行浓缩(200 ml浓缩至1~2 ml)[4]。采用透射电镜观察浓缩后的Exosome并拍照,蛋白质印迹法检测其抗原表达。提取Exosome总蛋白,经BCA法定量,取40 mg总蛋白进行10%聚丙烯酰胺凝胶电泳,转到PVDF膜上。一抗CD63(美国Lifetechnology公司)、CD81、HSP70和HSP90(美国Santacruz公司)按1∶1000稀释,并4℃孵育过夜,内参为GAPDH(美国Santa Cruz公司),二抗室温孵育1 h,ECL法荧光显色,并拍照。
ELISA法检测MSC分泌的Exosome所含细胞生长因子采用ELISA法检测MSC分泌的Exosome中所含的细胞生长因子,包括:肝细胞生长因子(hepatocyte growth factor,HGF)、脑源性神经营养因子(brain derived neurotrophic factor,BDNF)、血管内皮生长因子(vascular endothelial growth factor,VEGF)、胰岛素样生长因子(insulin-like growth factor,IGF)、神经生长因子(nerve growth factor,NGF)。ELISA试剂盒购自上海森雄公司,检测方法按说明书进行。
细胞系培养PC12细胞系(鼠嗜铬细胞瘤细胞系)购自中国医学科学院基础医学研究所细胞中心,采用1640RPMI培养基,加5%胎牛血清和5%马血清,37℃、5%CO2条件下培养至80%融合,常规消化传代。
谷氨酸神经细胞损伤模型的建立和分组将PC12细胞按照1×105个/孔的密度接种至96孔细胞培养板,正常培养24 h后弃去培养上清,D-hanks’洗 1遍,用DF12配制的0.5 mmol/L谷氨酸室温下作用15 min,弃去含谷氨酸的培养基,D-hanks’洗2遍,分别用不同组别培养基孵育,37℃培养箱培养24 h。具体分组如下:(1)未经谷氨酸损伤的细胞(对照组);(2)谷氨酸损伤未经其他处理的细胞(Glu组);(3)谷氨酸损伤后用100 ng/ml MSC Exosome 处理的细胞(Glu+Exo组);(4)谷氨酸损伤后用MSC Exosome Akt 抑制剂(10 μmol/L LY294002,美国Sigma公司)处理的细胞(Glu+Exo+Akt组);(5)谷氨酸损伤后用MSC Exosome 同时加Erk抑制剂(10 μmol/L U0126,美国Sigma公司)处理的细胞(Glu+Exo+Erk组);(6)谷氨酸损伤后用MSC Exosome同时加TrkB抑制剂(10 μmol/L K252a,美国Sigma公司)处理的细胞(Glu+Exo+TrkB组)。
MTS法检测各组细胞存活率接种细胞:用含10%胎小牛血清的培养液配成单个细胞悬液,以每孔1000个细胞接种到96孔板,每孔体积100 μl,根据实验目的培养或24 h加药。呈色:每孔加MTS溶液20 μl,继续孵育2 h。比色:选择490 nm波长,在酶联免疫检测仪上测定各孔光吸收值,记录结果。
统计学处理采用SPSS 19.0统计软件,数据以均数±标准差表示,组间数据比较采用t检验,P<0.05为差异有统计学意义。
结果
人脂肪MSC来源的Exosome的特征鉴定从人脂肪MSC培养上清中提取Exosome,透射电子显微镜下可见Exosome为40~100 nm的小囊泡结构(图1A)。Western blot法检测结果显示,Exosome可表达CD63、CD81、HSP70和HSP90(图1B)。
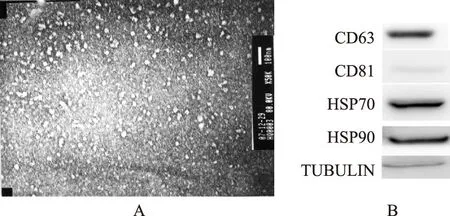
A.电镜图;B.Westen blot法鉴定Exosome抗原的表达
A.electron microscopy;B.Western blotting
图1人脂肪间充质干细胞源的Exosome的特征
Fig1Exosome characteristics of human adipose tissue-derived mesenchymal stem cell
人脂肪MSC来源Exosome分泌细胞生长因子的测定结果首先调整Exosome浓度为1000 μg/ml,然后用ELISA法检测Exosome分泌的细胞生长因子浓度,结果显示Exosome中主要包含的细胞因子为HGF和IGF,含量分别为9336.49±258.63和58645.50±16014.62;而BDNF、VEGF和NGF含量均较低,分别为1928.25±385.47、1136.94±5.99和33.34±9.43。
人脂肪MSC来源的Exosome对谷氨酸神经损伤的保护作用MTS检测结果显示,对照组、Glu组、Glu+Exo组、Glu+Exo+Akt组、Glu+Exo+Erk组和Glu+Exo+TrkB组的PC12细胞存活率分别为0.842±0.047、0.306±0.024、0.566±0.026、0.461±0.016、0.497±0.003和0.515±0.034,其中,Glu组显著低于对照组(P=0.02),Glu+Exo组显著高于Glu组(P=0.01),Glu+Exo+Akt组显著低于Glu+Exo组(P=0.01)。
讨论
已知MSC培养基上清中含有大量Exosome,Exosome是多种活细胞内分泌的直径30~100 nm的小囊泡体,其中含有大量蛋白和RNA,可在细胞间进行物质传递,并且可表达CD63、CD81、HSP70和HSP90抗体[6]。本研究采用电镜和Western blot法检测了人脂肪MSC来源的Exosome的特征,结果显示镜下所见的Exosome为40~100 nm的小囊泡结构,可表达CD63、CD81、HSP70和HSP90抗体,提示本研究成功提取Exosome。
已知IGF、HGF、BDNF、NGF和VEGF细胞因子对大脑损伤具有一定的保护作用,所以本研究采用ELISA法检测了Exosome中这5种细胞因子的含量,结果发现IGF和HGF含量较高,而BDNF、NGF和VEGF含量较低,推测可能是IGF和HGF这两种细胞因子对神经损伤具有保护作用。
White等[7]研究显示,脑卒中时,大量谷氨酸可在细胞间堆积,引起神经细胞过度兴奋,导致大量钙离子内流,活化NOS,造成氧自由基堆积,最终引发DNA损伤和细胞凋亡,因此本研究选择了谷氨酸神经损伤模型来研究Exosome对神经损伤的保护机制。而由于原代神经细胞培养困难,故以嗜铬细胞瘤细胞系PC12代替神经细胞。造模结果显示,Glu组的细胞存活率显著低于对照组,而Glu+Exo组显著高于Glu组,提示Exosome可以促进细胞的存活和生长。
已知磷脂酰肌醇- 3-激酶/蛋白激酶B(phosphoino- sitide3kinase/Akt,PI3K/Akt)通路是神经细胞存活的重要通路,而80%神经营养因子调节的神经细胞存活都是通过PI3/K-Akt通路实现的[8]。本研究发现IGF和HGF含量较高,因此添加了Glu+Exo+TrkB(TrkB抑制剂组)、Glu+Exo+Akt组(Akt抑制剂组)和Glu+Exo+Erk组(Erk抑制剂组),结果发现使用Akt抑制剂LY294002时,MSC来源的Exosome保护谷氨酸神经损伤显著下降,而TrkB抑制剂组和Erk抑制剂组的效果不明显,提示人脂肪MSC来源Exosome对神经损伤的保护作用可能是通过PI3/K-Akt通路实现的。
综上,本研究结果显示,人脂肪MSC分泌的Exosome对谷氨酸神经损伤具有保护作用,这可能是通过激活PI3/K-Akt信号通路实现的,但MSC分泌的Exosome中含有大量不同种类的蛋白和非编码RNA,所以激活PI3/K-Akt信号通路的具体机制仍然需要进一步研究。MSC在脑缺血动物模型中具有抑制炎症反应、促进血管新生和神经细胞增殖、减少凋亡的作用,不同MSC分泌的Exosome是否具有相似的作用,也是今后进一步研究的方向。
参考文献
[1]Lee C,Mitsialis SA,Aslam M,et al. Exosomes mediate the cytoprotective action of mesenchymal stromal cells on hypoxia-induced pulmonary hypertension [J]. Circulation,2012,126(22):2601- 2611.
[2]Zhang L,Li K,Yan X,et al. MicroRNA- 498 Inhibition enhances the differentiation of human adipose-derived mesenchymal stem cells into podocyte- like cells [J].Stem Cells Dev,2015,24(24):2841- 2852.
[3]Cao Y,Sun Z,Liao L,et al. Human adipose tissue-derived stem cells differentiate into endothelial cellsinvitroand improve postnatal neovascularizationinvivo[J]. Biochem Biophys Res Commun,2005,332(2):370- 379.
[4]Lin R,Wang S,Zhao RC. Exosomes from human adipose-derived mesenchymal stem cells promote migration through Wnt signaling pathway in a breast cancer cell model [J]. Mol Cell Biochem,2013,383(1- 2):13- 20.
[5]Lu S,Lu C,Han Q,et al. Adipose-derived mesenchymal stem cells protect PC12 cells from glutamate excitotoxicity-induced apoptosis by upregulation of XIAP through PI3-K/Akt activation [J]. Toxicology,2011,279(1- 3):189- 195.
[6]Skog J,Wurdinger T,van Rijn S,et al. Glioblastoma microvesicles transport RNA and proteins that promote tumour growth and provide diagnostic biomarkers [J]. Nat Cell Biol,2008,10:1470-1476.
[7]White BC,Sullivan JM,DeGracia DJ,et al. Brain ischemia and reperfusion:molecular mechanisms of neuronal injury [J]. J Neurol Sci,2000,179(S1- 2):1- 33.
[8]Almeida RD,Manadas BJ,Melo CV,et al. Neuroprotection by BDNF against glutamate-induced apoptotic cell death is mediated by ERK and PI3-kinase pathways [J].Cell Death Differ,2005,12(10):1329- 1343.
Protection of Nerve Injury with Exosome Extracted from Mesenchymal Stem Cell
WEI Jun-ji1,CHEN Yun-fei2,XUE Chun-ling2,MA Bai-tao1,SHEN Ya-mei2,GUAN Jian1,BAO Xin-jie1,WU Hao1,HAN Qin2,WANG Ren-zhi1,ZHAO Chun-hua2
1Department of Neurosurgery,PUMC Hospital,CAMS and PUMC,Beijing 100730,China2Center of Excellence in Tissue Engineering,Institute of Basic Medical Sciences, CAMS and PUMC,Beijing 100005,China Corresponding author:ZHAO Chun-huaTel:010- 65125311,E-mail:zhaochunhua@vip.163.com; WANG Ren-zhiTel:010- 69152532,E-mail:wangrz@126.com
ABSTRACT:ObjectiveTo investigate the protective effect of Exosomes from human adipose-derived mesenchymal stem cells(hAMSCs) in neural injury induced by glutamate and its possible mechanism. MethodsCharacteristics of Exosomes from hAMSCs were identified by electron microscopy and Western blot analysis.Cytokines that might play a major role in the protective effect were tested by enzyme-linked immunosorbent assay(ELISA). The protective action of Exosome and its possible signaling pathway were researched by the in vitro neural injury induced by glutamate,including control group(without Glu),Glu group(dealing with Glu),Glu+Exo group(dealing with Glu +100 ng/ml Exo),Glu+Exo+Akt group(dealing with Glu+100 ng/ml Exo+10 μmol/L Akt),Glu+Exo+Erk group(dealing with 100 ng/ml Glu+100 ng/ml Exo+10 μmol/L Erk),and Glu+Exo+TrkB group(dealing with Glu+100 ng/ml Exo +10 μmol/L TrkB). ResultsExosomes from hAMSCs had similar sizes to those isolated from other kinds of cells,and expressed the characteristic proteins such as CD63,CD81,HSP70,and HSP90. Cytokines that had neurotrophic effects on Exosomes were mainly insulin-like growth factor and hepatocyte growth factor,with the concentration being 9 336.49±258.63 and 58 645.50±16 014.62,respectively;brain derived neurotrophic factor,nerve growth factor,and vascular endothelial growth factor had lower levels,with the concentration being 1928.25±385.47,1136.94±5.99,and 33.34±9.43,respectively. MTS assay showed that the PC12 cell survival rates were 0.842±0.047,0.306±0.024,0.566±0.026,0.461±0.016,0.497±0.003,and 0.515±0.034 in the control group,Glu group,Glu+Exo group,Glu+Exo+Akt group,Glu+Exo+Erk group,and Glu+Exo+TrkB group;obviously,it was significantly lower in Glu group than in control group(P=0.02),significantly higher in Glu+Exo group than in Glu group(P=0.01),and significantly lower in Glu+Exo+Akt group than in Glu+Exo group(P=0.01). ConclusionExosomes secreted from hAMSCs have protective effect against neuron damage induced by glutamate,which may be mediated through activating the PI3/K-Akt signalling pathway.
Key words:mesenchymal stem cells;exosome;nerve damage;treatment mechanism
(收稿日期:2015- 11- 27)
DOI:10.3881/j.issn.1000- 503X.2016.01.006
中图分类号:R642
文献标志码:A
文章编号:1000- 503X(2016)01- 0033- 04
通信作者:赵春华电话:010- 65125311,电子邮件:zhaochunhua@vip.163.com;
基金项目:国家自然科学基金(81371344)Supported by National Natural Sciences Foundation of China(81371344)
