细丝蛋白A与蛋白激酶B在小肠腺癌中的表达与意义
2016-03-22张鸿滨张朝军
张鸿滨,张朝军
细丝蛋白A与蛋白激酶B在小肠腺癌中的表达与意义
张鸿滨,张朝军
[摘要]目的 探讨细丝蛋白A(filamin A,FLNA)和蛋白激酶B(protein kinase B,PKB)在小肠腺癌组织中的表达及其临床意义。方法 应用免疫组织化学法、逆转录-聚合酶链反应(reverse transcription-polymerase chain reaction,RT-PCR)和蛋白质印迹法(Western印迹法),检测56例小肠腺癌组织及正常小肠组织(距腺癌组织边缘5 cm以上)中FLNA、PKB的表达情况。结果 小肠腺癌组织中FLNA mRNA表达低于正常小肠组织,而PKBmRNA的表达水平高于正常小肠组织(P<0.05)。小肠腺癌组织中FLNA表达低于正常小肠组织,而PKB的表达水平高于正常小肠组织(P<0.05)。FLNA、PKB的表达与患者性别、年龄、肿瘤组织学分级无关(P>0.05),而与肿瘤淋巴结转移、临床肿瘤分期和肿瘤浸润深度相关(P<0.05);Spearman秩相关系数显示FLNA与PKB表达呈负相关(r=-0.289,P=0.008)。结论 FLNA、PKB参与小肠腺癌的发生、发展过程,磷脂酰肌醇3-激酶/PKB信号通路的活化可作为临床潜在治疗靶点。
[关键词]小肠肿瘤;细丝蛋白A;蛋白激酶B;磷脂酰肌醇3-激酶;免疫组织化学;逆转录-聚合酶链反应;蛋白质印迹法
[作者单位]100048北京,海军总医院普外科(张鸿滨,张朝军)
小肠肿瘤的发病率较低,恶性肿瘤则更为少见,占胃肠道恶性肿瘤的2%~3%[1]。原发性小肠腺癌发病率低、预后差,5年总生存率26%~38%。而肿瘤的复发和远处转移是小肠腺癌患者预后不良的主要原因[2-5]。细丝蛋白A(filamin A,FLNA)与肌动蛋白结合从而影响细胞骨架的重塑,在细胞的迁移、侵入行为中发挥作用[6],是细胞运动及信号转导的整合者[7]。蛋白激酶B(protein kinase B,PKB)能够调控细胞周期、生长因子介导的细胞生存、细胞迁移,以及肿瘤细胞的非锚定性生长[8]。PKB/FLNA信号通路在小肠腺癌发生、发展过程及预后中的作用目前尚不明确。本研究应用免疫组织化学法检测FLNA、PKB在小肠腺癌组织和正常小肠组织中的表达情况,并进一步使用逆转录-聚合酶链反应(reverse transcription-polymerase chain reaction,RT-PCR)和蛋白质印迹法(Western印迹法)检测FLNA、PKB的表达情况;同时,结合临床资料探讨其与小肠腺癌临床病理特征的关系,以期为临床小肠腺癌的治疗提供新的可能靶点。
1 资料与方法
1.1临床资料 海军总医院2005年1月—2013 年1月收治的56例小肠腺癌患者手术切除的小肠腺癌组织和正常小肠组织,男性34例、女性22例,年龄35~75岁、中位年龄53.4岁。
1.2方法
1.2.1取材 小肠腺癌组织取自肿瘤中心处,正常小肠组织取自距肿瘤边缘至少5 cm处。患者均无其他部位原发肿瘤,术前均未进行放疗和化疗,所有样本均经2位病理专家阅片证实。样本取材后,部分置于液氮中保存,供RT-PCR检测;部分样本用10%甲醛溶液固定,石蜡包埋组织,用于免疫组织化学染色。
1.2.2试剂 兔抗人FLNA单克隆抗体购自美国Epitomics公司。鼠抗人PKB单克隆抗体和兔抗人甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)多克隆抗体均购自日本Santa Cruz公司。RT-PCR试剂盒购自日本TaKaRa公司。免疫组织化学检测试剂盒购自北京中杉金桥生物技术有限公司。3,3′-二氨基联苯胺显色剂购自日本Tiangen公司。总RNA提取试剂和放射免疫沉淀裂解液均购自日本Solarbio公司。PCR引物由上海生物工程技术服务有限公司合成;逆转录试剂盒和聚丙烯酰胺凝胶电泳标准指示剂均购自加拿大Fermentas公司。
1.2.3免疫组织化学染色 严格按免疫组织化学试剂盒说明书进行操作,2种抗体染色阳性均主要在细胞质,即呈现棕黄色颗粒为阳性。以磷酸缓冲盐溶液代替一抗进行染色作为阴性对照。
1.2.4结果判定 按照Sun等[9]方法,FINA、PKB阳性细胞的百分比分为4个等级:0分,阳性细胞<5%;1分,阳性细胞5%~25%;2分,阳性细胞26%~50%;3分,阳性细胞>50%。染色强度分为:0分,无色;1分,弱阳性(浅黄色);2分,中度阳性(棕色);3分,强阳性(黄褐色)。最后得分综合判断:阴性为0分;+为1~3分;++为4~6分;+++为7~9分。
1.2.5RT-PCR法 参照日本TaKaRa公司SYBR Premix Ex TaqTMⅡ试剂盒说明书进行RT-PCR。根据生物样本库中人源FLNA、PKB和GAPDH的互补DNA全长设计PCR引物。FLNA的上游引物序列为5′-AGCCTCCACGAGACATCATC-3′,下游引物序列为5′-CCAGTGTGTACTCCCCCTTG-3′;PKB上游引物序列为5′-TGGAGTCACTGACACCCTC-3′,下游引物序列为5′-CGGACATCCGCTAAACAGGT-3′;GAPDH的上游引物序列为5′-GAAGGTGAAGGTCGGAGTC-3′,下游引物序列为5′-GAAGATGGT-GATGGGATTTC-3′。以GAPDH作为内参照,以FLNA/GAPDH、PKB/ GAPDH比值来定量。
1.2.6Western印迹法 使用放射免疫沉淀试剂提取细胞中的总蛋白,定量。取蛋白样品50μg,加入5×上样缓冲液(体积比4∶1),煮沸5 min后上样。经聚丙烯酰胺凝胶电泳、转膜,将蛋白质转至聚偏二氟化乙烯膜。将膜置于含5%脱脂奶粉的TBST(Tris-Buffered Saline and Tween 20)液中,室温封闭1 h,加入特异性的一抗(FLNA为1∶2 000、PKB为1∶200、GAPDH为1∶200)-4℃孵育过夜,次日用TBST液洗膜3次,每次10 min。二抗(1∶2 000)37℃孵育1 h。化学发光法检测条带。
1.3统计学处理 应用SPSS 19.0软件,计量资料以均数±标准差(±s)表示,组间比较采用X2检验、t检验,并采用Spearman秩相关系数分析小肠腺癌组织中FLNA、PKB表达的相互关系,P<0.05为差异有统计学意义。
2 结果
2.1检测 RT-PCR检测,FLNA mRNA在小肠腺癌组织中的表达水平较正常小肠组织低[(0.296± 0.030)与(0.850±0.130),t=3.250],而PKB mRNA在小肠腺癌组织中的表达水平较正常小肠组织高[(0.710±0.107)与(0.239±0.043),t=3.170],组间差异均有统计学意义(P<0.05,表1、图1A、图2A)。Western印迹法检测,FLNA在小肠腺癌组织中的表达水平较正常小肠组织低[(0.310±0.085) 与(0.711±0.165),t=3.490],PKB在小肠腺癌组织中的表达水平较正常小肠组织高[(0.860±0.108) 与(0.196±0.060),t=2.850],组间差异均有统计学意义(P<0.05,表1、图1B、图2B)。
表1 FLNA、PKB及其mRNA在小肠腺癌组织及正常小肠组织中的表达(±s)
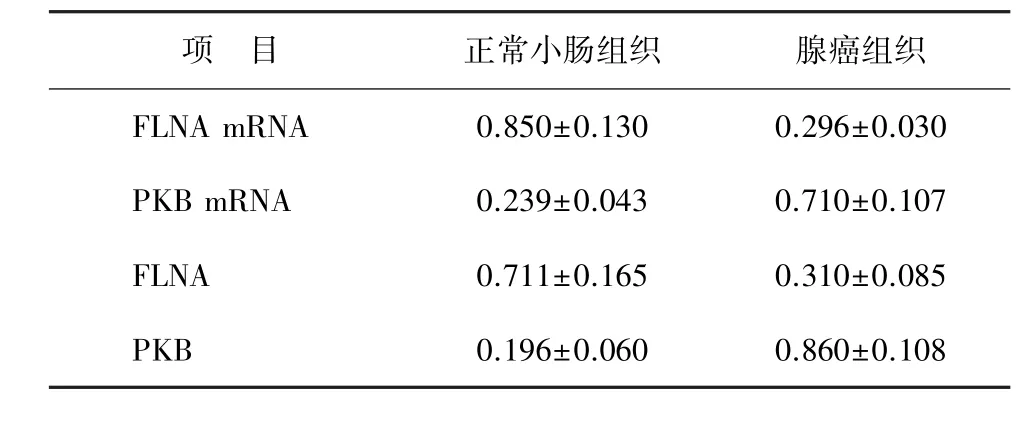
表1 FLNA、PKB及其mRNA在小肠腺癌组织及正常小肠组织中的表达(±s)
项 目 正常小肠组织 腺癌组织FLNA mRNA 0.850±0.130 0.296±0.030 PKB mRNA 0.239±0.043 0.710±0.107 FLNA 0.711±0.165 0.310±0.085 PKB 0.196±0.060 0.860±0.108
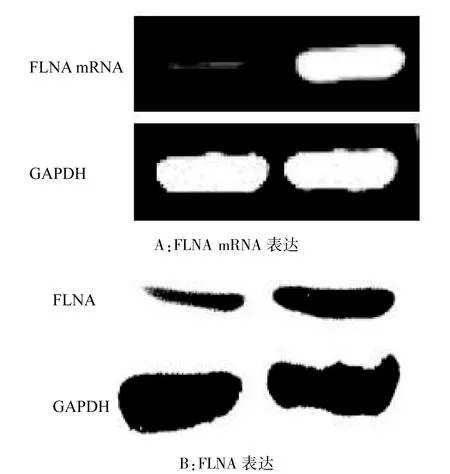
图1 小肠腺癌组织及正常小肠组织中FLNA及其mRNA表达

图2 小肠腺癌组织及正常小肠组织中PKB及其mRNA表达
2.2免疫组织化学 FLNA、PKB在小肠腺癌组织中的FLNA的阳性表达定位于细胞质,56例小肠腺癌组织样本阳性表达率为46.4%(26/56),其中强阳性表达率为17.8%(10/56)、中度阳性表达率为5.4%(3/56)、弱阳性表达率为23.2%(13/56);正常小肠组织样本的阳性表达率为87.5%(49/56),与肿瘤组织样本比较差异有统计学意义(X2=24.12、P<0.001,表2、图3)。PKB的阳性表达定位于细胞质,56例小肠腺癌组织样本阳性表达率为89.3% (50/56),其中强阳性表达率为51.8%(29/56)、中度阳性表达率为23.2%(13/56)、弱阳性表达率为14.3%(8/56);正常小肠组织样本的阳性表达率为30.4%(17/56),与肿瘤组织样本比较差异有统计学意义(X2=42.68、P<0.001,图4)。

表2 FLNA、PKB在小肠腺癌组织中表达的相关性(例)

图3 小肠腺癌组织FLNA免疫组织化学染色(×40)

图4 小肠腺癌组织PKB免疫组织化学染色(×40)
2.3相关性分析 Spearman秩相关系数分析,FLNA 与PKB在小肠腺癌组织中的表达呈负相关性(r= -0.289、P=0.008,表2)。
2.4蛋白表达与临床病理资料的关系 56例小肠腺癌组织中,FLNA、PKB阳性表达与患者年龄、性别、肿瘤组织学分级无关(P>0.05),而与淋巴结转移(X2FLNA=16.468、PFLNA<0.001,X2PKB=6.550、PPKB< 0.05)、临床肿瘤分期(X2FLNA=17.461、PFLNA<0.001,、肿瘤浸润深度相关,见表3。

表3 FLNA、PKB在小肠腺癌组织中的表达与临床病理资料的关系
3 讨论
FLNA是细丝蛋白家族的重要成员,具有高度保守的基因结构,表达广泛,在哺乳动物的生长发育中起着重要作用。FLNA的二聚体亚基相对分子质量为280×103,长约80 nm,包括氨基末端的肌动蛋白结合结构域和由24个串联的重复序列形成的人结构域。这个重复序列由含有约30个氨基酸残基间隔的2个铰链结构组成。2个多肽链连接到第24重复序列的羧基端形成一个“V”型的同型二聚体,此结构与FLNA功能[10]相关。FLNA主要分布在细胞质中,棒状分子结构域形成的β-折叠片层结构为蛋白质之间相互作用提供了界面,可与多种具有重要功能的蛋白质相互作用。其作为一种细胞膜分子受体的信号蛋白,是一种重要的信号转导支架蛋白,参与细胞增殖、黏附、迁移[11-12],以及肿瘤发生、发展[13]和器官发育的调控[14]。目前,有关FLNA与癌症的发生和发展关系研究较少。本研究中,采用RT-PCR、Western印迹法、免疫组织化学染色对小肠腺癌组织和正常小肠组织进行定位及定量检测,结果显示FLNA及其mRNA在小肠腺癌组织中的表达水平均低于正常小肠组织,这一结果与FLNA在正常小肠组织中的阳性表达率高于小肠腺癌组织的检测结果一致,且FLNA的表达与患者的性别、年龄以及肿瘤的分化程度无关,而与临床肿瘤分期、淋巴结转移和肠壁浸润深度具有相关性。说明FLNA可抑制小肠腺癌的发生,在病理状态下呈低表达,同时FLNA的表达水平与肿瘤的侵袭力呈负相关,对小肠腺癌的侵袭转移具有阻遏作用。Zhu等[15]发现FLNA调控Ras基因/细胞外调节蛋白激酶和Ras基因/鸟嘌呤核苷酸交换因子1通路,减少细胞内基质金属蛋白酶-9的水平,抑制细胞外基质降解,阻止肿瘤细胞的迁移。Campos等[16]发现FLNA与Smads蛋白家族之间相互作用,调控转化生长因子信号并抑制肿瘤细胞的迁移,然而转化生长因子信号在不表达FLNA的肿瘤细胞中明显缺乏。目前,FLNA这一抑制肿瘤的机制还并不清楚。
PKB通路是指由磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)始动的生物信息的传导,PKB为这一通路的中心环节。PKB位于PI3K通路中的下游,可以通过其介导的磷酸化过程调节下游分子活性转导调控细胞凋亡、细胞周期进程、生长因子介导的细胞生存、细胞迁移,并对端粒酶活性、肿瘤血管的生成以及肿瘤的浸润、非锚定性生长有一定的促进作用。研究表明,由多种机制导致的PKB失调是众多人类恶性肿瘤(胃癌、肺癌、卵巢癌、子宫内膜癌、乳腺癌和前列腺癌)发生的特点之一[17-18]。因此,PKB通路在肿瘤的研究中具有十分重要的意义。本研究中,PKB及其mRNA在小肠腺癌组织中的表达水平高于正常小肠组织,PKB在正常小肠组织中的阳性表达率低于小肠腺癌组织,且PKB的表达与患者的性别、年龄以及肿瘤的分化程度无关,而与临床肿瘤分期、淋巴结转移和肠壁浸润深度具有相关性。Leystra等[19]研究的活化PI3K在小鼠小肠增生及晚期肿瘤的表达表明,小鼠的远端小肠和结肠上皮细胞表达的组成性活化PI3K促使其进展为侵袭性腺癌,并蔓延至肠系膜和邻近器官。这些肿瘤的组织学特征与人类浸润性黏液腺癌显著相似,肿瘤的发生是通过激活PI3K介导的机制。因此,PI3K/PKB通路的激活、完全活化的PKB可能对小肠腺癌的发生和发展起一定的调节作用。Zhang 等[20]通过免疫组织化学和荧光定量检测11例正常小肠组织及53例小肠腺癌组织指出,小肠腺癌中PI3K/PKB信号通路高度活化,提示此通路可作为临床潜在治疗靶点。
本研究结论证实,FLNA及其mRNA在小肠腺癌组织中的表达水平与PKB及其mRNA在小肠腺癌组织中的表达水平呈现相反趋势,并且两者在癌组织中的表达水平呈负相关。FLNA是PKB的作用底物,PKB通过调节FLNA的磷酸化程度从而影响细胞骨架重构,调控细胞的迁移[4]。PKB的上调抑制了FLNA的磷酸化程度,从而加强细胞对细胞外基质的降解能力,最终增强了肿瘤细胞的侵袭能力。FLNA与PKB相互作用机制仍有待于进一步研究,有望为抑制肿瘤的侵袭和转移找到新的途径。
【参考文献】
[1]Khan K,Peckitt C,Sclafani F,et al.Prognostic factors and treatment outcomes in patients with Small Bowel Adenocarcinoma(SBA):the Royal Marsden Hospital(RMH) experience[J].BMCCancer,2015,15:15.
[2]Dabaja BS,Suki D,Pro B,et al.Adenocarcinoma of the small bowel:presentation,prognostic factors,and outcome of 217 patients[J].Cancer,2004,101(3):518-526.
[3]Nakanoko T,Koga T,Taketani K,et al.Characteristics and treatment strategies for small bowel adenocarcinoma in advanced-stage cases[J].Anticancer Res,2015,35(7): 4135-4138.
[4]Guo X,Mao Z,Su D,et al.The clinical pathological features,diagnosis,treatment and prognosis of small intestine primarymalignant tumors[J].Med Oncol,2014,31(4): 913.
[5]Aparicio T,Zaanan A,Svrcek M,et al.Small bowel adenocarcinoma:epidemiology,risk factors,diagnosis and treatment[J].Dig Liver Dis,2014,46(2):97-104.
[6]Yue J,Huhn S,Shen Z.Complex roles of filamin-A mediated cytoskeleton network in cancer progression[J].Cell Biosci,2013,3(1):7.
[7]Tian ZQ,Shi JW,Wang XR,et al.New cancer suppressor gene for colorectal adenocarcinoma:filamin A[J].World J Gastroenterol,2015,21(7):2199-2205.
[8]Ravid D,Chuderland D,Landsman L,et al.Filamin A is a novel caveolin-1-dependent target in IGF-I-stimulated cancer cellmigration[J].Exp Cell Res,2008,314(15):2762-2773.
[9]Sun GG,Sheng SH,Jing SW,et al.An antiproliferative gene FLNA regulatesmigration and invasion ofgastric carcinoma cell in vitro and its clinical significance[J].Tumour Biol,2014,35(3):2641-2648.
[10]Nakamura F,Osborn TM,Hartemink CA,et al.Structural basis of filamin A functions[J].J Cell Biol,2007,179 (5):1011-1025.
[11]Shao QQ,Zhang TP,Zhao WJ,et al.Filamin A:insights into its exact role in cancers[J].Pathol Oncol Res,2015 [Epub ahead of print].
[12]Kim H,Sengupta A,Glogauer M,etal.Filamin A regulates cell spreading and survival via beta1 integrins[J].Exp Cell Res,2008,314(4):834-846.
[13]史建伟,王士杰,王贵英.细丝蛋白A参与肿瘤发生发展的研究进展[J].肿瘤防治研究,2010,37(8):955-958.
[14]史建伟,王贵英.细丝蛋白A参与调节器官发育的研究进展[J].癌变·畸变·突变,2012,24(1):78-80.
[15]Zhu TN,He HJ,Kole S,et al.Filamin A-mediated downregulation of the exchange factor Ras-GRF1 correlateswith decreased matrixmetalloproteinase-9 expression in human melanoma cells[J].JBiol Chem,2007,282(20):14816-14826.
[16]Campos LS,Rodriguez YI,Leopoldino AM,etal.Filamin A expression negatively regulates sphingosine-1-phosphateinduced NF-κB activation in melanoma cells by inhibition of Akt signaling[J].Mol Cell Biol,2015,36(2):320-329.
[17]薛鹏,周翡,李宁,等.胃癌中PTEN和p-AKT蛋白的表达及其临床意义与预后分析[J].肿瘤,2012,32(4):281-285.
[18]Shtilbans V,Wu M,Burstein DE.Current overview of the role of Akt in cancer studies via applied immunohistochemistry[J].Ann Diagn Pathol,2008,12(2):153-160.
[19]Leystra AA,Deming DA,Zahm CD,et al.Mice expressing activated PI3K rapidly develop advanced colon cancer[J]. Cancer Res,2012,72(12):2931-2936.
[20]Zhang Y,Yao X,Jiang C,et al.Expression of PI3K,PTEN and Akt in small intestinal adenocarcinoma detected by quantum dots-based immunofluorescence technology[J]. Cancer Biomark,2013,13(4):299-305.
·临床研究·
Expressions of filam in A and protein kinase B in small bowel adenocarcinoma and their significance
ZHANG Hongbin,ZHANG Chaojun
(Department of General Surgery,Navy General Hospital,Beijing 100048,China)
[Abstract]Objective To explore the expression of filamin A(FLNA)and PKB in small bowel adenocarcinoma and to analyze their clinical significance.M ethods Reverse transcription polymerase chain reaction(RT-PCR),Immunohistochemistry(SP)RT-PCR and Western blotmethod were respectively used to detect the expression of FLNA and protein kinase B(PKB)in 65 specimens of small bowel adenocarcinoma and para carcinoma tissues(5 cm distant to themargin of small bowel cancer and no cancer infitration in microscope).Results The expression of FLNA mRNA was significantly lower in small bowel adenocarcinoma tissues than that in the corresponding normal tissues,while the expression of PKBmRNA was significantly higher in small bowel adenocarcinoma tissues than that in the corresponding normal tissues(P<0.05).The expression of FLNA protein was significantly lower in small bowel adenocarcinoma tissues than that in the corresponding normal tissues,while the expression of PKB protein was significantly higher in small bowel adenocarcinoma tissues than that in the corresponding normal tissues(P<0.05).Expression levels of FLNA and PKB were correlated with the TNM staging,lymphnodemetastasis,and the depth of tumor invasion,butwere not correlated with gender,age and the differentiation degree(P>0.05).Spearman rank correlation coefficient showed that the expression level of FLNA was in positive correlation with the PKB level(r=-0.289,P=0.008).Conclusion The expression of FLNA and PKB proteinsmay be correlated with the occurrence,development of small bowel adenocarcinoma.Highly activated phosphatidylcholine 3-kinase(PI3K)/PKB signaling pathway maybe a potential therapeutic target for treatment.
[Key words]Small bowel neoplasms;Filamin A(FLNA);Protein kinase B(PKB);Phosphatidylcholine 3-kinase(PI3K);Immunohistochemistry;Reverse transcriptase-polymerase chain reaction(RT-PCR);Western blot
(收稿日期:2015-12-20 本文编辑:徐海琴)
[基金项目]国家自然科学基金(810370479)
doi:10.3969/j.issn.2095-3097.2016.01.004
[中图分类号]R735.3+2;Q55.7
[文献标志码]A
[文章编号]2095-3097(2016)01-0014-05
