缺氧诱导因子-1靶基因参与生酮饮食提高大脑中动脉闭塞模型小鼠脑缺血耐受作用
2016-03-22国敏,崔梅,董强
国 敏,崔 梅,董 强
缺氧诱导因子-1靶基因参与生酮饮食提高大脑中动脉闭塞模型小鼠脑缺血耐受作用
国 敏,崔 梅,董 强
[摘要]目的 探究生酮饮食对大脑中动脉闭塞(middle cerebral artery occlusion,MCAO)模型小鼠的作用及缺氧诱导因子-1靶基因参与机制。方法 小鼠随机分为正常对照组及标准饮食组、高碳水化合物饮食组、生酮饮食组,建模前通过3周饮食干预后,饮食干预的3组小鼠建造MCAO模型,正常对照组给予标准饮食但不进行MCAO造模。2,3,5-三苯基氯化四氮唑染色观察脑梗死体积,Longa评分法对模型鼠进行神经功能评分,聚合酶链反应检测缺血区脑组织缺氧诱导因子-1下游靶基因红细胞生成素、血管内皮生长因子、葡萄糖转运体1、单羧酸转运体4的mRNA表达量。结果 生酮饮食组小鼠脑组织梗死体积更小,神经功能评分更低,缺血区脑组织中红细胞生成素、血管内皮生长因子、葡萄糖转运体1、单羧酸转运体4的mRNA表达显著增加。结论 生酮饮食可能是通过增加缺血区缺氧诱导因子-1靶基因表达,从而提高MCAO小鼠脑组织对缺血的耐受性。
[关键词]生酮饮食;大脑中动脉闭塞;缺氧诱导因子-1靶基因;卒中
[作者单位]200040上海,复旦大学附属华山医院神经内科(国敏,崔 梅,董 强)
缺血性卒中通常由局部脑组织血流量降低引起,是目前世界范围内引起死亡和终身残疾的主要原因之一[1]。脑组织对缺血、缺氧损伤敏感,但是研究发现预先给予非致死性缺血、缺氧刺激脑组织能够产生内源性保护机制,称为耐受[2]。缺氧预适应是目前研究较多的诱导局部或全脑缺血后缺血耐受的方法。将动物暴露于轻度低氧环境,观察到脑缺氧预适应能减轻缺血性卒中动物模型脑梗死体积[3-4]。缺氧诱导因子-1(hypoxia inducible factor-1,HIF-1)是缺氧预适应时激活的关键因子[5-6],HIF-1作为转录因子可调节下游靶基因,如红细胞生成素(erythropoietin,EPO)、血管内皮生长因子(vascular endothelial growth factor,VEGF)、葡萄糖转运体1(glucose transporter 1,GLUT1)、单羧酸转运体4(monocarboxylate transporter 4,MCT4)的表达,通过促进代谢、血管生成、葡萄糖转运等作用参与损伤修复,提高脑缺氧耐受[7-8]。尽管缺氧预适应在实验中有效,但临床上卒中对象为人,卒中发生时间也无法准确预知,其应用于临床难以实施,亟待寻找临床可行的其他干预方法。
生酮饮食为高脂肪、低碳水化合物饮食,供给机体代谢所需的碳水化合物较少,因此脂肪成为主要能量来源。生酮饮食最初作为癫痫的非药物疗法取得较好的临床效果[9],后来研究发现其对阿尔茨海默病和痴呆均有临床疗效[10],但生酮饮食对缺血性卒中的作用仍有待阐明。有研究报道[11],生酮饮食可增加缺血脑组织HIF-1含量,但HIF-1下游靶基因在生酮饮食中作用机制仍需探究。为进一步阐明生酮饮食对缺血性卒中HIF-1靶基因的影响,本研究拟采用大脑中动脉闭塞(middle cerebral artery occlusion,MCAO)小鼠模型,探究生酮饮食对HIF-1下游靶基因的表达及脑缺血损伤的影响。
1 材料与方法
1.1实验动物分组及处理 正常健康8~10周龄雌性C57BL/6小鼠24只[上海斯莱克实验动物有限公司,SCXK-(沪)-2012-0002)],体质量18~25 g,清洁级。小鼠随机分为正常对照(normal control,NC)组、标准饮食(standard diet,SD)组、高碳水化合物饮食(high carbohydrate,HC)组、生酮饮食(ketogenic diet,KD)组4组(每组6只)。NC组给予标准饮食但不进行MCAO造模,其他3组动物饮食配比情况见表1。各组在进行不同饮食干预前,所有小鼠饥饿处理18 h以平衡个体间血糖水平后,分别接受不同饮食干预3周[11]。
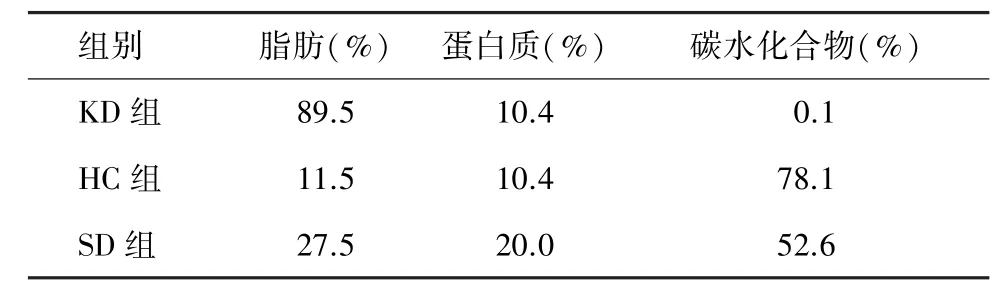
表1 小鼠饮食配比表
1.2方法
1.2.1MCAO模型 饮食处理3周后,SD组、HC组及KD组小鼠腹腔注射氯胺酮(65 mg/kg)和甲苯噻嗪(6mg/kg)进行麻醉,头部置于立体定位仪(KOPF,美国,Stoelting公司),四肢放置在加热垫上,使体温保持在37℃。将激光多普勒探头置于颅骨前囟旁开5 mm、后开2 mm处,石蜡包被的尼龙线栓从颈外动脉置入至大脑中动脉,同时用激光多普勒血流仪观察局部脑血流量降至基线水平的25%以下。45 min后取出尼龙线栓并颈外动脉进行永久性结扎,颈总动脉暂时结扎后恢复灌注。只有缺血期血流降至基线水平的25%以下、灌注期血流恢复80%以上的小鼠纳入后续实验。
1.2.2小鼠神经功能评定 MCAO模型72 h后,用Longa评分法对模型小鼠神经功能进行评定。评价标准:0级,无缺陷;1级,不能伸展对侧前肢;2级,对侧前肢屈曲;3级,轻度向对侧转圈;4级,严重的转圈;5级,对侧瘫痪。神经功能3~4级小鼠为成功模型。
1.2.3脑梗死体积测量 MCAO模型小鼠脑梗死72 h后处死,将脑组织在-20℃冰冻20 min,用切片机切成5~6片、厚度2 mm。37℃下脑片置于2,3,5-三苯基氯化四氮唑(2,3,5-triphenyl tetrazolium chloride,TTC)染色测量脑梗死体积,TTC染液避光染色1 h,期间翻转脑片数次使着色均匀。对每个脑片进行拍照,Image J软件计算梗死体积。
1.2.4HIF-1下游靶基因 MCAO模型小鼠脑梗死72 h后处死,断头取脑组织,取大脑中动脉供血区脑皮质,组织匀浆,用RNA提取试剂盒(美国,Qiagen公司)提取总RNA,用SuperScriptⅢ试剂盒(美国,Invitrogen公司)合成互补DNA,聚合酶链反应(polymease chain reaction,PCR)检测HIF-1下游靶基因。PCR反应采用SYBR GreenⅠMaster Mix试剂盒(美国,Biored公司),反应体系含上、下游引物各1μL,各基因所用引物见表2,操作均按照说明书进行。所有的样品均设置副孔,并作标准曲线以计算各样本基因表达量,结果以目的基因mRNA与β-actin mRNA表达量的比值(%)表示。
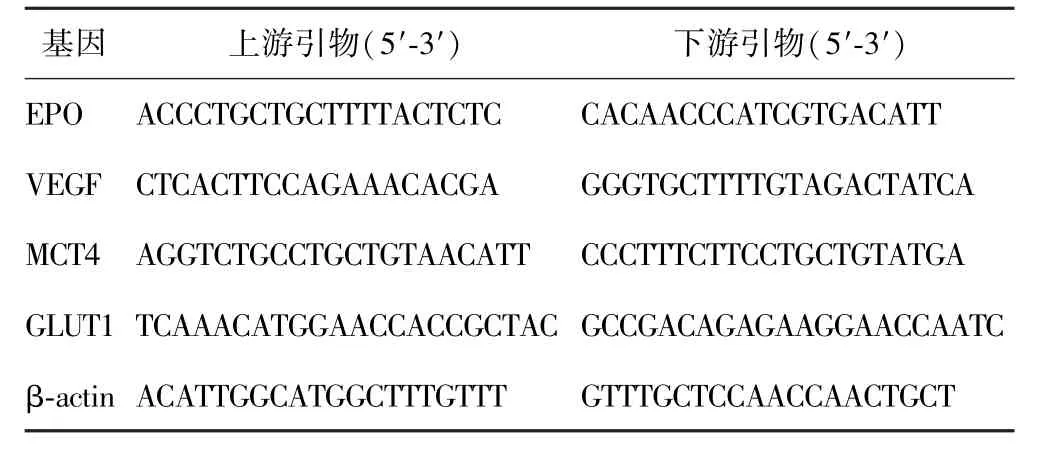
表2 目的基因引物序列
1.3统计学处理 应用SPSS 20.0软件,计量资料以均数±标准差(±s)表示,多组计量资料比较采用单因素方差分析(ANOVA),P<0.05为差异有统计学意义。
2 结果
2.1脑梗死体积及神经功能评分 MCAO模型建立72 h后不同饮食组小鼠的脑梗死体积测量(图1),SD组梗死体积平均为47 mm3,HC组梗死体积平均为48 mm3,神经功能评分均为3分(图2)。与SD组和HC组相比,KD组脑梗死体积减小(P<0.05),平均为28mm3;KD组神经功能评分降低(P<0.05),为2分。
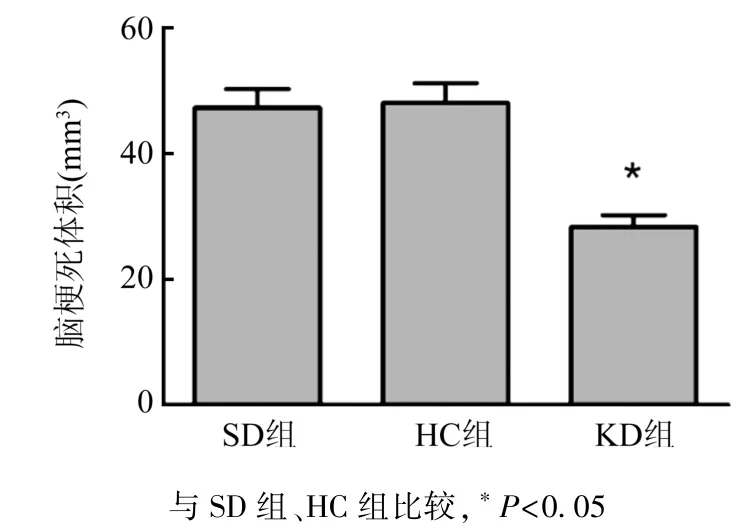
图1 MCAO模型脑梗死体积
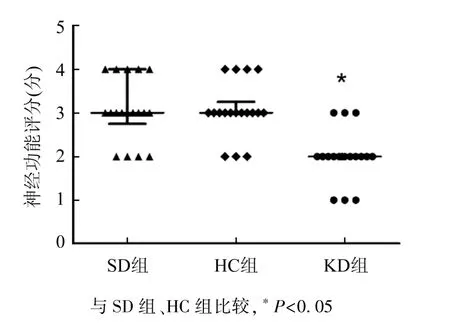
图2 MCAO模型神经功能评分
2.2HIF-1下游靶基因mRNA表达 大脑中动脉供血区脑皮质HIF-1靶基因mRNA,与NC组相比,3个饮食组缺血脑组织中VEGF、EPO、GLUT1、MCT4 的mRNA表达均增加,但是KD组mRNA表达量更高(P<0.01)分别增至正常对照组的3.4倍、14倍、3倍和3.7倍;与SD组、HC组相比,KD组表达量的增加也有统计学意义(P<0.05,图3)。
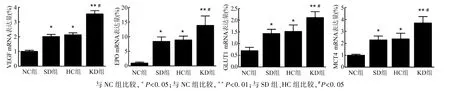
图3 HIF-1下游靶基因mRNA表达量
3 讨论
生酮饮食是一种高脂肪、低碳水化合物饮食,脂肪代谢产生大量酮体包括β羟基丁酸、乙酰乙酸和丙酮,可经单羧酸转运体转运入细胞,在葡萄糖缺乏时可作为脑组织的能量来源[10-12]。在MCAO小鼠模型股静脉注射β羟基丁酸能通过提高缺血期脑组织能量代谢效率而减轻脑组织水肿,减轻梗死程度[11]。实验观察到3周生酮饮食可减小MCAO小鼠脑梗死体积,神经功能评分好转,说明生酮饮食可提高脑缺血耐受性。
HIF-1由HIF-1α亚基和HIF-1β亚基组成,HIF-1β亚基恒定表达,而HIF-1α亚基在细胞缺氧时增加,从转录水平调节促细胞存活信号通路[7]。正常状态下,HIF-1α表达后脯氨酸残基被羟基化,通过泛素连接酶介导蛋白酶体迅速降解,细胞内无HIF-1α亚基累积[13]。生酮饮食干预时,酮体代谢使得细胞内琥珀酸盐含量增加[11],从而抑制脯氨酸羟化酶,未被羟基化的HIF-1α亚基逃脱蛋白酶体的降解,HIF-1α含量增加并与HIF-1β亚基结合为二聚体,形成有活性的HIF复合体。HIF-1作为转录因子可调节一系列下游基因,包括VEGF、EPO、GLUT1和MCT4。
VEGF可促进血管生成,脑缺血、缺氧时VEGF在神经元和星形胶质细胞表达快速增加[14]。本研究也观察到MCAO处理后,3组小鼠缺血脑组织中VEGFmRNA表达量均有增加。有研究报道,VEGF可减少低氧状态培养的海马神经元死亡[15],局部补充VEGF减小梗死体积、减轻局部脑水肿[16],脑缺血损伤后48 h静脉注射VEGF提高神经功能预后[17]。生酮饮食干预也观察到MCAO小鼠脑梗死体积下降、神经功能评分好转,VEGF mRNA表达量较SD组和HC组更高,提示VEGF参与生酮饮食提高脑缺血耐受作用。
EPO表达也受HIF-1调节,其作为红细胞生长因子在缺血、缺氧损伤动物模型中也具有增强血管生成的作用,且研究发现EPO及EPO受体在中枢均有表达[18-19]。免疫荧光双染色显示缺血损伤8 h 后EPO主要在神经元表达,1周后主要在星形胶质细胞表达[20],星形胶质细胞表达的EPO可作为旁分泌因子作用于神经元。MCAO模型小鼠建模72 h前缺氧预适应3 h,可使缺血1 h后脑EPO转录水平增加7倍[11],在体、离体实验均支持给予EPO干预对神经元的缺氧损伤具有保护作用[3,21]。本研究观察到MCAO缺血处理后,SD组及HC组小鼠EPO mRNA水平升高,而KD组升高约14倍,说明EPO在生酮饮食提高脑缺血耐受中也发挥作用。
GLUT1在内皮细胞广泛分布,是跨血脑屏障转运葡萄糖的主要转运体[22]。细胞外葡萄糖浓度很高时,脑内皮细胞GLUT1表达减少,跨血脑屏障葡萄糖转运减少[23]。MCT4属于单羧酸转运体家族,可以跨细胞膜双向转运乳酸,可摄取细胞外乳酸储存作为能量,细胞内乳酸增多时MCT4也可将其转运出细胞外,防止酸中毒。MCT4主要分布在星形胶质细胞[24],缺氧时MCT4可经HIF-1诱导表达增加[25],星形胶质细胞通过糖酵解释出乳酸被神经元摄取作为能量来源,此过程依赖MCT4[26]。葡萄糖和氧气剥夺条件下观察到神经元死亡,而神经元和胶质细胞共培养体系中神经元存活[27]。所以,GLUT1、MCT4是脑缺血时增加神经元能量供应的重要分子。本实验观察到缺血时GLUT1、MCT4的mRNA表达增加,KD组表达量更高,与其提高脑缺血耐受作用一致,说明GLUT1和MCT4可能通过增加神经元供能而发挥保护作用。
综上,本研究证实了生酮饮食能提高MCAO大鼠脑缺血耐受性,其作用可能是通过上调HIF-1靶基因水平实现,生酮饮食能否用于缺血性卒中患者仍需进一步临床研究。
【参考文献】
[1]Lopez AD,Mathers CD,Ezzati M,et al.Global and regional burden of disease and risk factors,2001:systematic analysis of population health data[J].Lancet,2006,367(9524): 1747-1757.
[2]Kitagawa K,Matsumoto M,Tagaya M,et al.‘Ischemic tolerance'phenomenon found in the brain[J].Brain Res,1990,528(1):21-24.
[3]Prass K,Scharff A,Ruscher K,et al.Hypoxia-induced stroke tolerance in themouse ismediated by erythropoietin [J].Stroke,2003,34(8):1981-1986.
[4]Bernaudin M,Nedelec AS,Divoux D,et al.Normobaric hypoxia induces tolerance to focal permanent cerebral ischemia in association with an increased expression ofhypoxiainducible factor-1 and its target genes,erythropoietin and VEGF,in the adultmouse brain[J].JCereb Blood Flow Metab,2002,22(4):393-403.
[5]Taie S,Ono J,Iwanaga Y,et al.Hypoxia-inducible factor-1 alpha has a key role in hypoxic preconditioning[J].JClin Neurosci,2009,16(8):1056-1060.
[6]Wacker BK,Perfater JL,Gidday JM.Hypoxic preconditioning induces stroke tolerance in mice via a cascading HIF,sphingosine kinase,and CCL2 signaling pathway[J]. JNeurochem,2012,123(6):954-962.
[7]Semenza GL.HIF-1:mediator of physiological and pathophysiological responses tohypoxia[J].JAppl Physiol(1985),2000,88(4):1474-1480.
[8]Sharp FR,Bernaudin M.HIF1 and oxygen sensing in the brain[J].Nat Rev Neurosci,2004,5(6):437-448.
[9]Sinha SR,Kossoff EH.The ketogenic diet[J].Neurologist,2005,11(3):161-170.
[10]Gasior M,RogawskiMA,Hartman AL.Neuroprotective and disease-modifying effects of the ketogenic diet[J].Behav Pharmacol,2006,17(5/6):431-439.
[11]Puchowicz MA,Zechel JL,Valerio J,et al.Neuroprotection in diet-induced ketotic rat brain after focal ischemia[J].J Cereb Blood Flow Metab,2008,28(12):1907-1916.
[12]Pierre K,Pellerin L.Monocarboxylate transporters in the central nervous system:distribution,regulation and function[J].JNeurochem,2005,94(1):1-14.
[13]Huang LE,Gu J,Schau M,et al.Regulation of hypoxia-inducible factor 1alpha is mediated by an O2-dependent degradation domain via the ubiquitin-proteasome pathway [J].Proc Natl Acad Sci USA,1998,95(14):7987-7992.
[14]Pichiule P,Agani F,Chavez JC,et al.HIF-1 alpha and VEGF expression after transient global cerebral ischemia [J].Adv Exp Med Biol,2003,530:611-617.
[15]Jin KL,Mao XO,Nagayama T,et al.Induction of vascular endothelial growth factor receptors and phosphatidylinositol 3′-kinase/Akt signaling byglobal cerebral ischemia in the rat[J].Neuroscience,2000,100(4):713-717.
[16]Hayashi T,Abe K,Itoyama Y.Reduction of ischemic damage by application of vascular endothelial growth factor in rat brain after transient ischemia[J].J Cereb Blood Flow Metab,1998,18(8):887-895.
[17]Zhang ZG,Zhang L,Jiang Q,et al.VEGF enhances angiogenesis and promotes blood-brain barrier leakage in the ischemic brain[J].JClin Invest,2000,106(7):829-838.
[18]Morishita E,Masuda S,Nagao M,et al.Erythropoietin receptor is expressed in rat hippocampal and cerebral cortical neurons,and erythropoietin prevents in vitro glutamateinduced neuronal death[J].Neuroscience,1997,76(1): 105-116.
[19]Marti HH,Wenger RH,Rivas LA,et al.Erythropoietin gene expression in human,monkey and murine brain[J]. Eur JNeurosci,1996,8(4):666-676.
[20]Mu D,Chang YS,Vexler ZS,et al.Hypoxia-inducible factor 1alpha and erythropoietin upregulation with deferoxamine salvage after neonatal stroke[J].Exp Neurol,2005,195(2):407-415.
[21]Baranova O,Miranda LF,Pichiule P,et al.Neuron-specific inactivation of the hypoxia inducible factor 1 alpha increases brain injury in amousemodel of transient focal cerebral ischemia[J].JNeurosci,2007,27(23):6320-6332.
[22]Guo X,Geng M,Du G.Glucose transporter 1,distribution in the brain and in neural disorders:its relationship with transport of neuroactive drugs through the blood-brain barrier[J].Biochem Genet,2005,43(3/4):175-187.
[23]Alpert E,Gruzman A,Riahi Y,et al.Delayed autoregulation of glucose transport in vascular endothelial cells[J]. Diabetologia,2005,48(4):752-755.
[24]Lim KS,Lim KJ,Price AC,et al.Inhibition of monocarboxylate transporter-4 depletes stem-like glioblastoma cells and inhibits HIF transcriptional response in a lactate-independentmanner[J].Oncogene,2014,33(35):4433-4441.
[25]Ullah MS,Davies AJ,Halestrap AP.The plasmamembrane lactate transporter MCT4,but not MCT1,is up-regulated by hypoxia through a HIF-1alpha-dependent mechanism [J].JBiol Chem,2006,281(14):9030-9037.
[26]Rosafio K,Pellerin L.Oxygen tension controls the expression of themonocarboxylate transporter MCT4 in cultured mouse cortical astrocytes via a hypoxia-inducible factor-1α-mediated transcriptional regulation[J].Glia,2014,62 (3):477-490.
[27]Gao C,Zhou L,Zhu W,et al.Monocarboxylate transporterdependentmechanism confers resistance to oxygen-and glucose-deprivation injury in astrocyte-neuron co-cultures [J].Neurosci Lett,2015,594:99-104.
Ketogenic dietmay im prove ischem ic tolerance ofm idd le cerebral artery occlusion m ice through up-regulation of hypoxia inducible factor-1 target genes
GUO Min,CUIMei,DONGQiang
(Department of Neurology,Huashan Hospital,Fudan University,Shanghai200040,China)
[Abstract]Objective To explore the effects of ketogenic diet on middle cerebral artery occlusion(MCAO)mice and the role of hypoxia inducible factor-1(HIF-1)target genes in this process.M ethods C57BL/6 mice were random ly allocated into four groups:standard diet group,high carbohydrate diet group,ketogenic diet group and control group.Mice of the 3 intervention groups were fed with corresponding diets for 3 weeks and were afterwards made into MCAO mice models.Control group was fed with standard diet for 3 weeks without MCAO treatment.Stroke volume wasmeasured by 2,3,5-triphenyl tetrazolium chloride(TTC)staining.Neurological function was accessed by Longa scoringmethod.Polymerase chain reaction(PCR)was used to detectmRNA expression quantity of HIF-1 downstream target genes including erythropoietin(EPO),vascular endothelial growth factor(VEGF),glucose transport 1(GLUT1)and monocarboxylic transporter 4 (MCT4)in the ischemic region.Results Compared with the other 3 groups,ketogenic diet group showed smaller stroke volume,better neurological score and higher mRNA expression quantity of HIT-1 downstream target genes.Conclusion Ketogenic dietmay improve brain ischemic tolerance of MCAOmice through up-regulation of HIF-1 target genes.
[Key words]Ketogenic diet;Middle cerebral artery occlusion(MCAO);Hypoxia inducible factor-1(HIF-1)target genes;Stroke
(收稿日期:2015-12-18 本文编辑:徐海琴)
[通讯作者]董 强,E-mail:dong_qiang@fudan.edu.cn
[基金项目]国家自然科学基金(81271295)
doi:10.3969/j.issn.2095-3097.2016.01.002
[中图分类号]R743.33-332
[文献标志码]A
[文章编号]2095-3097(2016)01-0005-05
