高pH下催化H2O2对羟丙基瓜胶氧化降解
2016-03-21胡龙刚
张 洁,胡龙刚,陈 刚!,谢 璇
( 1.西安石油大学化学化工学院,陕西西安710065; 2.中国石油长庆油田化工集团有限公司,陕西西安710021)
高pH下催化H2O2对羟丙基瓜胶氧化降解
张洁1,胡龙刚1,陈刚1!,谢璇2
( 1.西安石油大学化学化工学院,陕西西安710065; 2.中国石油长庆油田化工集团有限公司,陕西西安710021)
摘要:研究了在金属配合物FeL、CoL、NiL催化下,H2O2对羟丙基瓜胶的氧化降解效能.结果表明,3种配合物对H2O2均有一定的催化效果,在pH为5.0~9.0的范围内都具有较好的催化作用.在温度为30℃,pH= 5.0,H2O2用量为羟丙基瓜胶质量分数的5.0%,催化剂FeL用量为H2O2物质的量的1.0%,30 min时,该体系可将羟丙基瓜胶黏度从430 mPa·s降低至72.92 mPa·s,降黏率为83.04%,将其相对分子质量从2×106降解至6 623.
关键词:金属配合物;催化氧化;过氧化氢;羟丙基瓜胶
典型的Fenton体系是在弱酸性环境下,由于Fe(Ⅱ)催化H2O2分解时的活化能较低( 34.9 kJ· moL-1),反应过程中迅速产生羟基自由基HO·等大量具有高氧化活性的中间态物质(其中活性最强的羟基自由基HO·的氧化还原电位高达2.20 V),进而这些中间态物质将有机物高效氧化降解[1-2].该体系可将大多数有机物氧化降解,应用十分广泛,而一般化学氧化法难以企及.然而,由于大多数有机废弃物呈中性或碱性,且废弃物的处理标准大多规定中性排放,因此采用Fenton法时需要前后调节体系的pH,很大程度上制约了Fenton体系的应用范围.为拓宽Fenton法的适用范围,研究人员从配合物、类铁金属离子、固体催化剂等方面开展工作,取得了明显的进展[1].如GOODELL等[3]研究配合物—Fenton体系时发现,不同配合物在Fenton体系中拓宽pH的范围不同,草酸可使pH拓宽至4.0,苯氧基类可使pH拓宽至6.0; AYRTON等[4]研究了Fe(Ⅲ)类Fenton体系pH应用范围,发现加入大量FeCl3后可将体系的pH拓宽至5.0; MOLINA 等[5]利用合成的固体催化剂催化H2O2氧化苯酚,发现pH为6.5时对TOC的去除率较大,优于pH为3.0时的去除率,且H2O2的用量较小.基于此,本文作者制备了3种金属配合物催化剂,催化H2O2对羟丙基瓜胶进行氧化降解,并对配合物Fenton体系的应用范围进行进一步的探索.
1 实验部分
1.1原料与仪器
CH3COOH、NaOH、FeCl3·6H2O、Co ( CH3COO)2·4H2O、NiCl2·6H2O、H2O2(质量分数为30%)均为分析纯,金属离子配合物( FeL、CoL、NiL)为胺羧有机配体与金属氯化物制备的配位化合物,羟丙基瓜胶(相对分子质量为200万)为陕西延长石油(集团)有限责任公司(延长油矿管理局)提供;乌氏黏度计(上海精密科学仪器有限公司).
1.2实验原理
假定液体流动时没有湍流发生,即外加力F全部用以克服液体对流动的黏滞阻力,则可将牛顿黏性流动定律应用于液体在毛细管中的流动得到泊松义耳( Poiseuille)定律,又称R4定律:
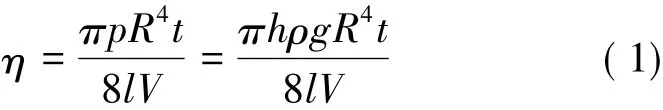
式中:η为黏度,Pa·s; t为试液流过乌氏黏度计计时标线E、F的时间的数值,s; p为液体流动时压强,Pa; R为毛细管半径,m; V为流经毛细管液体体积,m3; l为毛细管的长度,m.
实验证明,当聚合物、溶剂、温度确定以后,黏度与聚合物相对分子质量符合包含两个参数K、a的经验公式,即Mark-Houwink非线性方程:

式中:[η]为特性黏度,dL·g-1; Mη为黏均摩尔质量,K、a是与高聚物摩尔质量、温度、溶剂性质有关的常数[6].实验中K =3.8×10-4,a=0.723[7].
表达聚合物降解程度的另一重要指标即为降黏率,其计算公式如下:

式中:φ为降黏率;η1为所测空白聚合物黏度,430 mPa·s;η2为聚合物降解后黏度.
1.3实验方法
配制质量分数为0.6%的羟丙基瓜胶水溶液,密封后室温下放置4 h使其溶胀充分.向烧杯中加入10 mL上述溶胀充分的羟丙基瓜胶溶液,再加入一定量的H2O2、催化剂,补充蒸馏水使溶液总体积达到20 mL,搅拌均匀后倒入乌氏黏度计中,在30℃恒温水浴锅中恒温1 min,用秒表测量液体流经乌氏黏度计中毛细管所需时间,根据式( 1)计算液体的黏度,根据式( 3)计算其降黏率.按一定比例将降解后的羟丙基瓜胶溶液稀释成一系列浓度的溶液,用秒表测量其流经毛细管所需时间,根据式( 1)、( 2)计算羟丙基瓜胶降解后的黏均相对分子质量.
2 结果与讨论
2.1 H2O2对羟丙基瓜胶的降解
按照1.3中的实验方法,在温度为30℃,pH=7.0时,考察H2O2用量对羟丙基瓜胶降解的影响.H2O2用量分别为羟丙基瓜胶质量分数的0.1%、0.5%、1.0%、5.0%、10.0%、20.0%.结果如图1所示.

图1 H2O2加量对羟丙基瓜胶降解的影响Fig.1 Effect of H2O2addition on degradation of hydroxypropyl guar gum
从图1可见,无催化剂时,H2O2对羟丙基瓜胶有一定的氧化降解能力.H2O2的加量与其对羟丙基瓜胶的降解效能呈现出先增强后减弱的趋势.可能的原因是随着H2O2加量的增加,生成的羟基自由基HO·等高活性物质相应增加,然而随着H2O2加量的进一步增加,过多的H2O2不仅会无效分解而且可能吸收生成的羟基自由基HO·,导致对聚合物的降解效率下降.所以,确定在后续实验中H2O2的加量为羟丙基瓜胶质量分数的5.0%.
2.2配合物催化H2O2对羟丙基瓜胶的降解
在温度为30℃、pH=7.0、H2O2用量为羟丙基瓜胶质量分数的5.0%时,考察配合物FeL用量对羟丙基瓜胶降解效能的影响.催化剂用量分别为H2O2物质的量的0.5%、1.0%、2.0%、5.0%、10.0%,结果如图2所示.从图2可见,催化剂FeL的加量与其对H2O2的催化效能呈现出明显的正相关关系,即随着催化剂加量的增加,羟丙基瓜胶的降解速率和效率均有不同幅度的提升,当配合物催化剂FeL的加量为10.0%,30 min时聚合物的黏度降低至73.83 mPa· s,降黏率为82.83%.
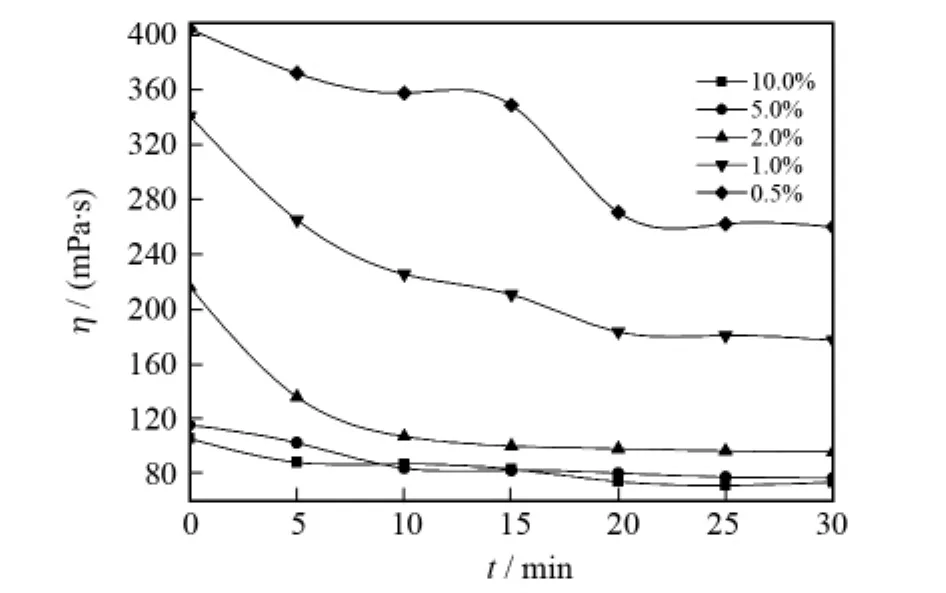
图2 FeL对羟丙基瓜胶降解的影响Fig.2 Effect of FeL on degradation of hydroxypropyl guar gum
配合物CoL用量对羟丙基瓜胶降解效能的影响如图3所示.从图3可见,配合物CoL可以较好地催化H2O2对羟丙基瓜胶的氧化降解.且随着催化剂用量的增加,H2O2对羟丙基瓜胶的降解效能呈现出先减小后增大的趋势,如催化剂CoL用量分别为0.5%、2.0%、10.0%,30 min时,羟丙基瓜胶的黏度分别为252.10、292.48、165.28 mPa·s,降黏率分别为41.37%、31.98%、61.56%.可能的原因是随着催化剂用量的增加,解离出的金属离子被羟基自由基HO·所氧化,消耗了部分羟基自由基HO·,导致其对羟丙基瓜胶的降解效能下降,而随着催化剂用量的进一步增加,生成羟基自由基HO·的速率和效率均增加,大量的羟基自由基HO·可以迅速将羟丙基瓜胶氧化降解,使其黏度快速下降.

图3 CoL对羟丙基瓜胶降解的影响Fig.3 Effect of CoL on degradation of hydroxypropyl guar gum
配合物NiL用量对羟丙基瓜胶降解效能的影响如图4所示.从图4可见,配合物催化剂NiL对H2O2氧化降解羟丙基瓜胶有一定的催化效能,且催化效能与配合物催化剂的用量呈现正相关关系,但与配合物催化剂FeL、CoL相比,其催化效率较低.

图4 NiL对羟丙基瓜胶降解的影响Fig.4 Effect of NiL on degradation of hydroxypropyl guar gum
综上所述,3种配合物催化剂对H2O2的催化效能大小顺序依次为FeL>CoL>NiL,可能的原因是Co、Ni的配位数较低,与配体L形成配合物后,剩余的空白配位点及弱配位点较少,使得H2O2与剩余的空白配位点及弱配位点的有效接触下降,从而导致催化效能较弱.因此,我们决定在此基础上进一步对配合物催化剂FeL进行考察,探索其pH适用范围,拓宽其应用环境.
2.3不同pH下配合物FeL催化H2O2对羟丙基瓜胶的降解
在温度为30℃,H2O2用量为羟丙基瓜胶质量分数的5.0%,配合物FeL用量为H2O2物质的量的1.0%条件下,用CH3COOH、NaOH调节溶液的pH为5.0~9.0,探索不同pH时配合物FeL催化下H2O2对羟丙基瓜胶的降解效能,结果如图5所示.

图5 不同pH下配合物FeL对羟丙基瓜胶降解的影响Fig.5 Effect of complex FeL on degradation of hydroxypropyl guar gum under different pH
从图5可见,在pH为5.0~9.0,配合物催化剂FeL均可较好的催化H2O2对羟丙基瓜胶进行氧化降解.且随着pH的增加,配合物FeL对H2O2的催化效能呈减弱趋势,如当pH分别为5.0、6.0、7.0、8.0、9.0,30 min时羟丙基瓜胶的黏度分别为72.92、78.80、76.79、158.28、175.28 mPa·s,降黏率分别为83.04%、81.67%、82.14%、63.19%、59.25%.
配合物催化剂FeL之所以能够在较为广泛的pH环境下对H2O2保持相对高效的催化效能,可能的原因主要有以下两个方面.一方面Fe( III)与配体L形成FeL配合物后,使得FeL在水中以较为稳定的形式存在,在较高的pH下不易生成Fe( OH)3沉淀,而能保持一定的催化活性物种.游离Fe( III)的催化反应机理如下所示[8-9]:

形成配合物后其可能的催化过程如下[10]:
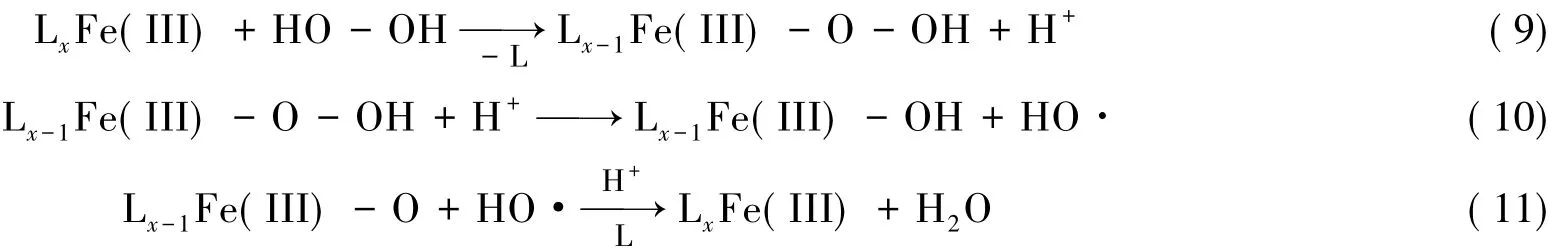
另一方面Fe( III)的配位数较大,其配位位点可多达6个,当配合物FeL存在于水溶液中与H2O2靠近时,配合物中被弱配位原子占据的配位点以及配体L占据的部分配位点可能会被取代从而与H2O2进行配位,将其活化,产生羟基自由基·OH等具有高活性的物质,进而对羟丙基瓜胶进行高效氧化降解[10-12].两方面作用的综合结果宏观表现即为该类配合物Fenton体系在较宽的pH范围内对羟丙基瓜胶具有高效的氧化降解能力.

图6 ηsP/c—c和lnηr/c—c图Fig.6 Graph of ηsP/c—c and lnηr /c—c
2.4羟丙基瓜胶相对分子质量变化
在温度为30℃,pH=5.0,H2O2用量为羟丙基瓜胶质量分数的5.0%,配合物FeL用量为H2O2物质的量的1.0%条件下,测定聚合物溶液黏度变化.将羟丙基瓜胶的最终降解液分别稀释1.1、1.2、1.3、1.4、1.5倍,重复1.3中的实验方法,测试不同稀释液在乌氏黏度计毛细管中的流出时间,计算后将不同稀释液的ηsP/c和lnηr/c对浓度c作图,结果如图6所示.从图6可知,[η]为0.22,将结果代入式( 2)得=6 623.48,即在上述优选条件下,H2O2可以将相对分子质量为2×106的羟丙基瓜胶降解到约为6 623,使其黏度大幅度降低.
3 结论
1) 3种金属配合物FeL、CoL、NiL催化下,H2O2对羟丙基瓜胶的氧化降解效能均有不同幅度地提高,其催化效能顺序为FeL>CoL>NiL;
2)在pH为5.0~9.0,金属配合物FeL对H2O2均有一定的催化性能;
3)在温度为30℃,pH = 5.0,H2O2用量为羟丙基瓜胶质量分数的5.0%,配合物FeL用量为H2O2物质的量的1.0%,30 min时,该体系可将羟丙基瓜胶黏度从430 mPa·s降低至72.92 mPa·s,降黏率为83.04%,将其相对分子质量从2×106降解至6 623.
参考文献:
[1]顾雪凡,秦芳玲,屈撑囤,等.Fenton试剂降解PAM催化剂的研究[J].油气田环境保护,2012,22( 3) : 15-17.
[2]顾雪凡,秦芳玲,陈刚.类Fenton体系催化剂的合成与催化降解聚丙烯酰胺性能研究[J].环境污染与防治,2012,34( 12) : 13-16.
[3 ]GOODELL B,JELLISON J,LIU J.Low molecular weight chelators and phenolic compounds isolated fromwood decay fungi and their role in the fungal biodegradation of wood [J].J Biotechnol,1997,53: 133-162.
[4]MARTINS A F,VASCONCELOS T G,WILDE M L.Influence of variables of the combined coagulation-Fentonsedimentation process in the treatment of trifluraline effluent[J].J Hazard Mater,2005,127: 111-119.
[5]MOLINA R,MARTINEZ F,MELERO J A.Mineralization of phenol by aheterogeneous ultrasound/Fe-SBA-15/H2O2process: Multivariate study by factorial design of experiments [J].Appl Catal B,2006,66: 197-206.
[6]华幼卿.高分子物理[M].北京:化学工业出版社,2013: 125-128.
[7]张玲,杨海洋,李化真,等.醇对瓜尔胶高分子水溶液黏度的影响[J ].高分子材料科学与工程,2011,27( 5) : 39-42.
[8]吴耀国,冯文璐,王秋华.Fenton法中拓宽pH范围的方法[J].现代化工,2008,28( 3) : 87-90.
[9]GARRIDO-RAMIREZ E G,THENG B K G,MORA M L.Clays and oxide minerals as and nanocatalysts in Fentonlike reactions: a review [J].Appl Clay Sci,2010,47 ( 3/4) : 182-192.
[10]李泓,王纪刚,宋莹盼,等.铁(Ⅲ)配合物催化双氧水氧化降解聚丙烯酰胺[J ].石油化工应用,2014,33( 3) : 85-88.
[11]李泓,王纪刚,宋莹盼,等.羟肟酸-铁(Ⅲ)配合物催化清洁氧化降解聚丙烯酰胺[J ].化工技术与开发,2014,43( 4) : 19-21.
[12]陈刚,汤颖,顾雪凡,等.2-( N,N-二羧甲基) -氨甲基-4-氯酚铜(Ⅱ)的合成结构与催化聚丙烯酰胺降解研究[J].化学研究与应用,2011,23( 3) : 268-272.
[责任编辑:吴文鹏]
Catalytic oxidation of hydroxyethyl guar by H2O2under high pH
ZHANG Jie1,HU Longgang1,CHEN Gang1*,XIE Xuan2
( 1.College of Chemistry and Chemical Engineering,Xi’an shiyou University,Xi’an 710065,Shaanxi,China; 2.Changqing Oilfield Chemical Group Limited,CNPC,Xi’an 710021,Shaanxi,China)
Abstract:In this paper,the oxidative degradation efficiency of hydroxyethyl guar gum by H2O2calalyzed by metal complexes FeL,CoL,NiL has been studied.The results showed that the three metal complexes have some catalytic effect on H2O2in the range of pH from 5.0 to 9.0.Under the conditions,the temperature 30℃,pH 5.0,5.0% H2O2( mass ratio to hydroxyethyl guar gum),1.0% FeL ( mass ratio to H2O2),the viscosity of hydroxyethyl guar gum was decreased from 430 mPa·s to 72.92 mPa ·s within 30 min,and the viscosity reduction rate was 83.04%,the molecular weight was decreased from 2×106to 6 623.
Keywords:metal complex; catalytic oxidation; hydrogen peroxide; hydroxyethyl guar gum
作者简介:陈刚( 1977-),男,副教授,研究方向为绿色油田化学品研究与应用.*通讯联系人,E-mail: gangchen@ xsyu.edu.cn.
基金项目:国家自然科学基金( 50874092).
收稿日期:2015-09-20.
中图分类号:O643.3
文献标志码:A
文章编号:1008-1011( 2016) 01-0102-05
