氧气/甲烷比对Mo/Al2O3催化剂上甲烷二氧化碳重整反应的影响
2016-03-21井德水方志刚张树友张哲武王蒙蒙林双喜姚颂东
井德水,方志刚,张树友,张哲武,王蒙蒙,林双喜,姚颂东
(辽宁科技大学化学工程学院,辽宁 鞍山 114051)
动态简讯
氧气/甲烷比对Mo/Al2O3催化剂上甲烷二氧化碳重整反应的影响
井德水,方志刚*,张树友,张哲武,王蒙蒙,林双喜,姚颂东*
(辽宁科技大学化学工程学院,辽宁 鞍山 114051)
实验研究了进料CO2/CH4、O2/CH4比对Mo/Al2O3催化剂上甲烷二氧化碳重整反应的影响,并利用XRD、H2-TPR等技术对催化剂和载体进行表征。结果表明,当n(CO2)/n(CH4)从1提高到1.5时,可以明显提高甲烷转化率和催化剂的稳定性。CO2含量的降低会使甲烷的转化率降低,且在n(CO2)/n(CH4)比降低为0.125时会使催化剂的活性快速下降。当n(O2)/n(CH4)比为0.1时,会明显提高甲烷二氧化碳的转化率和H2、CO的生成速率。但是当n(O2)/n(CH4)从0.4提高到0.6时,甲烷会与氧气发生部分氧化反应和完全氧化反应,从而抑制甲烷二氧化碳重整。
甲烷二氧化碳重整;氧添加;Mo/Al2O3催化剂;积炭
甲烷是天然气的主要成分,甲烷的化学转化分直接转化和间接转化两种。甲烷直接转化包括甲烷氧化偶联制乙烯、甲烷选择氧化制甲醇和甲醛[1]以及甲烷芳构化制芳烃等,虽然直接转化工艺近年取得了一些突破,但经合成气的间接法工业上仍是天然气化学转化的主导方法[2,3]。甲烷制合成气通常可采用方法有甲烷水蒸气重整、甲烷二氧化碳重整和甲烷部分氧化。其中,甲烷二氧化碳重整因可综合利用甲烷和二氧化碳两种温室气体资源且具有缓解能源危机和保护生态环境的意义而受到学术界的广泛关注[4-6]。
可用于甲烷二氧化碳重整反应的催化剂活性组分包括Pt、Ru、Rh、Pd等贵金属以及非贵金属Ni等[7-11]。非贵金属催化剂,如Ni、Co、Fe、Zn等,作为活性组分时催化活性较好但是抗积炭能力太弱。而当反应采用金属Pt、Rh等作为催化剂的活性组分时,虽然有更佳的催化活性和稳定性,但是价格昂贵,限制了其工业应用[12]。Mo基过渡金属碳化物在甲烷转化过程中可表现出近似于贵金属的活性且相对较为廉价,因而被众多研究者所喜爱[13,14]。然而,在甲烷CO2转化过程中,Mo基催化剂也会在其表面产生积炭导致催化剂失活。添加氧可以有效消除Mo基催化剂表面积炭,延长催化剂的使用寿命,但过量添加氧会导致Mo物种的氧化进而使反应失活。因此,选择适宜的氧添加量对反应至关重要。
本文考察了不同n(CO2)/n(CH4)、n(O2)/n(CH4)对Mo/Al2O3催化剂上甲烷二氧化碳重整反应的影响,并利用XRD、H2-TPR等技术对催化剂和载体进行表征。研究试图通过反应过程中CH4、CO2转化率,H2、CO生成速率及其相互比例的改变来探索含氧组分对Mo基催化剂甲烷反应类型及反应性能的影响。
1 实验部分
1.1 实验原料
氧化铝载体前驱体(拟薄水铝石)取自于抚顺石油化工研究院。钼酸铵(AR)购自天津市第四化学试剂厂。φ(CH4)为90%的CH4/N2混合气由大连特种气体厂配制。CO2和O2的混合气的配制在实验室自制配气装置上进行。
1.2 催化剂的制备
将拟薄水铝石在马弗炉中500℃下煅烧4h制成Al2O3。催化剂采用等体积浸渍法制备,将计量好的 (NH4)6Mo7O24·4H2O水溶液加入到制备好的载体Al2O3中,在室温下搅拌4h,静置12h。然后在80℃下4h烘干,最后在480℃焙烧4h。催化剂压片、筛分为40~60目备用。
1.3 样品表征
X光射线衍射分析采用DX-2000X型粉末衍射仪。采用CuKa靶、l.54056nm射线源,40kV管电压,30mA管电流。扫描速度20°/min,扫描范围10°~80°。
H2-TPR实验在天津先权公司TP-5000Ⅱ多用吸附仪上进行,TCD温度为80℃、桥流95mA。具体步骤如下:将200mg样品装入反应管内,首先在30mL/min的高纯N2气流中将反应管加热至300℃并恒温预处理30min,以去除水分。之后,将反应管温度降至100℃以下。将进样中气体切换为n(H2)/n(N2) =1/5的H2-N2混合气并保持流速不变。以10℃/min升温速率将反应温度从室温升至800℃,在800℃下恒温30min。
1.4 催化剂活性评价
催化剂活性评价在微型常压固定床催化反应装置上进行,石英反应管内径8mm,催化剂装填量为200mg。反应温度以10℃/min升温速率从室温升至850℃,850℃后开始取样。反应后的气体由六通阀自动取样在线分析,TCD检测器进行检测。
2 结果与讨论
2.1 表征结果
2.1.1 XRD表征
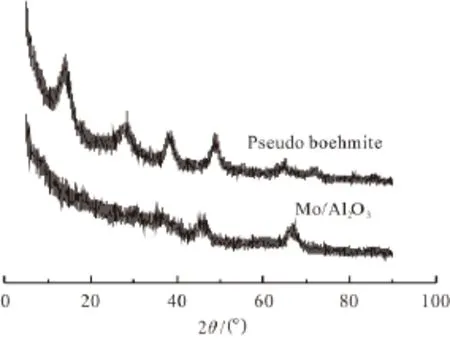
图1 Mo/Al2O3和拟薄水铝石的XRD谱图Fig.1 XRD patterns of Mo/Al2O3and pseudo boehmite
图1为拟薄水铝石、Mo/Al2O3的XRD谱图。拟薄水铝石在13.9°、28.2°、38.5°和48.7°等处出现的宽峰均为其特征衍射峰[15]。当Mo负载于氧化铝上时,只在45.8°和67.0°处观察到2个峰,这2个峰归属于γ-Al2O3,表明拟薄水铝石煅烧后已实现向氧化铝的完全转化[15]。与此同时,Mo物种高分散于催化剂表面。
2.1.2 H2-TPR表征
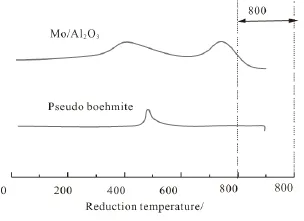
图2 Mo/Al2O3和拟薄水铝石的TPR谱图Fig.2 TPR profiles of Mo/Al2O3and pseudo boehmite
图2为拟薄水铝石、Mo/Al2O3的H2-TPR曲线。从图中可见,拟薄水铝石仅在480℃出现了一个很小的逸出峰,可能是拟薄水铝石在500℃焙烧后未分解完全所致,载体在高温下的二次分解导致逸出气体热导性能发生变化。Mo/Al2O3催化剂在400℃和750℃出现的两个还原峰分别对应于Mo物种的还原,这是由于在氢气气氛下Mo6+被还原成Mo5+、Mo4+等[16]。
2.2 反应性能
2.2.1 n(CO2)/n(CH4)对催化剂甲烷反应性能的影响
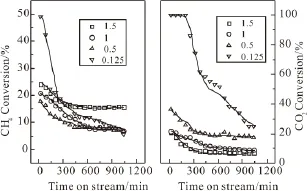
图3 n(CO2)/n(CH4)对转化率的影响Fig.3 Effect of n(CO2)/n(CH4)on conversion
图3为Mo/Al2O3催化剂上,n(CO2)/n(CH4)对甲烷转化率及CO2转化率的影响考察结果。当n(CO2)/ n(CH4)为1时,甲烷转化率和CO2转化率变化规律类似。两者分别从20min的21%和20%逐步下降并在600min的8%和9%进入一个相对稳定的平台。这是因为在反应初期,Mo/Al2O3催化剂中的活性组分MoO3被甲烷逐步还原为具有较高催化活性的Mo2C,从而使甲烷、CO2具有较高的转化率。随着反应的进行,在催化剂表面会产生积炭并覆盖,从而使催化剂活性逐步降低,表现为甲烷 、CO2的转化率降低。当n(CO2)/n(CH4)增加至1.5时,反应趋势类似但数值变化不同。甲烷转化率从最初20min的24%逐步下降至400 min的17%并在其后保持稳定。而CO2转化率从最初20min的20%逐步下降至400 min的8%,之后波动不大。原料中CO2的增加促使Mo2C表面积炭提前达到稳态。同时,高含量的CO2清除积炭的速率较快,也可使催化剂保持较高活性,并且CO2的加入也带动了甲烷的转化。当进料中n(CO2)/n(CH4)减少至0.5时,甲烷转化率降低但达到平衡的时间变化不大。
当n(CO2)/n(CH4)为0.125时,在低含量CO2下,Mo从初始MoO3被还原碳化为Mo2C,表现为反应初期可以监测到更高的甲烷和CO2转化。随着反应进行,甲烷、CO2转化率均呈现出迅速下降的趋势。这是由于催化剂表面产生积炭后,低含量的CO2清除积炭的速率太慢,导致催化剂积炭增多,催化剂迅速失活。
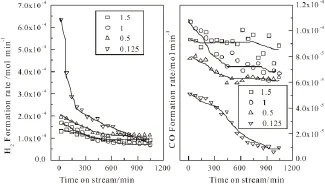
图4n(CO2)/n(CH4)对生成速率的影响Fig.4 Effect of n(CO2)/n(CH4)on formation rate
图4为Mo/Al2O3催化剂上n(CO2)/n(CH4)对H2和CO生成速率的影响的考察结果。从图中可以看出,当n(CO2)/n(CH4)在0.5~1.5之间时,H2生成速率变化不大且其规律与甲烷转化规律类似,即出现先缓慢下降后趋于平稳的趋势。而当n(CO2)/n(CH4)为0.125时,H2生成速率明显增加且下降较快。反应后期,H2生成速率趋于平稳。低含量CO2添加情况下,含氧组分的相对不足导致甲烷解离反应增加,使得H2生成速率增大。从图4可知,当n(CO2)/n(CH4)为1时,CO生成速率从20min的 1.07×10-4mol/min逐步下降并在600min的 7.0×10-5mol/min进入一个相对稳定的平台。当n(CO2)/n(CH4)增加至1.5时,CO生成速率基本保持稳定。而当n(CO2)/n(CH4)下降至0.5时,其下降趋势与n(CO2)/n(CH4)为1时类似但生成速率低。这是因为CO的生成来自于CO2的转化,高含量CO2可提高CO的生成并有效地消除催化剂表面积炭。当n(CO2)/n(CH4)比例进一步降低至0.125时,低含量CO2的消炭作用弱,会导致催化剂快速失活并降低CO2的转化和CO的生成。
2.2.2 n(O2)/n(CH4)对Mo/Al2O3催化剂上甲烷反应性能的影响
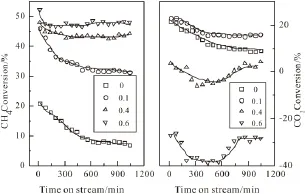
图5n(O2)/n(CH4)对转化率的影响Fig.5 Effect of n(O2)/n(CH4)on conversion
图5为氧添加对Mo/Al2O3催化剂上甲烷转化率和二氧化碳转化率的影响考察结果。进料组成中,n(CO2)/n(CH4)固定为1、n(O2)/n(CH4)从0.1变化至0.6。由图5可知,当n(O2)/n(CH4)为0.1时,甲烷的转化率由开始的47%迅速下降至300 min时的35%,然后缓慢下降至1000 min的31%。与没有氧气添加的变化规律类似,因为催化剂上产生积炭导致甲烷转化率在前300 min迅速下降,而后积炭速率下降且稳定,使转化率下降缓慢。但是甲烷转化率却高于没有氧气时的8%,这是因为添加的氧气清除积炭能力强,使Mo2C具有较高的活性。CO2的转化率由初期的20%下降至17%而后保持稳定,高于没有氧添加时的9%,这是因为甲烷的高转化带动了CO2的转化。当n(O2)/n(CH4)达到0.4时,甲烷的转化率更快稳定在44%,而CO2的转化率却在0%左右,这是因为氧气的增加,与CH4发生部分氧化反应,抑制了甲烷二氧化碳重整,导致反应尾气中CO2含量增加。随着n(O2)/n(CH4)增加至0.6时,甲烷发生完全氧化反应,甲烷的转化率稳定在47%左右,并生成大量的CO2。
图6为氧添加对Mo/Al2O3催化剂上H2生成速率和CO生成速率的影响考察结果。当n(O2)/n(CH4)为0.1时,H2和CO的生成速率由开始的2.8×10-4mol/min和1.3×10-4mol/min快速下降至300min时的2.0×10-4mol/min和9.5×10-5mol/min,而后缓慢下降至1000min的1.6×10-4mol/min和7.5×10-5mol/min,高于没有氧气添加时的7.0×10-5mol/min,与甲烷和二氧化碳转化率的变化规律类似。这是因为甲烷与二氧化碳重整速率的提高,带动H2和CO生成速率的提高。当n(O2)/n(CH4)为0.4时,甲烷的转化提高了H2生成速率,而CO的生成速率却明显降低。这是因为增加的氧气与甲烷发生部分氧化反应,并没有进行甲烷二氧化碳重整反应。当n(O2)/n(CH4)增加至0.6时,H2的生成速率为1.5×10-4mol/min,低于其他低含量氧气时H2的生成速率,但是高于没有氧气时H2的生成速率,说明CH4既发生了部分氧化反应也发生了完全氧化反应,同时导致CO的生成速率也进一步降低。

图6n(O2)/n(CH4)对生成速率的影响Fig.6 Effect of n(O2)/n(CH4)on formation rate
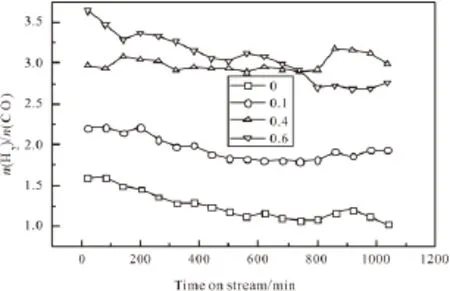
图7 不同n(O2)/n(CH4)下的n(H2)/n(CO)Fig.7 n(H2)/n(CO)under different n(O2)/n(CH4)
图7为氧添加对Mo/Al2O3催化剂上不同n(O2)/ n(CH4)下的n(H2)/n(CO)的影响考察结果。由图7可知没有氧添加时,n(H2)/n(CO)从开始的1.5快速下降至600min时的1.2,然后进入下一个平台。这是因为在反应初期,甲烷主要以裂解为主生成H2,使n(H2)/n(CO)较高。随着甲烷重整加强和裂解的减弱,从而使H2逐渐减少,使n(H2)/n(CO)逐步降低。甲烷转化稳定后,n(H2)/n(CO)也稳定在1.1左右。当n(O2) /n(CH4)升高时,由于氧气增多,生成的CO被深度氧化为CO2。可以看出n(O2)/n(CH4)为0.4和0.6时,n(H2)/n(CO)达到3左右。当n(O2)/n(CH4)为0.1时,n(H2)/n(CO)为2左右,该比例下有利于合成气的后续利用。
3 结论
(1)当n(CO2)/n(CH4)比为1.5时,可以明显提高甲烷的转化率和催化剂的稳定性。随着CO2含量的降低,甲烷的转化率降低,当n(CO2)/n(CH4)=0.125时催化剂的活性快速下降。
(2)在甲烷二氧化碳重整反应中添加氧气并改变n(O2)/n(CH4)比值,当n(O2)/n(CH4)为0.1时,CH4、CO2的转化率以及H2、CO的生成速率明显提高。但是当n(O2)/n(CH4)为0.4和0.6时,甲烷会与氧气发生部分氧化反应和完全氧化反应,从而抑制甲烷二氧化碳重整。当n(O2)/n(CH4)为0.1时,n(H2)/n(CO)为2左右,该比例下有利于合成气的后续利用。
[1]Wa ng Z C,Kretschmeret R,Dietl M,et al.Direct conveision of methane into formlehyde medioted by [Al2O3]+at room temperature[J].Angew Chem Int Ed, 2012,51:3703-3707.
[2]York A P E,Xiao T C,Green M L H,et al.Methane oxyforming for synthesis gas production[J].Catal Rev, 2007,49:511-560.
[3]Ross J R H,Keulen A N J,Hegarty M E S,et al.The catalytic conversion of natural gas to useful products[J]. Catal Today,1996,30:193-199.
[4]Zhang J G,Wang H,Dalai A K.Development of stable bimetallic catalystsforcarbon dioxidereforming of methane[J].J Catal,2007,249:300-310.
[5]Amin M H,Mantri K,Newnham J,et al.Highly stable ytterbium promoted Ni/gamma-Al2O3catalysts for carbon dioxide reforming of methane[J].Appl Catal B,2012,119-120:217-226.
[6]Rostrup-Nielsen JR,Sehested J,Norskov J K.Hydrogen and synthesis gas by steam and CO2reforming[J].Adv Catal,2002,47:65-76.
[7]Hou Z,Yokota O,Tanaka T.Characterization of Capromoted Ni/γ-Al2O3catalyst for CH4reforming with CO2[J].Appl Catal A,2003,253:381-387.
[8]Rostrup-Nielsen J R,Nielsen R.Fuels and energy for the future:The role of catalysis[J].Catal Rev Sci Technol, 2004,46:247-270.
[9]Bradford M C J,Vannice M A.CO2reforming of CH4over supported Ru catalysts[J].J Catal,1999,183:69-75.
[10]胡全红,黎先财,杨爱军.Ni/BaTiO3/γ-Al2O3催化剂的结构及其甲烷二氧化碳重整性能研究[J].天然气化工· C1化学与化工,2009,34(3):1-3.
[11]杨雅仙,秦大伟,谢辉.MgO改性Ni/Al2O3催化剂用于甲烷重整制取合成气研究 [J].天然气化工·C1化学与化工,2012,37(6):40-43.
[12]Pawelec B,Damyanova S,Arishtirova K,et al.Structural and surface features of Pt/Ni catalysts for reforming of meathane with CO2[J].Appl Catal A,2007,323:188-201.
[13]LaMont D C,Thomson W J.Dry reforeming kinetics over bulk molybdenum carbide catalyst[J].Chem Eng Sci, 2005,60:3553-3559.
[14]Claridge J B,York A P E,Green M L H,et al.New catalysts for the conversion of methane to synthesis gas: Molybdenum and tungsten carbide[J].J Catal,1998,180: 85-100.
[15]李友凤,周继承.活性氧化铝纳米粉末的制备[J].材料导报,2005,19(s2):157-159.
[16]Regalbuto J R,Ha J W.A corrected procedure and consistent interpretation for temperature programmed reduction of supported MoO3[J].Catal Lett,1994,29:189-207.
Effect of O2/CH4feed ratio oncarbon dioxide reforming of methane over Mo/Al2O3catalyst
JING De-shui,FANG Zhi-gang,ZHANG Shu-you,ZHANG Zhe-wu,WANG Meng-meng,LIN Shuang-xi,YAO Song-dong
(School of Chemical Engineering,University of Science and Technology Liaoning,Anshan 114051,China)
The effects of CO2/CH4and O2/CH4feed ratios on carbon dioxide reforming of methane over the Mo/Al2O3catalyst were investigated experimentally.XRD and H2-TPR were used to characterize the catalysts and supports.The results show that the conversion of methane and the stability of the catalyst were improved obviously when the n(CO2)/n(CH4)increased from 1 to 1.5.The conversion of methane decreased with the decrease of CO2content,and the activity of catalyst rapidly declined when the n(CO2)/ n(CH4)extremely decreased to 0.125.When n(O2)/n(CH4)was 0.1,a significant improvement on the conversions of methane and carbon dioxide and the generation rates of H2and CO was found.When n(O2)/n(CH4)increased from 0.4 to 0.6,the competitive methane partial and complete oxidation reactions could be found that significantly inhibited the carbon dioxide reforming of methane.
carbon dioxide reforming of methane;oxygen addition;Mo/Al2O3catalyst;carbon deposition.
TQ032.4
:A
:1001-9219(2016)06-54-05
2015-11-18;
:归国人员留学基金(第47批);国家自然科学基金资助项目(51144008);
:井德水(1991-),男,硕士,电话18242289675,电邮18790853887@163.com;*
:方志刚,教授,电话13050081260,电邮LNFZG@163.com;姚颂东,教授,电话13514129051,电邮stoneyao@163.com。
