溴化铜一步催化氧化液相甲醇合成甲缩醛
2016-03-21李美兰邓志勇王公应
龙 焱,李美兰,邓志勇*,张 华,王公应*
(1.中国科学院成都有机化学研究所,四川 成都 610041;2.中国科学院成都有机化学有限公司,四川 成都 610041;3.中国科学院大学,北京 100049)
溴化铜一步催化氧化液相甲醇合成甲缩醛
龙 焱1,2,3,李美兰1,2,3,邓志勇1,2,3*,张 华2,王公应1,2,3*
(1.中国科学院成都有机化学研究所,四川 成都 610041;2.中国科学院成都有机化学有限公司,四川 成都 610041;3.中国科学院大学,北京 100049)
采用CuBr2作为催化剂催化氧化液相甲醇合成甲缩醛,系统考察了CuBr2质量浓度、反应温度、反应压力、反应时间等因素对反应的影响。确定最佳反应条件为:CuBr2质量浓度0.04g/mL、温度130℃、O2压力3MPa和反应时间4h时。在此条件下,甲醇转化率达到29.7%,甲缩醛选择性达到81.0%。CuBr2重复使用16次后,活性仍然保持稳定。
甲缩醛;合成;甲醇;液相氧化;溴化铜
甲缩醛(CH3OCH2OCH3,DMM)是甲醇最重要的下游产品之一,具有毒性小,沸点低,溶解性好等特点。DMM广泛应用于油漆、香精和医药等领域。另外DMM因为具有较高的十六烷值可以作为燃油添加剂[1]。由DMM进一步合成的聚甲氧基二甲醚是非常优良的柴油添加剂[2,3]。
工业上生产DMM一般采用两步法[1],首先甲醇在氧化催化剂上部分氧化生成甲醛,然后甲醇与甲醛在酸性催化剂的作用下发生缩醛反应生成DMM。近年来,甲醇直接氧化法合成DMM成为研究热点[4]。已报道的催化剂有杂多酸[5-7]、SbRe2O5[8,9]、Cu-ZSM-5[10]、钒基催化剂[11-16]、V2O5-MoO3/γ-Al2O3[17]、负载型氧化铼[18,19]、RuOx/SiO2[20]、介孔Al-P-V-O催化剂[21]和Fe-Mo-O[22]等,其中钒基催化剂表现出较好活性,但上述反应均在固定床上进行,需要将反应物甲醇气化,为气相氧化反应。液相法一步氧化甲醇合成DMM的研究报道较少[23-25]。
本课题组前期研究工作发现RuCl3[24]对甲醇液相氧化法合成DMM表现出较好的活性。在温度120℃,O2压力3MPa和催化剂质量浓度为0.005g/mL的条件下,甲醇转化率达到了49.8%,DMM选择性达到了76.8%。然而,钌为贵金属,其成本较高。本文采用CuBr2作为催化剂,考察了催化剂质量浓度,反应温度、压力和时间等因素对反应的影响,并对其重复使用性能进行了考察。
1 实验部分
1.1 试剂与仪器
CuBr2、甲醇,分析纯,国药有限公司;氧气,φ≥99.9%,西南化工研究设计院有限公司;间歇式高压反应釜,GS-0.1型,威海化工机械有限公司;集热式磁力搅拌器科创仪器,DF-101S,巩义市予华仪器有限责任公司;色质联用,HP 6890/5973,美国安捷伦科技有限公司;气相色谱仪,7820A型,美国安捷伦科技有限公司。
1.2 实验过程
将50mL甲醇和一定量的CuBr2加入到高压反应釜中,通入氧气置换3次釜内空气后再进气至一定压力,加热,搅拌。当温度升至设定温度后开始记录反应时间;反应一定时间后,停止加热,将反应釜置于冰水中冷却至室温。收集釜液,采用色质联用对产物进行定性分析,并采用内标法进行定量分析。
2 结果与讨论
2.1 催化剂质量浓度的影响
考察CuBr2质量浓度对反应的影响,结果如表1所示。
色质联用分析发现,主要产物为DMM,副产物为甲醛(FA)、甲酸甲酯(MF)和甲酸(HCOOH)。从表1可以看出,当CuBr2质量浓度为0.01g/mL时,甲醇的转化率为16.9%,DMM选择性为81.4%。随着CuBr2质量浓度升高至0.04g/mL时,甲醇转化率升高至29.7%,DMM的选择性基本不变。继续升高CuBr2质量浓度,甲醇转化率略有下降,DMM选择性略有升高,DMM收率下降。因此,适宜的CuBr2质量浓度为0.04g/mL。
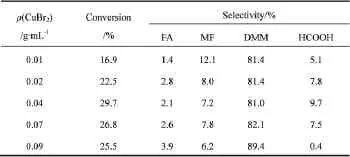
表1 不同CuBr2质量浓度对反应性能的影响Table 1 Effect of CuBr2dosage on reaction
2.2 反应温度的影响
表2为反应温度对反应的影响。从表2中可以看出,在110℃时,甲醇转化率仅为8.3%。随着温度升高到 130℃,甲醇转化率显著增加,达到了29.7%。温度升高,有利于反应的进行。当温度升高到140℃时,DMM选择性下降,甲酸选择性增加。这说明继续升高温度,甲醛倾向于进一步氧化生成甲酸,从而导致甲酸选择性升高,相应DMM的选择性下降[10]。因此,最佳反应温度为130℃。
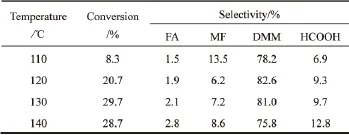
表2 反应温度对反应的影响Table 2 Effect of temperature on reaction
2.3 氧气压力的影响
图1为氧气压力对反应的影响。当氧压为1MPa时,甲醇转化率为12.4%,DMM选择性为86.6%。随着氧压的增加,有利于反应的进行,甲醇转化率逐渐增加,DMM选择性略微下降。当氧压为3MPa时,甲醇转化率达到29.7%,DMM选择性为81.0%。继续升高氧气压力,对反应性能影响不大。考虑到操作安全性,氧气压力3MPa较为适宜。
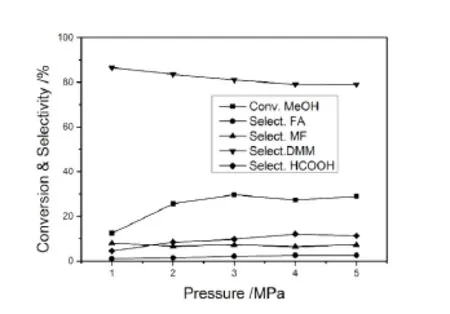
图1 氧气压力对反应的影响Fig.1 Effect of O2pressure on reaction
2.4 反应时间的影响
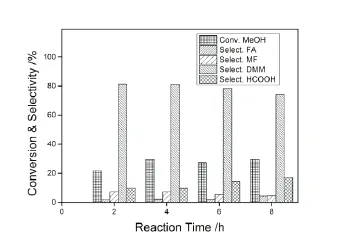
图2 反应时间对反应的影响Fig.2 Effect of reaction time on reaction
图2为反应时间对反应的影响。由图可知,随着反应时间的延长,甲醇转化率逐渐上升,反应时间超过4h之后,甲醇转化率基本不变,DMM和MF的选择性略有下降,甲酸的选择性显著上升,这是因为反应时间的延长,DMM和MF会部分分解,导致甲酸量增加,而甲醛也会进一步氧化成甲酸[10]。因此反应最佳时长为4h。
2.5 催化剂稳定性考察
图3为CuBr2重复使用考察。每次反应结束后,取微量反应液进行定量分析,剩余的反应液留在反应釜内于50℃真空烘箱烘干后,继续加入50mL甲醇和3MPa氧气于130℃再次反应4h。经过16次重复使用,甲醇转化率和DMM的选择性波动不大。这说明CuBr2较稳定,比先前报道的RuCl3的重复使用性要好[24],具有一定的应用前景。

图3 催化剂重复使用和稳定性考察Fig.3 Catalyst reusability and stability tests
3 结论
CuBr2可以一步催化氧化液相甲醇合成甲缩醛,具有潜在的应用前景。研究结果表明,最佳反应条件下(CuBr2质量浓度为0.04g/mL,反应温度为130℃,O2压力为3MPa,反应时间为4h),甲醇转化率为29.7%,甲缩醛选择性达到81.0%,CuBr2重复使用16次后,活性仍然保持稳定。
[1]康海昆,龙慧敏.甲缩醛应用技术进展 [J].天然气化工·C1化学与化工,2012,37(5):68-70.
[2]时米东,王云芳,王巨龙,等.聚甲氧基二甲醚合成工艺介绍[J].天然气化工·C1化学与化工,2015,40(4):91-96.
[3]王熙庭.我国聚甲氧基二甲醚工业化提速[J].天然气化工·C1化学与化工,2014,39(4):73.
[4]李美兰,邓志勇,翟刚,等.甲醇一步氧化制甲缩醛金属催化剂研究进展 [J].天然气化工·C1化学与化工, 2014,39(6):82-89.
[5]徐雪丽,宋伟.溶胶-凝胶法制备H3PW12O40/SiO2催化合成甲缩醛 [J].天然气化工·C1化学与化工,2014,39(2): 25-28.
[6]Liu H C,Iglesia E.Selective one-step synthesis of dimethoxymethane via methanolordimethylether oxidation on H3+nVnMO12-nPO40Keggin structures[J].J Phys Chem B,2003,107:10840-10847.
[7]Guo H Q,Li D B,Xiao H C,et al.Methanol selective oxidation to dimethoxymethane on H3PMo12O40/SBA-15 supported catalysts[J].Korean J Chem Eng,2009,26:902-906.
[8]Yuan Y Z,Liu H C,Imoto H,et al.Performance and characterization of a new crystalline SbRe2O6catalyst for selective oxidation of methanol to methylal[J].J Catal, 2000,195:51-61.
[9]Yuan Y Z,Tsai K R,Liu H H,et al.Selective methanol conversion to methylal on Re-Sb-O crystalline catalysts: Catalytic properties and structural behavior[J].Top Catal, 2003,22:9-15.
[10]Zhang Y H,Drake I J,Briggs D N,et al.Synthesis of dimethyl carbonate and dimethoxy methane over Cu-ZSM-5[J].J Catal,2006,244:219-229.
[11]Zhao H Y,Bennici S,Shen J Y,et al.Nature of surface sites ofV2O5-TiO2/SO42-catalysts and reactivity in selective oxidation of methanol to dimethoxymethane[J].J Catal,2010,272:176-189.
[12]Chen S,Wang S P,Ma X B,et al.Selective oxidation of methanol to dimethoxymethane over bifunctional VOx/ TS-1 catalysts[J].Chem Commun,2011,47:9345-9347.
[13]Kaichev V V,Popova G Y,Chesalov Y A,et al.Selective oxidation of methanol to form dimethoxymethane and methyl formate over a monolayer V2O5/TiO2catalyst[J].J Catal,2014,311:59-70.
[14]Lu X L,Qin Z F,Dong M,et al.Selective oxidation of methanol to dimethoxymethane over acid-modified V2O5/ TiO2catalysts[J].Fuel,2011,90:1335-1339.
[15]Zhao H Y,Bennici S,Cai J X,et al.Influence of the metaloxide supporton the surface and catalytic properties of sulfated vanadia catalysts for selective oxidation of methanol[J].J Catal,2010,274:259-272.
[16]Zhao H Y,Bennici S,Shen JY,et al.Calorimetric study of the acidic character of V2O5-TiO2/SO42-catalysts used in methanol oxidation to dimethoxymethane[J].J Therm Anal Calorim,2010,99:843-847.
[17]Meng Y L,Wang T,Chen S,et al.Selective oxidation of methanol to dimethoxymethane on V2O5-MoO3/gamma-Al2O3catalysts[J].Appl Catal B,2014,160:161-172.
[18]Yuan Y Z,Shido T,Iwasawa Y.The new catalytic property of supported rhenium oxides for selective oxidation of methanol to methylal[J].Chem Commun, 2000,15:1421-1422.
[19]Yuan Y Z,Iwasawa Y.Performance and characterization ofsupported rhenium oxide catalysts forselective oxidation of methanol to methylal[J].J Phys Chem B, 2002,106:4441-4449.
[20]Liu H,Iglesia E.Selective oxidation of methanol and ethanol on supported ruthenium oxide clusters at low temperatures[J].J Phys Chem B,2005,109:2155-2163.
[21]Chen S,Meng Y L,Zhao Y J,et al.Selective oxidation of methanol to dimethoxymethane over mesoporous Al-P-VO catalysts[J].AIChE J,2013,59:2587-2593.
[22]Thavornprasert K A,Capron M,Jalowiecki-Duhamel L,et al.Highly productive iron molybdate mixed oxides and their relevant catalytic properties for direct synthesis of 1,1-dimethoxymethane from methanol[J].Appl Catal B, 2014,145:126-135.
[23]Prado N T,Nogueria F G E,Nogueira A E,et al. Modified niobia as a new catalystfor selective production of dimethoxymethane from methanol[J].Energ Fuel,2010,24:4793-4796.
[24]Li M L,Long Y,Deng Z Y,et al.Ruthenium trichloride as a new catalyst for selective production of dimethoxymethane from liquid methanol with molecular oxygen as sole oxidant[J].Catal Commun,2015,68:46-48.
[25]刘鹏,邓志勇,杨先贵,等.CuCl/肟配合物催化甲醇液相一步氧化生成二甲氧基甲烷 [J].天然气化工·C1化学与化工,2013,38(6):16-19.
One-step oxidation of liquid methanol to dimethoxymethane with CuBr2as catalyst
LONG Yan1,2,3,LI Mei-lan1,2,3,DENG Zhi-yong1,2,3,ZHANG Hua2,WANG Gong-ying1,2,3
(1.Chengdu Institute of Organic Chemistry,Chinese Academy of Science,Chengdu 610041,China; 2.Chengdu Organic Chemicals Co.,Ltd.,Chinese Academy of Science,Chengdu 610041,China; 3.University of Chinese Academy of Sciences,Beijing 100049,China)
CuBr2was used as catalyst for oxidation of liquid methanol to dimethoxymethane (DMM).The effects of CuBr2concentration,reaction temperature,pressure and reaction time on reaction were investigated.The optimum reaction conditions were determined as follows:CuBr2concentration of 0.04g/mL,temperature of 130℃,oxygen pressure of 3MPa and reaction time of 4 hours, and under above conditions,methanol conversion and DMM selectivity reached 29.7%and 81.0%,respectively.After being reused 16 times,the activity of CuBr2was still kept.
dimethoxymethane;synthesis;methanol;liquid phase oxidation;cupric bromide
TQ223.121;O643.3
:A
:1001-9219(2016)06-07-03
2016-04-11;
:四川省科技厅杰出青年培育计划(2016JQ0062);四川省科技厅青年科技创新研究团队专项计划(2013 TD0010);四川省“千人计划”创新项目;
:龙焱(1989-),男,硕士研究生,电邮 aixiaqideyu@163. com;*
:邓志勇 (1983-),男,副研究员,硕士导师,电话028 85250005,电邮zhiyongdeng@cioc.ac.cn;王公应(1963-),男,研究员,博士生导师,电话 028 85215405,电邮gywang@cioc.ac.cn。
