HPLC测定大鼠血浆中1,8-二川芎嗪基大黄酸及其药代动力学研究
2016-03-21彭兆亮王雪琦栗进才汪电雷陈亚军王淑君汪珊珊
彭兆亮,李 洁,樊 玲,王雪琦,黄 鹏,栗进才,汪电雷,,陈亚军,王淑君,汪珊珊,张 悦
( 1.安徽中医药大学药学院,安徽合肥 230031;2.亳州职业技术学院,安徽亳州 236800)
HPLC测定大鼠血浆中1,8-二川芎嗪基大黄酸及其药代动力学研究
彭兆亮1,李洁1,樊玲1,王雪琦1,黄鹏1,栗进才2,汪电雷1,2,陈亚军1,王淑君1,汪珊珊1,张悦1
( 1.安徽中医药大学药学院,安徽合肥230031;2.亳州职业技术学院,安徽亳州236800)
中国图书分类号: R-332; R284. 1; R446. 11; R969. 1
摘要:目的建立测定大鼠血浆中1,8-二川芎嗪基大黄酸浓度的HPLC方法,并对大鼠尾静脉注射给药1,8-二川芎嗪基大黄酸后,研究其在大鼠体内的药代动力学。方法采用大黄素为内标,血浆样品用甲醇沉淀蛋白后进行HPLC分析,流动相为甲醇-0. 1%甲酸水( 78∶22,V/V),流速为1. 0 mL·min-1,检测波长为275 nm。大鼠单剂量静脉注射2、4、8 mg·kg-11,8-二川芎嗪基大黄酸后,测定给药后不同时间点大鼠血浆中1,8-二川芎嗪基大黄酸的浓度,并对其血药浓度-时间曲线采用DAS 2. 1软件拟合,计算药动学参数。结果1,8-二川芎嗪基大黄酸在0. 05-10. 00 mg·L-1血浆浓度范围内线性关系良好( r = 0. 996 2),定量下限为0. 05 mg·L-1,提取回收率均大于88%,日内和日间差异RSD均小于6%,方法学考察均符合要求。1,8-二川芎嗪基大黄酸按2、4和8 mg·kg-1静脉注射给药后,在大鼠体内的T1/2分别为( 68. 35±1. 36)、( 69. 32±2. 21)、( 69. 32±2. 03) min,AUC0-t分别为( 101. 03±24. 9),( 144. 79±3. 29),( 231. 92±19. 30) min·mg·L-1。结论本实验所建立的HPLC方法操作简便、快速、专属性强,可用于1,8-二川芎嗪基大黄酸血药浓度分析及其药代动力学研究。
关键词:1,8-二川芎嗪基大黄酸; HPLC;大鼠;药代动力学;血药浓度;静脉注射
栗进才( 1981-),男,硕士,讲师,研究方向:中药化学,通讯作者,Tel: 0558-5587006,E-mail: ahbanli@163.com;
汪电雷( 1977-),男,博士,教授,硕士生导师,研究方向:药物代谢动力学,通讯作者,Tel: 0551-68129153,E-mail: dlwang@ ahtcm.edu.cn
大黄酸属单蒽核类1,8-二羟基蒽醌衍生物,含有2个羟基和1个羧基,是蓼科植物大黄、何首乌、虎杖等多种中药的主要有效成分[1]。具有广泛的药理活性,例如抗肿瘤、抗炎、抗菌、调节肾功能等作用[2]。研究表明,大黄酸能抑制内毒素诱生的大鼠巨噬细胞IL-12mRNA过度表达,能使[Ca2 +]浓度降低[3]。另有报道,大黄酸对小鼠腹腔巨噬细胞内白三烯C4、B8( LTC4、LTB4)的生物合成有较强的抑制作用,其IC50分别为0. 44、2. 78 μmol·L-1,并能提高巨噬细胞内环磷腺苷( cAMP)水平,抑制其花生四烯酸代谢[4],以上研究说明大黄酸对炎症的预防和治疗具有明显的效果,且目前临床上已经使用的大黄酸1,8-二乙酰化物可治疗骨关节炎[5]。川芎嗪( tetramethylpyrazine,TMP,Fig 1A)是从伞形科藁本属植物川芎的根中提取的生物碱,是川芎的有效成分之一,具有广泛的药理作用,例如改善心、脑血管系统微循环,镇静镇痛,抗肿瘤等[6]。且川芎嗪具有很好的生物活性,易于透过血脑屏障。本课题通过药物化学拼合原理,将大黄酸和川芎嗪以醚键结合,将两个具有活性的化合物结合在一起,修饰成大黄酸醚类衍生物1,8-双( 3,5,6-三甲基吡嗪基-2-甲氧基) -9,10-二氧代-9,10二氢蒽-3-羧酸(简称1,8-二川芎嗪基大黄酸,Fig 1B)以期开发具有更好活性的大黄酸类药物。前期研究表明该化合物比大黄酸酯类化合物更具有明显的药理活性,且可用于治疗或预防与T-细胞增殖有关或由促炎细胞因子介导的疾病,具有抗炎、抗肿瘤等作用[7]。本文旨在采用HPLC建立大鼠血浆中1,8-二川芎嗪基大黄酸的测定方法,考察其在大鼠体内的药代动力学,以期为进一步的开发和研究提供必要的参考。
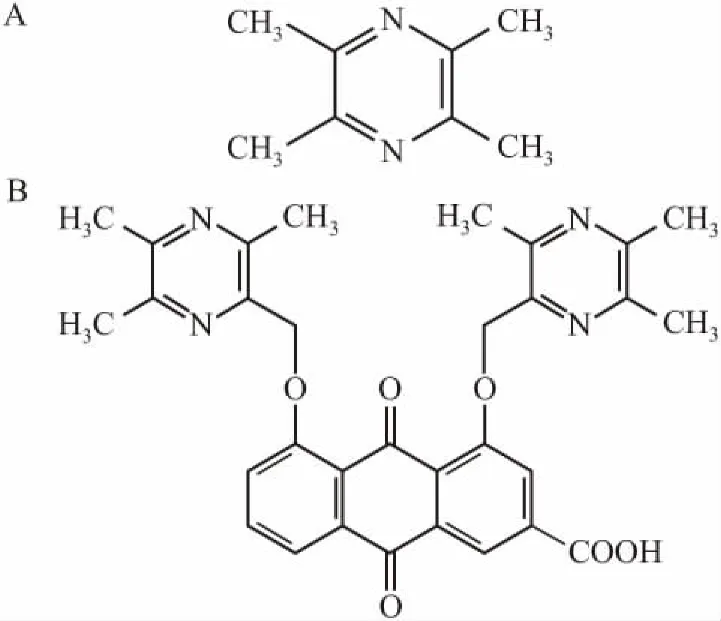
Fig 1 Chemical structure of TMP ( A) and 1,8 TMP Rhein ( B)
1 材料
1.1仪器岛津高效液相色谱仪:包括LC-10AT泵、CBM-10Alite控制器、SPD-10Avp紫外检测器、CTO-10ASvp柱温箱、LC-Solution工作站; Milli-Q Gradient A10超纯水器( Millipore Inc.USA) ; XW-80A微型漩涡混合器(上海医大仪器厂) ; Centrifuge 5804R台式高速离心机(上海东兢电子有限公司) ; BP211D型电子天平(德国Sartorius公司) ; JL-180超声仪(上海吉理超声仪器有限公司)。
1.2动物SPF级SD大鼠,♀♂兼用,体质量200 ~250 g,由安徽医科大学实验动物中心提供,合格证号为SCXK(皖) 2005-001。实验前禁食12 h,可自由饮水。
1.3药品与试剂1,8-二川芎嗪基大黄酸(安徽中医药大学黄鹏副教授课题组合成,纯度95. 64%,经IR、MS、1H NMR结构确认,20140905),色谱甲醇(上海星可高纯溶剂有限公司) ;水为双蒸水;其它试剂均为分析纯。
2 HPLC测定法的建立与考证
2.1色谱条件色谱柱: Shimadzu VP-ODS ( 150 mm×4. 6 mm,5 μm) ;流动相:甲醇-0. 1%甲酸水( 78∶22,V/V) ;流速: 1. 0 mL·min-1;紫外检测波长: 275 nm;柱温25℃;进样量: 20 μL;灵敏度: 0. 001 AUFS。
2.2标准溶液的配制1,8-二川芎嗪基大黄酸标准品的配制:精密称取1,8-二川芎嗪基大黄酸标准品5. 00 mg至50 mL量瓶中,用甲醇溶解并定容,配制成0. 1 g·L-1贮备液,临用前用甲醇稀释成浓度0. 5、1、2. 5、5、10、25、50、100 mg·L-1的标准溶液。精密称取大黄素2. 50 mg至50 mL量瓶中,甲醇溶解并定容,临用前甲醇稀释至25 mg·L-1作内标溶液,备用。
2.3血浆样品处理取200 μL血浆,加内标溶液20 μL( 2. 5 mg·L-1)混匀后,加入2 mL甲醇,涡旋振荡5 min,3 000 r·min-1离心10 min;取上清溶液1. 6 mL,在40℃水浴中用氮气吹干,用200 μL甲醇溶解残渣,再12 000 r·min-1离心10 min,取上清液适量,进样20 μL,用样品与内标峰面积比进行定量分析。
2.4专属性考察按“2. 1”项下操作,分别考察空白血浆( 6个空白个体)、空白血浆中加入1,8-二川芎嗪基大黄酸(浓度为1. 0 mg·L-1)、单剂量静脉注射给药4 mg·kg-11,8-二川芎嗪基大黄酸30 min后大鼠血浆样品。按“2. 3”项下操作,进行分析得到各样色谱图。
2.5标准曲线的制备及定量下限分别取空白血浆200 μL,加入1,8-二川芎嗪基大黄酸系列标准溶液,配制成相当于1,8-二川芎嗪基大黄酸浓度为0. 05、0. 1、0. 25、0. 5、1、2. 5、5、10 mg·L-1的血浆样品,每组浓度平行做3份,按“2. 3”项下操作,以待测物浓度( C)为横坐标,利用待测物与内标物的峰面积比值Ri为纵坐标进行线性回归。按照色谱峰信噪比( S/N)为5确定定量下限,按照信噪比( S/ N)为3确定检测下限。
2.6方法的精密度与准确度取大鼠空白血浆200 μL,加入不同浓度的1,8-二川芎嗪基大黄酸标准溶液,配制成低、中、高(分别为0. 1、1、5 mg· L-1) 3个浓度的血浆样品,每个浓度平行做5份( n =5),按“2. 3”项下操作,取20 μL进样,用样品与内标峰面积比Ri代入同一条工作曲线,计算得到相应的浓度,考察批内和批间的变异情况,再与加入浓度对照计算其准确度。
2.7提取回收率考察分别取空白血浆200 μL,加入1,8-二川芎嗪基大黄酸系列标准溶液,配制成低、中、高(分别为0. 1、1、5 mg·L-1) 3个浓度的血浆样品,每个浓度平行做5份,按“2. 3”项下处理,取20 μL进样,分析得到1,8-二川芎嗪基大黄酸峰面积As( H)。另取不同浓度的1,8-二川芎嗪基大黄酸标准溶液,用甲醇稀释到低、中、高(分别为0. 1、1、5 mg·L-1) 3个浓度的样品,每个浓度平行做5份( n =5),进样分析得到1,8-二川芎嗪基大黄酸峰面积As( D)。按照回收率= As( H) /As( D)平均值×100%,计算1,8-二川芎嗪基大黄酸的提取回收率。
2.8稳定性实验分别取空白血浆200 μL,加入1,8-二川芎嗪基大黄酸系列标准溶液,配制成低、中、高(分别为0. 1、1、5 mg·L-1) 3个浓度的血浆样品,每个浓度平行做5份( n = 5),分别考察室温放置6 h、样品处置后放置12 h、反复冻融3次、长期放置-20℃冰箱冻存2周的稳定性。
2.9动物实验取SPF级SD大鼠15只,♀♂兼用,体质量200~250 g,实验前禁食12 h以上,可自由饮水,随机分为3组,1,8-二川芎嗪基大黄酸经双蒸水溶解后,按2、4、8 mg·kg-1的剂量经大鼠尾静脉注射给药( 0. 2 mL/100 g),与给药前( 0 min)和给药后2、5、10、20、30、60、90、120、180、240、300 min,眼底静脉丛连续取血0. 3 mL于经肝素处理的试管中,于3 000 r·min-1离心10 min,分离出血浆,按“2. 3”项下处理,进样分析。
3 结果
3.1专属性考察从Fig 2中可以看出,1,8-二川芎嗪基大黄酸的保留时间为6. 08 min,大黄素的保留时间为10. 83 min。结果表明在选定的色谱条件下,血浆中的内源性物质不干扰1,8-二川芎嗪基大黄酸的测定。
3.2标准曲线的制备及定量下限以1/X2i( Xi= Ci)作权重因子1,8-二川芎嗪基大黄酸最小二乘法血浆标准曲线为Y = 0. 109 3X + 0. 000 2( r = 0. 996 2),线性范围0. 05~10 mg·L-1,定量下限0.05 mg ·L-1( n = 5; RSD = 5. 65%,准确度96. 63%)最低检测限0. 01 mg·L-1。
3.3提取回收率考察按“2. 7”项下操作,1,8-二川芎嗪基大黄酸低、中、高(分别为0. 1、1、5 mg·L-1) 3个浓度样品的回收率分别为( 90. 39±0. 64) %、 ( 89. 80±2. 21) %、( 88. 66±2. 06) %。RSD分别为0. 71%、2. 46%、2. 32%。回收率均大于88%,且在待测浓度范围内,样品低、中、高浓度回收率稳定( RSD <10 %),符合生物样品分析要求。
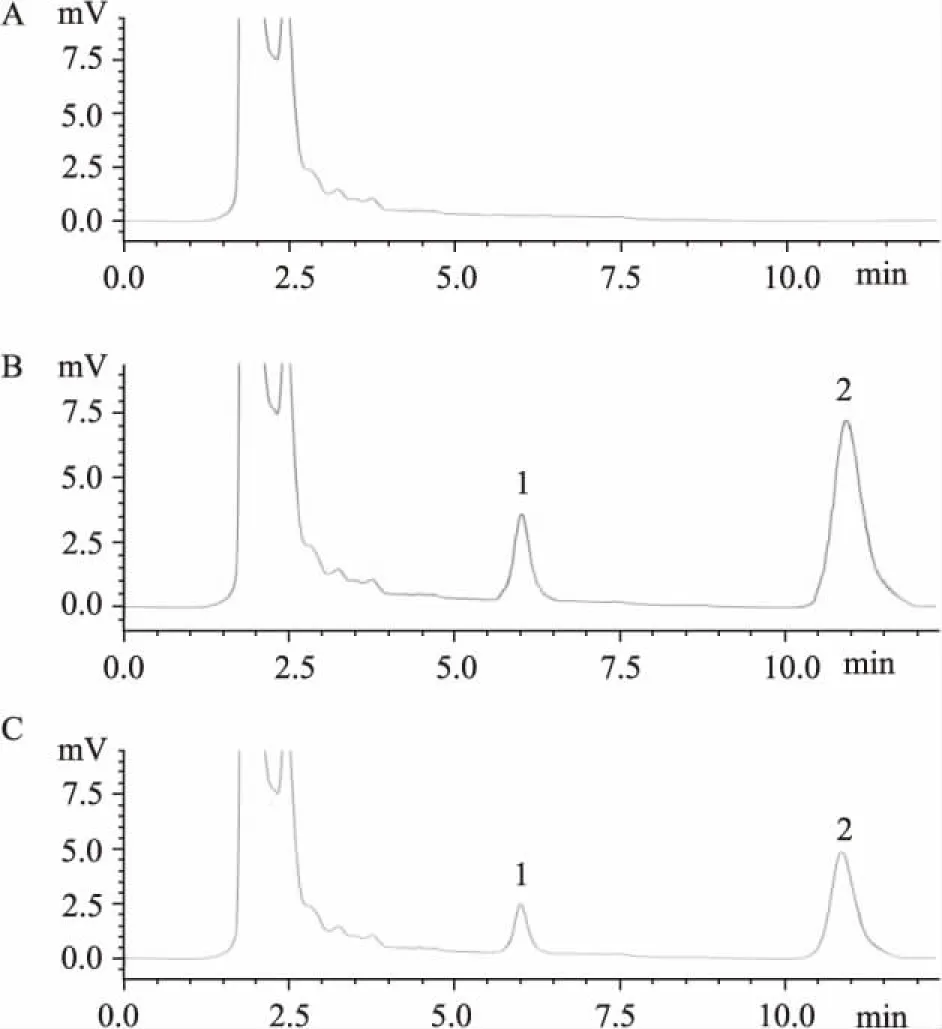
Fig 2 HPLC chromatograms of A) Blank plasma; B) Blank plasma spiked with 1 mg·L-11,8-TMP rhein and 2.5 mg·L-1internal standard emodin; C) Rat plasma ( 30 min) after a single i.v.administration of 4 mg·kg-11,8-TMP rhein spiked with 2.5 mg·L-1internal standard emodin; 1: 1,8-TMP rhein; 2: Emodin
3.4精确度与准确度考察按“2. 6”项下操作,制备1,8-二川芎嗪基大黄酸低、中、高(分别为0.1、1、5 mg·L-1) 3个浓度样品,每个浓度平行做5份( n =5),连续测定3 d。根据随行标准曲线求得实测浓度。实测浓度的RSD即为精密度,实测浓度和加入浓度的比值即为准确度。结果表明,1,8-二川芎嗪基大黄酸日内、日间准确度分别为94. 40%~99. 76%( RSD≤5. 7%,n = 5)和94. 32%~98. 65% ( RSD≤5. 4%,n =5)。所有样品的日内和日间RSD均小于10 %,同时低、中、高3种浓度的准确度在85%~115%之间,符合生物样品分析要求。
3.5稳定性考察按“2. 8”项下操作,结果表明在上述情况下样品稳定性良好,具体见Tab 1。
Tab 1 Results of 1,8-TMP rhein room temperature,long-term placement,reduplicate freeze thawing,place after treatment in rat plasma(±s,n =5)
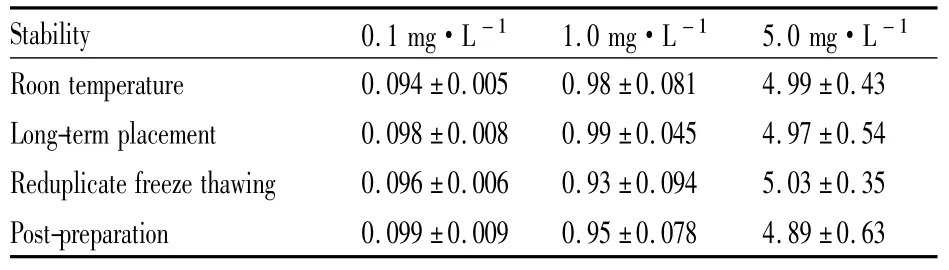
Tab 1 Results of 1,8-TMP rhein room temperature,long-term placement,reduplicate freeze thawing,place after treatment in rat plasma(±s,n =5)
Stability 0.1 mg·L-1 1.0 mg·L-1 5.0 mg·L -1 Roon temperature 0.094±0.005 0.98±0.081 4.99±0.43 Long-term placement 0.098±0.008 0.99±0.045 4.97±0.54 Reduplicate freeze thawing 0.096±0.006 0.93±0.094 5.03±0.35 Post-preparation____________ _______0.0_______________________ 99±0.009__0.95±0.078__4.89±0.63___
3.6血药浓度-时间曲线与药代动力学参数大鼠单剂量静脉注射1,8-二川芎嗪基大黄酸所得的平均血药浓度-时间曲线如Fig 4。将所得的血药浓度-时间数据,采用DAS 2.1软件拟合求算药代动力学参数。其主要药代动力学参数见Tab 2。2、4、8 mg·kg-1单剂量给药后血药浓度-时间曲线下面积AUC0-t与剂量相关性见Fig 3。
Tab 2 Main pharmacokinetic parameters of 1,8-TMP rhein after i.v.in rats (±s,n =5)
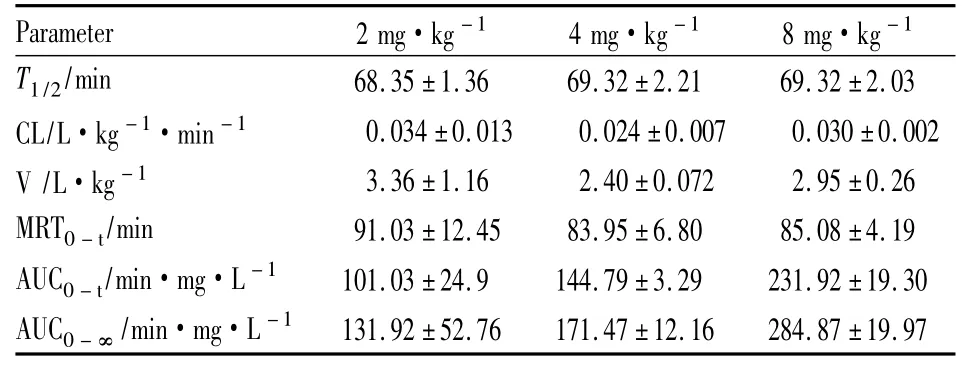
Tab 2 Main pharmacokinetic parameters of 1,8-TMP rhein after i.v.in rats (±s,n =5)
Parameter_______________ __________2 mg·kg-1 4 mg·kg-1 8 mg·kg-1___T1/2/min 68.35±1.36 69.32±2.21 69.32±2.03 CL/L·kg-1·min-1 0.034±0.013 0.024±0.007 0.030±0.002 V /L·kg-1 3.36±1.16 2.40±0.072 2.95±0.26 MRT0-t/min 91.03±12.45 83.95±6.80 85.08±4.19 AUC0-t/min·mg·L-1 101.03±24.9 144.79±3.29 231.92±19.30 AUC0-∞/min·mg·L-1____131.92±52.76______ 171.47±12.16______ 28___________ 4.87±19.97
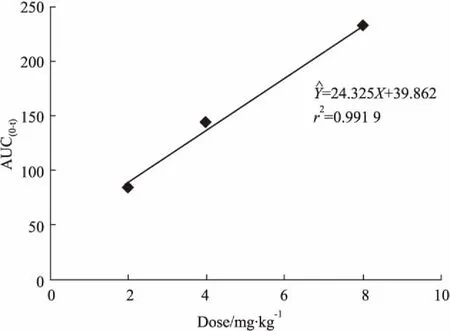
Fig 3 Dose positive correlation of single dose ( 2,4,8 mg·kg-1) AUC0-t
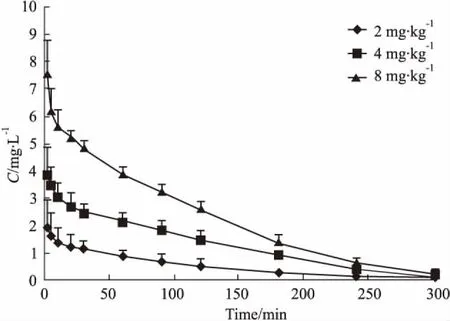
Fig 4 Mean concentration-time curve of fifiteen rats after single dose i.v.adminisration of( 2,4,8 mg·kg-1) 1,8-TMP rhein( (±s,n =5)
4 讨论
HPLC测定大鼠血浆中1,8-二川芎嗪基大黄酸的浓度,具有灵敏度高、分离度好等特点,尤其适用于大批量生物样品测定。根据大鼠药效剂量制定大鼠药代研究给药剂量,其高剂量最好接近最大耐受剂量,中、小剂量根据动物有效剂量的上下限范围选取。本课题参考大黄酸在大鼠和比格犬体内的吸收动力学研究文献中的给药剂量[8]及1,8-二川芎嗪基大黄酸HPLC测定方法的定量下限,综合考虑选择2、4、8 mg·kg-1的给药剂量。
本实验对于流动相的选择,分别考察了甲醇-水、甲醇-0. 1%甲酸水、甲醇-0. 05%甲酸水、甲醇-0. 01%甲酸水。发现用甲醇和不同浓度的甲酸水作为流动相时,1,8-二川芎嗪基大黄酸的峰型出现不同程度的拖尾现象。相比使用甲醇-0. 1%甲酸水作为流动相时拖尾现象减轻,且峰型较好。经过改变流动相比例,最终选择甲醇-0. 1%甲酸水( 78 ∶22,V/V)时,出峰效果最好。
本实验对比了大黄素、大黄酸和芦荟大黄素3种内标物质。紫外全波长扫描发现大黄酸的最大紫外吸收波长为230、254 nm,芦荟大黄素的最大紫外吸收波长为255、376 nm,大黄素的最大吸收波长为225、285、435 nm,而1,8-二川芎嗪基大黄酸的最大吸收波长为210、275 nm,其中210 nm左右1,8-二川芎嗪基大黄酸和大黄素吸收较强,在甲醇-0. 1%甲酸水( 78∶22,V/V)流动相条件下大黄酸和芦荟大黄素分别在5. 31、3. 92 min左右出峰,而大黄素在10. 82 min左右出峰。考虑到血浆中内源性杂质的紫外末端吸收较多,且在5 min左右仍有内源性物质吸收,所以综合考虑选择大黄素为内标,275 nm为紫外检测波长。
药代动力学研究发现,静脉注射给药后1,8-二川芎嗪基大黄酸从大鼠血浆中消除,其T1/2在69 min左右,平均驻留时间( MRT) 85 min左右,而大黄酸大鼠静脉注射后T1/2约在4 h左右,MRT约在2. 03 h左右,血浆清除率CL约在0. 1 L·kg-1· h-1,表观分布容积V约在1. 2 L·kg-1左右[8],经对比发现1,8-二川芎嗪基大黄酸药物消除较快,半衰期短,体内滞留时间短,而表观分布容积较改造前大,可能是由于1,8-二川芎嗪基大黄酸亲脂性增强。如果根据药理学研究的需要增加在体内的滞留时间,延长半衰期,可以通过剂型来进行优化。单剂量注射1,8-二川芎嗪基大黄酸高、中、低3种浓度的AUC0-t与所研究的剂量呈现简单的线性相关( r = 0. 9959,Fig 3)且T1/2基本不变,血浆清除率CL为常数,与给药剂量无关。初步判断在所研究的剂量范围内1,8-二川芎嗪基大黄酸体内药动学过程符合线性过程。
(致谢:本实验在安徽中医药大学药物代谢动力学实验室设计并完成研究,衷心感谢本研究室全体成员对本实验的大力帮助与支持。)
参考文献:
[1]万萍,孙建国,郝刚,等.大黄酸的HPLC-荧光检测及在人体药代动力学中的应用[J].中国药科大学学报,2013,44( 1) : 73-6.
[1]Wan P,Sun J G,Hao G,et al.Determination of Rhein in plasma,urine and feces by HPLC-fluorescence detection and its pharmacokinetics in healthy volunteers[J].J China Pharm Univ,2013,44 ( 1) : 73-6.
[2]张锦雯,王广基,孙建国,等.HPLC-荧光检测法测定大鼠血浆中大黄酸的浓度及其药代动力学[J].中国天然药物,2005,3 ( 4) : 238-41.
[2]Zhang J W,Wang G J.Sun J G,et al.Determination of Rhein in plasma by HPLC-fluorescence detection and its pharmacokinetics in rats[J].Chin J Nat Med,2005,3( 4) : 238-41.
[3]赵琪,崔乃强,张立冬.内毒素诱生大鼠腹腔巨噬细胞IL-12 mRNA表达调控及大黄酸对其作用研究[J].中国中西医结合外科杂志,1998,4( 1) : 1-4.
[3]Zhao Q,Chui N Q,Zhang L D.Regulation of IL-12 mRNA expression in lipopolysaccharide and Rhein stimulated rat peritoneal macrophages[J].Chin J Surg Integr Tradit Western Med,1998,4( 1) : 1-4.
[4]倪弘,薛小平,杨秀竹,等.大黄酸抑制小鼠腹腔巨噬细胞炎性介质活化的作用机理[J].天津中医,2001,18( 1) : 35-36.
[4]Ni H,Xue X P,Yang X Z,et al.Mechanism of Rhein inhibition of murine peritoneal macrophage activation of inflammatory mediators [J].Tianjin J Tradit Chin Med,2001,18( 1) : 35-6.
[5]陶蕾,薛建峰,李兴福.双醋瑞因在骨关节炎治疗中的应用[J].医学综述,2013,4: 700-9.
[5]Tao L,Xue J F,Li X F.Application of Diacerein in the treatment of osteoarthritis[J].Med Recap,2013,4: 700-9.
[6]杨雪梅.川芎嗪药理作用研究进展[J].中国生化药物杂志,2010,3: 215-7.
[6]Yang X M.Research progress on the pharmacological effects of ligustrazine[J].Chin J Biochem Pharm,2010,3: 215-7.
[7]栗进才.大黄酸的醚衍生物以及它们的治疗用途:中国,201110086106.4[P].2011-10-26.
[7]Li J C.Rhein ether derivatives and its therapeutic Uses: China,201110086106.4[P].2011-10-26.
[8]张锦雯,孙建国,王广基,等.大黄酸在大鼠和比格犬体内的吸收动力学研究[J].中国临床药理学与治疗学,2010,15( 5) : 511-8.
[8]Zhang J W,Sun J G,Wang G J,et al.Pharmacokinetics comparision in absorption of Rhein in SD rats and Beagle dogs[J].Chin J Clin Pharmacol Therap,2010,15( 5) : 511-8.
Determination of 1,8-TMP rhein and its pharmacokinetics in rat plasma by HPLC
PENG Zhao-liang1,LI Jie1,FAN Ling1,WANG Xue-qi1,HUANG Peng1,LI Jin-cai2,WANG Dian-lei1,2
CHEN Ya-jun1,WANG Shu-jun1,WANG Shan-shan1,ZHANG Yue1
( 1.College of Pharmacy,Anhui University of Chinese Medicine,Hefei 230031,China; 2.Bozhou Vocational and Technical College,Bozhou Anhui 236800,China)
Abstract:AimTo develop a HPLC method for the determination of the concentration of 1,8-TMP rhein in rat plasma and study the pharmacokinetics of 1,8-TMP rhein in rat plasma after single dose i.v.administration of 1,8-TMP rhein ( 2,4,8 mg·kg-1).Methods Emodin was used as an internal standard.Plasma samples were extracted with methanol and analyzed by HPLC.The mobile phase was methanol-0. 1% formic acid water ( 78∶22,V/V),with a flow rate of 1. 0 mL·min-1and UV 275 nm as the detection wavelength.The plasma concentration of 1,8-TMP rhein in rats was determined by HPLC after single-dose intravenous injection in rats with 2,4 and 8 mg·kg-1of 1,8-TMP rhein,and the pharmacokinetic parameters were caclulated by DAS 2.1.ResultsThe result of calibration curve was linear over the range of 0. 05~10. 00 mg·L-1( r =0. 996 2).The lower limit of quantification was 0. 05 mg·L-1.The intra-day and inter-day precision ( RSD%) were both lower than 6%,and the extraction recoveries were higher than 88%,respectively.The validated method was successfully applied to a pharmacokinetic study after i.v.administration of 1,8-TMP rhein in rats with a dose of 2,4 and 8 mg· kg-1.The T1/2was ( 68. 35±1. 36),( 69. 32±2. 1) and ( 69. 32±2. 03) min,respectively.The AUC0-twas ( 101. 03±24. 90 ),( 144. 79±3. 29 ) and ( 231. 92±19. 30) min·mg·L-1,respectively.Conclusion A simple and specific HPLC method for the analysis of 1,8-TMP rhein is successfully developed and applied to a pharmacokinetic study in rat plasma.Key words: 1,8-TMP Rhein; HPLC; rat; pharmacokinetics; plasma concentration; intravenous injection
作者简介:彭兆亮( 1991-),男,硕士生,研究方向:药物代谢动力学,Tel: 0551-68129153,E-mail: 747972445@ qq.com;
基金项目:国家自然科学基金资助项目( No 81473536) ;安徽省教育厅高等教育振兴计划人才项目(皖教秘[2014]181号)
收稿日期:2015-10-27,修回日期: 2015-11-25
文献标志码:A
文章编号:1001-1978( 2016) 01-0109-05
doi:10.3969/j.issn.1001-1978.2016.01.023