Sorting nexin 10缺失对小鼠巨噬细胞功能的影响
2016-03-21李婉贞沈晓燕
李婉贞,游 艳,彭 锦,周 春,李 东,沈晓燕,2
( 1.中山大学药学院药理与毒理学实验室,广东广州 510006;2.复旦大学药学院药理学教研室,上海 201203)
Sorting nexin 10缺失对小鼠巨噬细胞功能的影响
李婉贞1,游艳1,彭锦1,周春1,李东1,沈晓燕1,2
( 1.中山大学药学院药理与毒理学实验室,广东广州510006;2.复旦大学药学院药理学教研室,上海201203)
中国图书分类号: R-332; R329.24; R341; R392. 12; R977. 6
摘要:目的内涵体/溶酶体转运对巨噬细胞处理病原体和炎症应答等功能至关重要。该研究探讨了内涵体/溶酶体转运调节蛋白SNX10对巨噬细胞功能的影响,为治疗多种巨噬细胞相关免疫疾病提供新的潜在靶点。方法PCR反应鉴定小鼠基因型;激光共聚焦检测巨噬细胞吞噬功能;庆大霉素保护实验检测巨噬细胞的杀菌功能; RT-q-PCR法检测TNF-α、IL-12/23 p40、IL-6的表达水平; ELISA检测细胞培养上清中TNF-α、IL-12/23 p40、IL-6的表达; Western blot和免疫荧光染色检测NF-κB通路;脂多糖( lipopolysaccharides,LPS)刺激巨噬细胞炎症化。结果SNX10敲除后对其吞噬功能没有影响,但能够增强巨噬细胞的杀菌能力;同时SNX10缺失还可以抑制巨噬细胞分泌促炎因子TNF-α、IL-12/23 p40和IL-6,抑制NF-κB信号通路。结论SNX10敲除增强了巨噬细胞的杀菌能力,同时可以抑制巨噬细胞的炎症应答,其作用机制可能是通过NF-κB信号途径而实现的。
关键词:SNX10;巨噬细胞;细胞因子;杀菌; TNF-α; IL-12/23 p40; IL-6; NF-κB
沈晓燕( 1968-),女,博士,教授,博士生导师,研究方向:药物药理与毒理学,通讯作者,Tel: 021-51980182,E-mail: shxiaoy@ fudan.edu.cn
分拣连接蛋白家族( sorting nexins,SNXs)是一个进化上保守的磷酸肌醇结合蛋白大家族,迄今已发现34个成员,该家族成员均具有与磷酸肌醇结合的PX域,SNXs通过PX与磷酸肌醇的结合锚定到内涵体膜上。通过蛋白质-蛋白质和蛋白质-脂相互作用参与内体囊泡运载物分拣和膜转运[1-4]。SNX10是SNXs家族成员中结构最简单的一类蛋白,在内涵体/溶酶体的膜转运过程中发挥重要作用。目前对于它在破骨细胞活化中的功能研究已有多篇报道[5,11]。由于内涵体/溶酶体转运对巨噬细胞吞噬和消化病原体、处理与呈递抗原、炎症应答、以及维持组织稳态等功能至关重要,我们推测SNX10很可能对巨噬细胞的功能具有调控作用。
本研究利用SNX10基因敲除鼠,通过测定骨髓来源巨噬细胞的杀菌能力、吞噬能力、TNF-α、IL-12/ 23 p40、IL-6等细胞因子的分泌、以及NF-κB信号通路活化等相关指标,研究SNX10敲除后对骨髓巨噬细胞功能的影响,为阐明SNX10的功能提供了新的依据。
1 材料与方法
1.1材料
1.1.1动物与试剂SNX10基因敲除小鼠购自复旦大学发育生物学研究所;荧光微球及LPS购自美国Sigma-Aldrich公司;人源重组巨噬细胞集落刺激因子M-CSF购自Peprotech公司; TNF-α、IL-12/23 p40、IL-6 ELISA试剂盒购自深圳达科为公司; RPMI 1640培养基、胎牛血清以及抗生素购自Gibco公司;引物购自Invitrogen公司; TRIzol、RT-q-PCR试剂盒购自TaKaRa公司;抗体GAPDH、β-actin、IκB、p65购自CST公司。
1.1.2仪器双人单面超净工作台(苏州净化设备有限公司) ;二氧化碳培养箱( Thermo Electron) ;激光共聚焦系统( Zeiss 710,ZEISS) ;定量PCR仪( Bio-Rad) ;凝胶成像系统( Bio-Rad) ; PCR扩增仪( Bio-Rad)。
1.2方法
1.2.1小鼠鉴定哺乳期满且经过分笼后的小鼠,剪下小鼠尾尖部约0. 7 cm,置于EP管中,每个EP管中加入180 μL裂解液A和20 μL蛋白酶K充分涡旋混匀,置于55℃水浴锅中消化过夜。后续步骤具体方法按照碧云天基因组DNA小抽提试剂盒说明书进行操作。以纯化后的总DNA为模板,进行PCR反应,PCR结果经琼脂糖凝胶电泳进行鉴定,并拍照保存。
1.2.2小鼠骨髓巨噬细胞的制备与培养取5~6周龄♂小鼠,颈椎脱臼处死,置于75%酒精中浸泡消毒3~5 min。分离股骨与胫骨,去除肌肉组织,用剪刀剪开两端骨垢端,用1 mL注射器将骨髓冲出,100μm过筛,1 000×g离心5 min,弃上清,用含10%血清的RPMI 1640培养液重悬细胞,调整细胞密度至1×106个cells·L-1,并加入10-5mg·L-1M-CSF,种板,于5% CO2,37℃培养箱中培养7 d,每2 d换1次液。
1.2.3细胞培养RAW264. 7细胞培养于含10%胎牛血清的RPMI 1640培养基中,于5% CO2,37℃培养箱中培养。每2~3 d传代1次,取对数生长期的细胞做实验。
1.2.4吞噬实验将骨髓巨噬细胞种于含有玻片的小皿中,分3组,M-CSF刺激7 d后,用预冷的PBS洗3次,根据使用说明加入荧光微球,混匀后于冰上放置5 min后,再置于37℃孵箱孵育30 min,然后通过激光共聚焦显微镜观察小鼠巨噬细胞对荧光微球的吞噬情况。
1.2.5庆大霉素保护实验接种细胞于12孔板,分两组,即WT组、SNX10敲除组,每组3个复孔。按照Larous FS[6]的步骤:将细菌与细胞按10∶1比率混合后置于37℃培养箱中共同孵育1 h,弃去培养上清,用100 mg·L-1庆大霉素作用1 h,清除胞外细菌,随后改用10 mg·L-1庆大霉素作用,于37℃分别孵育2、6、24 h,于相应时间点,收集细胞裂解液。PBS清洗细胞3次,用0. 5%的Triton X-100室温裂解15 min,用无菌PBS稀释成不同倍数,涂皿,37℃倒置24 h,计算菌落数。
1.2.6 TNF-α、IL-12/23 p40、IL-6转录水平测定采用实时定量PCR( real time PCR)。将小鼠骨髓巨噬细胞接种于6孔细胞培养板,于d 8用1 μg·L-1LPS刺激24 h后,按照TaKaRa试剂盒说明书,提取细胞总RNA后进行逆转录。Real Time PCR反应体系为: SYBY Premix Ex Taq II 12. 5 μL;无RNase水8. 5 μL;上下游引物各1 μL; cDNA模板2 μL。反应程序为: 95℃5min、95℃30s、60℃30s ; 40循环。
1.2.7 TNF-α、IL-12/23 p40、IL-6表达水平的检测将小鼠骨髓巨噬细胞种于6孔细胞培养板,分组为WT、KO、WT + LPS、KO + LPS培养7 d后,无血清培养4 h后,在WT + LPS、KO + LPS组加入1 mg· L-1的LPS孵育24 h,细胞经处理完毕后,离心收集上清。按照深圳达科为的ELISA试剂盒说明书检测相应的细胞因子。
1.2.8Western blot检测细胞蛋白变化按照“1. 2. 4”将小鼠骨髓巨噬细胞种于6孔板,分别给予1 μmol·L-1LPS刺激1 h和24 h后,分别提取核蛋白和总蛋白,分别用Bradford法和BCA法定量。分装蛋白,根据目的蛋白分子量大小配置分离胶和浓缩胶,SDS-PAGE电泳、转膜。将NC膜置于含5%脱脂牛奶的TBST中室温封闭1 h,4℃孵育IκB、p65一抗过夜。TBST洗3次,每次5 min。室温孵育相应种属的二抗( 1∶10 000) 1 h,TBST洗3次,显影。将显影得到的条带用Quantity One软件进行半定量分析。
1.2.9免疫荧光染色将RAW264. 7细胞种于含盖玻片的24孔板进行培养,长至40%左右进行SNX10小RNA干扰。干扰72 h后弃去培养基,用预冷的PBS洗涤后加入免疫染色固定液室温固定15 min,用PBS洗涤2次。然后用含1%Triton X100 的PBS洗室温静置透膜10 min。透膜结束后用PBS 洗3次,然后用含10%山羊血清的PBS洗室温封闭30 min。室温孵育p65一抗1 h,PBS洗3次,再用相应种属的二抗室温避光孵育1 h,染核与封片,激光共聚焦显微镜拍照成像。
1.3统计学分析实验数据采用SPSS 13. 0软件进行统计学分析处理。两组间比较采用t检验,多组间比较采用单因素方差分析。
2 结果
2.1PCR鉴定小鼠基因型使用杂合型( + /-)小鼠进行繁殖的后代中,含3种基因型不同的小鼠,分别为野生型( + / + ),约占0. 25;杂合型( + / -),约占0. 5;纯合型(-/-),约占0. 25。基本符合遗传学规律( Fig 1)。
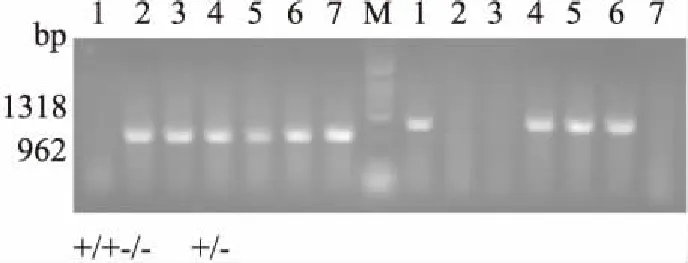
Fig 1 Identification of genotype of mice by PCR
2.2SNX10对巨噬细胞吞噬功能的影响吞噬识别是巨噬细胞发挥功能的前提,由Fig 2可知,SNX10敲除小鼠的骨髓巨噬细胞与野生组相比,吞噬能力并没有明显差异。说明敲除SNX10对巨噬细胞的吞噬功能并无明显影响。
2.3SNX10对巨噬细胞杀菌能力的影响进一步研究SNX10基因敲除后对巨噬细胞处理细菌能力的影响。由Fig 3可知,SNX10敲除后可明显增强巨噬细胞的杀菌能力,差异具有显著性( P<0. 05,P <0. 01 vs野生型)。
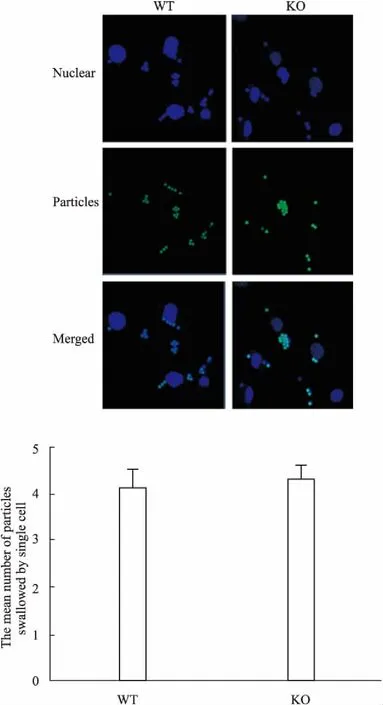
Fig 2 Effect of SNX10 knockout on phagocytosis of bio-particles
2.4SNX10对小鼠巨噬细胞分泌TNF-α、IL-12/ 23 p40、IL-6的影响巨噬细胞在炎症反应中会分泌各种细胞因子,本实验研究巨噬细胞炎症化后分泌的几种主要细胞因子。由Fig 4A中发现,LPS刺激后,可明显升高TNF-α、IL-12/23 p40、IL-6 mRNA的表达( P<0. 01)。与WT组相比,SNX10敲除组TNF-α、IL-12/23 p40、IL-6 mRNA表达明显下调( P <0. 01)。由Fig 4B可知,ELISA检测结果与q-PCR一致。结果表明,SNX10敲除后可以抑制LPS诱导的巨噬细胞分泌促炎因子。
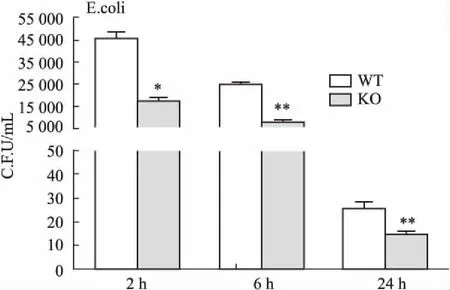
Fig 3 Effect of SNX10 knockout on sterilization ability of bone marrow derived macrophages
2.5SNX10对骨髓细胞NF-κB通路的影响NF-κB信号通路是炎症反应等病理过程中的重要调控途径,调节某些炎症因子如TNF-α、IL-6的活性,本实验研究SNX10敲除后对巨噬细胞IκB蛋白水平的表达及p65入核情况。由Fig 5A可知,SNX10敲除后,骨髓巨噬细胞IκB表达上调,同时,Fig 5B表明,SNX10敲除后,p65入核减少。SNX10干扰后p65免疫荧光染色结果与Western blot结果一致( Fig 5C)。
3 讨论
巨噬细胞是机体重要的固有免疫效应细胞,可塑性是巨噬细胞的一个标志性特点,可随着环境的变化激活极化为不同的类型,按照其功能可分为两种亚型,即M1型和M2型[7]。M1型参与促炎反应,主要分泌一些促炎因子,如TNF-α、IL-6等,在宿主防御细菌和病毒感染发挥核心作用[8]。M2型巨噬细胞与抗炎反应、寄生虫感染等疾病密切相关。巨噬细胞在机体正常发育、体内平衡、组织修复和对病原体的免疫反应中扮演着不同的角色,在组织稳态和肿瘤细胞的免疫反应中发挥着重要的作用[9-10]。因此,研究巨噬细胞的相关功能,对理解机体疾病的发生发展并提出治疗方案具有重要意义。
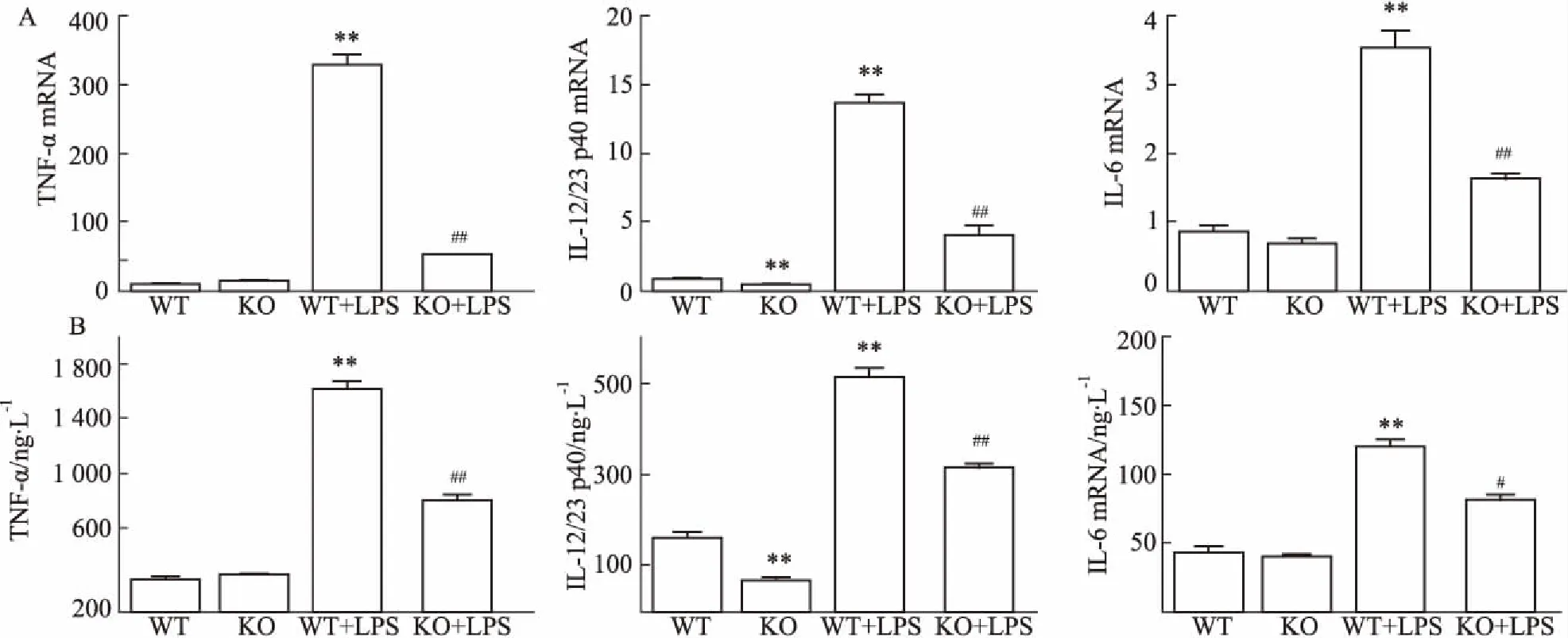
Fig 4 Effect of SNX10 knockout on expression and production of TNF-α,IL-12/23 p40,IL-6 in bone marrow derived macrophages
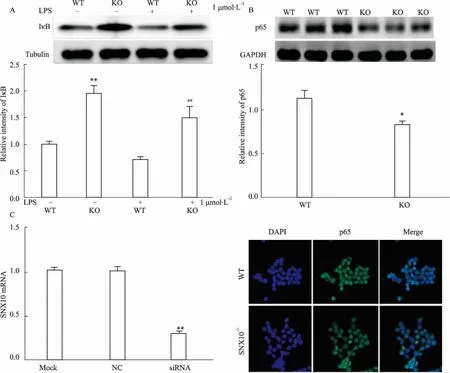
Fig 5 Effect of SNX10 knockout on NF-κB signaling pathway
巨噬细胞作为一种重要的免疫细胞,广泛参与机体的各种免疫反应,而NF-κB是炎症反应中重要的核转录因子,常以异源二聚体的形式存在。当细胞受到各种胞内外刺激后,IκB激酶激活,IκB蛋白磷酸化,泛素化从而被降解。NF-κB信号途径迅速激活,激活后的NF-κB进入核内,与DNA模板上的特异性蛋白结合,诱导特异性mRNA的产生,最后转录、产生和释放各种细胞因子。在炎症反应中,NF-κB参与上调早期炎症因子TNF-α、IL-6等的基因转录。
分拣连接蛋白10( sorting nexin 10,SNX10)是含有PX结构域的SNX家族成员,具有调节内体分选的功能。SNX蛋白家族是近年来发现的一类调控真核细胞内吞过程的家族,越来越多证据表明SNX家族不仅参与细胞内物质运输、内体分选,而且还与细胞内信号传导和细胞骨架重建等密切相关。然而,关于SNX10的具体功能及其分子调控机制尚不完全清楚。最新研究发现,SNX10与恶性骨硬化症、类风湿性关节炎的骨破坏等有着密切联系[11-12]。
本研究结果发现,SNX10缺失能够促进巨噬细胞清除病原菌的能力,并能抑制炎症因子TNF-α、IL-12/23 p40、IL-6的表达,TNF-α、IL-6是参与早期炎症反应的炎症因子,大量研究表明TNF-α、IL-6的表达与炎症程度呈正相关,NF-κB信号通路是调控炎症因子表达的关键途径[13],SNX10敲除后IκB蛋白表达明显增多,p65入核减少,据此推测,SNX10很可能是通过调节NF-κB信号通路来影响巨噬细胞功能。综上所述,SNX10敲除可增强巨噬细胞抗菌消炎的免疫功能,其作用机制可能与调节NF-κB信号通路有关,其具体调控机制还在深入研究之中。本研究的实施为阐明SNX10新功能提供了依据,也为巨噬细胞相关的多种免疫疾病的治疗提供了新的潜在靶点。
(致谢:实验工作是在中山大学药学院药理与毒理学实验室完成的,谨致谢意。)
参考文献:
[1]van Weering J R,Sessions R B,Traer C J,et al.Molecular basis for SNX-BAR-mediated assembly of distinct endosomal sorting tubules[J].EMBO J,2012,31( 23) : 4466-80.
[2]Johannes L,Wunder C.The SNXy flavours of endosomal sorting [J].Nat Cell Biol,2011,13( 8) : 884-6.
[3]Cullen P J.Endosomal sorting and signaling: an emerging role for sorting nexins[J].Nat Rev Mol Cell Biol,2008,9( 7) : 574-82.
[4]Worby C A,Dixon J E.Sorting out the cellular functions of sorting nexins[J].Nat Rev Mol Cell Biol,2002,3( 12) : 919-31.
[5]Cullen P J,Korswagen H C.Sorting nexins provide diversity for retromer-dependent trafficking events[J].Nat Cell Biol,2012,14( 1) : 29-37.
[6]Larous F S,Romero X,Wetzler L,et al.Cutting edges: MyD88 controls phagocyte NADPH oxidase function and killing of gramnegative bacteria[J].J Immunol,2005,175( 9) : 5596-6000.
[7]Murray P J,Allen J E,Biswas S K,et al.Macrophage activation and polarization: nomenclature and experimental guidelines[J].Immunity,2014,41( 1) : 14-20.
[8]Portaa B C,Rimoldic M,Raesd G,et al.Tolerance and M2 ( alternative) macrophage polarization are related processes orchestrated.by p50 nuclear factor IκB[J].Proc Natl Acad Sci USA,2009,106( 35) : 14978-83.
[9]Kozicky L K,Sly L M.Phosphatase regulation of macrophage activation[J].Semin Immunol,2015,doi: 10.1016.
[10]Wynn T H,Chawla A,Pollard J W.Macrophage biology in development,homeostasis and disease[J].Nature,2013,496( 7446) : 445-55.
[11]Zhou C,You Y,Shen W X,et al.Deficiency of sorting nexin 10 prevents bone erosion in collagen-induced mouse arthritis through promoting NFATc1 degradation[J].Ann Rheum Dis,2015,doi: 10.1038.
[12]Zhu C H,Morse L R,Battaglino R A.SNX10 is required for osteoclast formation and resorption activity[J].J Cell Biochem,2012,113( 5) : 1608-15.
[13]游艳,周春,李翠限,等.隐丹参酮对骨髓来源巨噬细胞功能的影响[J].中国药理学通报,2015,31( 3) : 346-50.
[13]You Y,Zhou C,Li C X,et al.Effects of cryptotanshinone on the function of bone marrow macrophages[J].Chin Pharmacol Bull,2015,31( 3) : 346-50.
Effects of Sorting nexin 10 deficiency on function of mouse macrophages
LI Wan-zhen1,YOU Yan1,PENG Jin1,ZHOU chun1,LI Dong1,SHEN Xiao-yan1,2
( 1.Laboratory of Pharmacology and Toxicology,School of Pharmaceutical Science,Sun Yat-sen University,Guangzhou 510006,China; 2.Dept of Pharmacology,School of Pharmacy and Institute of Biomedical Sciences,Fudan University,Shanghai 201203,China)
Abstract:AimTo discuss the influence of endosome /lysosome transport proteins SNX10 on macrophage,providing new potential targets for the treatment of a variety of related immune diseases.MethodsThe genotype of mice was identified by PCR.The role of SNX10 in phagocytosis of bacterial components andbook=89,ebook=98sterilization by macrophages were assessed.The levels of TNF-α、IL-12/23 p40 and IL-6 were measured by q-PCR and ELISA assay.Finally,the NF-κB signaling pathway was evaluated by Western blot and immunofluorescence staining.ResultsEx vivo experiments showed that SNX10 knockout could enhance bactericidal ability and inhibit the expression and production of TNF-α,IL-12/23 p40 and IL-6 of macrophages. These effects might attribute to the inhibition of NF-κB signaling pathway activation.ConclusionSNX10 knockout could enhance bactericidal ability and inhibit the inflammatory response of macrophages,and its mechanism may be achieved through the NF-κB signaling pathway.
Key words:SNX10; macrophage; phagocytosis; sterilization; TNF-α; IL-12/23p40; IL-6; NF-κB
作者简介:李婉贞( 1991-),女,硕士生,研究方向:药物药理与毒理学,E-mail: lwz531lwz@163.com;
基金项目:国家自然科学基金面上项目( No 81573441,81371923) ;广东省自然科学基金课题( No S2013010015313)
收稿日期:2015-09-10,修回日期: 2015-11-18
文献标志码:A
文章编号:1001-1978( 2016) 01-0084-06
doi:10.3969/j.issn.1001-1978.2016.01.018