显脉旋覆花不同部位体内外抗氧化作用比较
2016-03-21贺安娜佘朝文曾军英彭圣贤
贺安娜,佘朝文,曾军英,彭圣贤
( 1.怀化学院生物与食品工程学院; 2.民族药用植物资源研究与利用湖南省重点实验室; 3.湘西药用植物与民族植物学湖南省高校重点实验室,湖南怀化 418008)
显脉旋覆花不同部位体内外抗氧化作用比较
贺安娜1,2,3,佘朝文2,3,曾军英1,2,3,彭圣贤1
( 1.怀化学院生物与食品工程学院; 2.民族药用植物资源研究与利用湖南省重点实验室; 3.湘西药用植物与民族植物学湖南省高校重点实验室,湖南怀化418008)
中国图书分类号: R282.71; R284.1; R284.2; R345.49; R349. 1; R916. 4
摘要:目的为合理利用显脉旋覆花资源,研究了显脉旋覆花体内外抗氧化作用。方法通过水煎法、索氏醇提法及超声醇提法对显脉旋覆花地上及地下部分药用成分进行提取,并通过体内外实验比较了不同部位超声醇提物的抗氧化效果。结果超声醇提所得总酚及总黄酮含量最高,提取物中总酚含量明显高于总黄酮含量;显脉旋覆花超声醇提物对DPPH、ABTS及超氧阴离子自由基都有很好的清除效果,地下部分提取物的清除效果明显优于地上部分;提取物灌药可明显提高D-半乳糖致衰小鼠肝脏、肾脏及血清的过氧化氢酶( CAT)、超氧化物歧化酶( SOD)、总抗氧化能力( T-AOC)、谷胱甘肽过氧化物酶( GSH-Px)酶活性,并降低丙二醛( MDA)含量,地上部分高浓度抗氧化效果相当于地下部分低浓度的效果。结论显脉旋覆花醇提物对自由基有良好的清除作用,具有较好的抗氧化能力,地下部分抗氧化的效果明显高于地上部分。
关键词:显脉旋覆花;不同部位;提取方式;总酚;总黄酮;抗氧化
显脉旋覆花( Inula nervosa Wall.)是菊科旋覆花属植物,分布于我国湖南西南部、广西北部、贵州及云南等地[1]。张鸭关等[2]研究表明,显脉旋覆花富含蛋白质、亚油酸、α-亚麻酸及多种维生素和矿物质,平均营养价值很高;刘敏等[3]亚慢性毒性试验证明显脉旋覆花的提取物对大鼠没有产生明显毒性影响,卫生部已批准显脉旋覆花(小黑药)为新资源食品,食用其地下部分。显脉旋覆花中含有较多的挥发性油类物质,其中百里香酚等酚类物质占80%[4-5],李柯等[6]研究发现该药不同产地及不同部位酚类物质含量差异较大。显脉旋覆花是一种多民族使用的药用植物,具有补肾益肺通经络等功效[7],不同民族使用该药的部位有差异[8]。目前未见显脉旋覆花不同部位药理药效差异的报道,本文对显脉旋覆花地上部分和地下部分的抗氧化效果进行了比较,旨在验证民族用药的科学性,也为充分合理利用该资源提供理论依据。
1 材料
1.1实验材料与试剂显脉旋覆花采自湖南怀化通道县,10月挖取全草,将地上和地下部分分别洗净晒干研磨成粉;昆明小鼠购于湖南斯莱克景达实验动物有限公司,8周龄,体质量( 30±2) g,许可证号SCXK(湘) 2014-0002,饲养于( 22±1)℃和光周期12 h动物房内,给予充足标准饲料和饮用水;没食子酸、芦丁标准品购于上海金穗生物,纯度98%以上; Vit C、D-半乳糖购于美国Sigma公司; ABTS、DPPH、超氧阴离子自由基试剂盒、过氧化氢酶( CAT)试剂盒、超氧化物歧化酶( SOD)试剂盒、总抗氧化能力( T-AOC)测试盒、谷胱甘肽过氧化物酶( GSH-Px)试剂盒、丙二醛( MDA)试剂盒购于南京建成生物工程研究所;乙醇、NaNO2、Al( NO3)3、Folin-酚、NaOH、NaCl等试剂均为分析纯。
1.2仪器RE-52AA旋转蒸发器(上海亚荣生化仪器厂) ; JY98-ⅢDN超声波细胞粉碎机(宁波新芝生物科技股份有限公司) ; HH-S数显恒温水浴锅(金云市医疗仪器厂) ; 5804R高速冷冻离心机(德国Eppendorf) ; UV-2450紫外可见分光光度计(日本岛津)。
2 方法
2.1提取液的制备水煎法提取:取显脉旋覆花干燥粉末10 g于钢杯中,120 mL蒸馏水煎煮3次,参考传统中药煎煮时间,每次约20min,合并3次提取液,浓缩过滤蒸馏水定容至100 mL。索氏醇提:显脉旋覆花粉末10 g于索氏提取器中,加入120 mL 75%乙醇回流提取4 h,重复提取3次,合并上清,蒸馏浓缩去乙醇,过滤后用蒸馏水定容至100 mL。超声醇提:显脉旋覆花粉末10 g于锥形瓶中,加120 mL 75%乙醇,放入超声波细胞破碎仪,25℃超声40 min,超声强度为500W,重复提取3次,合并上清,浓缩蒸馏去乙醇,过滤后蒸馏水定容至100 mL。每种提取方式重复3次取样。
2.2提取液中总酚及总黄酮含量测定总酚含量测定:取50μL提取物,蒸馏水稀释至1 mL,加入2 mL Folin-酚试剂摇匀后静置5min,加入1. 6 mL 1 mol·L-1Na2CO3溶液摇匀,蒸馏水定容至25 mL,50℃水浴15min,冷却后于λ= 750 nm处测定吸光度,通过标准曲线计算提取物中的总酚浓度( g· L-1),样品中总酚含量/% = (总酚浓度×提取液体积×稀释倍数) /样品重量。总黄酮含量测定:取1 mL提取物于锥形瓶中,加人25 mL 30%乙醇及1. 4 mL 5% NaNO2摇匀后静置5min,再加入1. 4 mL 10% Al( NO3)3混匀静置6 min,最后加入10 mL 1 mol·L-1NaOH,以30%乙醇定容至50 mL,λ=510 nm处测定吸光度,通过标准曲线计算样品中总黄酮浓度( g·L-1),样品中总黄酮含量/% = (总黄酮浓度×提取液体积×稀释倍数) /样品重量× 100%。
2.3动物材料准备实验动物小鼠分空白对照组、衰老模型组及6个给药组,小鼠♀♂各半,随机分配,每组10只。空白对照组每日皮下注射生理盐水( 1 mg·g-1·d-1),灌胃蒸馏水( 0. 5 mL) ;衰老模型组注射D-半乳糖( 1 mg·g-1·d-1),灌胃蒸馏水( 0. 5 mL) ;实验组注射D-半乳糖( 1 mg·g-1· d-1),分别灌胃显脉旋覆花低( L)、中( M)、高( H)剂量组( 300、600、1200 μg·g-1·d-1)。连续给药30 d。最后1次给药12 h后处死小鼠,收集血液、肝脏及肾脏。用冰浴的生理盐水将肝脏及肾脏研磨成10%的组织匀浆液,匀浆及血液在4℃、3 000 r· min-1条件下离心15 min,取上清液待用。
2.4生化指标测定DPPH自由基清除率、ABTS自由基清除率测定参考谭娟等[9]的方法。超氧阴离子自由基清除率、SOD、CAT、T-AOC、GSH-Px酶活性及MDA含量测定均按照试剂盒说明书进行操作(南京建成生物工程研究所)。
2.5统计学分析实验数据统计用SPSS 11. 0软件进行,采用重复测量的方差分析,结果用±s表示;成分含量测定采用Duncan法进行多重比较,组间比较采用t检测。
Tab 1 Content of polyphenol and total flavonoids of I.nervosa Wall.by different extraction methods(±s,n =3)
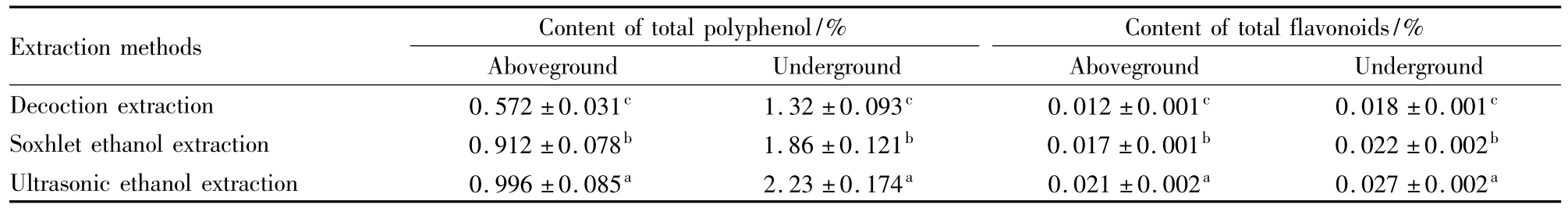
Tab 1 Content of polyphenol and total flavonoids of I.nervosa Wall.by different extraction methods(±s,n =3)
Different small letters in the same column indicate significant difference at P<0. 05
Extraction methods Content of total polyphenol/%Content of total flavonoids/% Aboveground Underground Decoction extraction 0.572±0.031c 1.32±0.093c 0.012±0.001c 0.018±0.001 Aboveground Underground c Soxhlet ethanol extraction 0.912±0.078b 1.86±0.121b 0.017±0.001b 0.022±0.002bUltrasonic ethanol extraction 0.996±0.085a 2.23±0.174a 0.021±0.002a 0.027±0.002a
3 结果
3.1不同提取方法所得总酚及总黄酮含量比较
以没食子酸为标准品,测得标准曲线回归方程为: Y =6. 2661X + 0. 0147,R2= 0. 9997,线性范围在0~0. 4 g·L-1。以芦丁为标准品,测得标准曲线回归方程为: Y =0. 0244X + 0. 0037,R2= 0. 9992,线性范围在0~0. 7 g·L-1。通过标准曲线计算显脉旋覆花提取液中总黄酮及总酚含量,结果表明总黄酮含量远远低于总酚含量( Tab 1) ;相同提取方法所得总酚及总黄酮含量均表现为地下部分高于地上部分;采用超声乙醇提取得到的总酚及总黄酮含量明显高于其他两种提取方法,水煎提取所得成分含量最低,因此文章后期体内外抗氧化实验所用提取液均采用超声乙醇提取。
3.2不同部位提取物体外抗氧化作用比较显脉旋覆花地上及地下部分提取物在低浓度时对DPPH自由基、超氧阴离子自由基的清除效果较弱,随浓度升高,抑制效果呈明显线性关系( Fig 1,Tab 2)。对ABTS自由基的清除效果在低浓度时有明显线性关系,浓度较高时则不明显,线性范围远远低于DPPH自由基、超氧阴离子自由基。地上部分提取物的半抑制浓度均高于地下部分,说明地下部分体外抗氧化的效果强于地上部分,这与显脉旋覆花地下部分总酚及总黄酮含量高于地上部分的结果相符。
3.3不同部位提取物对衰老小鼠肝脏的影响空白对照组小鼠肝脏的抗氧化酶活性均明显高于衰老模型组,同时MDA含量明显低于衰老模型组( Tab 3)。显脉旋覆花醇提物对D-半乳糖致衰小鼠肝脏CAT、SOD、T-AOC、GSH-Px酶活性有提高作用,并降低MDA含量,地上部分低浓度组的T-AOC酶活性与衰老组相比没有明显差异,随灌药浓度的增加肝脏抗氧化酶活性也得到增加。抗氧化效果随提取物浓度的增加而增强,同等浓度的地下部分提取物抗氧化效果均优于地上部分。
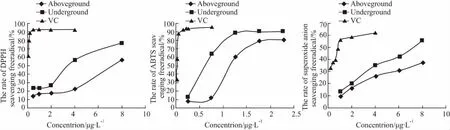
Fig 1 Clearing effects of I.nervosa Wall.on DPPH free radical,ABTS free radical and superoxide anion
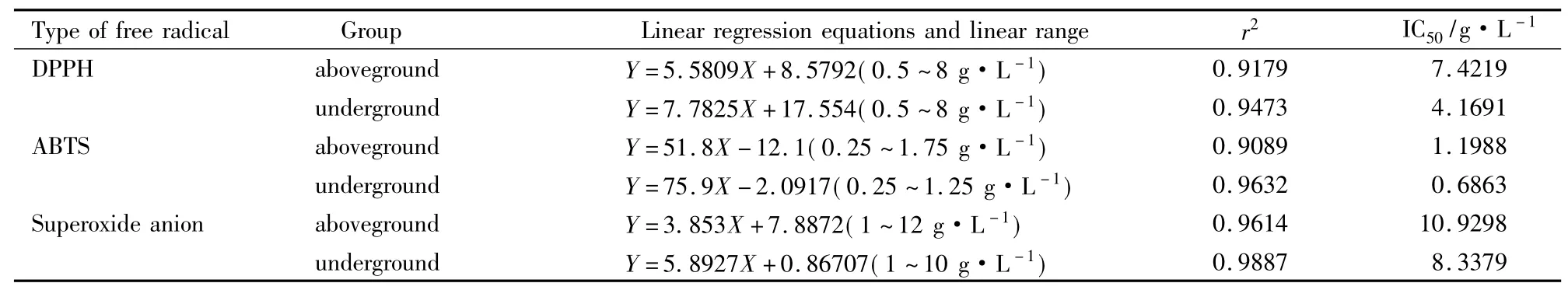
Tab 2 Clearing effects of alcohol extraction of I.nervosa Wall.on DPPH free radical,ABTs free radical and superoxide anion
Table 3 Effects of alcohol extraction of I.nervosa Wall.on aging mouse liver(±s,n =10)
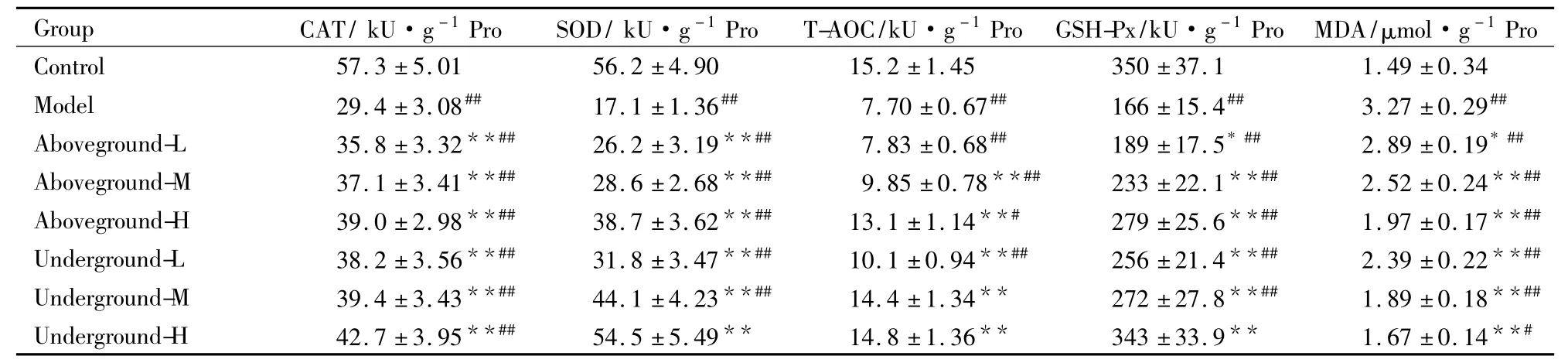
Table 3 Effects of alcohol extraction of I.nervosa Wall.on aging mouse liver(±s,n =10)
*P<0. 05,**P<0. 01 vs model;#P<0. 05,##P<0. 01 vs control.
_Group CAT/ kU·g-1Pro_______ SOD/ kU·g-1Pro_____ T-AOC/kU·g-1Pro__ GSH-Px/kU·g-1Pro MDA/μmol·g-1Pro_ Control 57.3±5.01 56.2±4.90 15.2±1.45 350±37.1 1.49±0.34 Model 29.4±3.08## 17.1±1.36## 7.70±0.67## 166±15.4## 3.27±0.29##Aboveground-L 35.8±3.32**## 26.2±3.19**## 7.83±0.68## 189±17.5* ## 2.89±0.19* ##Aboveground-M 37.1±3.41**## 28.6±2.68**## 9.85±0.78**## 233±22.1**## 2.52±0.24**##Aboveground-H 39.0±2.98**## 38.7±3.62**## 13.1±1.14**# 279±25.6**## 1.97±0.17**##Underground-L 38.2±3.56**## 31.8±3.47**## 10.1±0.94**## 256±21.4**## 2.39±0.22**##Underground-M 39.4±3.43**## 44.1±4.23**## 14.4±1.34** 272±27.8**## 1.89±0.18**##_Underground-H 42.7±3.95**## 54.5±5.49** 14.8±1.36** 343±33.9** 1.67±0.14**#
3.4不同部位提取物对衰老小鼠肾脏的影响衰老组小鼠的肾脏抗氧化酶活性均极明显低于空白对照组( Tab 4)。灌胃低浓度的显脉旋覆花地上部分提取物对衰老小鼠肾脏CAT、T-AOC酶活性及MDA含量影响不明显,随灌药浓度升高,肾脏抗氧化酶活性也明显升高。地下部分的效果同样优于地上部分,地下部分高浓度组的CAT、GSH-Px酶活性及MDA含量甚至与空白对照组无显著性差异,说明此时衰老小鼠的肾脏得到了很好的修复。3.5不同部位提取物对衰老小鼠血清的影响在D-半乳糖的作用下,小鼠血清中CAT、SOD等抗氧化酶活性明显下降,MDA含量极显著升高( Tab 5)。显脉旋覆花提取物对衰老小鼠血清的抗氧化酶都有不同程度的提高作用,并降低MDA含量。与衰老组相比,地上部分低浓度组T-AOC酶活性的升高及MDA含量的降低不明显,随浓度的增加,地上部分抗氧化的效果也逐步增加。地下部分的抗氧化效果同样比地上部分强,各组抗氧化酶活性与衰老组相比差异均有统计学意义,CAT酶活性与空白对照组无显著性差异。
Tab 4 Effects of alcohol extraction of I.nervosa Wall.on aging mouse kidney(±s,n =10)
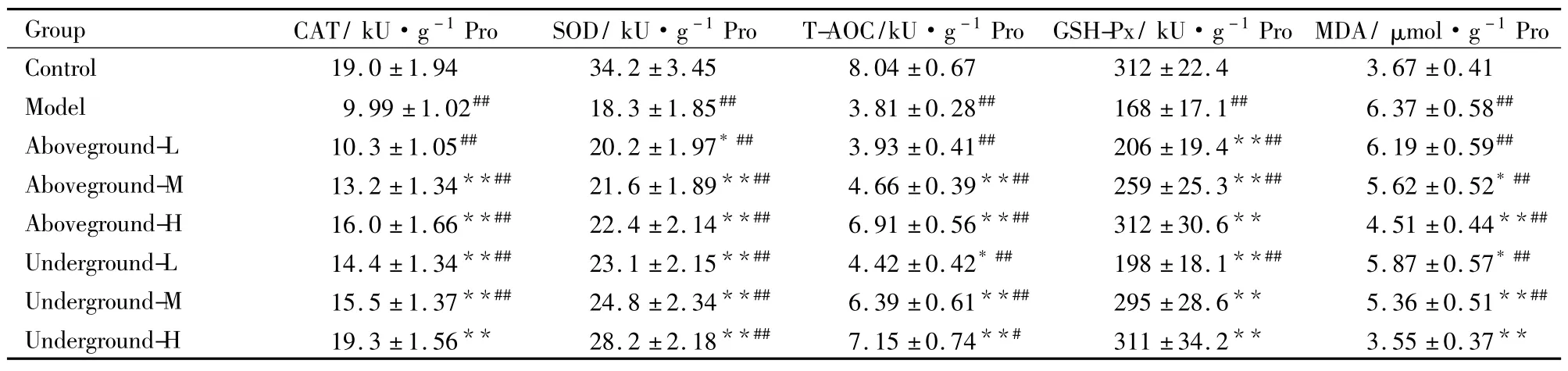
Tab 4 Effects of alcohol extraction of I.nervosa Wall.on aging mouse kidney(±s,n =10)
*P<0. 05,**P<0. 01 vs model;#P<0. 05,##P<0. 01 vs control.
_Group CAT/ kU·g-1Pro_______ SOD/ kU·g-1Pro______T-AOC/kU·g-1Pro___GSH-Px/ kU·g-1Pro MDA/μmol·g-1Pro Control 19.0±1.94 34.2±3.45 8.04±0.67 312±22.4 3.67±0.41 Model 9.99±1.02## 18.3±1.85## 3.81±0.28## 168±17.1## 6.37±0.58##Aboveground-L 10.3±1.05## 20.2±1.97* ## 3.93±0.41## 206±19.4**## 6.19±0.59##Aboveground-M 13.2±1.34**## 21.6±1.89**## 4.66±0.39**## 259±25.3**## 5.62±0.52* ##Aboveground-H 16.0±1.66**## 22.4±2.14**## 6.91±0.56**## 312±30.6** 4.51±0.44**##Underground-L 14.4±1.34**## 23.1±2.15**## 4.42±0.42* ## 198±18.1**## 5.87±0.57* ##Underground-M 15.5±1.37**## 24.8±2.34**## 6.39±0.61**## 295±28.6** 5.36±0.51**##_Underground-H__________ _______19.3±1.56** 28.2±2.18**## 7.15±0.74**# 311±34.2** 3.55±0.37**___
Tab 5 Effects of alcohol extraction of I.nervosa Wall.on aging mouseserum(±s,n =10)
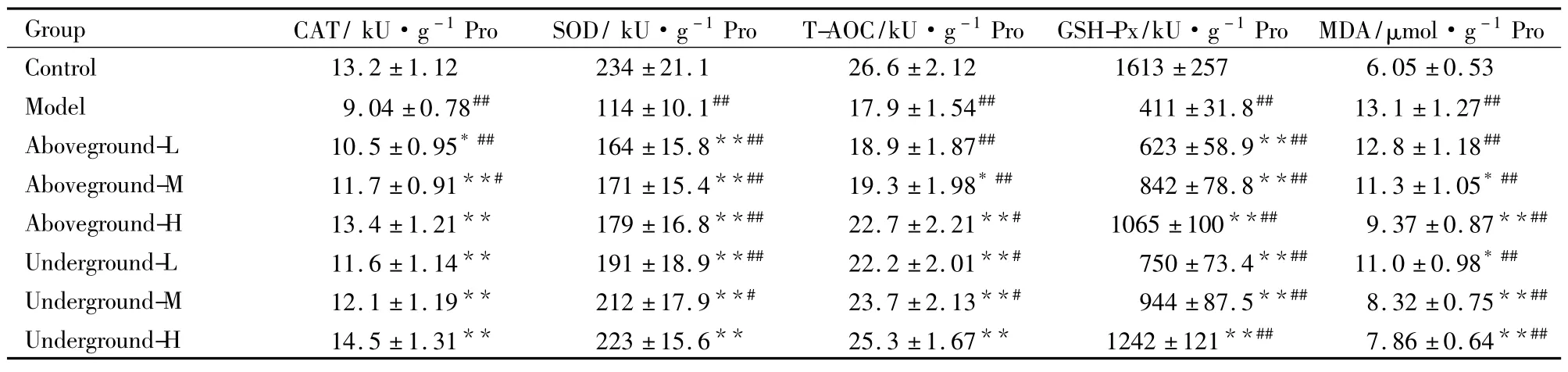
Tab 5 Effects of alcohol extraction of I.nervosa Wall.on aging mouseserum(±s,n =10)
*P<0. 05,**P<0. 01 vs model;#P<0. 05,##P<0. 01 vs control.
_Group CAT/ kU·g-1Pro_______ SOD/ kU·g-1Pro_____ T-AOC/kU·g-1Pro__ GSH-Px/kU·g-1Pro MDA/μmol·g-1Pro_ Control 13.2±1.12 234±21.1 26.6±2.12 1613±257 6.05±0.53 Model 9.04±0.78## 114±10.1## 17.9±1.54## 411±31.8## 13.1±1.27##Aboveground-L 10.5±0.95* ## 164±15.8**## 18.9±1.87## 623±58.9**## 12.8±1.18##Aboveground-M 11.7±0.91**# 171±15.4**## 19.3±1.98* ## 842±78.8**## 11.3±1.05* ##Aboveground-H 13.4±1.21** 179±16.8**## 22.7±2.21**# 1065±100**## 9.37±0.87**##Underground-L 11.6±1.14** 191±18.9**## 22.2±2.01**# 750±73.4**## 11.0±0.98* ##Underground-M 12.1±1.19** 212±17.9**# 23.7±2.13**# 944±87.5**## 8.32±0.75**##_Underground-H 14.5±1.31** 223±15.6** 25.3±1.67** 1242±121**## 7.86±0.64**##
4 讨论
近年来天然抗氧化剂的研究开发取得了很大进展,已报道发现很多植物都具有一定的抗氧化效果[10],这些研究都基于药材的特殊用途,通过药理实验对药效进行了验证[11]。本文研究发现,显脉旋覆花提取物在体外对超氧阴离子自由基、DPPH自由基及ABTS自由基都有一定的清除效果,地上部分提取物的半抑制浓度均高于地下部分。注射D-半乳糖致衰小鼠的肝脏、肾脏及血清中CAT、SOD、T-AOC、GSH-Px酶活性明显低于空白对照组,MDA含量则明显增高,与文献报道的结果一致[12],表明实验动物造模成功。通过灌胃显脉旋覆花提取物,致衰小鼠的抗氧化酶系统得到很好的修复,抗氧化效果随提取物浓度的增加而增强。
酚类物质是有效的自由基清除剂、抑制剂和螯合剂,黄酮类化合物也都有较强的抗自由基作用,这两类物质的抗氧化效果已有众多报道[13-14]。显脉旋覆花中含有较高的酚类物质,本文实验结果表明,显脉旋覆花地下部分提取物的总酚及总黄酮含量高于地上部分,同浓度提取物的地下部分抗氧化效果都强于地上部分,提取物体内外抗氧化的效果与总酚及总黄酮含量呈正比,可见酚类及黄酮类物质是显脉旋覆花抗氧化的重要药用成分。实验通过比较地上及地下部分的活性成分及抗氧化效果,验证了显脉旋覆花使用部位的科学性(卫生部公布的食用地下根茎部位)。
(致谢:本实验在怀化学院民族药用植物资源研究与利用湖南省重点实验室完成。)
参考文献:
[1]中国植物志编辑委员会.中国植物志[M].第75卷.北京:科学出版社,2005,75: 267-9.
[1]Editorial committee of Flora of China.Flora of China[M].Vol.75.Beijing: Science Press,2005,75: 267-9.
[2]张鸭关,刘品华,汪帆.显脉旋覆花的营养成分及营养价值评价[J].食品工业科技,2012,7: 16-8.
[2]Zhang Y G,Liu P H,Wang F.Nutrients and nutritional value of Inula nervosa wall[J].Sci Technol Food Industry,2012,7: 16-18.
[3]刘敏,胡嘉想,徐晓静,等.显脉旋覆花的大鼠亚慢性毒性研究[J].毒理学杂志,2012,26( 2) : 156-7.
[3]Liu M,Hu J X,Xu X J,et al.Study on sub-chronic toxicity in rats of Inula nervosa wall.[J].J Toxicol,2012,26( 2) : 156-7.
[4]舒晔,江滨,林桦,等.显脉旋覆花总挥发油的药理研究[J].云南中医学院学报,1990,13( 1) : 22-4.
[4]Shu Y,Jiang B,Lin Y,et al.Pharmacological research on total volatile oil of Inula nervosa wall.[J].J Yunnan Coll Tradit Chin Med,1990,13( 1) : 22-4.
[5]范多青,罗士德,王慧英,张起凤.草威灵化学成分的研究[J].中草药,1997,2: 67-9.
[5]Fan D Q,Luo S D,Wang H Y,Zhang Q F.Study on chemical composition of Inula nervosa wall.[J].Chin Tradi Herbal drugs,1997,2: 67-9.
[6]李柯,史蕾喆,陈丹,等.HPLC测定不同药用部位、产地及采收时期显脉旋覆花中麝香草酚和异丁酸百里香酚的含量[J].湖南中医药大学学报,2013,33( 7) : 41-4.
[6]Li K,Shi L J,Chen D,et al.Content determination of thymol and thymyl isobutyrate in Inula nervosa Wall.from different parts,different habitats and different harvest periods by HPLC[J].J Hunan Univ Chin Med,2013,33( 7) : 41-4.
[7]南京中医药大学.中药大辞典,下册[M],第2版.上海:科学技术出版社,2005: 2139.
[7]Nanjin university of Chinese Medicine.The second edition of the dictionary of traditional Chinese Medicine[M],VolumeⅡ.Shanghai: Science and Technology Press,2005: 2139.
[8]贺安娜,佘朝文.显脉旋覆花的民族植物学调查[J].植物分类与资源学报,2013,35( 4) : 497-500.
[8]He A N,She C W.Ethnobotanical survey of use of Inula nervosa ( Compositae)[J].Plant Divers Resourc,2013,35( 4) : 497-500.
[9]谭娟,黄静,欧立军.天门冬水提液体外抗氧化及抑菌作用观察[J].中成药,2014,36( 8) : 1753-6.
[9]Tan J,Huang J,Ou L J.Effects observed on antioxidant and antibacterial of water extract of Asparagus cochinchinensis[J].Chin Trad Patent Med,2014,36( 8) : 1753-6.
[10]Garg S,Sharma K,Ranjan R,et al.In vivo antioxidant activity and hepatoprotective effects of methanolic extract of Mesua ferrealinn[J].Internat J Pharm.Tech Res,2009,1: 1692-1696.http: / /sphinxsai.com/PTVOL4/pdf _ vol4/PT = 118% 20 ( 1692-1696).pdf
[11]Aoxue Luo,Zhong fu Ge,Yijun Fan,et al.In vitro and in vivo antioxidant activity of a water-soluble polysaccharide from dendrobium denneanum[J].Molecules,2011,16,1579-1592.http: / /www.mdpi.com/1420-3049/16/2/1579
[12]高莉,林娟,张富春,等.类叶升麻苷对D-半乳糖致衰老小鼠抗氧化作用的研究[J].中国药理学通报,2013,29 ( 10) : 1440-3.
[12]Gao L,Lin J,Zhang F C,et al.Antioxidant effects of acteoside on aged mice induced by D-galactose[J].Chin Pharmacol Bull,2013,29( 10) : 1440-3.
[13]马荣林,王尉平,蒋小岗,等.黄芩总黄酮对博莱霉素致大鼠肺纤维化的干预作用[J].中国药理学通报,2011,27( 4) : 537-42.
[13]Ma R L,Wang W P,Jiang X G,et al.Effects of total flavonoids of scutellaria baicalensis georgi ( TFSB) on bleomycin-induced pulmonary fibrosis in rats[J].Chin Pharmacol Bull,2011,27 ( 4) : 537-42.
[14]薛占霞,高永山,沈丽霞,薛贵平.大黄酚通过抗氧化应激改善高血氨小鼠学习记忆功能障碍[J].中国药理学通报,2015,31( 9) : 1330-1.
[14]Xue Z X,Gao Y S,Shen L X,Xue G P.Improve learning and memory dysfunction in mice with hypertension by oxidative stress of chrysophanol[J].Chin Pharmacol Bull,2015,31( 9) :1330-1.
Comparison study on in vitro and in vivo antioxidant activities of Inula nervosa Wall.extracts from different parts
HE An-na1,2,3,SHE Chao-wen2,3,ZENG Jun-ying1,2,3,PENG Sheng-xian1
( 1.College of Biological and Food Engineering,Huaihua University; 2.Key Laboratory of Research and Utilization of Ethnomedicinal Plant Resources of Hunan Province; 3.Key Laboratory of Xiangxi Medicinal Plant and Ethnobotany of Hunan Higher Education,Hunan Huaihua 418008,China)
Abstract:AimTo study the in vitro and in vivo antioxidant activity of Inula nervosa wall.in order to legitimately use the resources of I. nervosa.Methods The medicinal ingredients of aboveground and underground parts of I.nervosa were extracted by different extraction methods.Ultrasonic extractions from different parts were compared by their in vitro and in vivo antioxidant effects.ResultsUltrasound alcohol extraction had the highest content of total phenols and flavonoids,with the content of total phenolics much higher than that of total flavonoids.Ultrasound alcohol extractions had very good scavenging effect on DPPH,ABTS and superoxide anion radical,with the extraction from underground part more effective than extraction from aboveground part.Ultrasound alcohol extractions significantly increased the level of catalase ( CAT), superoxide dismutase ( SOD),total antioxidant capacity ( T-AOC),glutathione peroxidase ( GSH-Px) activity and decreased the level of malondialdehyde ( MDA) in liver,kidney and serum in drenching aging mice.The antioxidant activity of high concentration of the extraction from aerial part was equivalent to that of low concentration of the extraction from underground part.Conclusions Ultrasound alcohol extractions of I.nervosa have very good scavenging effect on free radicals,which indicates good antioxidant ability.Antioxidant activity of underground part is much stronger than that of the aboveground part.
Key words:Inula nervosa Wall.; different parts; extraction methods; total polyphenol; total flavonoids; antioxidant
作者简介:贺安娜( 1981-),女,硕士,副教授,研究方向:民族药用植物方面,Tel: 0745-2861281,E-mail: anna99102 @ 163.com
基金项目:湖南省科技计划重点项目( No 2013FJ4324) ;湖南省科技计划一般项目( No 2013NK4108) ;植物学湖南省“十二五”重点建设学科资金资助( No ZWX2014-4)
收稿日期:2015-08-26,修回日期: 2015-11-26
文献标志码:A
文章编号:1001-1978( 2016) 01-0079-05
doi:10.3969/j.issn.1001-1978.2016.01.017
