基于人胚胎干细胞的实时细胞系统评价心脏毒性方法的建立
2016-03-21汪溪洁王淑颜
赵 琪,汪溪洁,王淑颜,马 璟
(中国医药工业研究总院上海医药工业研究院国家上海新药安全评价研究中心,上海 201203)
基于人胚胎干细胞的实时细胞系统评价心脏毒性方法的建立
赵琪,汪溪洁,王淑颜,马璟
(中国医药工业研究总院上海医药工业研究院国家上海新药安全评价研究中心,上海201203)
中国图书分类号: R322.11; R329.24; R329.411; R965.1; R917
摘要:目的采用人胚胎干细胞诱导分化的心肌细胞( human embryonic stem cells derived cardiomyocytes,hESC-CM)联合实时细胞分析系统( real-time cell analysis Cardio,RTCA Cardio),建立一种体外药物心脏毒性早期筛选方法。方法
将hESC-CM接种到RTCA Cardio E-Plate 96孔板,分析心肌细胞的搏动频率、幅度和搏动节律不规则性指数确定细胞最佳接种密度及检测时间,建立体外药物心脏毒性早期筛选方法。在此基础上,分别采用0.1 % DMSO作为溶剂对照及具有抗心律失常作用的药物奎尼丁( 0. 2、0. 78、3. 13、12. 5、50和100 μmol·L-1)作为阳性对照进行了验证。结果0. 1 %DMSO对hESC-CM的生长指数( cell index,CI值)、搏动特征图谱及搏动频率和幅度均无影响。而与溶剂对照组相比,奎尼丁浓度≥3. 13 μmol·L-1时影响细胞CI值和特征性搏动图谱,抑制细胞搏动频率和幅度,且具有浓度依赖性,浓度越高细胞搏动信号恢复所需时间越长,对搏动频率和幅度的抑制作用越明显。结论采用hESC-CM联合RTCA Cardio系统建立的体外药物心脏毒性早期筛选方法可以检测出奎尼丁对心肌细胞搏动状况的影响,该方法可作为一种高通量筛选工具用于临床前药物心脏毒性早期筛选。
关键词:hESC-CM; RTCA Cardio;心脏毒性;药物;体外筛选;奎尼丁
马璟( 1963-),女,博士,研究员,博士生导师,研究方向:药物毒理学,通讯作者,E-mail: jma@ ncdser.com
心脏毒性在新药研发、审批和上市销售过程中是一个非常重要的关注点。据报道,45%的药物上市后因心血管系统不良反应而撤市,27%的新药因心血管毒性在临床前安全性评价阶段被迫终止研发[1]。因此,提高药物早期心脏毒性筛选的预测能力可以大大降低制药公司研发成本,提高新药研发成功率。目前,常用的药物心脏毒性体外评价模型如原代心肌细胞、类心肌细胞系等通常存在难以获取、缺乏自然心肌细胞环境中的复杂通道相互作用以及种属差异等缺点。缺少能够准确模拟人类生理反应的低成本实验模型成为限制药物早期心脏毒性筛选研究的主要原因之一。近年来,随着干细胞研究的不断深入,干细胞诱导分化的心肌细胞成为心脏毒性体外评价研究的新热点。
胚胎干细胞衍生于囊胚的内细胞团或原始外胚层的细胞,具有自我更新、无限增殖和多向分化的特性。2001年,Kehat等[2]首次将人胚胎干细胞诱导分化为心肌细胞,开启了hESC-CM在药物心脏毒性研究领域的新篇章。hESC-CM的形态结构、基因表达及电生理特性与正常人心肌细胞极为相似,是一种非常理想的心脏毒性体外评价模型。研究表明hESC-CM模型的对药物性心律失常的预测能力在定性和定量两个方面都可取代兔浦肯野纤维束模型,而且与犬的浦肯野纤维束模型相比,hESC-CM模型对引起动作电位改变的多离子通道阻滞剂所致心律失常的敏感性更高[3-4]。采用hESC-CM模型进行实验研究不仅可以减少动物使用,缩短实验周期,降低研发成本,同时避免了种属差异,提高了临床预测准确性。本研究将hESC-CM接种到RTCA Cardio EPlate 96孔板上,建立了基于人胚胎干细胞和实时细胞分析技术的体外药物心脏毒性早期筛选方法,并采用0. 1% DMSO作为溶剂对照和具有抗心律失常作用药物奎尼丁作为阳性对照对该方法进行验证。
1 材料与方法
1.1主要试剂奎尼丁,批号: BCBB6721V,购自美国Sigma公司;胎牛血清、明胶和B27因子购自美国Sigma公司; RPMI 1640培养基和PBS购自美国Gibco公司;乙醇和二甲亚砜( dimethyl sulfoxide,DMSO)购自国药集团化学试剂有限公司; Y10因子由北京生物物理所友情提供。
1.2主要仪器设备xCELLigence Cardio细胞功能分析仪,美国ACEA Biosciences公司; AE100精密天平,美国Mettler Toledo公司; ESC01CLM-170A-B二氧化碳培养箱; ST16R台式离心机,美国Thermo Scientific公司;生物安全柜,上海瑞仰净化设备有限公司;倒置显微镜,日本OLYMPUS公司; 8道电动移液器,德国Eppendorf公司。
1.3RTCA Cardio系统基线的测定及细胞接种hESCCM(马跃课题组,胚胎干细胞H7改造后的细胞系诱导分化d 30的心室肌细胞)由北京生物物理所友情提供[2]。向RTCA Cardio E-Plate 96孔板每孔中加入50 μL灭菌后1 g· L-1明胶溶液,置于4℃过夜或37℃孵育4 h。弃去包被液,待RTCA Cardio E-Plate 96孔板干燥后,加入50 μL培养基,37℃孵育3-5 min后,将其放在RTCA Cardio工作站上测基线。
从液氮中取出hESC-CM冷冻管,立即将冷冻管的下半部浸入37℃水浴中,不断摇晃1~2 min,待80 %细胞融化时从水浴中取出,酒精消毒后将冷冻管移至超净台中,立即将细胞逐滴加入10 mL预热培养基中,边加边摇。待摇匀后,吸取100 μL细胞悬液于EP管中,加入100 μL台盼蓝染液,进行活细胞计数,其余细胞于室温条件下,300×g离心3 min。
细胞计数后将离心所得细胞制成4×108cells·L-1的细胞悬液,按照1∶1 000的比例向细胞悬液中加入Y10因子。RTCA E-Plate Cardio 96孔板每孔中加入100 μL细胞悬液,使孔中细胞数量达到每孔40 000个,室温放置20~30 min后,将其放在RTCA Cardio工作站上监测。每天换液,换液体积120 μL (总体积150 μL)。因为hESC-CM对温度及培养环境的变化非常敏感,所以每次换液必须剩余部分培养液,以避免温度及培养环境变化对细胞搏动信号的影响。第2次换液4 h后加药。本实验采用0. 1% DMSO作为溶剂对照,设置4个复孔。采用奎尼丁作为阳性对照,奎尼丁的工作终浓度分别为0. 2、0. 78、3. 13、12. 5、50和100 μmol· L-1,每组4个复孔。分别观察0. 1 % DMSO及奎尼丁对hESC-CM的CI值、搏动特征图谱和标准化搏动频率及幅度的影响。
1.4数据采集及处理实验数据由RTCA Cardio Software 1.0进行控制和采集,数据采集设置每次测量时间为20 s,时间分辨率为12. 9 ms( Tab 1)。获得实验数据后,使用RTCA Cardio Software 1.0对hESC-CM的搏动频率和幅度进行分析。各浓度组心肌细胞搏动频率和搏动幅度均以给药前的值进行标准化,得到标准化搏动频率和标准化搏动幅度。
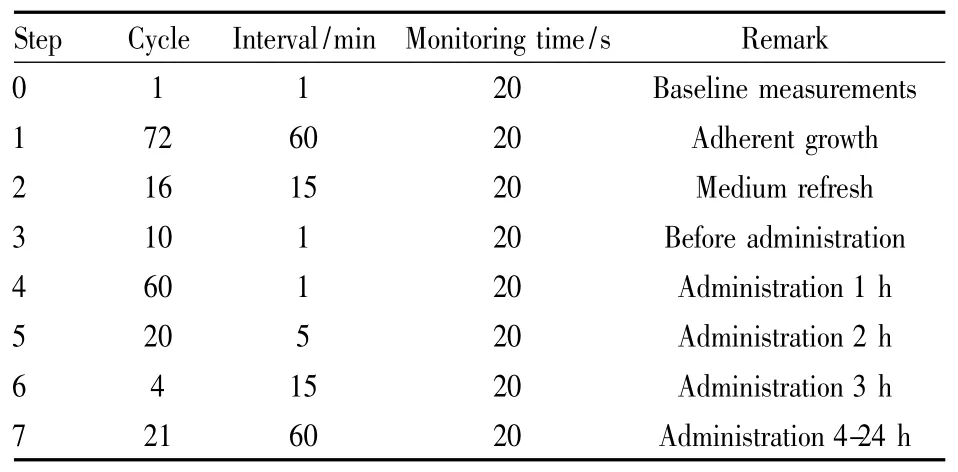
Tab 1 Data collection setting
1.5统计学方法应用RTCA Cardio software1.0软件,SPSS 21. 0软件及Excel对数据进行统计学分析。计量资料以±s表示,用Levene's检验检测数据的方差齐性,若方差齐,则进行单因素方差分析( ANOVA) ;若方差不齐,则Dunnett T3检验进行组间比较检验。
2 结果
2.1心脏毒性评价方法的建立将hESC-CM接种到RTCA Cardio E-Plate 96孔板后上,放在培养箱中的实时细胞分析工作站上培养96 h。随着hESC-CM的贴壁生长,CI值逐渐增大直到细胞贴壁完全( Fig 1)。随着hESC-CM不断收缩舒张,可观察到细胞特征性搏动图谱( Fig 2)。最早可在细胞培养40 h后采集到hESC-CM持续搏动数据,细胞搏动频率为28±55( 1/min),幅度为0. 0050±0. 0115,节律不规则指数为21%±47%,此时节律不规则指数过大,搏动节律严重不规则。48 h换液后细胞搏动趋于稳定,细胞搏动频率为58±4( 1/min),幅度为0. 0627±0. 0066,节律不规则指数降为7%±3%。由于换液过程中温度的变化和新鲜培养液的加入会造成细胞搏动参数的改变,可以在换液后稳定2~4 h再进行加药。96 h后节律不规则指数过大( Fig 3),不再适宜加药检测,因此检测药物对hESC-CM影响最好在48~96 h之间完成。
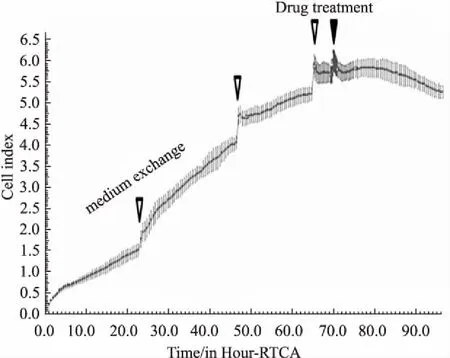
Fig 1 Growth curve of hESC-CM at 96 h (±s,n =4)
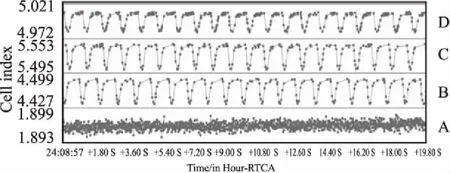
Fig 2 Transient pulse patterns of hESC-CM cultured after different time points
2.2心脏毒性评价方法的验证
2.2.10. 1%DMSO对hESC-CM搏动状态影响hESC-CM搏动稳定后给予0.1%DMSO,观察其对hESC-CM的CI值、搏动特征图谱和搏动频率及幅度的影响。结果表明,培养液组与0.1%DMSO组细胞生长曲线趋势基本保持一致,CI值无明显变化( Fig 4),给予0.1%DMSO不影响hESC-CM的贴壁和生长;给予0. 1%DMSO后可观察到与培养液组相似的持续、稳定的细胞特征性搏动图谱( Fig 5),给予0.1% DMSO对hESC-CM收缩舒张产生的特征性搏动图谱无明显影响;给予0. 1 %DMSO后细胞在各个时间点的标准化搏动频率和幅度与培养液组相比差异无显著性( Fig 6,Tab 2、3)。因此,可以确定0. 1 %DMSO对hESC-CM搏动状态无明显影响。
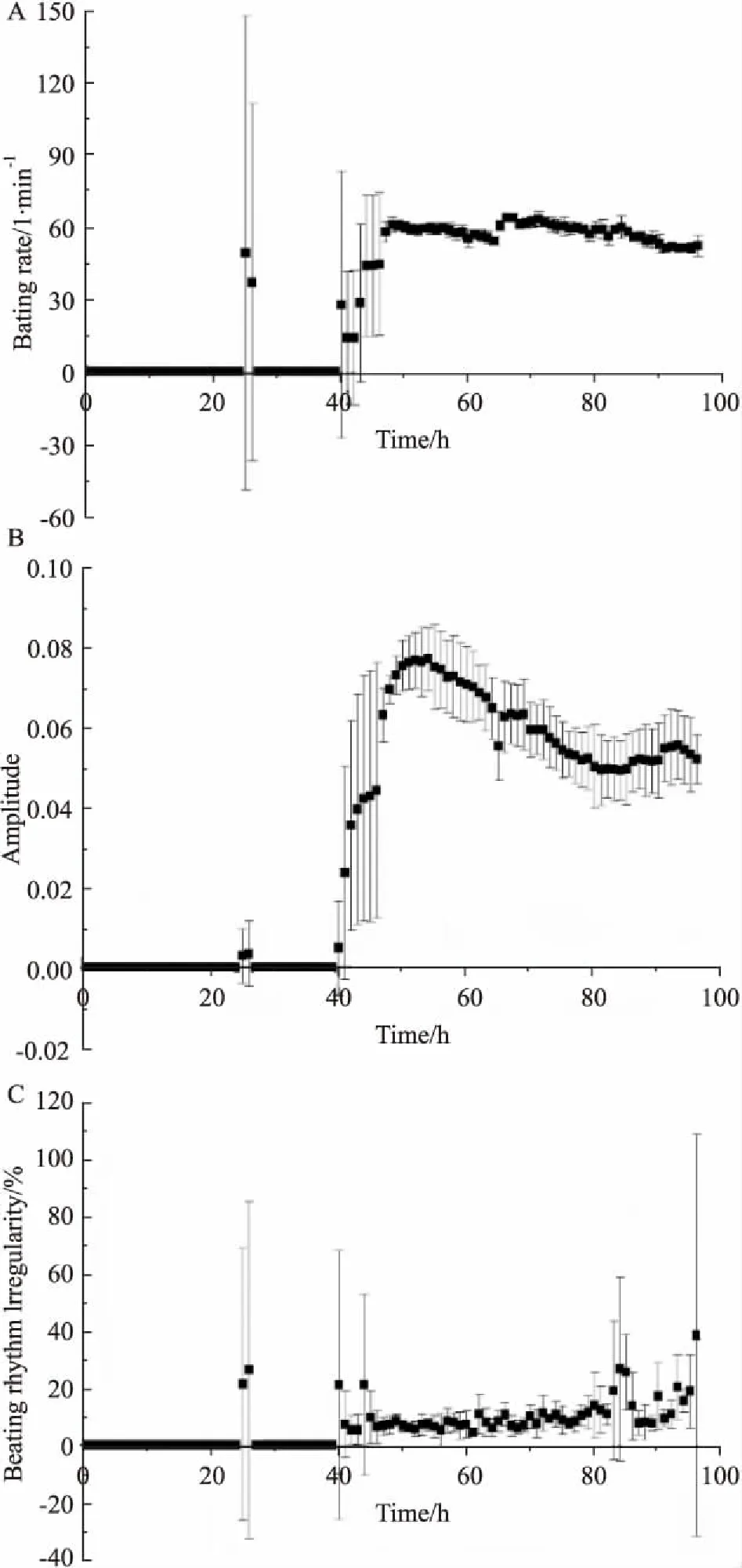
Fig 3 Beating index of hESC-CM (±s,n =4)
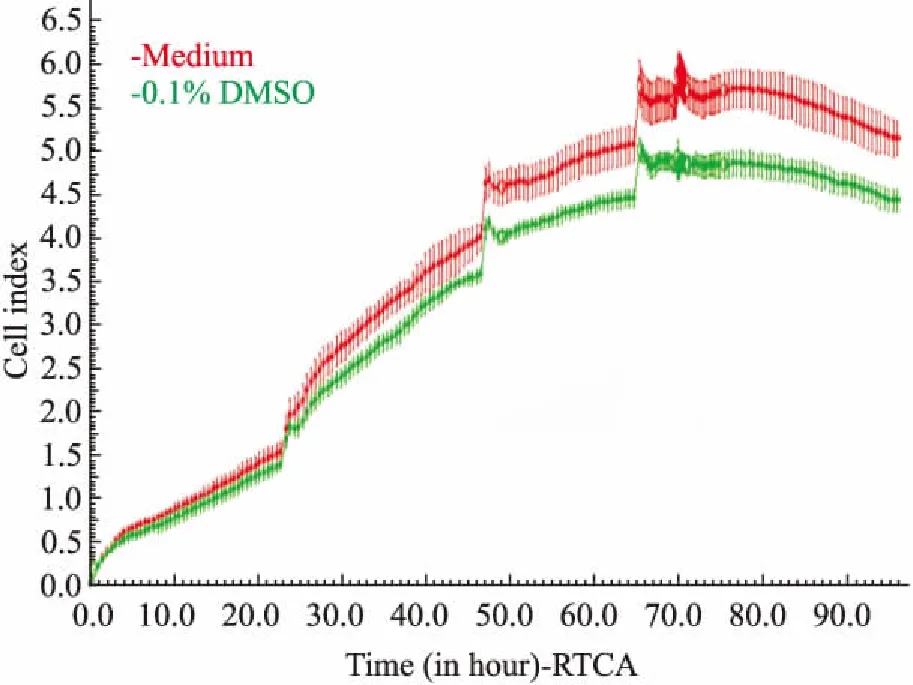
Fig 4 Effect of 0.1 %DMSO on growth curve of hESC-CM (±s,n =4)
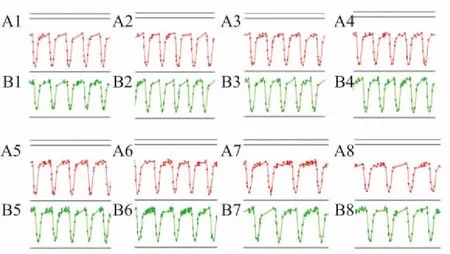
Fig 5 Effect of 0.1 %DMSO on transient pulse patterns of hESC-CM
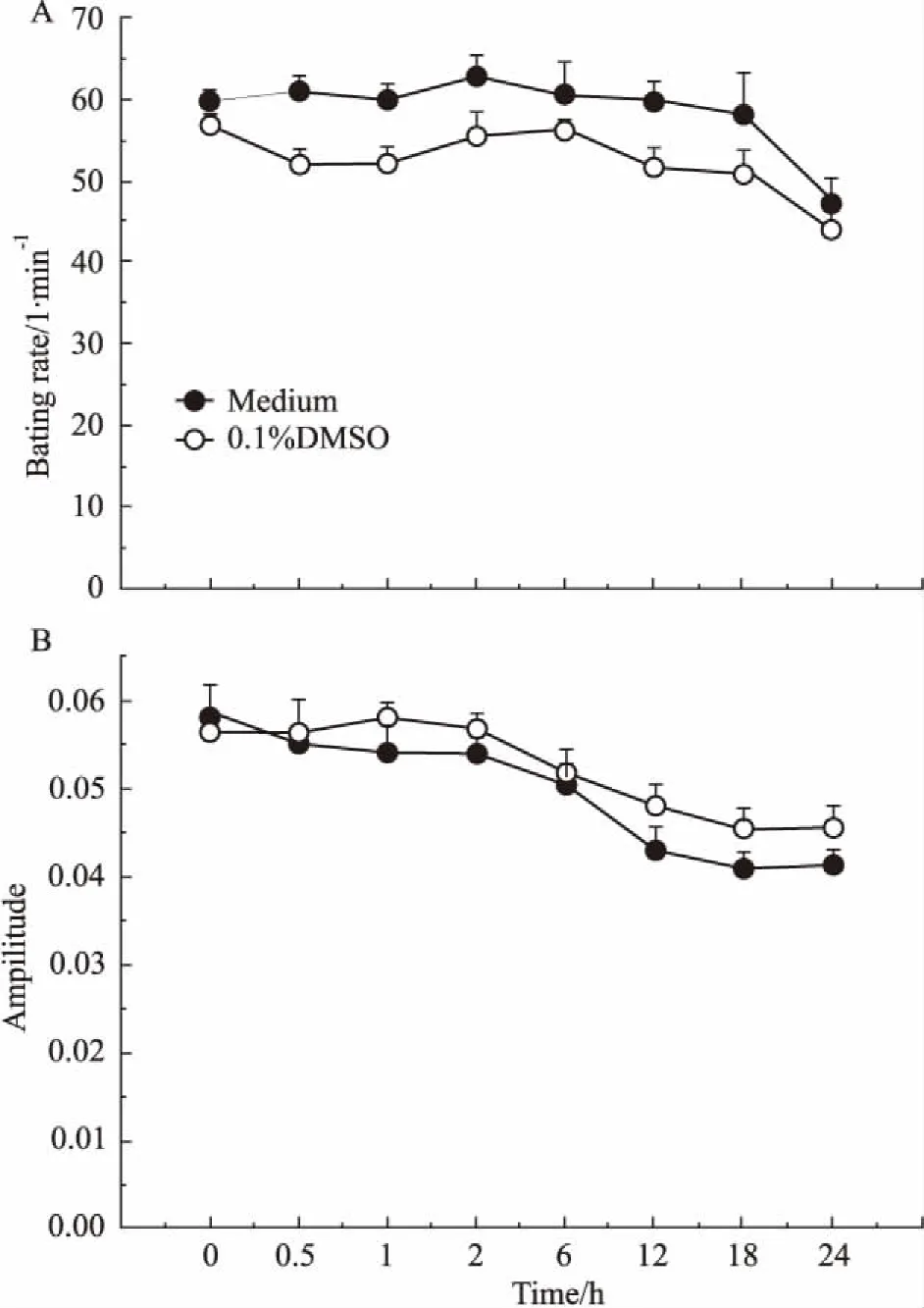
Fig 6 Effect of 0.1 %DMSO on beating rate and amplitude of hESC-CM (±s,n =4)
2.2.2奎尼丁对hESC-CM搏动状态影响hESC-CM搏动稳定后给予不同浓度奎尼丁( 0. 2、0. 78、3. 13、12. 5、50和100 μmol·L-1),观察其对hESC-CM的CI值、搏动特征图谱和搏动频率及幅度的影响。结果表明,与溶剂对照组相比,给药后奎尼丁浓度≥50 μmol·L-1时影响细胞生长曲线,CI值明显减小,且100 μmol·L-1组CI值减小较50 μmol·L-1组明显( Fig 7)。与溶剂对照组相比,给药后奎尼丁浓度≥3. 13 μmol·L-1时影响细胞特征性搏动图谱,且具有一定的浓度-时间依赖性( Fig 8)。3. 13 μmol·L-1组给药后,细胞搏动信号明显减弱; 12. 5、50和100 μmol·L-1组给药后,细胞搏动信号消失,12. 5 μmol·L-1组细胞搏动信号于给药6 h后恢复出现,但信号明显弱于溶剂对照组; 50 μmol·L-1组细胞搏动信号于给药24 h后恢复出现,但信号明显弱于溶剂对照组; 100 μmol·L-1组给药后细胞搏动信号不再恢复出现。奎尼丁浓度≥3. 13 μmol·L-1时明显抑制细胞搏动频率和幅度,且具有明显的浓度依赖性,浓度越高对细胞搏动频率和幅度抑制越明显,细胞搏动信号恢复所需时间越长( Fig 9,Tab 2、3)。
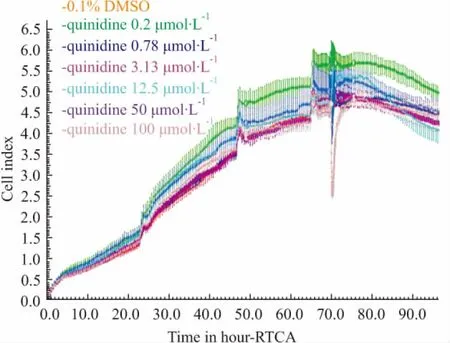
Fig 7 Effect of quinidine on growth curve of hESC-CM (±s,n =4)
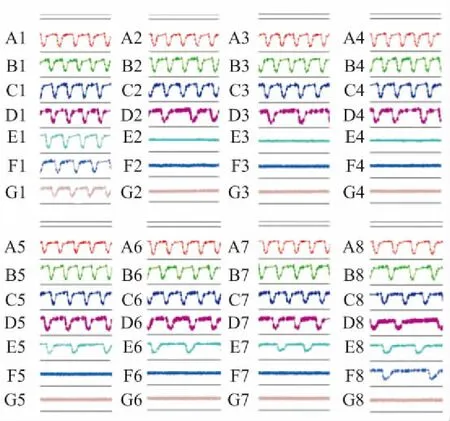
Fig 8 Effect of quinidine on transient pulse patterns of hESC-CM
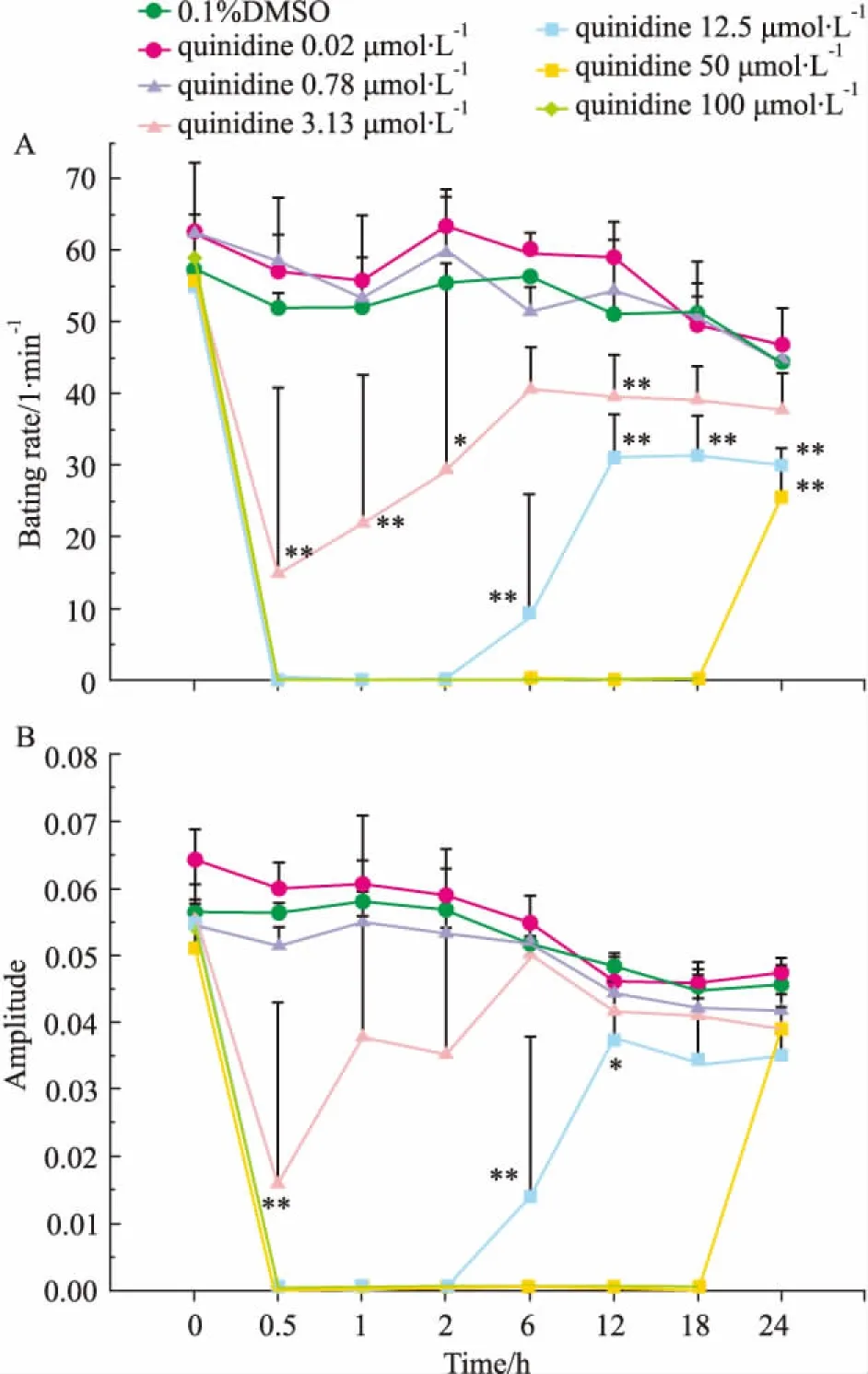
Fig 9 Effect of quinidine on bating rate and amplitude of hESC-CM (±s,n =4)
3 讨论
RTCA Cardio系统能够在近似生理环境下实时、定量、无标记、非侵入性动态地监测心肌细胞搏动频率和幅度,进而通过分析这些指标变化评价药物引起心肌细胞生长和搏动状态变化,预测其潜在心脏毒性[5]。目前,罗氏等制药公司已开始采用RTCA Cardio系统进行药物和候选化合物心脏毒性研究,美国FDA也已购买了RTCA Cardio系统,该系统的应用前景十分广阔。本实验室也已采用RTCA Cardio系统研究药物对原代大鼠心肌细胞作用[6],但国内鲜有采用hESC-CM作为实验模型进行研究鲜有报道,我们建立了以hESC-CM为基础,运用RTCA Cardio系统采集记录hESC-CM生长和搏动信号的体外药物心脏毒性早期筛选方法,并采用0. 1 %DMSO作为溶剂对照及奎尼丁作为阳性对照进行了验证。
本研究中有一些关键点需要特别注意,( 1)细胞密度:细胞密度过高或过低都会影响细胞搏动稳定性及规律性,实验中设置了3个密度进行接种,发现40 000/孔为最佳细胞接种密度; ( 2)换液:每次换液须残留部分培养液,以免温度及细胞周围环境变化过大,造成细胞搏动信号减弱或消失; ( 3)细胞状态:实验过程中,动作应尽量轻柔,以避免对细胞造成损伤,影响细胞状态; ( 4) Y10因子: Y10因子可以提高hESC-CM存活率,实验过程中应在接种前以1: 1000的比例加入Y10因子; ( 5)无菌操作:实验过程中必须保证无菌操作,细胞染菌后其搏动信号将会减小甚至消失; ( 6)加药时间: hESC-CM接种培养48~96 h之间为最佳加药检测时间范围,在此范围内,细胞搏动稳定,可准确的预测药物的心脏毒性; ( 7)设置对照:本研究设有空白对照、溶剂对照及阳性对照以保证本实验系统稳定可靠。
Tab 2 Effect of 0.1 %DMSO and quinidine on beating rate of hESC-CM (±s,n =4)
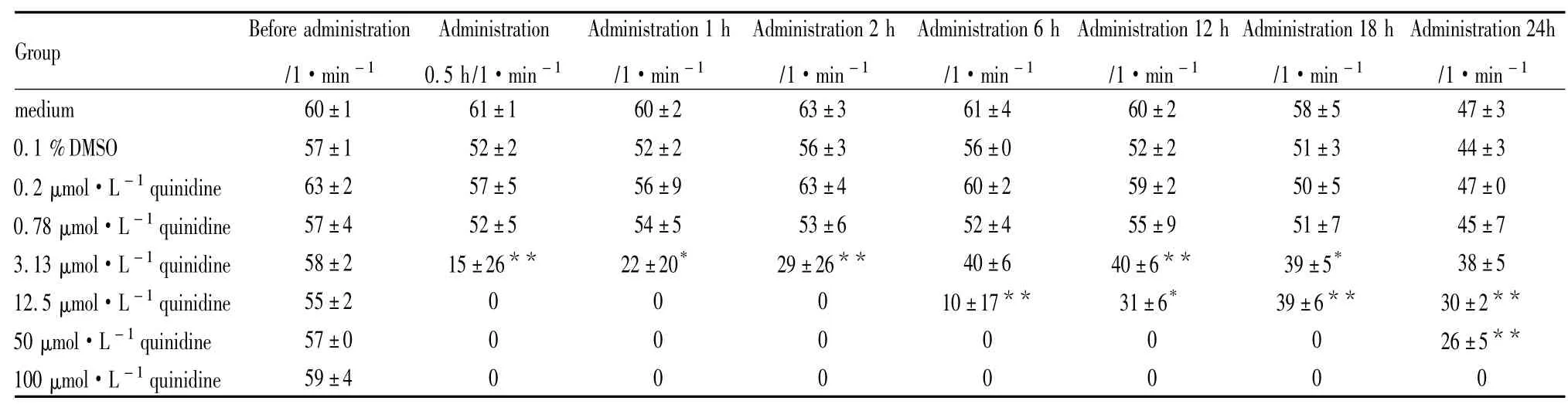
Tab 2 Effect of 0.1 %DMSO and quinidine on beating rate of hESC-CM (±s,n =4)
*P<0.05,**P<0.01 vs 0.1 %DMSO group.
Group Before administration _________________________/1·min-1Administration 0.5 h/1·min-1______ Administration 1 h /1·min-1_________ Administration 2 h /1·min-1________ Administration 6 h /1·min-1________ Administration 12 h /1·min-1________ Administration 18 h /1·min-1_________ Administration 24h /1·min -1____ medium 60±1 61±1 60±2 63±3 61±4 60±2 58±5 47±3 0.1 %DMSO 57±1 52±2 52±2 56±3 56±0 52±2 51±3 44±3 0.2 μmol·L-1quinidine 63±2 57±5 56±9 63±4 60±2 59±2 50±5 47±0 0.78 μmol·L-1quinidine 57±4 52±5 54±5 53±6 52±4 55±9 51±7 45±7 3.13 μmol·L-1quinidine 58±2 15±26** 22±20* 29±26** 40±6 40±6** 39±5* 38±5 12.5 μmol·L-1quinidine 55±2 0 0 0 10±17** 31±6* 39±6** 30±2**50 μmol·L-1quinidine 57±0 0 0 0 0 0 0 26±5**100 μmol·L-1quinidine_______59±4 0 0 0 0 0 0 0_______
Tab 3 Effect of 0.1% DMSO and quinidine on amplitude of hESC-CM (±s,n =4)
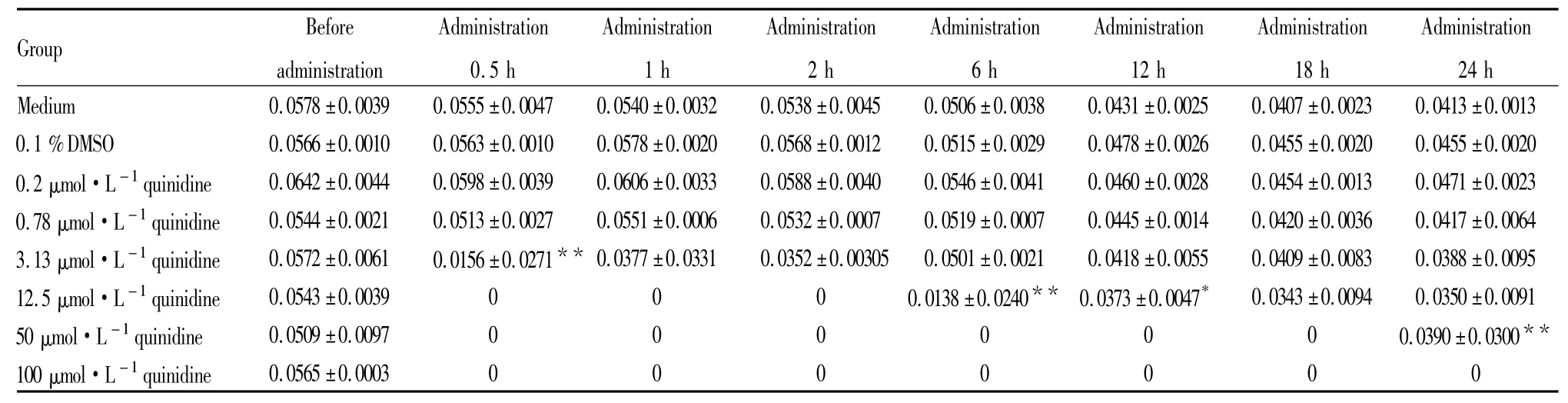
Tab 3 Effect of 0.1% DMSO and quinidine on amplitude of hESC-CM (±s,n =4)
*P<0. 05,**P<0. 01 vs 0. 1 %DMSO group.
Group Before ________________________________________________________________________________________________________________________________ __________administration Administration 0.0025 0.0407±0.0023 0.0413±0.0013 0.1 %DMSO 0.0566±0.0010 0.0563±0.0010 0.0578±0.0020 0.0568±0.0012 0.0515±0.0029 0.0478±0.0026 0.0455±0.0020 0.0455±0.0020 0.2 μmol·L-1quinidine 0.0642±0.0044 0.0598±0.0039 0.0606±0.0033 0.0588±0.0040 0.0546±0.0041 0.0460±0.0028 0.0454±0.0013 0.0471±0.0023 0.78 μmol·L-1quinidine 0.0544±0.0021 0.0513±0.0027 0.0551±0.0006 0.0532±0.0007 0.0519±0.0007 0.0445±0.0014 0.0420±0.0036 0.0417±0.0064 3.13 μmol·L-1quinidine 0.0572±0.0061 0.0156±0.0271**0.0377±0.0331 0.0352±0.00305 0.0501±0.0021 0.0418±0.0055 0.0409±0.0083 0.0388±0.0095 12.5 μmol·L-1quinidine 0.0543±0.0039 0 0 0 0.0138±0.0240** 0.0373±0.0047* 0.0343±0.0094 0.0350±0.0091 50 μmol·L-1quinidine 0.0509±0.0097 0 0 0 0 0 0 0.0390±0.0300**100 μmol·L-1quinidine_____ 24_h Medium 0.0578±0.0039 0.0555±0.0047 0.0540±0.0032 0.0538±0.0045 0.0506±0.0038 0.0431± Administration 0.5_h___________ Administration 1_h____________ Administration 2_h____________ Administration 6_h____________ Administration 12_h___________ Administration 18_h____________________ 0.0565±0.0003 0 0 0 0 0 0 0______
DMSO是一种“万能溶剂”,很多药物都可采用DMSO溶解。根据文献报道,DMSO浓度≤0. 1 %时不会造成细胞损伤[7]。我们检测了hESC-CM给予0. 1 % DMSO后24 h内细胞搏动频率及幅度的变化,并与hESC-CM给予培养液后24 h内细胞搏动频率及幅度的变化进行了比较。结果表明,0. 1 %DMSO对hESC-CM的CI值,细胞特征性搏动图谱以及搏动频率和幅度变化均无影响,证明了0. 1 % DMSO对hESCCM生长及搏动状态没有明显影响,为后续研究将其作为溶剂对照提供了可靠的实验依据。
本研究采用奎尼丁作为阳性药物进行验证。奎尼丁是临床上应用最早且效果明显的抗心律失常药物,其对单纯性室性心律失常患者的有效率可达到81. 2 %,对房性心律失常患者的有效率可达到65. 8 %[8]。但是,奎尼丁是一种非选择性钠离子通道阻滞剂,治疗过程中容易造成心脏离子电流失衡,导致严重的心律失常,严重时甚至会导致患者死亡[9]。研究表明奎尼丁可通过增大心脏跨室壁复极离散,导致尖端扭转型室性心动过速[10]。本研究通过RTCA Cardio系统监测了不同浓度奎尼丁( 0. 2、0. 78、3. 13、12. 5、50和100 μmol·L-1)对hESC-CM生长及搏动状态的影响。与溶剂对照组相比,奎尼丁浓度为0. 2和0. 78 μmol·L-1时对hESCCM生长及搏动无明显影响。奎尼丁浓度≥3. 13 μmol·L-1时影响细胞和特征性搏动图谱,抑制细胞搏动频率和幅度,且具有剂量依赖性,浓度越高细胞搏动信号恢复所需时间越长,对搏动频率和幅度的抑制作用越明显。这与采用微电极阵列技术检测不同浓度奎尼丁对hESC-CM场电位时程作用结果相同[11]。这些结果表明提示该方法可以用于临床前药物体外心脏毒性早期筛选。
综上所述,我们成功建立了基于人胚胎干细胞和实时细胞分析系统的临床前药物体外心脏毒性早期筛选方法,并采用0. 1 % DMSO和奎尼丁进行了验证。实验所用hESC-CM为人源性细胞,避免了种属差异,临床预测准确性较高,能够为临床试验提供大量可靠的新药心脏毒性作用的相关信息。该方法能够对hESC-CM进行长时间实时动态监测,准确预测非离子通道药物潜在的心脏毒性,具有低成本、高通量、实验周期短、所需化合物少的优点,非常适用于药物心脏毒性早期筛选。
(本研究于国家上海新药安全评价研究中心完成,衷心感谢我的导师马璟主任在本实验研究过程中的指导,并为我的研究生学习和课题研究提供领先的实验设施和充足的资金支持!衷心感谢一般毒理组全体老师和员工的鼎力支持和无私帮助!特别感谢汪溪洁老师在整个课题的设计、试验开展、数据统计分析和论文撰写等过程中给予的莫大帮助、支持和鼓励!衷心感谢王淑颜、惠涛涛等所有曾经帮助、支持和鼓励过我的员工!衷心感谢北京生物物理所提供的hESC-CM! )
参考文献:
[1]Laverty H G,Benson C,Cartwright E J,et al.How can we improve our understanding of cardiovascular safety liabilities to develop safer medicines[J].Br J Pharmacol,2011,163( 4) : 675-93.
[2]Kehat I,Kenyagin-Karsenti D,Snir M,et al.Human embryonic stem cells can differentiate into myocytes with structural and functional properties of cardiomyocytes[J].J Clin Invest,2001,108 ( 3) : 407-14.
[3]Jonsson M K,Duker G,Tropp C,et al.Quantified proarrhythmic potential of selected human embryonic stem cell-derived cardiomyocytes[J].Stem Cell Res,2010,4( 3) : 189-200.
[4]Peng S,Lacerda A E,Kirsch G E,et al.The action potential and comparative pharmacology of stem cell-derived human cardiomyocytes[J].J Pharmacol Toxicol Methods,2010,61( 3) : 277-86.
[5]Wang T,Hu N,Cao J,et al.A cardiomyocyte-based biosensor for antiarrhythmic drug evaluation by simultaneously monitoring cell growth and beating[J].Biosens Bioelectron,2013,49C: 9-13.
[6]王淑颜,汪溪洁,靳康,等.运用实时细胞分析系统监测原代乳鼠心肌细胞的生长及搏动评价抗心律失常药物[J].中国药理学与毒理学杂志,2014,28( 6) : 837-43.
[6]Wang S Y,Wang X J,Jin K,et al.A real-time cell analysis system for evaluating anti-arrhythmic drugs by monitoring the growth and beating of primary neonatal rat cardiomyocytes[J].Chin J Pharmacol Toxicol,2014,28( 6) : 837-43.
[7]Pal R,Mamidi M K,Das A K,et al.Diverse effects of dimethyl sulfoxide ( DMSO) on the differentiation potential of human embryonic stem cells[J].Arch Toxicol,2011,86( 4) : 651-61.
[8]李应祥.抗心律失常药物作用于心率失常的效果评价[J].中西医结合心血管病杂志,2014,2( 8) : 32-3.
[8]Li Y X.Evaluation of the effect of antiarrhythmic drugs on arrhythmia[J].Cardiov Dis J Integ Tradit Chin Western Med,2014,2 ( 8) : 32-3.
[9]王小川,谢晓慧,陆浩,等.抗心律失常药物致心律失常作用的文献分析[J].中国医院药学杂志,2013,33( 21) : 1825-6.
[9]Wang X C,Xie X H,Lu H,et al.The literature analysis of the arrhythmogenic effect of antiarrhythmic drugs[J].Chin Hosp Pharm J,2013,33( 21) : 1825-6.
[10]周强,李泱,刘启功,等.奎尼丁相关性尖端扭转型室性心动过速机制的实验研究[J].中国药理学通报,2003,19 ( 4) : 415-8.
[10]Zhou Q,Li Y,Liu Q G,et al.Experimental study on the mechanism of quinidine induced torsade de pointes in rabbit heart[J].Chin Pharmacol Bull,2003,19( 4) : 415-8.
[11]Braama S R,Tertoolena L,van de Stolpe A,et al.Prediction of drug-induced cardiotoxicity using human embryonic stem cell-derived cardiomyocytes[J].Stem Cell Res,2010,4( 2) : 107-16.
◇研究简报◇
Establishment of the method to evaluate cardiac toxicity by real-time cell analysis system on human embryonic stem cells
ZHAO Qi,WANG Xi-jie,WANG Shu-yan,MA Jing
( Shanghai Institute of Pharmaceutical Industry National Shanghai Center for New Drug Safety Evaluation Research State Institute of Pharmaceutical Industry,Shanghai 201203,China)
Abstract:AimTo establish an in vitro early drug cardiac toxicity evaluation method by human embryonic stem cells derived cardiomyocytes ( hESC-CM) and real-time cell analysis Cardio ( RTCA Cardio) system.Method The hESC-CM were cultured at RTCA Cardio E-Plate 96.Impedance signals from hESC-CM were analyzed for beating rate,contraction amplitude and beating rhythm irregularity to determine the optimum inoculation density and detection duration.Based on this,we used 0.1 %DMSO to be the solvent and quinidine ( 0.2,0.78,3.13,12.5,50 and 100 μmol·L-1) known as affecting cardiac activity to validate this method.Result The results revealed no significant changes in the cell index ( CI),transient pulse patterns,beating rate and amplitude of hESC-CM.Quinidine will affect the CI and transient pulse patterns of hESC-CM and decrease the beating rate and amplitude of hESC-CM when its concentration≥3. 13 μmol· L-1.And this effect is concentration-dependent,the higher the concentration,the more time they need to recover beating and the more significant the beating rate and amplitude inhibition of quinidine on hESC-CM.ConclusionThe method established by hESC-CM and RTCA Cardio system can detect the effect of quinidine on the contraction of hESC-CM,and this indicates that this method has the potential to be an attractive high-throughput tool for screening potential drugs in early evaluation of drug cardiotoxicity.
Key words:hESC-CM; RTCA Cardio; cardiotoxicity; drug; in vitro screening; quinidine
作者简介:赵琪( 1990-),女,硕士生,研究方向:药物毒理学,E-mail: zhqi1990@126.com;
基金项目:“十二五”国家科技部重大新药创制重大专项资助项目( No 2012ZX09302002)
收稿日期:2015-10-02,修回日期: 2015-11-25
文献标志码:A
文章编号:1001-1978( 2015) 01-0138-06
doi:10.3969/j.issn.1001-1978.2016.01.029
