斑马鱼胚胎评价5种药物的发育毒性与模型验证
2016-03-21许冰洁张立将李春启宣尧仙
许冰洁,张立将,李春启,宣尧仙
(浙江省医学科学院安全性评价研究中心,浙江杭州 310013;2.杭州环特生物科技有限公司,浙江杭州 311231)
斑马鱼胚胎评价5种药物的发育毒性与模型验证
许冰洁1,张立将1,李春启2,宣尧仙1
(浙江省医学科学院安全性评价研究中心,浙江杭州310013;2.杭州环特生物科技有限公司,浙江杭州311231)
中国图书分类号: R-332; R321.3; R971.1; R979.1; R977.1; R978. 14; R991
摘要:目的用斑马鱼胚胎探究环磷酰胺、乙酰水杨酸、盐酸四环素、乙酸地塞米松、阿扎胞苷5种已知对人类胚胎致畸药物的毒性和安全性。方法挑选4 hpf发育正常的受精卵,采用水浴染毒法,将药物添加到人工海水中,每种药物分别设置5个浓度组,另设空白对照组和溶剂对照组,观察给药120 hpf后斑马鱼的死亡情况,统计各实验组斑马鱼胚胎的死亡数、畸形数,并求出120 hpf时斑马鱼胚胎的死亡率、畸形率、半数致死浓度( LC50)、半数致畸浓度( EC50)、致畸指数( TI)。并利用公式: TI = LC50/EC50计算出阳性药物的致畸指数。根据已经测得的LC50,求出各药物的最大非致死浓度( MNLC),分别设置1/10 MNLC、1/3 MNLC,MNLC和LC104个浓度,以沙利度胺为阳性对照,维生素C为阴性对照,人工海水为空白对照,0. 5% DMSO为溶剂对照,28. 5℃下作用至120 h,每天观察胚胎的发育情况,统计胚胎死亡及畸形状态。结果5种药物的LC50从大到小依次为:环磷酰胺>阿扎胞苷>盐酸四环素>乙酰水杨酸>乙酸地塞米松。EC50从大到小依次为:环磷酰胺>盐酸四环素>阿扎胞苷>乙酰水杨酸>乙酸地塞米松。环磷酰胺、乙酰水杨酸、盐酸四环素、乙酸地塞米松、阿扎胞苷TI值分别为1. 92,1. 11,1. 05,1. 44,2. 99。结论斑马鱼胚胎模型可用于初步评价药物的发育毒性和安全性。
关键词:斑马鱼胚胎;半数致死浓度;半数致畸浓度;致畸;发育毒性;模型验证
宣尧仙( 1954-),女,研究员,研究方向:药理毒理学,通讯作者,Tel: 0571-87568016,E-mail: nndsvc@ mail.hz.zj.cn
斑马鱼( Daniorerio)属于辐鳍亚纲( Actinopterygii)鲤科( Cyprinidae)短担尼鱼属( Danio)的一种淡水鱼,原产于巴基斯坦和印度,是国家卫生机构认可的模式生物之一,在世界范围内,斑马鱼已成为一种流行的生物医学和毒理学模型。用斑马鱼胚胎检验药物的致畸效应,具有体积小,成本低,易于饲养,重复性好、便于观察,繁殖周期短,繁殖频率高等诸多优点,因此它是一种理想的试验模型,同时,斑马鱼与人类基因组相似度高达87%[1],与人类各种器官系统极为相似,如心血管系统、神经系统等[2]。斑马鱼毒理学模型虽然仍处于起步阶段,但存在着巨大的潜力,欧洲经济合作与发展组织( OECD)将斑马鱼胚胎发育试验列为药物安全性评价标准方法之一,促使斑马鱼胚胎发育试验广泛的应用于环境、农业、水产等领域[3-6]。
常规毒性实验常采用啮齿类和非啮齿类动物进行,能较准确地反映药物的安全性,但实验周期一般较长,药物用量较大,而斑马鱼试验周期短,相对哺乳动物成本低,药物用量少,给药方式简单[7]。全身透明,易于观察,能较直观的反映药物吸收、分布、代谢过程,还有各项生化指标,早期各个阶段的发育形态等,确定药物暴露在胚胎中的毒性[8]。
实验所用的环磷酰胺、乙酰水杨酸、盐酸四环素、乙酸地塞米松、阿扎胞苷5种药物均为临床常用药物。环磷酰胺在体内代谢后有抗肿瘤活性,用于治疗白血病及其他肿瘤。乙酰水杨酸是一种解热镇痛药,通过与环氧化酶中的COX-1活性部位多肽链530位丝氨酸残基的羟基发生不可逆的乙酰化,导致COX失活,继而阻断了AA转化为血栓烷A2( TXA2)的途径,抑制PLT聚集,主要用于发热、疼痛及类风湿关节炎等。盐酸四环素为广谱抗菌素,高浓度时具杀菌作用,应用本品超过2g/日可能引起致命的肝毒性。乙酸地塞米松是肾上腺皮质激素药,其抗炎、抗过敏、抗休克作用效果明显。阿扎胞苷胞是嘧啶核苷类药物,能直接参入DNA中,抑制DNA和RNA合成,可杀伤处于S期的细胞,可引起胃肠道反应、白细胞减少、肝损害。
采用已知的胚胎致畸阳性药物沙利度胺和阴性药物维生素C建立斑马鱼胚胎发育毒性模型。针对不同靶器官的毒性,选取了环磷酰胺、乙酰水杨酸、盐酸四环素、乙酸地塞米松、阿扎胞苷5种阳性药物,格列本脲、头孢噻肟钠两种阴性药物对前期建立的方法进行验证。
1 材料与方法
1.1实验动物AB型成年斑马鱼,由杭州环特生物科技有限公司提供( AAALAC)。
1.2主要药物与试剂阳性药物:环磷酰胺由江苏恒瑞医药股份有限公司生产。乙酰水杨酸由Sigma公司(美国)提供。沙利度胺由Sigma公司(美国)提供。盐酸四环素由北京绿源大德生物科技有限公司提供。乙酸地塞米松由阿拉丁试剂(上海)有限公司提供。阿扎胞苷由Sigma公司(美国)提供。分别称取一定量的5种药物,充分溶解于DMSO中,再按0. 5%比例稀释于人工海水中。
阴性药物:维生素C由华中药业股份有限公司提供,格列本脲由天津太平洋制药有限公司提供,头孢噻肟钠由华北制药河北华民药业有限责任公司提供。
DMSO购自Sigma公司(美国)。超纯水取自EPED超纯水机。
1.3主要仪器奥林巴斯SZX7解剖显微镜,EPED超纯水机。上海博讯实业有限公司SPX-250B-Z生化培养箱。
1.4胚胎收集♀♂斑马鱼按1∶2比例放置在鱼缸内,由隔板分开。次日清晨,取下隔板开始交配,30 min后,收集胚胎。收集好的鱼卵用养鱼水冲洗3遍,置于培养皿中,挑选发育一致的斑马鱼鱼卵备用。
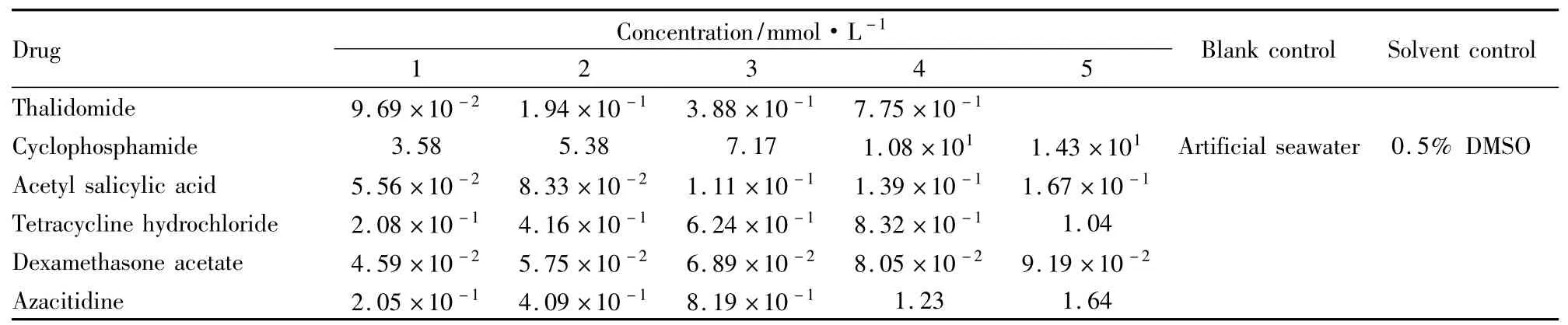
1.5药物配制及浓度根据预实验所得结果,以最大非致死浓度( MNLC)为下限,每个药物设定5个浓度。阳性对照(沙利度胺)最大溶解度为7. 75×10-1mmol·L-1,所以只设4个浓度梯度。为了便于观察斑马鱼胚胎畸形状态,每个药物设定4个致畸试验剂量,分别为MNLC/10、MNLC/3、MNLC、LC10。
1.6实验方法选取4 h pf已受精的斑马鱼胚胎加入6孔板中,每孔30尾,每孔3ml,置于5个不同浓度的药物( DMSO先溶解)中,见Tab 1。在28. 5℃下发育至120 hpf,以0. 5% DMSO(人工海水稀释)为溶剂对照,以人工海水为空白对照组,进行3次独立重复实验。每天观察斑马鱼胚胎死亡情况,并记录死亡胚胎数、致畸胚胎数,分别计算5种药物的半数致死浓度( LC50)、半数致畸浓度( EC50)。
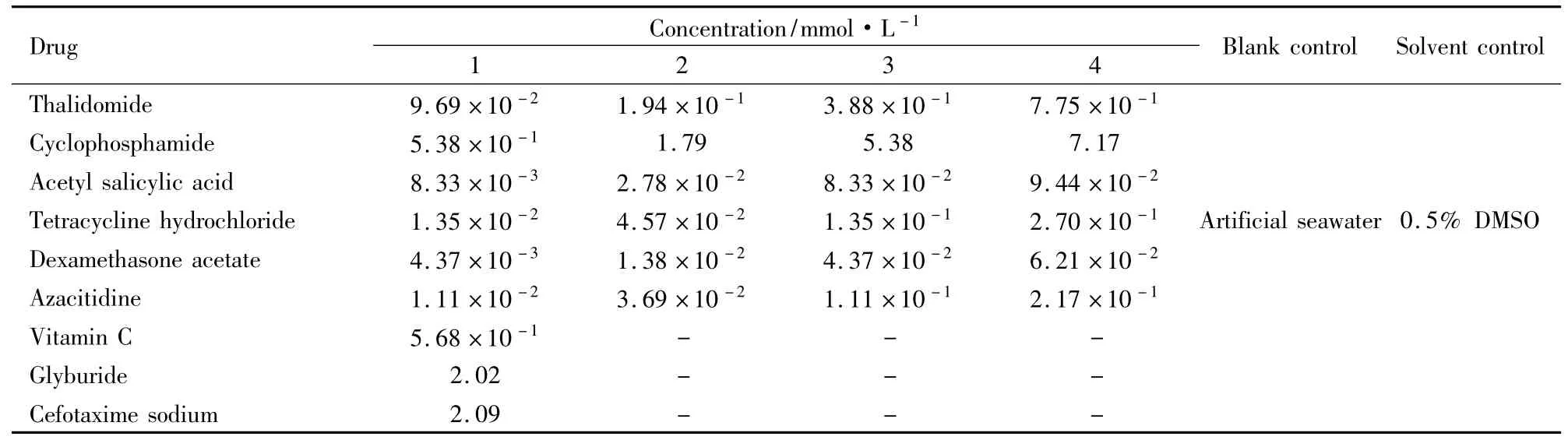
根据5种药物实验结果,设定4个致畸试验剂量,分别为各个药物的MNLC/10,MNLC/3,MNLC,LC10。阴性药物选择MNLC观察。见Tab 2。设置1/10 MNLC、1/3 MNLC、MNLC和LC104个浓度是为了便于观察胚胎畸形状态而不至胚胎死亡。以沙利度胺为阳性对照、维生素C为阴性对照,用环磷酰胺、乙酰水杨酸、盐酸四环素、乙酸地塞米松、阿扎胞苷5种阳性药,格列本脲、头孢噻肟钠2种阴性药物,对已建立的斑马鱼胚胎发育毒性模型进行验证。观察并记录各药物处理组斑马鱼胚胎的畸形情况,评价各药物对斑马鱼胚胎的致畸性。
1.7数据处理与评价胚胎从4 hpf暴露给药至120 hpf,计算120hpf斑马鱼胚胎死亡率、畸形率。
死亡率/% =死亡数/胚胎总数×100%
畸形率/% =畸形数/存活胚胎数×100%
在受精后120 hpf显微观察斑马鱼胚胎的发育变化。应用SPSS16.0软件进行统计分析。根据实验结果,求取各药物LC50、EC50,并利用公式: TI = LC50/EC50,计算出阳性药物及阴性药物的致畸指数。采用单因素方差分析,显著性水准设在α= 0.05。
Tab 1 Five drugs lethal concentration
2 结果
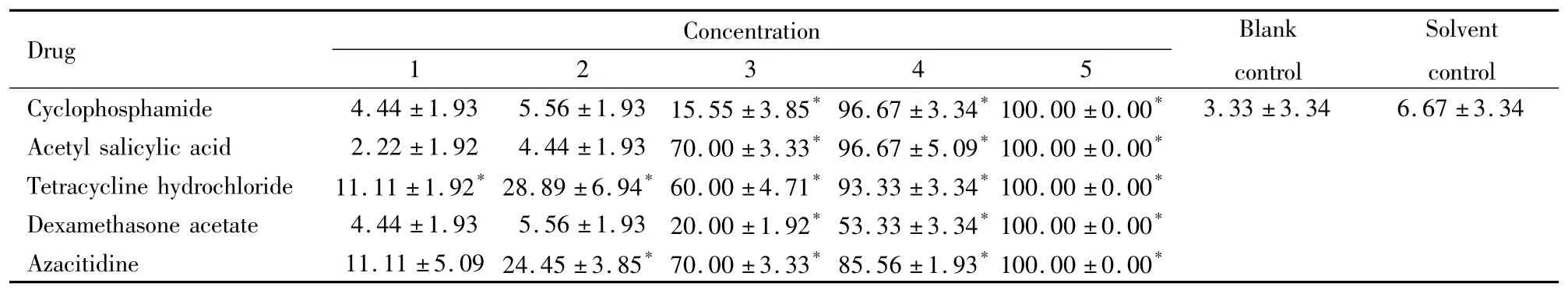
2.1斑马鱼胚胎死亡率及畸形率空白对照组、溶剂对照组死亡数均≤3,并且未观察到明显畸形。空白对照组与溶剂对照组的死亡率、畸形率差异无显著性( P>0. 05)。5种药物出现胚胎死亡和畸形发生率与空白对照组比较P<0. 05,并呈明显的浓度关系,浓度高,畸形发生率也随之变高。见Tab 3,4。2.2受试药物对120hpf斑马鱼胚胎的LC50,EC50,TI值的测定5种药物LC50从大到小依次为:环磷酰胺8. 25mmol·L-1、阿扎胞苷5. 63×10-1mmol·L-1、盐酸四环素4. 69×10-1mmol·L-1、乙酰水杨酸1. 07×10-1mmol·L-1、乙酸地塞米松7. 71×10-2mmol·L-1; EC50的从大到小次序为:环磷酰胺4. 30 mmol·L-1、盐酸四环素4. 46×10-1mmol·L-1、阿扎胞苷1. 88×10-1mmol·L-1、乙酰水杨酸9. 61×10-2mmol·L-1、乙酸地塞米松5. 35×10-2mmol·L-1。由LC50、EC50结果可知,5种药物中乙酸地塞米松毒性最强,乙酰水杨酸次之,其次是盐酸四环素、阿扎胞苷,环磷酰胺毒性较弱。利用公式: TI = LC50/EC50,计算出阳性药物的致畸指数,结果表明:环磷酰胺1. 92,乙酰水杨酸1. 11,盐酸四环素1. 05,乙酸地塞米松1. 44,阿扎胞苷2. 99。阴性药格列本脲、头孢噻肟钠均未出现明显的致畸作用。见Tab 5。
Tab 2 Five drugs teratogenicity concentration
Tab 3 Effect of five drugs on 120 hpf zebrafish embryo mortality
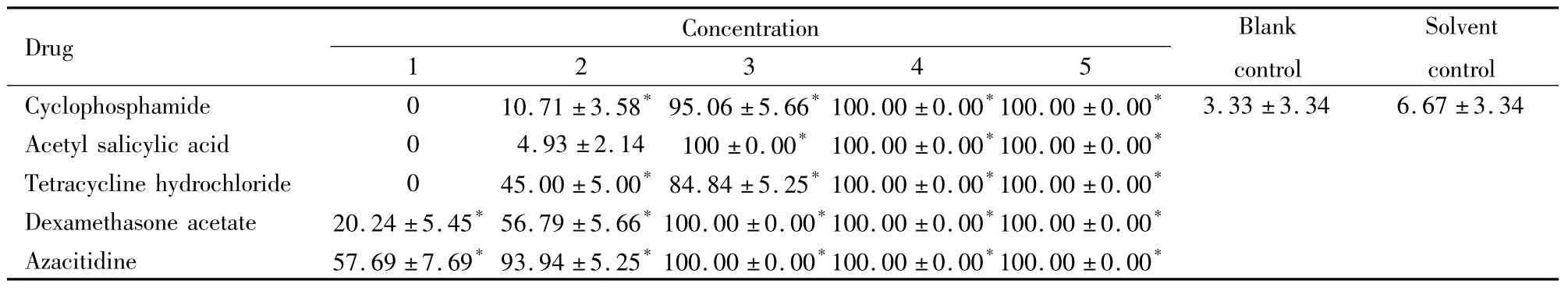
Tab 4 Effect of five drugs on 120 hpf zebrafish embryo malformation rate
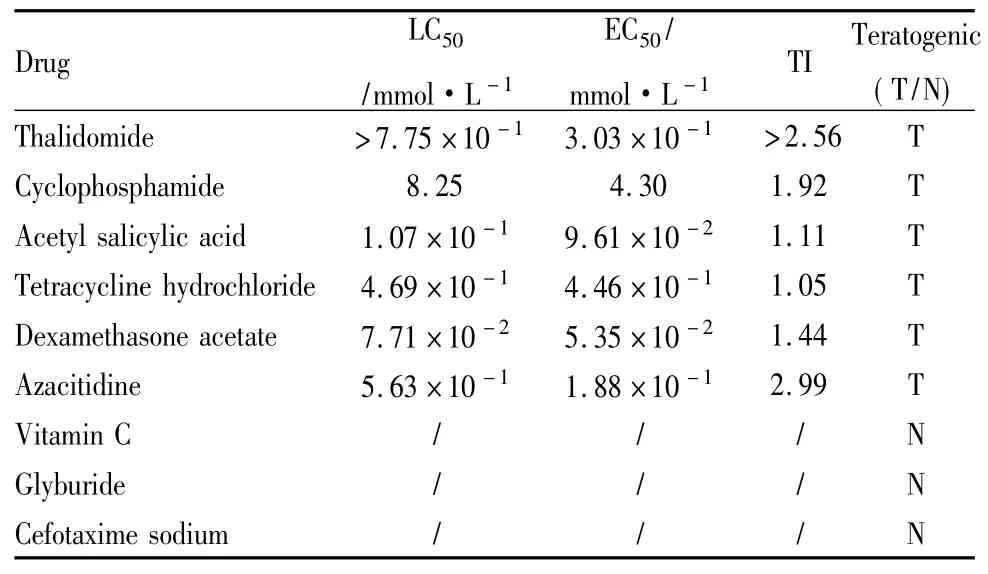
Tab 5 The LC50,EC50,TI of test drugs on 120 hpf zebrafish embryos
2.3受试药物对斑马鱼胚胎形态学的影响环磷酰胺在1/10 MNLC( 5. 38×10-1mmol·L-1)和1/3 MNLC( 1. 79 mmol·L-1)浓度时,发育至120 hpf斑马鱼胚胎未观察到明显畸形,在MNLC ( 5. 38 mmol·L-1) 和LC10( 7. 17 mmol·L-1)浓度时,畸形率100%,72 hpf表现为卵黄囊变黑,卵黄囊吸收延迟( Fig 1 C3),96hpf表现为无鳔,心包水肿,卵黄囊变黑( Fig 1 D4),120 hpf表现为体长短,卵黄囊吸收延迟,心包水肿,肾包水肿,心律不齐,肝变小( Fig 1 D5)。
乙酰水杨酸1/10 MNLC( 8. 33×10-3mmol· L-1)、1/3 MNLC( 2. 78×10-2mmol·L-1)和MNLC ( 8. 33×10-2mmol·L-1)浓度时,斑马鱼胚胎未观察到明显畸形,在LC10( 9. 44×10-2mmol·L-1)浓度时,畸形率100%,96hpf出现无鳔,卵黄囊吸收延迟,心包水肿、脑颅变性( Fig 1 D4),120 hpf出现心包水肿、肾包水肿、脑颅变性( Fig 1 D5)。
盐酸四环素在1/10 MNLC( 1. 35×10-2mmol· L-1)、1/3 MNLC( 4. 57×10-2mmol·L-1)和MNLC ( 1. 35×10-1mmol·L-1)浓度时,斑马鱼胚胎未观察到明显畸形,在LC10( 2. 70×10-1mmol·L-1)浓度时,表现为少数肝变性,在4. 16×10-1mmol·L-1浓度时,肝变性更加明显,发生率较高( Fig 1 E5)。
乙酸地塞米松1/10 MNLC( 4. 37×10-3mmol· L-1)和1/3 MNLC( 1. 38×10-2mmol·L-1)浓度时,斑马鱼胚胎未观察到明显畸形,在MNLC ( 4. 37 ×10-2mmol·L-1)和LC10( 6. 21×10-2mmol· L-1)浓度时,畸形率100%,72 hpf表现为卵黄囊吸收延迟,心包水肿,96 hpf心包水肿更加严重,无鳔( Fig 1 F4),120 hpf表现为心律不齐,心跳减慢,心包水肿发生率100%,无鳔( Fig 1 F5)。
阿扎胞苷1/10 MNLC( 1. 11×10-2mmol·L-1)和1/3 MNLC( 3. 69×10-2mmol·L-1)浓度时,斑马鱼胚胎未观察到明显畸形,在MNLC ( 1. 11×10-1mmol·L-1)和LC10( 2. 17×10-1mmol·L-1)浓度时,畸形率100%,24 hpf胚胎就有明显的畸形,死亡胚胎出现卵凝结( Fig 1 G1),48 hpf胚胎发育短小( Fig 1 G2),72 hpf表现为眼睛小,卵黄囊吸收延迟,体长短( Fig 1 G3),96 hpf发生心包水肿,卵黄囊吸收延迟,无鳔,眼睛小,皮肤纹理错乱( Fig 1 G4),120 hpf表现为无鳔,体长短,卵黄囊吸收延迟,心包水肿,肝变小,尾巴弯曲,色素分布异常( Fig 1 G5-1、G5-2)。5种药物在LC10时都会出现少数胚胎死亡,表现为卵凝结( Fig 1 H)。
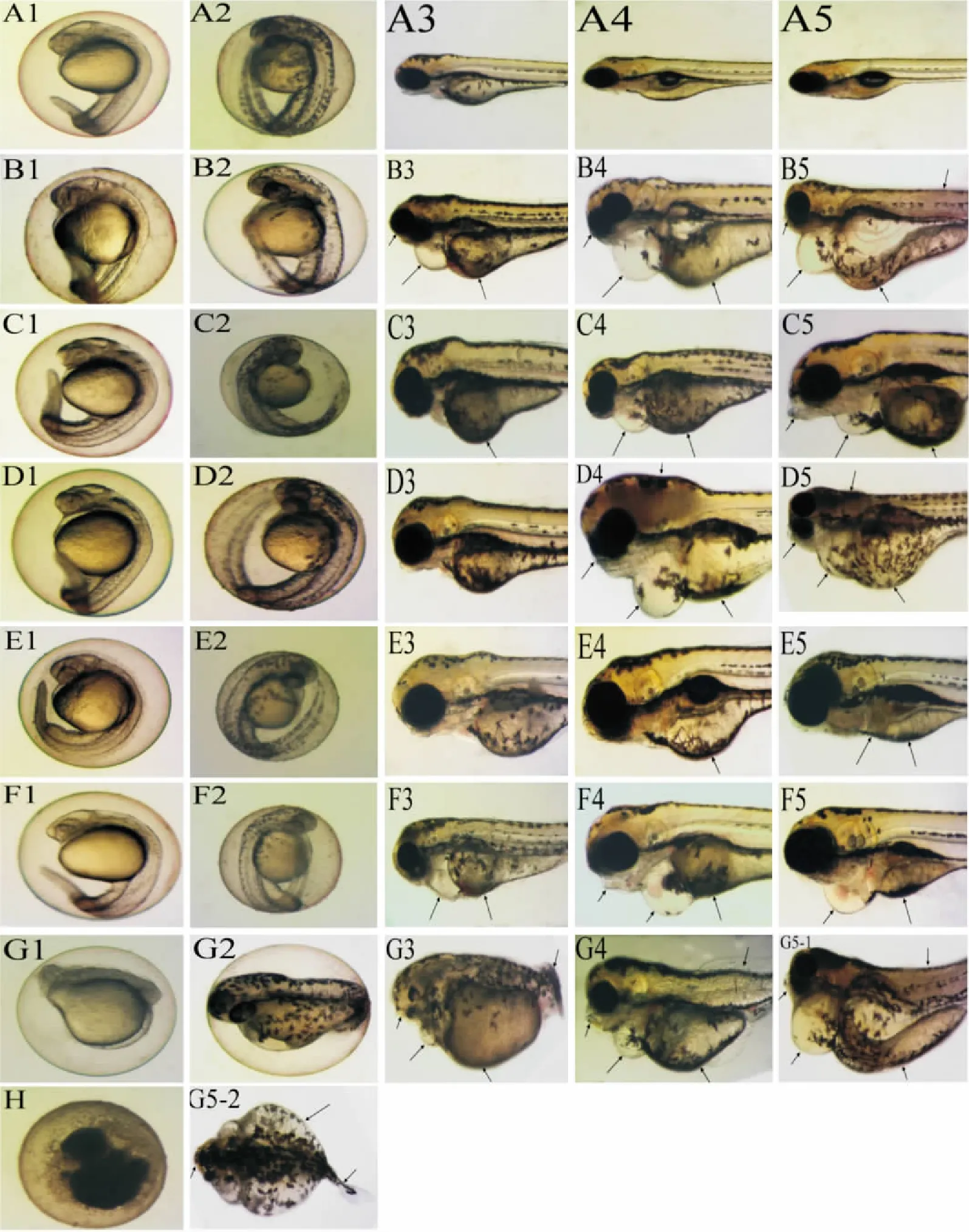
Fig 1 Five drugs used to treat the abnormal state of zebrafish embryos at different time
3 讨论
我们采用已知的阳性药物沙利度胺和阴性药物维生素C建立了斑马鱼胚胎发育毒性模型,再使用5种阳性药物和2种阴性药物进行验证。实验结果显示灵敏度、特异性均为100%。说明以斑马鱼胚胎为模式生物用于药物安全性评价的实验方法安全、可靠,可以用来进行药物的早期毒性筛选。
目前国内主要采用哺乳动物作为一般毒性的实验动物,但是成本高,用量大、实验周期长,实验结果不易观察。虽然斑马鱼模型也存在一定的局限性,还需要进一步的优化,但是可以快速筛选药物,从而缩短实验的周期,减少动物使用量,节约成本。斑马鱼是一种新兴的药学研究工具,用于疾病模型和药物的高通量筛选及药物代谢,特别是应用于早期的药物安全性评价研究引起越来越多学者的重视和青睐[9-10]。
斑马鱼死亡观测点通常为受精卵凝聚在一起,无心跳。观察时长为4 hpf至120 hpf,以便更好的观察整个毒性过程。并验证了斑马鱼胚胎模型的可靠性,说明该模型可用于药物的早期发育毒性筛选。
(致谢:本实验在杭州环特生物科技有限公司完成。感谢导师宣尧仙研究员为本实验提供充足的资金支持和精心指导;感谢张立将老师的整体思路指导;感谢李春启老师的尽心协助。)
参考文献:
[1]Tsang M. Zebrafish: a tool for chemical screens[J].Birth Defects Res C Embryo Today,2010,90( 3) : 185-92.
[2]颜慧,苏瑞斌,宫泽辉.利用斑马鱼成鱼建立致幻类化合物行为评价模型[J].中国药理学通报,2014,30( 10) : 1464-8.
[2]Yan H,Su R B,Gong Z H.Adult zebrafish as a model organism for assessing the effects of hallucinogenic drugs on behaviors[J].Chin Pharmacol Bull,2014,30( 10) : 1464-8.
[3]Cook LW,Paradise C J,Low B.The pesticide malathion reduce survival and growth in developing zebrafish[J].Environ Toxicol Chem,2005,24( 7) : 1745-50.
[4]Biales A D,Bencic D C,Villeneuve D L,et al.Proteomic analysis of zebrafish brain tissue following exposure to the pesticide prochloraz[J].Aquat Toxicol,2011,105( 3-4) : 618-28.
[5]Stegeman J J,Goldstone J V,Hahn M E.10-Perspectives on zebrafish as a model in environmental toxicology[J].Fish Physiology,2010,10: 367-439.
[6]Smolders R,De Boeck G,Blust R.Changes in cellular energy budget as a measure of whole effluent toxicity in zebrafish ( Daniorerio)[J].Environ Toxicol Chem,2003,22( 4) : 890-9.
[7]Shin J T,Fishman M C.From zebrafish to human: modular medical models[J].Annu Rev Grenomics Hum Grenct,2002,3( 1) : 311-40.
[8]Hill A J,Teraoka H W,Peterson R E,et al.Zebrafish as a model vertebrate for investigating chemical toxicity[J].Toxicol Sci,2005,86( 1) : 6-19.
[9]Smmanas S,Lin S.Zebrafish as a model system for drug target screening and validation[J].Targets,2004,3( 4) : 89-96.
[10]Wang S,Liu K,Wang X,et al.Toxic effects of celastrol on embryonic development of zebrafish ( Daniorerio)[J].Drug Chem Toxicol,2011,34( 1) : 61-5.
Model validation and evaluation of developmental toxicity of five drugs using zebrafish embryos
XU Bing-jie1,ZHANG Li-jiang1,LI Chun-qi2,XUAN Yao-xian1
( 1.Center of Safety Evaluation,Zhejiang Academy of Medical Sciences,Hangzhou 310013,China; 2.Hangzhou Hunter Biotechnology,Hangzhou 311231,China)
Abstract:AimTo explore the toxicity and safety of five kinds of known positive drugs,cyclophosphamide,acetyl salicylic acid,tetracycline hydrochloride,dexamethasone acetate and azacitidine,using zebrafish embryos.MethodsWe selected normally developed 4 hpf zygote,and used water bath infecting method to add the drug to the artificial seawater.Each drug had five concentrating groups,a separate control group and solvent control group.We observed the dead zebrafish embryos after 120 hpf drugs,counted the number of deaths and deformities of zebrafish embryos,and calculated mortality abnormal rate,the median lethal concentration ( LC50),concentration for 50% of maximal effect ( EC50),therapeutic index ( TI) under 120 hpf condition.We also used the formula TI = LC50/ EC50to calculate positive drug therapeutic index.Based on measured LC50we calculated most nonlethal concentration ( MNLC) of each drug setting,namely 1/10 MNLC,1/3 MNLC,MNLC,LC10four concentration,thalidomide as a positive control,vitamin C as a negative control,artificial seawater as control,0. 5% DMSO as solvent control.Put in 28. 5℃environment for 120book=79,ebook=88hours,embryo development was observed daily for developmental state,mortality,deforming rate and abnormal condition.Results The result of five drugs LC50in descending order: cyclophosphamide>azacitidine >tetracycline hydrochloride>acetylsalicylic acid>dexamethasone acetate.EC50in descending order: cyclophosphamide>tetracycline hydrochloride>azacitidine>acetylsalicylic acid>dexamethasone acetate.The TI values of cyclophosphamide,acetyl salicylic acid,tetracycline hydrochloride,dexamethasone acetate,azacitidine were 1. 92,1. 11,1. 05,1. 44,2. 99,respectively.ConclusionZebrafish embryo model can be used in the preliminary evaluation of drugs,and the study of early developmental toxicity and safety.
Key words:zebrafish embryos; median lethal concentration; concentration for 50% of maximal effect; teratogenic; developmental toxicity; model validation
作者简介:许冰洁( 1990-),女,硕士生,研究方向:药理学,E-mail: xbj1223@163.com;
基金项目:浙江省医药卫生科技计划项目( No 2014KYA046)
收稿日期:2015-09-29,修回日期: 2015-11-15
文献标志码:A
文章编号:1001-1978( 2016) 01-0074-06
doi:10.3969/j.issn.1001-1978.2016.01.016