沉默DNMT1基因对Molt-4细胞增殖、凋亡及组蛋白调控的影响
2016-03-21陈淑瑜黄轶群游育红马旭东
陈淑瑜,黄轶群,游育红,马旭东
( 1.漳州卫生职业学院药学系、2.福建医科大学附属漳州市医院血液科,福建漳州 363000; 3.福建医科大学药学院,福建福州 350004)
沉默DNMT1基因对Molt-4细胞增殖、凋亡及组蛋白调控的影响
陈淑瑜1,黄轶群2,游育红3,马旭东2
( 1.漳州卫生职业学院药学系、2.福建医科大学附属漳州市医院血液科,福建漳州363000; 3.福建医科大学药学院,福建福州350004)
中国图书分类号: R329.24; R329.25; R341; R342.2; R394. 2; R733. 7
摘要:目的探讨siRNA沉默DNMT1基因对人急性T淋巴细胞性白血病Molt-4细胞增殖、凋亡及组蛋白调控的影响。方法将DNMT1特异性siRNA经LipofectamineTM2000转染Molt-4细胞后,应用RT-PCR检测Molt-4细胞DNMT1 mRNA表达,MTT法绘制细胞生长曲线;流式细胞术分析细胞凋亡。Western blot检测Bcl-2、procaspase-3、P15蛋白表达以及组蛋白甲基化、乙酰化状态的改变。结果DNMT1 siRNA可沉默DNMT1基因的表达,并呈现浓度依赖性;抑制Molt-4细胞增殖,诱导细胞凋亡。经0、30、60、120 nmol·L-1DNMT1 siRNA作用24h后,细胞凋亡率分别为( 4. 27± 1. 42) %,( 15. 25±1. 54) %,( 35. 63±2. 54) %,( 66. 27± 3. 02) %,差异具有统计学意义( P<0. 05)。DNMT1 siRNA可上调P15的表达;下调Bcl-2、procaspase-3的表达,下调组蛋白H3K9甲基化水平,上调组蛋白H3K4的甲基化水平,而组蛋白H3乙酰化水平无明显变化。结论DNMT1 siRNA可以有效地抑制Molt-4细胞中DNMT1的表达,下调组蛋白H3K9甲基化水平,上调组蛋白H3K4的甲基化水平,从而抑制细胞增殖和诱导细胞凋亡。
关键词:RNA干扰; DNMT1;组蛋白;乙酰化;甲基化;急性白血病;表观遗传学
马旭东( 1957-),女,硕士,主任医师,教授,研究方向:血液肿瘤学,通讯作者,Tel: 0596-2082021,Fax: 0596-2593904,E-mail: maxudong005@ hotmail.com
DNA甲基化反应是由DNA甲基转移酶( DNMT)催化的,目前发现的DNMTs家族包括: DNMT1、DNMT2、DNMT3A、DNMT3B以及DNMT3L,其中DNMT1是一种持续性DNA甲基转移酶,维持有丝分裂期DNA的甲基化状态[1-2]。DNA甲基化不仅参与基因表达调控,而且参与肿瘤的发生发展过程,是肿瘤常见表观遗传学改变之一[3],DNMT成为一个重要的分子靶标,在疾病的治疗和预防中发挥重要作用[4]。有实验证明,在急性白血病患者和白血病细胞株中,DNMT基因异常高表达[5]。这些高表达的DNMT可能诱导某些相关基因,尤其是一些抑癌基因异常甲基化,最终可能导致白血病发生。因此,通过靶向性沉默DNMT1基因,重新启动基因转录,阻滞细胞周期,抑制肿瘤细胞增殖,诱导肿瘤细胞凋亡。
目前去甲基化治疗已成为肿瘤诱导分化、抑制增殖的新方法,为探讨靶向沉默DNMT1对急性淋巴细胞白血病的作用,本研究通过人工化学合成针对DNMT1基因的siRNA片段,以LipofectamineTM2000为介导,靶向沉默Molt-4细胞DNMT1基因的表达,探讨其对Molt-4细胞增殖、凋亡以及对组蛋白调控的影响,研究白血病靶向基因治疗。
1 材料与方法
1.1实验仪器细胞培养箱( 3111,美国Thermo公司),低温离心机( J2-21型Beckman公司),常温离心机(上海医疗器械公司),倒置显微镜( Model-U-LH 100HG,日本OLYMPUS产品),全自动凝胶成像系统( GeneGenius,英国Syngene公司),UV2100紫外分光光度仪(上海谱析公司),PCR扩增仪( AG22331,德国Eppendorf公司),迷你垂直电泳槽(美国BIO-RAD公司),脱色摇床(北京东方仪器厂)。
1.2试剂RPMI 1640培养基(美国Gibco公司) ; LipofectamineTM2000转染试剂、RNA提取试剂盒、RT-PCR试剂盒及Opti-MEM试剂(美国Invitrogen公司) ; DNMT1 siRNA及PCR引物(上海吉玛制药技术有限公司) ;细胞凋亡检测试剂盒(美国BD公司) ;二甲基亚砜及MTT(浓度为5 g·L-1) (美国Sigma公司) ; BCA蛋白定量试剂盒( Thermo公司) ; β-actin、DNMT1、procaspase-3、BCL-2、P15单克隆抗体及Goat anti-mouse with HRP conjugate、Goat antirabbit with HRP conjugate二抗(美国Santa Cruz公司) ; Anti-acetyl-Histone H3、Anti-trimethyl-Histone H3 ( Lys9)、Anti-trimethyl-Histone H3 ( Lys4) (美国Upstate公司)。
1.3细胞培养取人类急性T淋巴细胞性白血病Molt-4细胞株(中国科学院上海细胞库),培养于含15%胎牛血清、青霉素100 kU·L-1+链霉素100 kU·L-1的RPMI 1640培养液,置于37℃、饱和湿度、5%CO2培养箱培养,每2~3天传代1次,选择对数生长期细胞进行实验。
1.4Molt-4细胞转染和转染效率检测依据Reynolds等总结的设计siRNA原则,针对DNMT1区域选择作用靶点的小干扰RNA片段,委托上海吉玛公司合成。DNMT1 siRNA序列Sense 5'-GCACCU CAUUUGCCGAAUATT-3',Antisense5'-UAUUCGGCA AAUGAGGUGCTT -3',同时合成标有荧光标记的通用随机阴性序列作为对照。转染前取对数生长期Molt-4细胞,悬浮于无抗生素的培养液中,调整细胞浓度为( 8~16)×105。以LipofectamineTM2000为载体进行转染,步骤参照说明书。
1.5RT-PCR法检测Molt-4细胞DNMT1 mRNA表达选择对数生长期的Molt-4细胞,接种在6孔板上,DNMT1 siRNA浓度分别为0、30、60、120 nmol ·L-1,每孔总体积为2 mL。转染后培养24 h,TRIzol法提取总RNA,经紫外分光光度法鉴定定量,A260/A280比值均在1. 8~2. 0之间,经逆转录为cDNA。以反应制备所得的cDNA进行PCR扩增。设计PCR引物序列如下: DNMT1上游引物: 5'-AGGTTGATGTCTGCGTGGTAGC-3',下游引物5'-CCGAGTTGGTGATGGTGTGTAC-3';β-actin上游引物: 5'-CAGGAGGAGCAATGATCTTGATCT-3',下游引物5'-TCATGAAGTGTGACGTGGACATC-3'。PCR反应条件:95℃5 min预变性,95℃45 s变性,49℃45 s退火,72℃45 s延伸,40个循环,72℃10 min再延伸。最后将PCR产物经16 g·L-1琼脂糖凝胶电泳,于凝胶图像分析仪上自动分析成像。
1.6MTT法绘制细胞生长曲线将对数生长期的Molt-4细胞接种于96孔培养板中,2×104个/孔,DNMT1 siRNA浓度分别为0、30、60、120 nmol· L-1。终体积为200 μL,每组设6个平行孔。细胞转染后置于37℃、5% CO2饱和湿度的培养箱中继续培养24、48和72 h,于实验结束前4 h取出一块板,加5 g·L-1MTT 20 μL,继续培养4 h,离心,吸去上清,加入二甲基亚砜150 μL,震荡10 min,使结晶物充分溶解,酶标仪单波长492 nm测吸光度( A 值),计算细胞增殖率。细胞增殖率/% = ( A实验-A空白) / ( A对照-A空白)×100%。实验重复3次。以时间为横坐标,细胞增殖率为纵坐标绘制细胞增殖曲线。
1.7流式细胞仪检测细胞早期凋亡将Molt-4细胞悬液接种于6孔板上,终体积为2 mL,DNMT1 siRNA浓度分别为0、30、60、120 nmol·L-1,转染后培养24 h,离心收集细胞。依据BD公司Annexin V和PI双染试剂盒说明书进行处理,应用流式细胞仪检测。
1.8Western blot检测DNMT1蛋白、凋亡相关蛋白及组蛋白调控影响DNMT1 siRNA转染24h后,收集上述各处理组细胞,预冷的PBS洗涤2次后,按照1×106细胞加入100 μL裂解液和1 μL酶抑制剂的比例充分裂解细胞。于低温( 4℃)下,12 000 r·min-1离心15 min后,收集蛋白,-20℃保存备用。BCA法进行蛋白定量,取备用蛋白,以12% SDS-PAGE电泳分离后,电转移法转膜,室温下水平摇床上缓慢摇动,封闭1 h;放入TBS 1∶400稀释的一抗中,4℃过夜。TBS洗涤液洗膜3次后,分别放入辣根过氧化物酶标记的二抗,室温下水平摇床上缓慢摇动1 h;洗膜后化学发光法显色,X射线胶片扫描后,以β-actin为内参,应用AlphaDigiDoc图像分析软件分析比较。
1.9统计学处理应用SPSS 17. 0软件处理。计量资料数据以±s表示。单变量两组资料比较采用t检验,多组资料比较采用单因素方差分析。
2 结果
2.1DNMT1 siRNA对DNMT1 mRNA表达的影响DNMT1 siRNA转染Molt-4细胞24 h后,提取mRNA进行RT-PCR,与对照组比较可见,DNMT1 siRNA组的mRNA条带亮度明显减弱,而且随着DNMT1 siRNA浓度的增加,亮度呈递减趋势,其中120 nmol·L-1组亮度减弱最明显,表现出浓度依赖性( Fig 1)。0、30、60、120 nmol·L-1组DNMT1扩增条带灰度值与β-actin比值分别为: 0. 99±0. 18、0. 85±0. 15、0. 20±0. 07和0. 09±0. 01,与对照组相比,各处理组差异均有统计学意义( P<0. 05)。
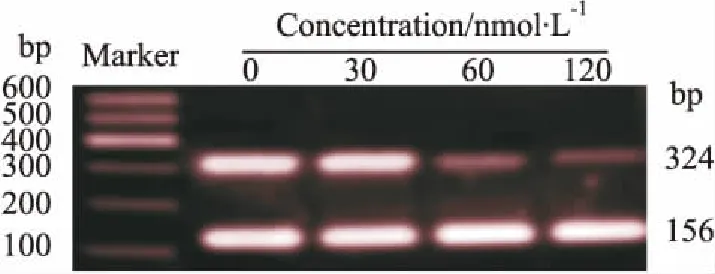
Fig 1 Expression of DNMT1 mRNA in Molt-4 cells after transfection with DNMT1 siRNA for 24 h
2.2 DNMT1 siRNA抑制Molt-4细胞增殖MTT法检测DNMT1 siRNA对Molt-4细胞增殖率的影响,经0、30、60、120 nmol·L-1的DNMT1 siRNA作用24、48、72 h后,Molt-4细胞的增殖率变化见Tab 1。结果显示,细胞的增殖率随着DNMT1 siRNA浓度的增加而逐渐下降;而且随着DNMT1 siRNA作用时间的延长,增殖率逐渐下降,说明其作用具有浓度依赖性和时间依赖性( Fig 2),与对照组细胞增殖率相比,各处理组差异均有统计学意义( P<0. 05)。
Tab 1 Proliferation rates of Molt-4 cells after transfection with DNMT1 siRNA for 24 h,48h and 72h(±s)
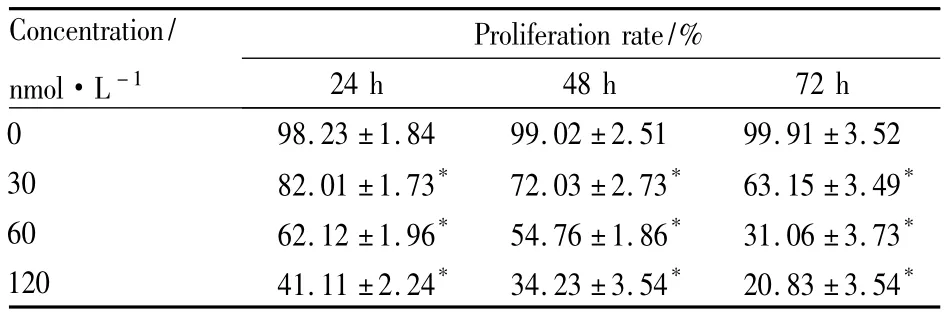
Tab 1 Proliferation rates of Molt-4 cells after transfection with DNMT1 siRNA for 24 h,48h and 72h(±s)
*P<0. 05 vs 0 nmol·L-1
Concentration/ nmol·L-1Proliferation rate/% 24 h 48 h 72 h 0 98.23±1.84 99.02±2.51 99.91±3.52 30 82.01±1.73* 72.03±2.73* 63.15±3.49*60 62.12±1.96* 54.76±1.86* 31.06±3.73*120 41.11±2.24* 34.23±3.54* 20.83±3.54*__
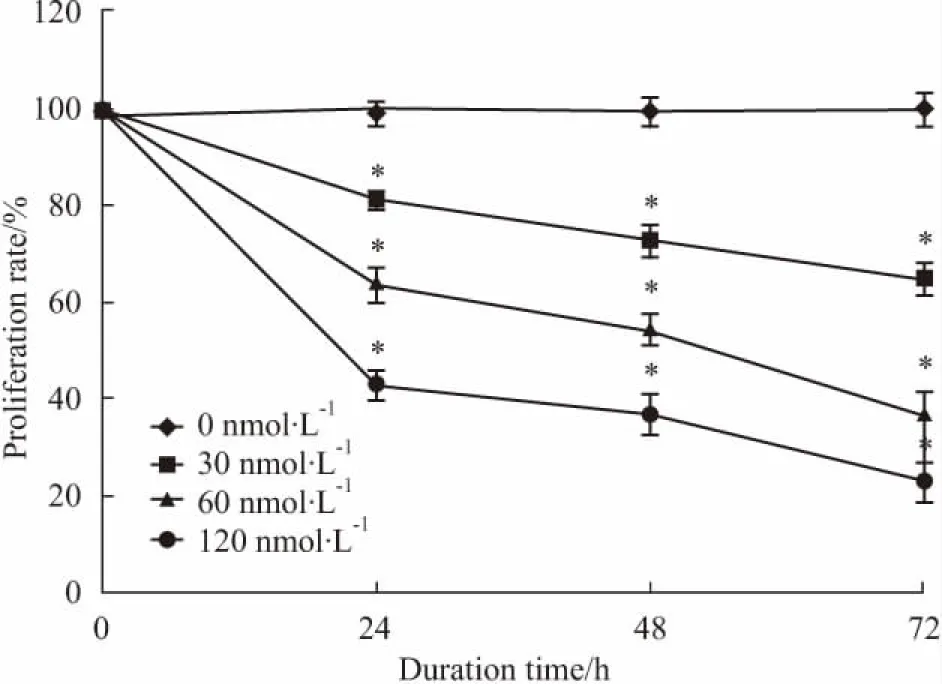
Fig 2 Proliferation rates of Molt-4 cells after transfection with DNMT1 siRNA for 24,48 and 72 h
2.3DNMT1 siRNA诱导Molt-4细胞凋亡经DNMT1 siRNA作用24 h后,0、30、60、120 nmol· L-1siRNA组细胞凋亡率分别为( 4. 27±1. 42) %、( 15. 25±1. 54) %、( 35. 63±2. 54) %、( 66. 27± 3. 02) %,结果显示:细胞凋亡率随着siRNA浓度增加而逐渐上升,说明其作用具有浓度依赖性。DNMT1 siRNA组与对照组凋亡率比较,差异有统计学意义( P<0. 05),见Fig 3。
2.4DNMT1 siRNA对Molt-4细胞P15、DNMT1表达的影响经0、30、60、120 nmol·L-1DNMT1 siRNA作用Molt-4细胞24 h后,Western blot法检测结果显示,随着DNMT1 siRNA浓度递增,抑癌蛋白P15的表达量呈现递增趋势;而DNMT1蛋白表达量呈现递减趋势。AlphaDigiDoc图像分析软件分析比较,各组条带灰度值与β-actin及对照组比较,差异有统计学意义( P<0. 05),见Fig 4。
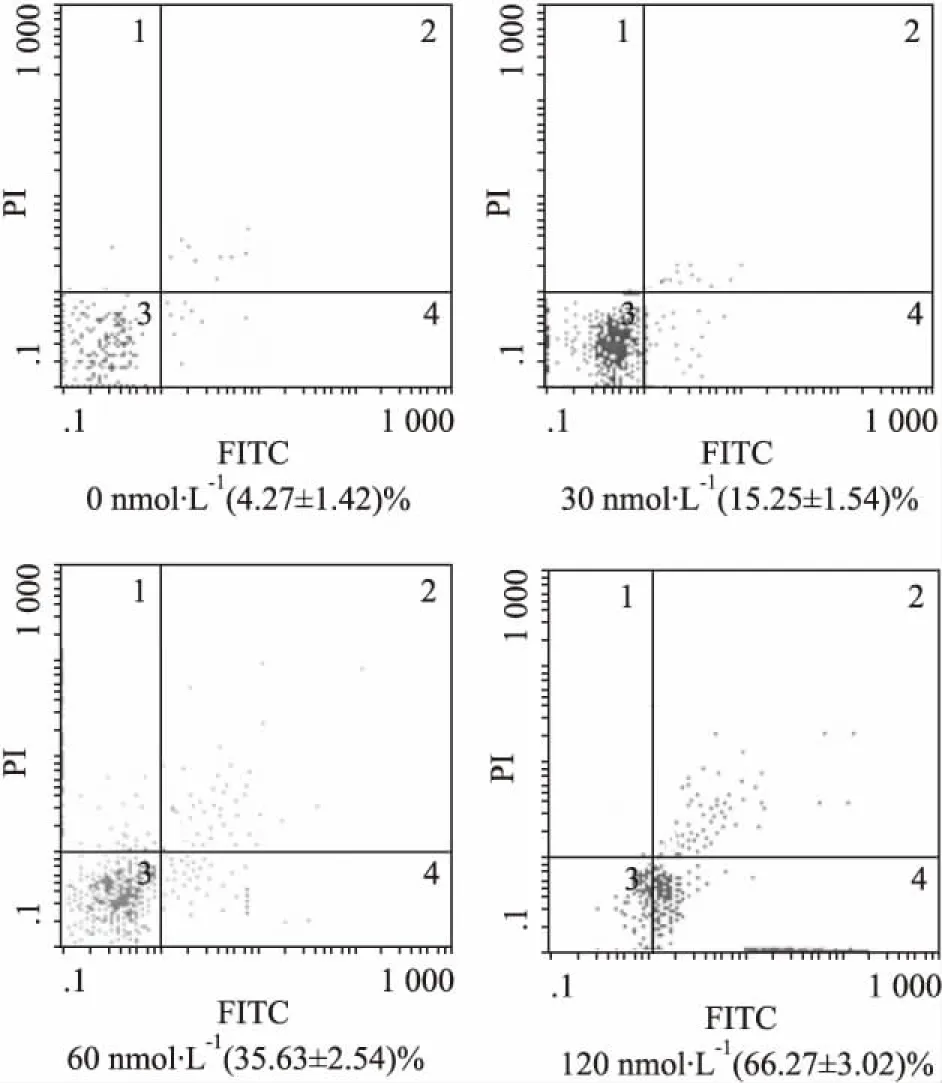
Fig 3 Apoptotic rates of Molt-4 cells after transfection with DNMT1 siRNA for 24 h
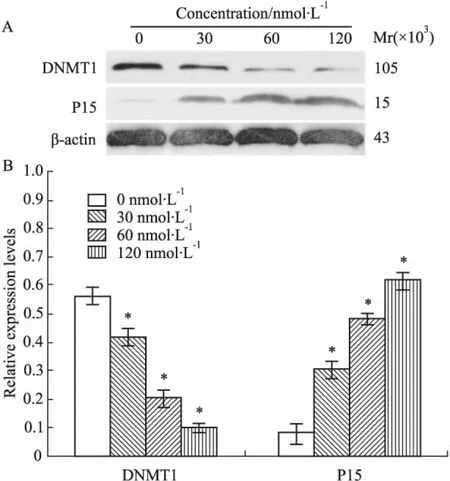
Fig 4 Alteration of DNMT1,P15 protein in Molt-4 cells after transfection with DNMT1 siRNA for 24 h
2.5 DNMT1 siRNA对Molt-4细胞凋亡相关蛋白的影响经上述不同浓度的DNMT1 siRNA处理Molt-4细胞24 h后,结果显示:抗凋亡蛋白Bcl-2和胱天蛋白酶procaspase-3的表达量随着DNMT1 siRNA浓度的增加而递减,呈现浓度依赖性( P<0. 05),差异有统计学意义( Fig 5)。
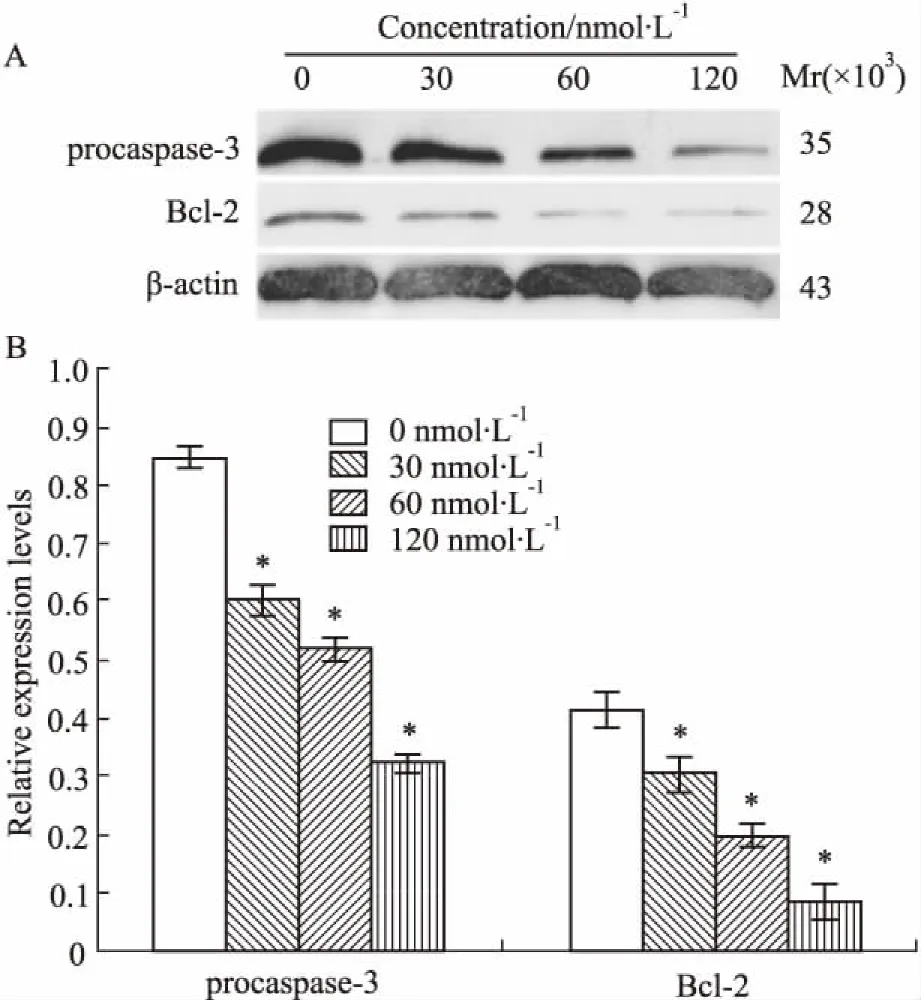
Fig 5 Alteration of apoptosis-related proteins in Molt-4 cells after transfection with DNMT1 siRNA for 24 h
2.6DNMT1 siRNA对Molt-4细胞组蛋白调控的影响经上述不同浓度的DNMT1 siRNA处理Molt-4细胞24 h后,H3K4甲基化水平随siRNA处理浓度增加而表达逐渐增强,H3K9甲基化水平随着siRNA处理浓度的增加而逐渐降低; P<0. 05,差异有统计学意义。而组蛋白H3乙酰化水平未见明显变化,差异无统计学意义( P>0. 05),见Fig 6。
3 讨论
DNMT1是人体发育过程中必需的基因,定位于人类19pl3.2-19pl3.3,是人体内最早发现且最为重要的甲基转移酶[6],主要维持DNA甲基化。DNMT1基因的高表达参与或影响恶性肿瘤的形成过程,启动子甲基化异常导致的转录失活是多种肿瘤发病的共同机制之一[7]。研究发现:在胃癌、肝癌、卵巢癌、肺癌等多种肿瘤临床样本中均检测到DNMT1蛋白的高表达[8],DNA甲基转移酶抑制剂( DNMTis)对于治疗基因启动子区存在高甲基化的癌症有重要的意义[9]。因此,本研究通过DNMT1 siRNA降低DNMT1基因的表达,从而逆转肿瘤抑制基因的高甲基化状态,抑制肿瘤的发生发展。
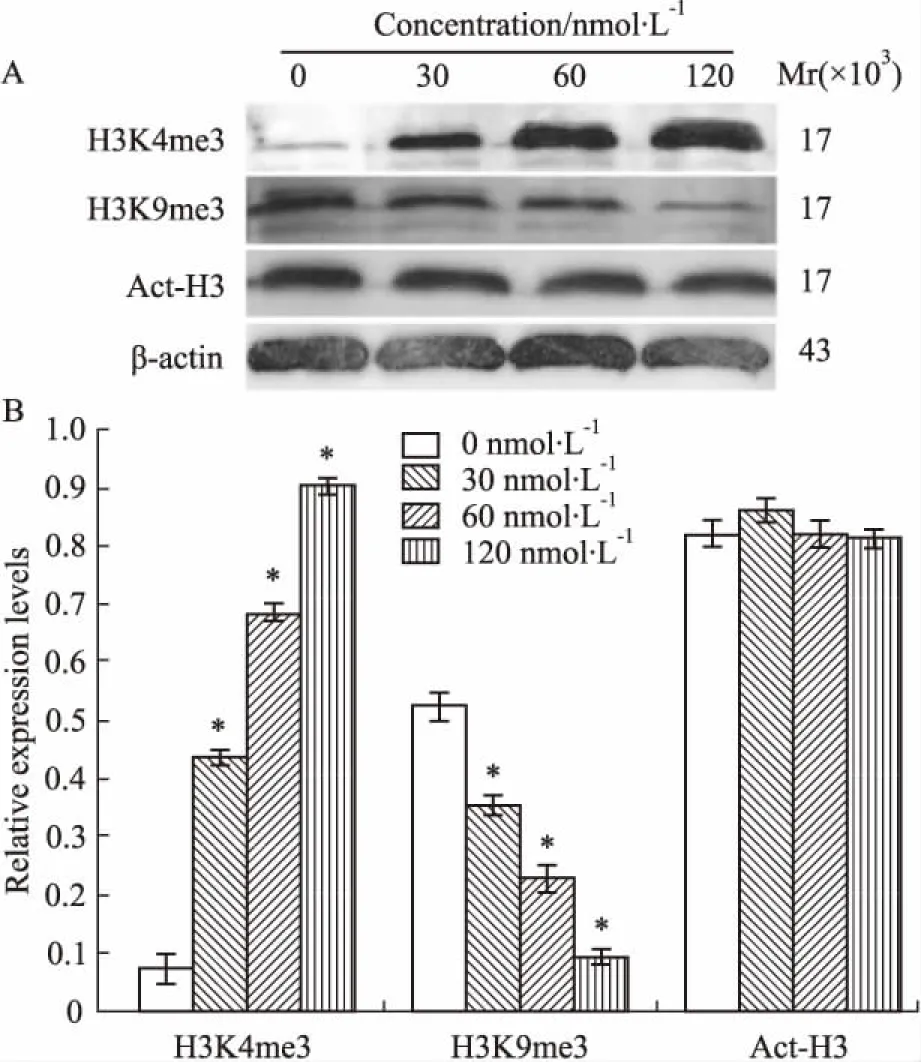
Fig 6 Alteration of histone-related proteins in Molt-4 cells after transfection with DNMT1 siRNA for 24 h
Kurita等[10]构建DNMT1 siRNA及DNMT3b siRNA转染肝癌细胞,发现siRNA抑制肝癌细胞的增殖及促进细胞凋亡。本研究显示: Molt-4细胞经不同浓度的DNMT1 siRNA作用后,增殖率逐渐下降,表现出时间依赖性和浓度依赖性,说明DNMT1 siRNA可阻滞细胞周期,抑制细胞增殖。研究还发现: DNMT1 siRNA可上调抑癌蛋白P15表达。p15基因作为细胞周期的负性调控因子,如果p15基因失活,则P15蛋白不能正常表达,细胞增殖失去控制,导致细胞癌变。p15基因缺失、突变、失活等在恶性血液病中容易发生,而且p15基因甲基化与血液病的疗效及预后也有关系[11]。本研究采用的急性T淋巴细胞性白血病Molt-4细胞株,其p15基因高度甲基化,p15基因弱表达,对正常细胞周期不能发挥负性调控功能,导致细胞生长周期失调,细胞癌变。通过转染DNMT1 siRNA,上调p15基因和P15蛋白的表达水平,从而抑制肿瘤细胞增殖。
本研究显示,DNMT1 siRNA可诱导Molt-4细胞凋亡,随着DNMT1 siRNA浓度增加,Molt-4细胞凋亡率逐渐增高;同时procaspase-3及Bcl-2表达量逐渐递减,具有明显的浓度依赖性。推测沉默DNMT1可通过线粒体介导的通路(内在通路)发挥对Molt-4细胞株凋亡的调控,Bcl-2家族中促凋亡蛋白,诱发细胞色素C从线粒体释放入胞质,激活caspase-9前体,活化的caspase-9继而激活下游的caspase-3,引发caspases级联反应,诱导细胞凋亡发生,启动内源性凋亡通路。亦不排除受体介导的外源性凋亡通路参与的凋亡过程,其作用机制有待进一步研究。本研究通过DNMT1 siRNA转染Molt-4细胞,结果p15基因表达增加,Bcl-2表达降低,抑制细胞增殖,并诱导细胞凋亡,推测DNMT1 siRNA通过增加p15基因表达,降低Bcl-2表达,参与细胞周期调控过程。
本研究发现: DNMT1 siRNA可下调组蛋白H3K9甲基化水平,上调组蛋白H3K4的甲基化水平。DNMT1 siRNA抑制H3K9甲基化,解除对抑癌基因的转录抑制作用,从而使p15基因转录活性增加、表达水平增加,发挥细胞周期负性调控作用促使细胞周期停滞; Bcl-2表达水平下降,启动线粒体介导的通路,诱导细胞进入凋亡程序。DNMT1 siRNA干扰DNMT1基因表达,H3K4甲基化水平升高,说明在基因沉默机制中,H3K9甲基化与DNA甲基化正相关,而H3K4甲基化与DNA甲基化负相关,具体机制有待进一步研究证实。由此可见,DNA甲基化与组蛋白修饰之间存在密切的联系,DNMT1的N端与HDAC1、HDAC2结合,引起组蛋白去乙酰化;亦可招募赖氨酸特异性脱甲基酶1 ( LSDl)和组蛋白甲基化酶Suv39hl,导致组蛋白不同的氨基酸去甲基化或甲基化。另外,组蛋白低乙酰化状态促进DNA甲基化,而组蛋白高乙酰化状态抑制DNA甲基化[12]。有研究报道: DNA甲基转移酶抑制剂5-氮杂-2’脱氧胞苷能改变组蛋白乙酰化状态[13],而本研究显示转染DNMT1 siRNA后,组蛋白H3乙酰化水平无明显变化,因此推测在DNA甲基化与组蛋白乙酰化相互之间的调控可能存在多样性。
本研究证实采用RNA干扰技术沉默DNMT1基因后,通过调控组蛋白的甲基化,重新启动基因转录,上调p15基因表达,裂解Bcl-2,激活caspase-3,启动线粒体介导的凋亡途径,抑制肿瘤细胞增殖,诱导细胞凋亡。因此,在今后临床治疗中,有望通过siRNA沉默DNMT1基因,发挥抑癌作用,成为癌症基因治疗的有效手段。
(致谢:本文实验在闽南师范大学菌物产业工程技术中心实验室完成,感谢实验室的老师对本实验的支持。)
参考文献:
[1]Gu H,Bock C,Mikkelsen T S,et al.Genome-scale DNA methylation mapping of clinical samples at single-nucleotide resolution [J].Nat Meth,2010,7( 2) : 133-6.
[2]Song J,Teplova M,Ishibe-Murakami S,Patel D J.Structurebased mechanistic insights into DNMT1-mediated maintenance DNA methylation[J].Science,2012,335( 6069) : 709-12.
[3]Christensen B C,Kelsey K T,Zheng S,et al.Breast cancer DNA methylation profiles are associated with tumor size and alcohol and folate intake[J].PLoS Genet,2010,6( 7) : e1001043.
[4]Ben G R,Ben A O,Ziadi S,et al.Methylation of miR-124a-1,miR-124a-2,and miR-124a-3 genes correlates with aggressive and advanced breast cancer disease[J].Tumour Biol,2014,35( 5) : 4047-56.
[5]乔淑凯,徐世荣,郭晓楠,等.急性白血病患者甲基转移酶基因的表达其及临床意义[J].中国实验血液学杂志,2005,13 ( 2) : 260-5.
[5]Qiao S K,Xu S R,Guo X N,et al.Clinical significance of the expression of DNA methyltransfearse genes( DNMT) in acute leukemia patients[J].J Exp Hematol,2005,13( 2) : 260-5.
[6]Armstrong C A,Jones G D,Anderson R,et al.DNMTs are required for delayed genome instability caused by radiation[J].Epigenetics,2012,7( 8) : 892-902.
[7]Bian E B,Zhao B,Huang C,et al.New advances of DNA methylation in liver fibrosis,with special emphasis on the crosstalk between microRNAs and DNA methylation machinery[J].Cell Signal,2013,25( 9) : 1837-44.
[8]Zhang Y,Chen F Q,Sun Y H,et al.Effects of DNMT1 silencing on malignant phenotype and methylated gene expression in cervical cancer cells[J].J Exp Clin Cancer Res,2011,30( 98) : 1-8.
[9]张玲,盛树力,秦川.表观遗传学药物的研究进展[J].中国药理学通报,2013,29( 3) : 297-302.
[9]Zhang L,Sheng S L,Qin C.Research progress in the epigenetic drug[J].Chin Pharmacol Bull,2013,29( 3) : 297-302.
[10]Kurita S,Higuchi H,Saito Y,et al.DNMT1 and DNMT3b silencing sensitizes human hepatoma cells to TRAIL-mediated apoptosis via up-regulation of TRAIL-R2/DR5 and caspase-8[J],Cancer Sci,2010,101( 6) : 1431-9.
[11]Galm O,Wilop S,Lüders C,et al.Clinical implications of aberrant DNA methylation patterns in acute myelogenous leukemia [J].Ann Hematol,2005,1( 84) : 39-46.
[12]Hellebrekers D M,Jair KW,Viré E,et al.Angiostatic activity of DNA methyltransferase inhibitors[J].Mol Cancer Ther,2006,5 ( 2) : 467-75.
[13]Oda M,Kumaki Y,Shigeta M,et al.DNA methylation restricts lineage-specific functions of transcription factor Gata4 during embryonic stem cell differentiation[J].PLoS Genet,2013,9 ( 6 ) : e1003574.
Effect of Silencing DNMT1 gene on histone methylation modulation,cell proliferation and apoptosis in Molt-4 cell line
CHEN Shu-yu1,HUANG Yi-qun2,YOU Yu-hong3,MA Xu-dong2
( 1.Dept of Pharmacy,Zhangzhou Health Vocational College,Zhangzhou Fujian 363000,China; 2.Dpet of Hematology,Zhangzhou Affiliated Hospital of Fujian Medical University,Zhangzhou Fujian 363000,China; 3.School of Pharmacy,Fujian Medical University,Fuzhou 350004,China)
Abstract:AimTo investigate the effect of small interfering RNA( siRNA) targeting DNMT1 gene on cell proliferation,apoptosis and histone modulation in acute lymphoid leukemia cell line,Molt-4.Methods The small interfering RNA targeting DNMT1 gene was transfected into Molt-4 cells by LipofectamineTM2000.The DNMT1 mRNA and protein level were detected by RT-PCR and Western blot.Cell proliferation was determined by MTT.Cell apoptosis was measured by Flow Cytometry.The expression of Bcl-2,procaspase-3,P15,histone methylation and histone acetylation was detected by Western blot.Results DNMT1 was suppressed by siRNA targeting DNMT1 in a concentration-dependent manner.DNMT1 siRNA suppressed cells proliferation and induced apoptosis in Molt-4 cells.Apoptotic rate was ( 4. 27±1. 42) %,( 15. 25 ±1. 54) %,( 35. 63±2. 54) %,( 66. 27±3. 02) % after transfecting with DNMT1 siRNA at 0,30,60,120 nmol·L-1for 24 hours,P<0. 05.The expression of Bcl-2,procaspase-3 was suppressed and P15 was promoted after transfecting of DNMT1 siRNA.DNMT1 siRNA downregulated histone methylated H3K9 and upregulated histone methylated H3K4.The alteration of histone acetylation of H3 was not seen.Conclusion DNMT1 siRNA suppresses DNMT1 efficiently in Molt-4 cells.The depletion of DNMT1 downregulates histone methylation of H3K9,and upregulates histone methylation of H3K4.It inhibits cell growth and induces cell apoptosis in Molt-4 cell line.
Key words:RNA interference; DNMT1; histone; acetylation; methylation; acute leukemia; epigenetics
作者简介:陈淑瑜( 1972-),女,硕士,副教授,研究方向:药理学,Tel: 0596-2559522,E-mail: csy6688@126.com;
基金项目:福建省引进重大项目计划基金( No 2012I2004) ;福建省自然科学基金资助项目( No 2012J01420) ;福建医科大学科学研究专项基金资助项目(重点类) ( No 2013FZS 13004Z) ;福建省医学创新课题( No 2012-CX-32) ;福建省中青年教师教育科研项目( No JB13364)
收稿日期:2015-09-06,修回日期: 2015-11-24
文献标志码:A
文章编号:1001-1978( 2016) 01-0064-06
doi:10.3969/j.issn.1001-1978.2016.01.014