黄芪提取物对肺纤维化小鼠肺泡炎症影响及抗纤维化作用研究*
2016-03-20徐昌君方松文李宏彬徐林林张莉莉杨长福
徐昌君,方松文,李宏彬,但 勇,张 川,徐林林,刘 杨,张莉莉,杨长福**
(1. 贵阳中医学院基础医学院 贵阳 550002;2. 贵州省人民医院护士学校 贵阳 550002)
黄芪提取物对肺纤维化小鼠肺泡炎症影响及抗纤维化作用研究*
徐昌君1,方松文1,李宏彬1,但 勇1,张 川1,徐林林1,刘 杨1,张莉莉2,杨长福1**
(1. 贵阳中医学院基础医学院 贵阳 550002;2. 贵州省人民医院护士学校 贵阳 550002)
目的:研究黄芪多糖、黄芪总黄酮、和黄芪总皂苷对博莱霉素(BLM)诱导肺纤维化KM小鼠肺泡炎症影响及抗肺纤化的作用。方法:KM小鼠随机分为假手术组、模型组、药物处理组(黄酮组、多糖组、皂苷组、皂苷+黄酮组)共6组,模型组及药物处理组小鼠气管内一次性滴注BLM,假手术组予等量生理盐水,造模后予相应药物或生理盐水灌胃,第28天取材;分别行肺泡灌洗液细胞计数分类,肺组织HE、Masson染色,免疫组化及western blot测TGF-β1、TNF-α表达水平。结果:①与对照组比较,模型组肺泡灌洗液(BALF)单核细胞和巨噬细胞明显增多(P<0.05),黄芪黄酮治疗组改善较明显,且优于其他成份组(P<0.05);②Masson结果和HE结果具有高度一致性,炎症反应强度和纤维化程度成正比。黄芪总黄酮能明显改善肺纤维化炎症反应,抑制早期纤维化结节出现,黄芪多糖和黄芪皂苷改善作用不如黄芪黄酮;③模型组TNF-α、TGF-β1免疫组化阳性颗粒明显比对照组增多,与模型组比较,黄芪黄酮能有效降低TNF-α、TGF-β1水平,黄芪多糖组和黄芪皂苷组与模型组比较虽有一定改善,但是效果不如黄芪黄酮;黄芪皂苷+黄酮联合应用无协同作用;④蛋白印迹结果与免疫组化结果具有一致性。结论:黄芪黄酮能有效抑制肺纤维化炎症反应及后期的纤维化过程,该抑制作用与抑制TNF-α、TGF-β1表达具有密切关系。
黄芪糖 黄芪黄酮 黄芪皂苷 肺纤维化 炎症 TNF-α TGF-β1
肺纤维化(Pulmonary Fibrosis,PF)是由多种因素导致的纤维增殖性疾病,是以细胞外基质(Extracellular Matrixc,ECM)沉积伴随炎症损伤、大纤维细胞增生,导致肺组织结构破坏为特征的病理过程[1]。迄今,对PF尚没有一种令人满意的治疗方法,西医治疗以糖皮质激素为主,但长期激素应用会产生严重的副作用。PF属中医“肺痿”、“肺痹”范畴,病机为“气虚血瘀”,益气活血法是治疗PF的基本治疗方法。对中医方剂的筛查总结发现:以黄芪为核心的补益药用药频度高达36%,而黄芪用药频度达19%[2],黄芪在抗PF的作用过程具有重要作用。本实验研究黄芪3种主要成份:黄芪多糖、黄芪总黄酮、黄芪总皂苷对PF肺泡炎症的影响及PF作用。
1 材料与方法
1.1 材料
1.1.1 实验动物
SPF级KM小鼠90只,雄性,8周龄,体质量19-21 g,购自北京维通利华实验动物有限公司,合格证号:SCXK(京)2012-0001。适应性喂养1周,自由饮水、进食。
1.1.2 药物
黄芪总黄酮(批号:ZL150206582),黄芪总皂苷(批号:ZL150306582),黄芪多糖(批号:ZL150206),均购于南京春秋生物工程有限公司。
1.1.3 主要试剂及仪器
抗体TNF-α(英国Abcam公司,ab1793,批号:GR54204-2);抗体TGF-β1(英国Abcam公司,ab4715,批号:GR70926-1),免疫组化试剂盒(北京中衫金桥生物技术有限公司,批号:k152411B),DAB显色液(北京中衫金桥生物技术有限公司,批号:k1556158),Masson试剂盒(南京建成生物工程研究所有限公司),博莱霉素粉剂(日本化药株式会社),总蛋白提取试剂盒(北京普利莱基因技术有限公司),BCA蛋白定量试剂盒(北京康为世纪生物科技有限公司),SDS-PAGE凝胶试剂盒(北京索莱宝科技有限公司),PVDF膜(德国默克公司),ECL超敏发光液(北京普利莱基因技术有限公司),10×电泳液、10液转膜液、膜再生液(北京索莱宝科技有限公司),防脱载玻片(武汉博士德生物工程有限公司),包埋石蜡(德国莱卡公司);LD4-2型低速离心机(北京医用离心机厂)、PLUS新型-86℃超低温冰箱(美国Thermo Scientific公司),显微镜摄像CCD照相系统,型号:DP73+standard 1.6(日本奥林巴斯公司),Bio-Rad蛋白凝胶电泳仪、BIO-RAD凝胶成相系统(美国Bio-Rad公司)。
1.2 实验方法
1.2.1 造模
雄性KM小鼠90只,分为6组,采用随机数字表法分为对照组、模型组、多糖组、皂苷组、黄酮组、皂苷+黄酮组,共6组,每组15只。小鼠用4%水合氯醛(10 mL·kg-1)腹腔注射麻醉后,仰卧固定于鼠台上,颈部酒精消毒后逐层分离并暴露气管,注射器经气管软骨环间隙朝向心端刺入,模型组及药物处理组缓慢注入博莱霉素(Bleomycin,BLM)(10 mL·kg-1),对照组予等量生理盐水[3]。术后密切观察动物状态,造模后药物处理组灌胃,给予相应药物(黄芪多糖:284 mg·kg-1,黄芪黄酮43 mg·kg-1,黄芪皂苷:105 mg·kg-1)黄芪皂苷+黄芪黄酮43+105 mg·kg-1),模型组及对照组给予等量生理盐水,共28天。
1.2.2 取材
第29天各组小鼠按数字表法随机分为2组。一组小鼠予4%水合氯醛麻醉(10 mL·kg-1),仰卧位固定,腹主动脉采血处死小鼠,分离颈部气管,气管中部作T型切口,气管插管(消毒灌胃针替代),近心端手术线结扎气管与气管插管,用1 mL注射器抽取0.8 mL预冷的PBS缓冲液,通过插管灌洗双肺,回收BALF于消毒的EP管中,3次灌洗约获得灌洗液1.2 mL,于4℃离心机离心5 min,转速1 500 rpm。EP管内细胞沉淀待作细胞计数和细胞涂片。另一组小鼠按上述同样操作,取左叶肺门部组织置于10%中性福尔马林固定,右侧肺组织存放于-80℃冰箱备用。
1.2.3 BALF细胞计数及分类
BALF离心,取细胞沉淀用0.3 mL生理盐水重悬,混合均匀后用细胞计数板进行细胞计数,每一标本计数3次,取平均值。细胞计数公式:细胞数/mL=四大格细胞总数/4×104。
1.2.4 细胞涂片
取20 μL细胞悬液点片,95%酒精固定10 min,干燥后将玻片浸入苏木素染液中孵育8 min,自来水清洗,1%盐酸酒精分色,1%伊红染色5 min,后分别于85%酒精、 95%酒精、100%酒精中逐级脱水,二甲苯透明两次,每次2 min,中性树胶封片。封片后将玻片置于倒置显微镜下观察,并进行分类计数,每张切片计数400个白细胞,计数3次,取平均值。
1.2.5 HE和Masson染色
组织常规固定、脱水透明、石蜡包埋后切片,HE常规染色:石蜡切片二甲苯脱蜡2次,12 min/次,于100%酒精、95%酒精、80%酒精、70%酒精梯度脱水,苏木精染色6 min,自来水蓝化10 min。视核染深浅进行盐酸酒精分化,伊红染色3 min,酒精梯度脱水,二甲苯透明,中性树胶封片。Masson染色:石蜡切片脱蜡,入水同前,染色按照试剂盒依次操作,最后脱水、透明、封片等操作步骤同前。
1.2.6 免疫组化
组织切片常规脱腊,梯度酒精入水,抗原用柠檬酸缓冲液修复,3%H2O2灭活过氧化氢酶,加入一抗TNF-α、TGF-β1孵育过夜。TBS洗涤,加二抗于37℃孵育20 min,洗涤。DAB显色,苏木精复染,透明、封片。
1.2.7 Western blot检测TNF-α、TGF-β1表达
肺组织标本从-80℃冰箱取出,称重,按50 mg/500 μL加入裂解液匀浆,静置10 min,1:2加抽提试剂混匀,4℃静置10 min,12 000 rpm离心,提取中间分离相,1%SDS溶解,BCA蛋白定量分析,4:1加上样缓冲液95℃变性。SDS-PAGE蛋白凝胶电泳:上样量为30 μg/孔,电泳时间为1.5 h、电压80-120 V,转膜2 h、电压为60V;5%脱脂牛奶封闭后,加入TGF-β1和TNF-α1一抗孵育液(1:1000稀释),4℃孵育过夜,二抗孵育液按1:8000稀释,常温下孵育2 h(摇床轻摇)。洗涤后超敏发光液显色,Bio-Rad蛋白凝胶电泳仪成像拍照。
1.2.8 统计学方法
免疫组化和原位杂交结果使用Image-Pro Plus6.0专业图像分析软件进行图像分析,用Image J软件分析western blot图像。采用SPSS 20.0统计学软件进行统计分析,所有数据资料均用均数±标准差(±s)来表示。当数据符合正态和方差齐时,各组间比较采用单因素方差分析,多组定量资料之间的比较采用LSD-t检验,P<0.05认为结果有统计学差异。
2 结果
2.1 细胞总数及细胞分类变化
模型组与对照组比较,无论是单核细胞还是巨噬细胞,所占比例明显比对照组增加(P<0.05或P<0.01),说明在PF过程中炎症是一个重要反应。药物处理组中,黄芪黄酮组单核和巨噬细胞虽然比假手组增加,但是比模型组却明显减少(P<0.01),且黄酮治疗效果明显优于多糖和皂苷组(P<0.05)(见表1)。
2.2 肺组织HE染色结果
对照组小鼠肺内结构清晰,肺泡间隔未见增厚,无充血、水肿及急慢性炎症,各时间点均未出现明显病理改变。模型组肺泡结构塌陷,肺毛细血管充血,肺泡间隔水肿,肺泡壁增厚,肺泡腔内出现以巨噬细胞、中性粒细胞和淋巴细胞为主的炎症细胞浸润,出现大量肺纤维结节,PF瘢痕形成;多糖组肺泡炎仍然较明显,肺泡结构紊乱,肺泡间隔增宽,成纤维细胞明显增多,较模型组有所减少,总体有一定改善;黄酮组有轻微炎症反应,但肺泡结构较清晰,纤维增生不严重,但还是观察到少量纤维结节,与模型组比较改善作用明显;皂苷组肺泡结构比多糖组稍好,但炎症细胞浸润较明显,结果不如黄酮组;联合治疗组表现为明显的纤维增生,炎症细胞浸润多,抗PF效果较差(图1)。从炎症反应评分标准看(见表2),模型组炎症反应与对照组有明显区别(P<0.05),黄酮治疗组虽然存在炎症反应,但是与模型组比较可见明显好转(P<0.05),而多糖、皂苷、以及联合治疗组比模型组虽有不同程度好转,但是疗效不及黄酮组(见表3)。
表1 BALF单核细胞及巨噬细胞计数(±s,n=8)

表1 BALF单核细胞及巨噬细胞计数(±s,n=8)
注:因为受取样和稀释浓度的影响,细胞绝对值不能反应炎症情况,而细胞所占比例与炎症反应具有关联性,与假手术组比较,*P<0.05,**P<0.01;与模型组比较,#P<0.05,##P<0.01;给药组间比较,△P<0.05,△△P<0.01。
组别单核细胞单核细胞百分比/%巨噬细胞巨噬细胞百分比/%对照组0.10±0.05 15.00±0.06 0.015±0.002 2.800±0.065模型组0.27±0.07 46.00±0.12*0.035±0.018 9.600±0.074**黄芪总黄酮组0.24±0.01 19.50±0.09*##△0.023±0.008 3.800±0.011##△黄芪多糖组0.18±0.02 25.00±0.13*#0.037±0.012 5.560±0.021*#黄芪皂苷组0.13±0.04 25.65±0.11*#0.030±0.014 6.100±0.013*#黄芪黄酮+皂苷组0.22±0.10 44.40±0.18**0.380±0.009 6.150±0.013*#F值25.6 23.0 15.3 24.1
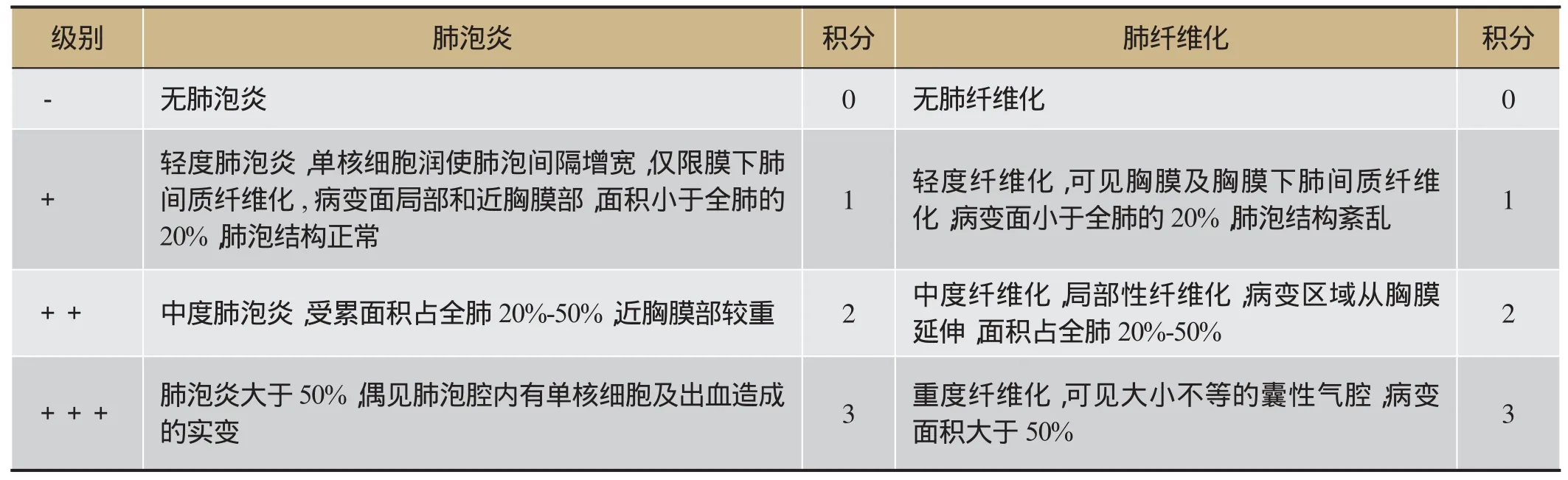
表2 肺泡炎症和肺纤维化评分标准
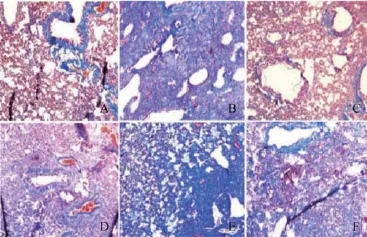
图2 Masson染色不同成份对胶原蛋白表达影响(×200)
2.3 肺组织Masson染色结果
对照组肺泡清晰,肺泡间质间少量胶原蓝染,以小气管为中心的胶原蓝染属于正常胶原,而模型组肺纤维样变非常明显,肺泡塌陷,萎缩,大量纤维胶原生成,呈实变样。黄酮组肺纹理尚清晰,胶原染色不明显,与模型组比较明显改善。与模型组比较,多糖组、皂苷组胶原表达减少,但相比于黄酮组表达增加,说明黄酮的治疗作用明显优于多糖和皂苷组,而联合治疗组肺泡结构紊乱,胶原表达增加、呈实变样,与模型组比较无明显差异(见图2)。PF得分情况与HE呈现高度一致性(见表3)。
表3 HE染色镜下炎症反应和Masson染色纤维化程度得分(s,n=7)
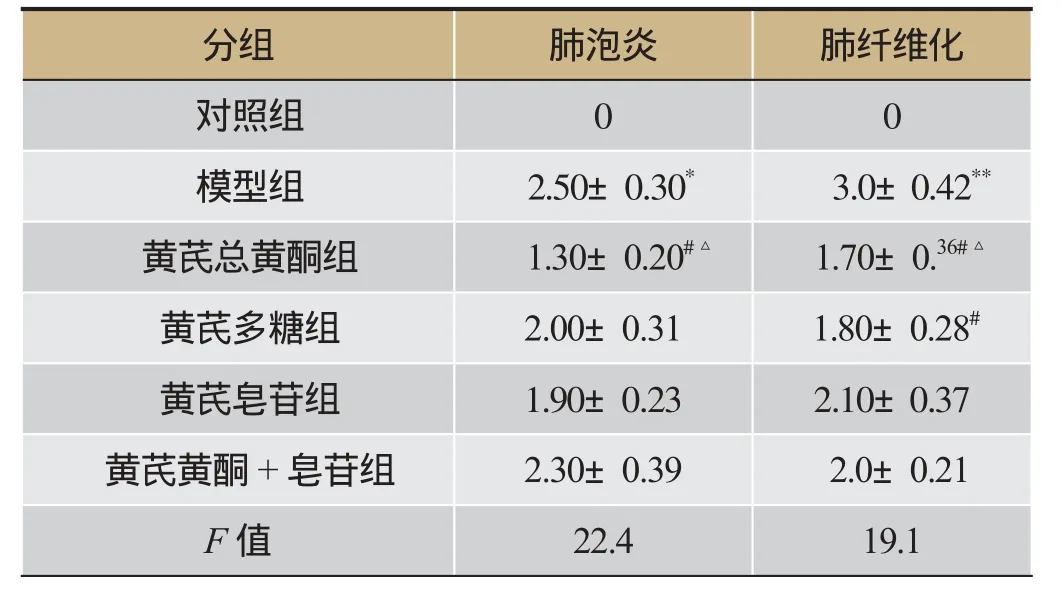
表3 HE染色镜下炎症反应和Masson染色纤维化程度得分(s,n=7)
注:与对照组比较,*P<0.05,**P<0.01;与模型组比较,#P<0.05;黄芪总黄酮组与多糖组、黄芪皂苷组、黄芪黄酮+皂苷组比较,△P<0.05。
分组肺泡炎肺纤维化对照组0 0模型组 2.50±0.30* 3.0±0.42**黄芪总黄酮组 1.30±0.20#△ 1.70±0.36#△黄芪多糖组2.00±0.31 1.80±0.28#黄芪皂苷组1.90±0.23 2.10±0.37黄芪黄酮+皂苷组2.30±0.39 2.0±0.21F值22.4 19.1
2.4 肺组织TGF-β1和TNF-α的表达
2.4.1 肺组织TGF-β1的表达
免疫组化结果显示(图3),TGF-β1在对照组也有少量表达,主要在细胞质和肺泡腔的分泌物中。与假手术组相比,模型组表达明显增加,主要在分泌物较多的部位和细胞外周呈现高表达。黄酮治疗组TGF-β1表达比多糖组和皂苷组明显减少(D组、E组),TGF-β1主要表达于胞浆和肺泡粘液中。以上表达特点提示,TGF-β1属于分泌型炎症因子,在细胞外周分泌区高表达,通过细胞膜信号转导,刺激纤维细胞大量增殖。
2.4.2 肺组织TNF-α的表达
对与对照组相比,模型组差异明显,表现为:模型组TNF-α表达增加,即便是在实变区,其表达仍然明显,与对照组相比,黄铜治疗组无明显差异,多糖、皂苷和联合治疗组TNF-α表达水平明显提高,其表达部位与TGF-β1类似,即在小支气管上皮细胞,肺泡区有高表达(见图4)。
2.5 Western blot测定肺组织TGF-β1和TNF-α的表达
模型组和对照组比较(图5),TGF-β1高表达(见表5),黄芪黄酮治疗组能明显降低TGF-β1水平(P<0.01),虽然黄芪多糖和皂苷也能一定程度降低TGF-β1水平,但是降低程度没有黄芪黄酮组明显,联合组则无明显变化。TNF-α表达水平与TGF-β1具有相似的表达趋势,但是皂苷组也能明显降低TNF-α(P<0.01)。总之,黄芪黄酮降低TGF-β1和TNF-α优于与多糖组合皂苷组,而联合治疗组无明显降低作用。
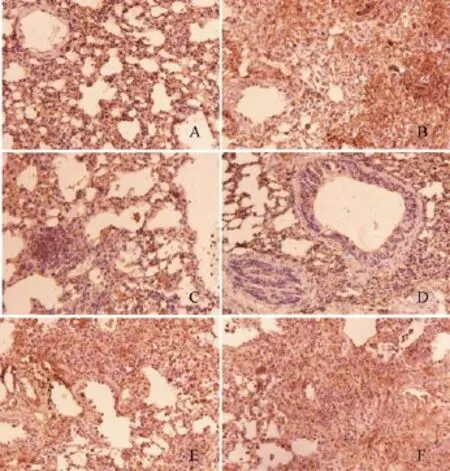
图3 各组小鼠肺组织TGF-β1的表达(×200)
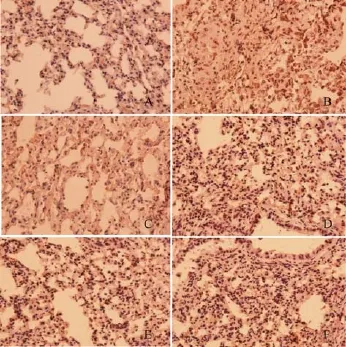
图4 各组小鼠肺组织TNF-α的表达(×200)
表4 黄芪不同组份对TGF-β1和TNF-α表达影响(±s,n=7)
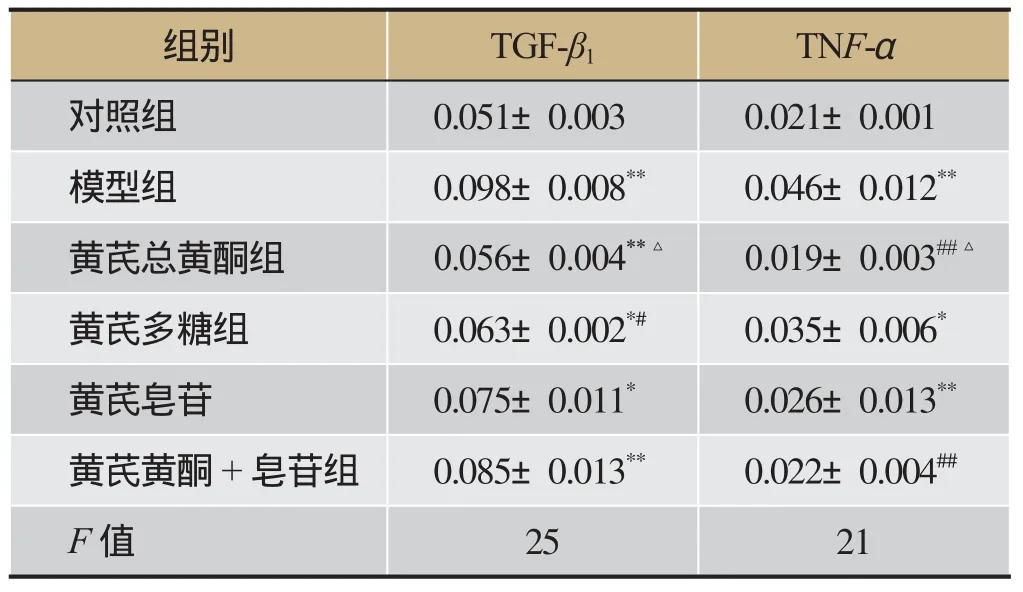
表4 黄芪不同组份对TGF-β1和TNF-α表达影响(±s,n=7)
注:与对照组比较,*P<0.05,**P<0.01;与模型组比较,*P<0.05,**P<0.01;黄芪总黄酮组与多糖组、黄芪皂苷组、黄芪黄酮+皂苷组比较,△P<0.05。
组别TGF-β1 TNF-α对照组0.051±0.003 0.021±0.001模型组0.098±0.008**0.046±0.012**黄芪总黄酮组0.056±0.004**△0.019±0.003##△黄芪多糖组0.063±0.002*#0.035±0.006*黄芪皂苷0.075±0.011*0.026±0.013**黄芪黄酮+皂苷组0.085±0.013**0.022±0.004##F值2521
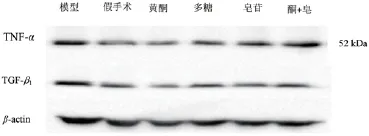
图5 Western-blot测定肺组织TNF-α和TGF-β1的表达
表5 Western-blot测定肺组织TNF-α和TGF-β1的表达(-±s,n=4)
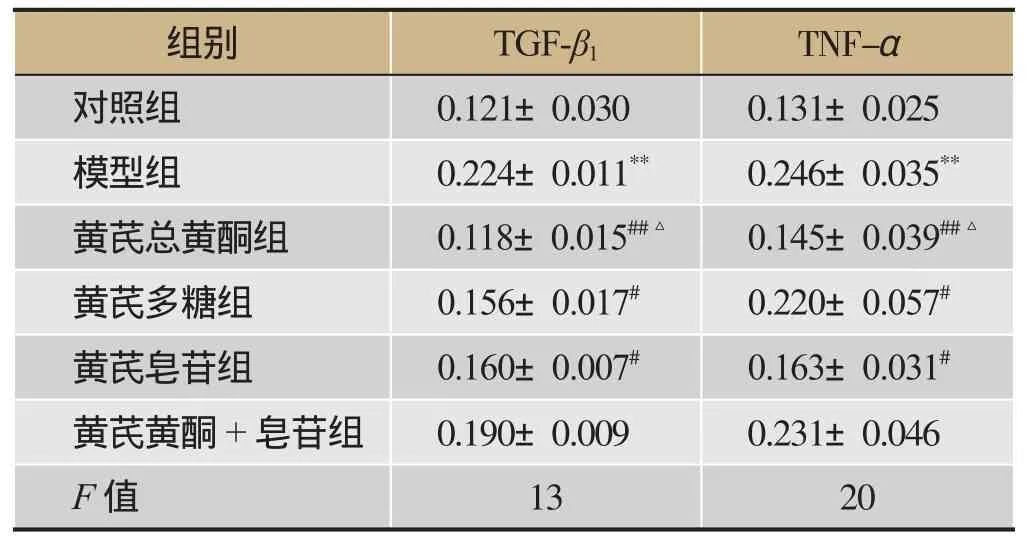
表5 Western-blot测定肺组织TNF-α和TGF-β1的表达(-±s,n=4)
注:与假手术组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01;黄芪总黄酮组与多糖组、黄芪皂苷组、黄芪黄酮+皂苷组比较,△P<0.05。
组别TGF-β1TNF-α对照组0.121±0.030 0.131±0.025模型组0.224±0.011**0.246±0.035**黄芪总黄酮组0.118±0.015##△0.145±0.039##△黄芪多糖组0.156±0.017#0.220±0.057#黄芪皂苷组0.160±0.007#0.163±0.031#黄芪黄酮+皂苷组0.190±0.009 0.231±0.046F值1320
3 讨论
PF病理形态以早期以肺部炎症为主,表现为大量中性粒细胞、淋巴细胞、单核细胞嗜酸性粒细胞等炎症细胞浸润,肺泡巨唾细胞(Alveolar Macrophage,AM)活化,毛细血管内皮细胞(Alveolar Epithelial Cell,AEC)和肺泡上皮细胞损伤,肺泡腔内有大量脱落的上皮细胞,主要为II型肺泡上皮细胞和少量单核细胞、巨噬细胞,肺泡壁由于血管扩张、渗出、细胞浸润呈弥漫性增厚;[4]随着病程的进展,由炎性细胞和细胞因子介导,胶原纤维大量生成,肺泡数量减少、变形、闭索或残留裂隙状不规则形态,细支气管代偿、扩张呈蜂窝肺,正常肺组织结构被破坏,功能丧失,肺毛细血管数量减少甚至闭索。
研究发现,TGF-β以激活的形式过度表达,是导致组织持久严重的间质纤维化发生的病理基础[5]。在TGF-β家族中,参与纤维化形成的主要是TGF-β1,它在PF过程中起着重要的作用,例如 I、III型胶原基因转录和ECM蛋白均可在其刺激下大量增殖[6]。TGF-β1被认为是器官纤维化过程中的核心介质,并喻为细胞因子网络的“启动枢纽”,抑制其表达或生物活性可延缓器官纤维化进程,制约着纤维化的发展方向[7]。在PF过程中,TGF-β1主要分布于细支气管、支气管粘膜上皮、支气管腺体和血管平滑肌及肺泡巨噬细胞中,各种原因引起的过度表达可导致PF的发生[8,9]。TNF-α属于胞浆分泌型炎症因子,其生物学活性广泛,参与炎性反应、免疫应答、抗肿瘤、内毒素性休克等病理过程,对免疫调节和抗感染等方面发挥重要作用,但是若持续释放或产生过多则会引起发热、休克、纤维化等[10]。
在中医学属于“肺痿”、“肺痹”等范畴,病机为“气虚血瘀”,益气活血法是治疗PF的基本治疗方法。黄芪其性微温,味甘,归肺、脾二经,具有补气升阳、固表止汗、托毒排脓、利水消肿等功效。黄芪成份复杂,含有皂苷、黄酮、多糖,以及氨基酸、亚油酸、生物碱、胆碱等化学成分[11],广泛用于肺,心肌,肝肾等组织纤维化治疗。黄芪能下调心肌成纤维细胞TGF-β1分泌,抑制其增殖[12],黄芪能抑制大鼠肝纤维化TGF-β1/Smad2、p38MAPK信号治疗肝纤维化[13],其联合TNF-α对CCl4诱导的大鼠肝纤维化产生较好保护作用[14]。在治疗PF方面,以黄芪为核心的补益药用药频度高达36%,黄芪用药频度达19%[2],因此黄芪具有较好抑制PF的作用。实验研究认为,黄芪注射液对人胚肺成纤维细胞增殖及细胞外基质合成的干预作用[15],黄芪提取物能降低矽肺模型大鼠支气管肺泡灌洗液 MMP-2、 MMP-9 的表达,抑制矽PF[16]。
本实验首次在同一模型中比较黄芪不同成份对PF炎症反应及TGF-β1和TNF-α的调控作用。该模型组织炎症反应强烈,表现为:形成了大量的炎性反应中心和肺纤维结节,纤维结节和炎性反应共同存在,肺泡灌洗液炎性细胞比例大幅升高,肺纤维实变区TGF-β1和TNF-α高表达。黄芪总黄酮,黄芪多糖、黄芪皂苷、黄芪黄酮联合皂苷灌胃28天,3种成份都不同程度抑制肺泡炎症,下调TGF-β1和TNF-α表达水平,但是黄芪总黄酮的治疗作用最明显,该治疗作用与下调TGF-β1和TNF-α具有密切关系。
综上所述,黄芪治疗PF具有确切作用,黄芪治疗PF与黄芪总黄酮类成份有关,黄芪总黄酮通过抑制TGF-β1和TNF-α表达而抑制PF进程。
1 藏凝子,庞立健,刘创,等.特发性肺纤维化在病证结合模式指导下的疗效评价体系框架.世界科学技术-中医药现代化, 2014, 16(10): 2118-2123.
2 赵国静.现代中医药治疗特发性肺纤维化的文献研究.山东:山东中医药大学硕士学位论文, 2012.
3 黄春芳,王继峰,牛建昭,等.姜黄素上调博来霉素诱导肺纤维化C57BL/6小鼠CathepsinK表达.世界科学技术-中医药现代化, 2011, 13(2): 293-297.
4 Wang Q, wang Y, Hyde D M. Reduation of bleomcin induced lung fibrosis by transforming growth factor beta souble receptor in hamsters. Thorax, 1999, 54: 805-812.
5 Schilter H, Cantemir-Stone C Z, Leksa V. The mannose-6-phosphate analogue, PXS64, inhibits fibrosis via TGF-β1pathway in human lung fibroblasts. Immunol Lett, 2015, 165(2): 90-101.
6 Oruqaj G, Karnati S, Vijayan V, et al. Compromised peroxisomes in idiopathic pulmonary fibrosis, a vicious cycle inducing a higher fibrotic response via TGF-β signaling. Proc Natl Acad Sci U S A, 2015, 112(16): E2048-E2057.
7 Lee A, Borthwick, Thomas A. Wynn. IL-13 and TGF-β1: Core mediators of fibrosis. Current Pathobiology Reports, 2015, 3(4): 273-282.
8 Alberti A, Sarchielli P, Gallinella E, et al. Plasma cytokine levels in patients with obstructive sleep apnea syndrome: A preliminary study. J Sleep Res, 2003, 12(4): 305-311.
9 余维涛,崔社怀,杨雪梅.特异性stealth siRNA抑制小鼠肺成纤维细胞TGF-β1表达的实验研究.第三军医大学学报, 2007, 29(21): 8302.
10 Redente E F, Keith R C, Janssen W, et al. Tumor necrosis factor-α accelerates the resolution of established pulmonary fibrosis in mice by targeting profibrotic lung macrophages. Am J Respir Cell Mol Biol, 2014, 50(4): 825-837.
11 史静超,李浩铮,王永辉,等.不同产地蒙古黄芪中黄芪甲苷、黄芪皂苷I、黄芪皂苷II和黄芪皂苷III含量的比较与分析.世界科学技术-中医药现代化, 2015, 17(5): 1016-1021.
12 阮涛,何学华,刘丽萍,等.黄芪对心肌成纤维细胞增殖及分泌转化生长因子-β1的影响.临床儿科杂志, 2015, 33(3): 284-286.
13 林红,蔡钢,杨百京.黄芪后处理对大鼠肝纤维化中TGF-β1/ Smad2、p38MAPK的影响及作用.世界科学技术-中医药现代化, 2014, 16(2): 410-413.
14 李峰,岳蓓,程媛媛,等.黄芪联合干扰素α对CCl4诱导的大鼠肝纤维化的保护作用.临床和实验医学杂志, 2015, 14(16): 1326-1329.
15 李琳琳,申绯翡,马雷雷,等.黄芪注射液对人胚肺成纤维细胞增殖及细胞外基质合成的干预作用.中国医药指南, 2014, 12(18): 86-87.
16 颜春鲁,陈丽,胡继宏,等.黄芪及其提取物对矽肺模型大鼠支气管肺泡灌洗液MMP-2、MMP-9.西部中医药, 2015, 28(10): 22.
Impacts of Astragalus Extract on the Alveolar Inflammation and Anti-Fibrosis Effects in Pulmonary Fibrosis Mice
Xu Changjun1, Fang Songwen1, Dan Yong1, Zhang Chuan1, Xu Linlin1, Liu Yang1, Zhang Lili2, Yang Changfu1
(1. Basic Medical College, Guiyang College of Traditional Chinese Medicine, Guiyang 550002, China;
2. The Nurse School, Guizhou Province People's Hospital, Guiyang 550002, China)
Astragalus was widely used in the TCM treatment of pulmonary inflammation in fibrosis. This study aimed to exam the therapeutic effects of flavonoids, polysaccharides and saponins in astragalus on pulmonary inflammation in bleomycin (BLM) induced fibrosis KM mice model. BLM were administered intratracheally in the model group and the medication group, while the same volume of normal saline in the control group. Mice were sacrificed after astragalus ingredients administration for 28 days. It was found that neutrophile granulocyte and macrophagocyte in bronchoalveolar lavage fluid were significantly increased in the model group (P < 0.05), which were reversed after administration of astragalus flavonoids. The same cell count results were showed both in Masson and HE staining (P < 0.05). And a positive correlation between inflammatory response and pulmonary fibrosis was presented in the study. However, there was no significant change after the treatments of astragalus polysaccharides, saponins and astragalisaponins plus flavonoids. Quantifing analysis of collagen was consistent with that of inflammation. Astragalus saponins and flavonoids both restrained early fibrosis nodules, while astragalus flavone was superior to the astragalus saponin group and the astragalus saponin plus flavone group. TNF-α, TGF-β1were significantly increased in IHC and western blot results in the model group. Tragalus astragalus flavonoids reversed these trends, which surpassed other ingredients. In conclusion, astragalus flavone and astragalus saponin can inhibit pulmonary inflammation and fibrosis, which may be related to the antiinflammatory effects of TNF-α and TGF-β1.
Astragalusmembranaceus sugar, astragalus flavones, astragalus saponin, pulmonary fibrosis, inflammatory, TNF-α, TGF-β1
10.11842/wst.2016.04.015
R563
A
(责任编辑:朱黎婷,责任译审:朱黎婷)
2015-12-20
修回日期:2016-02-04
* 国家自然科学基金委地区科学基金项目(81260587):从自噬/溶酶体途径探讨组织蛋白酶D对特发性肺纤维化中II肺泡上皮细胞损伤的的分子机制及加减补肺汤的干预研究,负责人:杨长福;贵州省科技厅科学技术基金(黔科合J字[2014]2034号):miRNA-21、LET-7d对IPF炎症反应及细胞自噬途径的影响,负责人:徐昌君;贵州省高等学校大学生创新创业训练计划:黄芪抗肺纤维化药用成份分析及筛选,负责人:方松文。
** 通讯作者:杨长福,副教授,主要研究方向:中药治疗肺纤维化。
