柴芪汤对非酒精性脂肪肝大鼠固醇调节元件结合蛋白-1c表达的影响*
2016-03-19陈丽如张立平马丽娜阿新拜
陈丽如,张立平,刘 源,聂 玮,马丽娜·阿新拜
1 北京中医药大学,北京 100029;2 北京中医药大学国际交流与合作处
柴芪汤对非酒精性脂肪肝大鼠固醇调节元件结合蛋白-1c表达的影响*
陈丽如1,张立平2△,刘 源1,聂 玮1,马丽娜·阿新拜1
1 北京中医药大学,北京 100029;2 北京中医药大学国际交流与合作处
目的:观察柴芪汤对非酒精性脂肪性肝病(NAFLD)大鼠肝脏固醇调节元件结合蛋白-1c(SREBP-1c)mRNA及蛋白表达的影响,探讨其防治NAFLD的可能机制。方法:将32只SPF级雄性SD大鼠随机分为正常组、模型组、柴芪汤组和罗格列酮组,每组8只,采用高脂高糖高盐饮食喂养8周复制NAFLD模型,造模第一天开始用药,给予柴芪汤[5.67g/(kg·d)]及罗格列酮混悬液[3 mg/(kg·d)]灌胃干预,8周后检测大鼠血清丙氨酸氨基转移酶(ALT)、天冬氨酸转氨酶(AST)、甘油三酯(TG)、胆固醇(TC)、高密度脂蛋白(HDL-C)、低密度脂蛋白(LDL-C)及肝组织中TG含量;观察肝组织病理形态改变;Western Blot测定肝SREBP-1c蛋白表达;RT-PCR测定肝SREBP-1c mRNA表达。结果:模型组大鼠血清ALT、AST、TC、TG、HDL-C、LDL-C水平及肝组织中TG含量明显高于正常组(P<0.05),2用药组各项指标低于模型组,差异有统计学意义(P<0.05);但2组间比较,差异无统计学意义(P>0.05)。2用药组SREBP-1c mRNA及蛋白表达水平较模型组降低,差异具有统计学意义(P<0.05),但2用药组比较差异无统计学意义(P>0.05)。结论:柴芪汤能够改善NAFLD大鼠肝脏脂肪变,其干预效果与西药罗格列酮相似,抑制SREBP-1c mRNA和蛋白表达,从而降低NAFLD大鼠血清ALT、AST、TG、TC、HLD-C、LDL-C,这可能是柴芪汤治疗NAFLD的机制之一。
非酒精性脂肪肝;柴芪汤;罗格列酮;固醇调节元件结合蛋白-1c
非酒精性脂肪性肝病(NAFLD),按病理学分类可分为单纯性非酒精性脂肪肝、非酒精性脂肪性肝炎和非酒精性脂肪性肝硬化[1-2]。其常与肥胖、2型糖尿病、血脂紊乱同时存在,被视为代谢综合征的肝脏表现[3]。近年来随着生活水平的提高和饮食结构的改变,NAFLD已经成为现代社会最常见的肝病之一[4]。相关研究发现[5],固醇调节元件结合蛋白-1c(SREBP-1c)是调控肝脏脂质代谢的重要核转录因子,同时在脂肪酸代谢中起关键调控作用。根据其临床症状及体征,NAFLD应当属中医“肥胖”“胁痛”“积聚”“痰饮”等范畴,病因多为过食肥甘厚味,过逸少劳,情志失调等,发病机制主要为肝失疏泄,脾失健运,痰浊瘀血阻滞。肝郁脾虚是该病主要病理基础,本研究以高脂、高糖、高盐饮食建立大鼠NAFLD模型,观察具有疏肝健脾之效的柴芪汤对NAFLD大鼠肝脏SREBP-1c mRNA及蛋白表达,探讨柴芪汤对防治NAFLD的作用机制。
1 材料与方法
1.1 实验动物及饲料 SPF级SD雄性大鼠6~8周龄,体质量(200±20)g,共32只购于北京维通利华实验动物技术有限公司[动物实验合格证号:SCXK(京2012-0001)]。高盐高脂高糖饲料(52.5%基础饲料,10%熟猪油,10%蛋黄粉,2%胆固醇,10%奶粉,10%果糖,5%食用盐,0.5%胆盐)由北京科澳协力饲料有限公司提供。
1.2 药品、主要试剂及仪器 柴芪汤(柴胡10 g,黄芪30 g,白术10 g,枳实10 g,三七粉3 g)由北京中医药大学东方医院中药房代煎制备。罗格列酮(葛兰素史克公司生产,规格4 mg/片,批号:H20020475)。谷草转氨酶(AST)、谷丙转氨酶(ALT)、甘油三酯(TG)、总胆固醇(TC)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)测试盒均购中生北控生物科技股份有限公司,肝脏组织甘油三酯测试盒均购自南京建成生物工程研究所,兔抗大鼠SREBP-1c多克隆抗体(Abcam,ab28481),鼠单抗β-actin(中杉金桥,TA-09),Trizol及引物均由Invitrogen公司提供,Taq酶(RR82LR)、SYBR R Premix Ex TaqTMⅡ(Tli RNaseH Plus)试剂盒及DNA Marker(3427Q)均购于大连宝生物工程有限公司。全自动生化检测仪(日立7160),灰度分析软件:tanon公司(Gel Image System Ver 4.0),分光光度计(Therno scientific,NANODROP 2000),ABI7500荧光定量PCR仪(美国Applied Biosystems公司)。
1.3 实验方法
1.3.1 动物分组及给药 将32只大鼠适应性喂养1周后,按随机数字表法随机分为4组:正常组、模型组、柴芪汤组与罗格列酮组,每组8只。除正常组给予普通饲料外,其余3组均给予高盐高脂高糖饲料喂养8周。自造模第1天开始持续灌胃8周,柴芪汤组给予柴芪汤5.67 g/(kg·d)(按“人和动物体表面积折算的等效剂量比值表”计算),罗格列酮组予罗格列酮混悬液3 mg/(kg·d),正常组及模型组给予10 mL/(kg·d)蒸馏水对照。
1.3.2 标本采集 实验第8周末取材,禁食不禁水12小时,以10%水合氯醛溶液(4 mL/kg)腹腔注射麻醉后,于腹主动脉取血,静置1小时,置于离心机4℃,3 000 r/min离心15分钟,分离上层血清,分装冻存待测。于各组大鼠肝脏最大叶距边缘0.5 cm处,切取约1.0 cm×0.5 cm×0.5 cm大小的肝组织,置于4%多聚甲醛溶液中,待做病理学观察。将最大叶剩余肝组织切成约0.5 cm×0.5 cm× 0.5 cm大小若干块(全部过程在冰上操作),置于冻存管中,-80℃冰箱冻存待用。
1.3.3 指标检测 采用全自动生化检测仪检测血清丙氨酸氨基转移酶(ALT)、天冬氨酸转氨酶(AST)、TG、TC、HDL-C、LDL-C。精确称取一块大鼠肝组织,按质量(g)∶体积(mL)=1∶9的比例加入9倍体积的冰生理盐水,制备成10%的肝组织匀浆液,在冰浴下使用超声匀浆机匀浆5 s/次,间隔5 s,共7~8次,至匀浆液均匀无颗粒为止,3 500 r/min离心15分钟后取上清,按试剂盒方法测定肝脏组织中TG含量。
1.3.4 肝组织病理学 将固定好的肝组织从多聚甲醛中取出,流水过夜后脱水机梯度脱水,常规石蜡包埋,以4 μm连续切片行HE染色,光镜下观察大鼠肝脏脂肪变性情况。
1.3.5 Western blot检测SREBP-1c蛋白表达 取约200 mg的肝组织加入RIPA裂解液2 mL及20 μL PMSF,在冰浴下使用超声匀浆机匀浆5 s/次,间隔5秒,共7~8次,至匀浆液均匀无颗粒为止。冰浴静置1小时;4℃离心,30 000 r/min,10分钟。取中层清液(上层为油脂,下层为少许沉淀),重复离心1次。BCA法定量后,将蛋白高温变性,行聚丙酰胺凝胶电泳,转移至PVDF膜,5%脱脂奶粉室温封闭1.5小时,将膜浸于兔抗鼠SREBP-1c抗体1∶500,4℃过夜,洗涤后加入辣根过氧化酶结合的山羊抗兔IgG液1∶20000(Jackson,111-035-003)室温孵育1.5小时,洗膜后在膜上滴加ECL发光试剂,胶片曝光显影,对条带进行半定量分析,利用软件读取积分光密度值(OD),以目的蛋白的OD值除以内参(β-actin)条带的OD值作为最终结果进行统计。
1.3.6 RT- PCR检测肝组织SREBP-1c mRNA表达 从-80℃冰箱中取出肝组织,加入Trizol裂解肝组织,提取总RNA,分光光度计检测总RNA浓度后,逆转录合成cDNA。再以cDNA为模板进行PCR扩增。目的基因SREBP-1c的引物:上游5′-AGGGAGTTCTCAGATGCTCTTGGAT-3′,下游为5′-GTCTGTGCCAGTGGTGGTAGCC-3′,产物大小为80 bp;内参GAPDH引物:上游为5′-TGGAGTCTACTGGCGTCTT-3′,下游为5′-TGTCAT-ATTTCTCGTGGTTCA-3′产物大小为 138 bp。用 SYBRR Premix Ex TaqTMⅡ(Tli RNaseH Plus),ROX plus进行扩增,实验操作按产品说明书进行。扩增程序为:95°30sec,(95℃5sec,60℃40sec)×45个循环。用ABI 7500型荧光定量PCR仪,采用2-△△CT法进行数据的相对定量分析。
1.4 统计学方法 应用SPSS 17.0统计学软件进行处理,计量资料用表示,采用单因素方差分析,P<0.05表示差异有统计学意义。
2 结果
2.1 各组大鼠血清生化指标的比较 血清ALT、AST、TG、TC、HDL-C及LDL-C模型组与正常组比较,差异有统计学意义(P<0.05);血清ALT、AST、TG、HDL-C及LDL-C柴芪汤组与模型组比较,差异有统计学意义(P<0.05);血清ALT、AST、TG、TC及LDL-C罗格列酮组与模型组比较,差异有统计学意义(P<0.05);上述指标两用药组比较,差异均无统计学意义(P>0.05),见表1。
表1 各组大鼠血清生化指标比较

表1 各组大鼠血清生化指标比较
注:#表示与正常组比较,P<0.05;*表示与模型组比较,P<0.05。
?
2.2 各组大鼠肝脏组织TG水平 大鼠肝组织中TG含量模型组、柴芪汤组、罗格列酮组与正常组比较,差异有统计学意义(P<0.05);柴芪汤组、罗格列酮组与模型组比较,差异也有统计学意义(P<0.05);两用药组间比较,差异无统计学意义(P>0.05)。见表2。
表2 各组大鼠肝脏组织TG含量mmol/L

表2 各组大鼠肝脏组织TG含量mmol/L
注:#表示与正常组比较,P<0.05;*表示与模型组比较,P<0.05。
?
2.3 各组大鼠肝脏组织观察结果 光镜下正常组肝组织结构完整,肝细胞以中央静脉为中心向四周呈条索状、放射状整齐排列,肝细胞分界清,肝小叶结构完整,肝窦排列规则,汇管区清晰。模型组大鼠肝细胞胞质内充满大量大小不等的圆形脂滴,肝小叶结构不清,肝索排列紊乱,大部分肝细胞呈脂肪变性。柴芪汤组大鼠肝细胞胞质内脂滴较少,肝索排列较正常,肝血窦扩张,肝细胞形态接近正常。罗格列酮组大鼠肝脏脂变程度介于模型组与柴芪汤组之间,肝细胞形态基本可见,肝细胞脂肪变性少见,可见点状炎性细胞浸润。见图1。
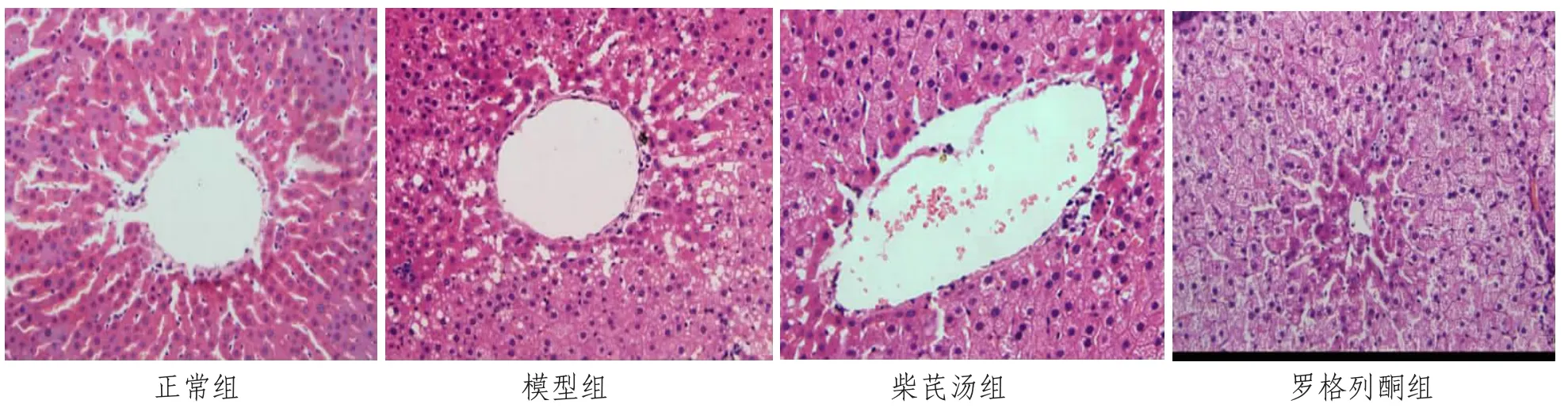
图1 光镜下观察大鼠肝组织(HE,×200)
2.4 各组SREBP-1c mRNA及蛋白的表达情况
SREBP-1c及SREBP-1c mRNA表达模型组、柴芪汤组、罗格列酮组与正常组比较,差异有统计学意义(P<0.05);柴芪汤组、罗格列酮组与模型组比较,差异也有统计学意义(P<0.05);2用药组间比较,差异无统计学意义(P>0.05)。见表3。
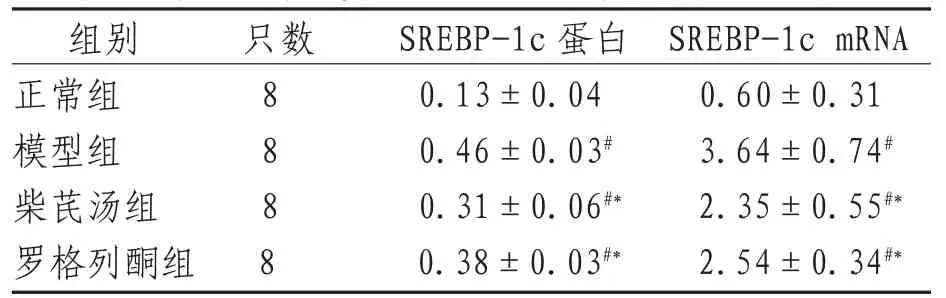
表3 各组大鼠肝脏SREBP-1c蛋白及其mRNA表达
3 讨论
3.1 NAFLD的中医学认识 中医学认为食物的消化吸收有赖于肝疏泄和脾运化的功能正常,饮食不节、过食肥甘厚味,劳逸失常或情志所伤,可损伤肝脾,而致肝失疏泄,气机阻滞,脾胃运化失健,水谷精微不化,停聚湿生痰,痰湿阻络,血行不畅,留而为瘀,终致气、血、湿、痰互结于肝而成脂肪肝。故肝郁脾虚是NAFLD的主要病理基础。柴芪汤由黄芪、柴胡、白术、枳实、三七粉组成。方中黄芪补中益气健脾,柴胡疏肝解郁,调畅气机,共为君药;白术健脾助运,“见肝之病,知肝传脾,当先实脾”,故实脾以防肝乘,为臣药;枳实理气解郁,与柴胡共同调畅肝脾气机,为佐药;三七化瘀止血活血为使药。此方补中有疏,调中有养,护脾治肝,使脾运复健,肝郁得疏,标本同治。
3.2 柴芪汤对大鼠血清血脂及肝功能的影响 LDL-C为极低密度脂蛋白水解后除去部分脂肪及少量蛋白质后的残余部分,主要用于运输体内胆固醇至肝脏,检测LDL-C水平可反映肝脏胆固醇水平[6]。HDL-C主要由肝脏生成和分泌,用于将肝脏中的磷脂和胆固醇转运出去[7]。模型组血清TG、TC及LDL-C较正常组明显升高,同时HDL-C降低,符合NAFLD病变模型。柴芪汤干预8周后,可明显降低TG及LDL-C,并提高HDL-C含量,但对血清TC含量改善较模型改善无统计学意义。罗格列酮可降低NAFLD大鼠血清TG、TC及LDL-C含量,但对提高HDL-C无明显效果。ALT和AST主要分布于肝及心肌细胞内,血清中含量较少,当肝细胞膜通透性增加或严重受损时ALT和AST被释放至血,血清ALT和AST水平升高[8]。因此,模型组大鼠经喂养特殊饲料后发生肝脏脂肪病变时肝细胞膜通透性改变,大量细胞受损或坏死,导致血清ALT和AST水平升高。利用柴芪汤或罗格列酮干预后均可较模型组降低血清ALT及AST含量,且血清中该2项指标与正常组比较差异无统计学意义(P>0.05),表示柴芪汤与罗格列酮有一定保护肝脏功能的作用,且效果相当。
3.3 柴芪汤对肝脏组织TG影响 过量高脂饮食可使肝内TG堆积[9],引起肝组织脂肪变性。研究结果显示,NAFLD患者存在脂代谢紊乱[10],肝细胞内脂质代谢紊乱是引起TG大量沉积于肝脏的重要原因,TG是肝细胞正常生理功能的必需物质之一,但当肝组织中沉积大量TG则会导致脂肪肝变性[11]。本研究发现柴芪汤及罗格列酮均可改善TG在肝组织中的沉积,两者比较差异无统计意义。
3.4 柴芪汤对肝脏SREBP-1c的影响 SREBP-s是一类分布于内质网和核膜上的膜连接蛋白,有3种同工型:SREBP-1a、SREBP-1c和SREBP-2,啮齿类动物和人类的肝脏中以SREBP-1c为主,它是一类调控脂肪酸TG和TC的合成,参与LDL-C代谢相关基因表达的核转录因子,上调脂肪合成基因的表达,可明显增加游离脂肪酸和TG的合成,在NAFLD的发病过程中具有重要作用[12]。
本实验利用特殊饲料诱发NAFLD模型,病理形态证实模型成立,RT-PCR与Western Blot实验结果提示模型组SREBP-1c mRNA表达及蛋白含量较正常组明显增加,与文献中报道一致[13]。使用柴芪汤及罗格列酮干预后发现SREBP-1c mRNA表达及蛋白含量较模型组降低,且差异具有统计学意义(P<0.05),提示柴芪汤与罗格列酮可能有相似的干预机制,均可以通过抑制SREBP-1c mRNA表达和下调SREBP-1c的表达,减少脂肪酸和甘油三酯的生成,从而对NAFLD具有防治作用。
[1] De Alwis NM,Day CP.Nonalcoholic fatty liver disease:the mist gradually clears[J].Hepatol,2008,48(Suppl1):104-112.
[2] Brunt EM,Tiniakos DG.Histopathology of nonalcoholic fatty liver disease[J].World J Gastroenterol,2010,16:5286-5296.
[3] 唐启盛.抑郁症——中西医基础与临床[M].北京:中国中医药出版社,2006:217-227.
[4] Erickson SK.Nonalcoholic fatty liver disease[J]. J Lipid Res2009,50(Suppl):412-416.
[5] Jump BD,Botolin D,Wang Y,et al.Fatty acid regulation of hepatic gene transcription[J].Nutr,2005,135(11):2503-2509.
[6] 全晓红,叶冬梅,唐晓光.六味地黄丸对NAFLD大鼠肝脏组织SOD、MDA、TG和TC的影响及意义[J].世界华人消化杂志,2014,22(6):819-824.
[7] Arienti V,Aluigi L,Pretolani S,et al.Ultrasonography(US)and non-invasive diagnostic methods for nonalcoholic fatty liver disease(NAFLD) and early vascular damage,possible application in a population study on the metabolic syndrome(MS)[J].Intern Emerg Med,2012,7(Suppl3):283-290.
[8] 张弛,刘瑛,李华珠,等.血清谷丙转氨酶在正常范围内对非酒精性脂肪性肝病的预测[J].世界华人消化杂志,2011,18(19):841-844.
[9] Zou Y,Li J,Lu C,et al.High fat emulsion induced ratmodel of nonalcoholic steatohepatitis[J].Life Sci,2006,79(11):1100.
[10]Choi SS,Diehl AM.Hepatic triglyceride synthesis and nonalcoholic fatty liver disease[J].Curr Opin Lipidol,2008,19:295.
[11]Friedman J.Fat in all the wrong places[J].Nature,2002,4(15):268.
[12]Staels B,Handelsman Y,Fonseca V.Bile acid sequestrants for lipid and glucose control[J].Curr Diab Rep,2010,10(1):70-77.
[13]艾正琳,陈东风,史洪涛,等.非酒精性脂肪性肝病大鼠肝X受体和固醇调节元件结合蛋白1c的表达及意义[J].重庆医学,2007,36(8):689-691.
Effects of ChaiQi Tang on Expression of SREBP-1c in Rats with Nonalcoholic Fatty Liver Disease
CHEN Liru1,ZHANG Liping2△,LIU Yuan1,NIE Wei1,Malina·AXINBAI1
1 Beijing University of Chinese Medicine,Beijing 100029,China;
2 International Exchange and Cooperation of Beijing University of Chinese Medicine
Objective: To observe the effects of ChaiQi Tang on SREBP-1c mRNA and protein expression in rats with nonalcoholic fatty liver disease(NAFLD) and explore the possible mechanism of preventing and treating NAFLD. Methods: All 32 male SPF rats were randomly divided into the normal group, the model group, ChaiQi Tang group and rosiglitazone group, each group eight rats, all groups were fed with high salt, high fat and high sugar diet for eight weeks for duplicating NAFLD model, the medication groups accepted gastric lavage of ChaiQi Tang [5.67 g/ (kg·d)] and rosiglitazone suspension [3 mg/(kg·d)] from the first day of preparing the models, ALT, AST, TG, TC, HDL-C, LDL-C and TG level in liver were detected after eight weeks; pathological changes of hepatic tissue were observed; SREBP-1c protein expression was measured by Western Blot; SREBP-1c mRNA expression was measured by RT-PCR. Results: The model group was higher than the normal group obviously in the levels of ALT, AST, TG, TC, HDL-C, LDL-C in serum and TG in liver(P<0.05), the two medication groups were lower than the model group in different indexes, and there were statistical differences (P<0.05); there were no statistical difference between two groups(P>0.05). Two medication groups were lower than the model group in the levels of SREBP-1c mRNA and protein expression, there were statistical differences(P<0.05), but there were no statistical differences between two medication groups(P>0.05). Conclusion: ChaiQi Tang can improve fatty change of liver in rats with NAFLD, its intervention function is similar to rosiglitazone, ChaiQi Tang also can inhibit SREBP-1c mRNA and protein expression, finally reducing ALT, AST, TG, TC, HDL-C, LDL-C of serum in rats with NAFLD, this may be one of mechanisms of ChaiQi Tang treating NAFLD.
NAFLD; ChaiQi Tang; rosiglitazone; SREBP-1c
R285.5
A
1004-6852(2016)12-0013-05
2016-07-08
国家自然科学基金资助项目(编号81273695);高等学校博士学科点专项科研基金项目(编号20130013110016);北京中医药大学在读研究生项目(编号2015-JYB-XS163)。
陈丽如(1976—),女,在读博士研究生。研究方向:消化系统疾病的中医诊治。
△通讯作者:张立平(1963—),女,博士学位,博士研究生导师,教授,主任医师。研究方向:消化系统疾病的中医诊治。
