六盘水野生蕨菜多糖的生物活性研究
2016-03-18方玉梅王毅红张萍谭萍王盼六盘水师范学院贵州水城553004
方玉梅,王毅红,张萍,谭萍,王盼(六盘水师范学院,贵州水城553004)
六盘水野生蕨菜多糖的生物活性研究
方玉梅,王毅红,张萍,谭萍,王盼
(六盘水师范学院,贵州水城553004)
摘要:采用纸片法测定其抑菌作用,并同时采用水杨酸比色法和DPPH法测定其抗氧化能力,来评价六盘水野生蕨菜多糖的生物活性。结果表明:蕨菜多糖提取液对金黄色葡萄球菌、大肠杆菌和枯草芽孢杆菌均有抑菌作用。不同浓度的蕨菜多糖对清除DPPH自由基和抑制·OH都有明显的效果,且在一定的浓度范围内,蕨菜多糖的浓度与DPPH自由基的清除率和·OH的抑制率呈正相关。为六盘水野生蕨菜资源的进一步开发利用提供参考。
关键词:蕨菜;多糖;抑菌;DPPH·;·OH
蕨菜,别名拳头菜、如意菜、龙头菜等,属于蕨科。喜生于浅山区向阳地块,多分布于稀疏针阔混交林。其食用部分是未展开的幼嫩叶芽[1]。农业、医学及食品营养学等方面的研究结果显示,蕨菜的某些有效成分能扩张血管,降低血压;粗纤维能促进胃肠蠕动,具有下气通便的作用;蕨菜还具有清热解毒、杀菌清炎、补脾益气、强健机体、增强抗病能力保健功能,为某些疾病问题的解决提供了更简便有效的新途径[2]。
随着食品营养学的不断发展,人们更加关注植物性来源的非传统营养素,并试图从植物中寻找生理活性物质来降低、缓解、解决呈不断上升趋势的各种现代社会居民退行性疾病问题。研究表明植物多糖具有增强机体免疫功能、抗肿瘤、抗病毒、抗衰老、降血糖、刺激造血等多种生物学功效,而且对机体几乎没有毒性,故对植物多糖生物学功效的研究愈来愈引起国内外药理学家、生物学家和化学家们的兴趣,它已成为当代生物学的热门领域[3-4]。
蕨菜作为一种野生植物资源,生长在深山丛林之中,没有工业排放“三废”污染,也没有现代工业产品造成的农药污染,是一颗天然无公害的绿色珍珠,常年埋没在高山深谷内,属于天然无公害绿色食品[5]。近年来,随着野生资源的开发利用,对蕨菜的引栽加工以及一般的营养成分有了一些报道,但多见报道的是氨基酸、矿物质、维生素及次生代谢物质(生物类黄酮)等,而对蕨菜多糖的研究也仅见于含量测定和成分分析。但是蕨菜中次生代谢物质的含量毕竟较少,而多糖是初生物代谢产物,其含量较生物类黄酮要大得多,如果蕨菜多糖也有一定的抗氧化作用和抑菌作用,则蕨菜将具有很大的医疗保健价值。
1仪器与试剂
1.1主要原料及试剂
原料:蕨菜,采自六盘水石龙。
试剂:无水葡萄糖、FeSO·47H2O、石油醚、浓硫酸、水杨酸、盐酸、过氧化氢、苯酚、无水乙醇、铝片、碳酸氢钠、牛肉膏、蛋白胨、NaCl、琼脂,均为市售国产分析纯;二苯代苦味酰自由基(DPPH)为Sigma公司产品。
1.2仪器
TU-1901双光束紫外可见分光光度计:北京普析通用仪器有限责任公司;sartoriusBS110S电子天平:北京赛多利斯仪器有限公司;DK-98-1型电热恒温水浴锅、FW80型高速万能粉碎机:天津泰斯特仪器有限公司;LC-600B型数控超声波清洗机(总功率600 W):济宁市中区鲁超仪器厂;202A-3型恒温干燥箱:上海浦东跃欣科学仪器厂;TGL-16G型离心机:上海安亭科学仪器厂;LDZX-50KBS高压灭菌锅:上海宜川仪表厂;HH.B11.420-BS-Ⅱ电热恒温培养箱:上海跃进医疗器械厂;SW-CJ-1F超净工作台:上海博讯实业有限公司医疗设备厂。
2 方法
2.1蕨菜多糖样品的制备
2.1.1蕨菜的前处理及脱脂
将采来的新鲜蕨菜洗净置于调至65℃的恒温干燥箱中进行烘干处理,彻底脱水后用粉碎机粉碎成粉末,过60目筛,然后称取200 g蕨菜干粉于1 000 mL烧杯中,再量取400 mL石油醚加入其中,放置24 h进行脱脂,24 h后将蕨菜粉末过滤,然后将蕨菜粉末铺在大滤纸上待其干燥,将其盛入试剂瓶中放入恒温干燥箱备用。
2.1.2蕨菜多糖的制备及含量的测定
2.1.2.1标准曲线的绘制[6]
精确称取105℃干燥至恒重的无水葡萄糖0.1000 g,置100 mL容量瓶中,加水溶解并稀至刻度,摇匀。精确吸取上述溶液1.0 mL,置50 mL容量瓶中,加水稀释至刻度。
精确量取0.500 0 mg/mL葡萄糖溶液0、2.0、3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0 mL,分别置于100 mL容量瓶中,加水稀释至刻度,摇匀,配成不同浓度的对照品系列溶液。于485 nm波长处测定吸光度,以吸光度(A)为纵坐标,以浓度(X)为横坐标,得回归方程,绘制标准曲线。
2.1.2.2蕨菜多糖含量测定
准确称取0.1g蕨菜粉末一份置于干净标号的具塞试管中,按料液比1∶100(g/mL)入10mL蒸馏水,调节超声波清洗机功率70%(420 W),温度35℃,提取50 min。然后离心取上清液,将上清液定容至10 mL,备用。
精确吸取3 mL提取液进行显色,以制备的参比液作参比,在485 nm处分别测其吸光度。以上试验,每一处理3次重复。之后取吸光度平均值带入回归方程,从而求得多糖浓度X。
2.2蕨菜多糖对细菌的抑制
首先配制好适宜大肠杆菌、金黄色葡萄球菌、枯草芽孢杆菌的培养基,即牛肉膏蛋白胨培养基[7],配方为:牛肉膏0.5 g、蛋白胨1 g、氯化钠0.5 g、琼脂2 g、蒸馏水100 mL、pH 7.0~7.2、灭菌1.05 kg/cm2,22 min。将大肠杆菌、金黄色葡萄球菌[8]、枯草芽孢杆菌从保藏状态恢复到室温状态。然后在超净工作台上按规范操作将上述菌种分别接种到培养基中,放到35℃恒温箱中培养,挑选培养基中茁壮的菌落,继续接种培养,重复此步骤2次~3次,得到生长良好的菌落(备用)。
在无菌操作室中将剪好并灭菌的滤纸片放入多糖提取液和无菌水中,各9片(防止操作失误,可多放),浸泡1 h。把已活化的金黄色葡萄球菌接种到已经倒好的培养皿中央,接种4皿,在第一、二皿上放入泡有多糖提取液的滤纸片,每皿一片,覆盖接种菌株,第三皿中放入泡有无菌水的,第四组作对照。按上述步骤将大肠杆菌、枯草芽孢杆菌接入,放置于35℃恒温箱中培养。
2.3蕨菜多糖对DPPH自由基的清除[9-11]
DPPH溶液的配制:用分析天平精确称取44 mg DPPH,并用水乙醇溶解定容于100mL容量瓶中,避光放入冰箱保鲜层保存。用时取配好的DPPH溶液1 mL用无水乙醇稀释100 mL,此时DPPH浓度为120 μmol/L。
样品稀释:分别取蕨菜多糖提取液0.2、0.4、0.6、0.8、1.0 mL,分别加入蒸馏水0.8、0.6、0.4、0.2、0 mL,作为不同浓度的蕨菜多糖样品液,分别标示为样品1~样品5。
样液:用移液枪分别取上述不同浓度的0.1 mL蕨菜多糖提取液与3 mL120 μmol/L的DPPH溶液加入同一支比色管中,摇匀,在黑暗中放置30 min,无水乙醇作空白,在517 nm波长处测定其吸光度Ai。
对照:用移液枪取0.1 mL无水乙醇与3 mL 120 μmol/L DPPH溶液加入同一比色管中,摇匀,在黑暗中放置30 min,以无水乙醇作为空白,在517 nm测定其吸光度Ac。
用以下公式计算清除率。
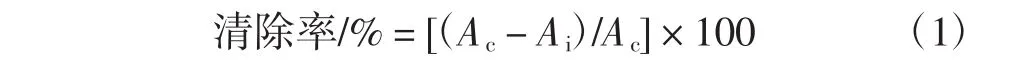
式中:Ac为0.1 mL无水乙醇+3.0 mL DPPH溶液的吸光度;Ai为0.1 mL待测液+3.0 mL DPPH溶液的吸光度。
由上面公式计算清除率,清除率越大抗氧化能力就越强。
2.4蕨菜多糖对·OH的抑制率[12]
按照Smirnof(1989)的方法,通过利用H2O2与FeSO4混合产生·OH,在体系内加入水杨酸捕捉·OH,并产生有色物质,该种物质在510 nm下有最大吸光值。
反应体系:分别在比色管中依次加入2 mmol/L FeSO45 mL,6 mmol/L H2O25 mL,6 mmol/L水杨酸-乙醇15 mL,于37℃水浴锅中保温15 min取出,并以超纯水作为参比,510 nm下测该溶液吸光度(A0),然后在该比色管中加入1 mL被测定样品,摇均匀,于37℃水浴锅中保温15 min后取出,并以超纯水作为参比,510 nm下测该溶液吸光度(Ax)。
由于多糖本身可能存在吸收光值,所以我们做一组对照试验:在比色管中依次加入2mmol/LFeSO45mL,超纯水5 mL,6 mmol/L水杨酸-乙醇15 mL,放入37℃水浴锅中保温15 min,然后在该比色管中加入1 mL被测定样品,摇均匀,于37℃水浴锅中保温15 min后取出,并以超纯水为参比,510 nm下测该溶液吸光度(Ax0)。
样品稀释:分别取蕨菜多糖提取液0.2、0.4、0.6、0.8、1.0 mL,分别加入蒸馏水0.8、0.6、0.4、0.2、0 mL,作为不同浓度的蕨菜多糖样品液,分别标示为样品1~样品5。
按下面公式计算抑制率:
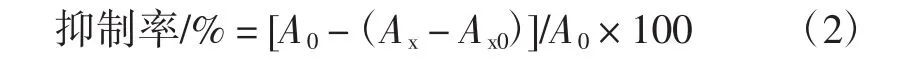
式中:A0为用蒸馏水代替样品的对照值;Ax为加样后的吸光度;Ax0为样品本身的本底值。
3结果与分析
3.1蕨菜多糖含量测定结果
根据试验所得标准曲线回归方程为A=0.070 97X-0.050 23,r=0.999 0。
式中:A为吸光度;X为浓度,mg/mL。
计算样品液浓度,结果如下:
在485 nm下测得蕨菜多糖提取液的吸光度Y= 0.473,根据上述公式计算得到:蕨菜多糖提取液的浓度为245.751 7 μg/mL。
3.2蕨菜多糖对细菌的抑制
蕨菜多糖对金黄色葡萄球菌的影响见图1。

图1蕨菜多糖对金黄色葡萄球菌的抑制图片Fig.1 Inhibition of picture pteridium revolutum polysaccharide on Staphylococcus aureus
其中a无菌水对照培养皿和b空白对照培养皿金黄色葡萄球菌长势良好,说明蘸无菌水的纸片对金黄色葡萄球菌的生长无较大的影响,c多糖样品培养皿中加入蘸有蕨菜多糖的纸片进行培养,最终没有培养出现金黄色葡萄球菌,说明蕨菜多糖对金黄色葡萄球菌的生长有较好的抑制作用。
蕨菜多糖对大肠杆菌的影响见图2。

图2蕨菜多糖对大肠杆菌的抑制图片Fig.2 Inhibition of picture pteridium revolutum polysaccharide on E. Coli
其中a无菌水对照培养皿、b空白对照培养皿大肠杆菌长势良好,说明蘸有无菌水的纸片对大肠杆菌的生长无较大的影响,c多糖样品培养皿中加入蘸有蕨菜多糖的纸片进行培养,最终没有培养出现大肠杆菌,说明蕨菜多糖对大肠杆菌有较好的抑制作用。
蕨菜多糖对枯草芽孢杆菌的影响见图3。
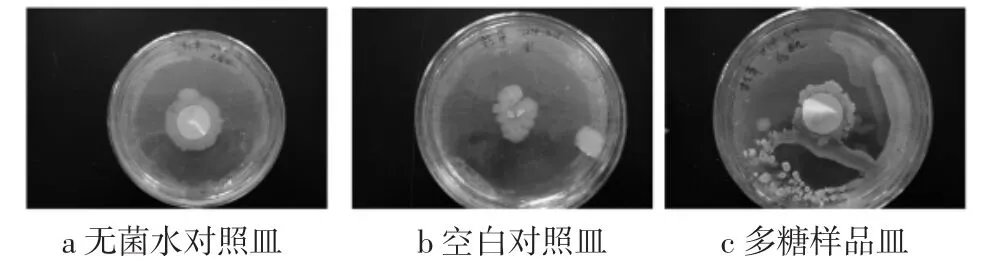
图3蕨菜多糖对枯草芽孢杆菌的抑制图片Fig.3 Inhibition of picture pteridium revolutum polysaccharide on Bacillus subtilis
其中a无菌水对照培养皿和b空白对照培养皿枯草芽孢杆菌长势良好,说明蘸有无菌水的纸片对枯草芽孢杆菌的生长无较大的影响,c多糖样品培养皿中加入蘸有蕨菜多糖的纸片进行培养,没有培养出枯草芽孢杆菌,说明蕨菜多糖对枯草芽孢杆菌有抑制作用。
综上所述,在料液比为1∶100(g/mL),超声波清洗机功率70 %(420 W),温度35℃,时间为50 min温度为60℃的条件下提取出来的蕨菜多糖提取液对金黄色葡萄球菌、大肠杆菌和枯草芽孢杆菌均有较好的抑菌作用。
3.3蕨菜多糖对DPPH自由基的清除率
由于DPPH在有机溶剂中是一种比较稳定的自由基,呈紫色,而且在517 nm处有强吸收光值,并在有自由基清除剂存在时,DPPH的孤电子被配对,溶液颜色变浅,在517 nm波长处的吸光度也变小,而且这种颜色变浅的程度与配对的电子数成一定化学计量关系。因此,可以通过在517 nm波长处吸光度的测定来评价该色素对DPPH自由基的清除率。
取已稀释好的蕨菜多糖提取液0.1 mL,测量其对DPPH自由基的清除率,测得Ac=0.732,根据公式(1)计算清除率,其结果如表1。
蕨菜多糖对DPPH自由基的清除率见图4。
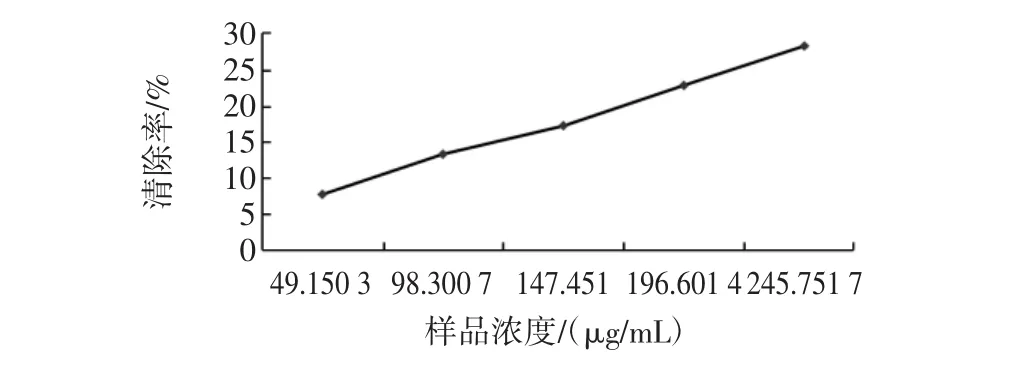
图4蕨菜多糖对DPPH自由基的清除率折线图Fig.4 Pteridium revolutum polysaccharide on DPPH free radical clearance line chart
由表1和图4可知,蕨菜多糖提取液对DPPH·具有较好的清除作用,且在提取液浓度为49.150 3 μg/mL 到245.751 7 μg/mL范围内,蕨菜多糖的浓度与DPPH自由基清除效果呈正相关,在浓度为245.751 7 μg/mL时,清除效果最好,达到28.42 %。
3.4蕨菜多糖对·OH抑制作用的效果
取已稀释好的蕨菜多糖溶液,测量其对·OH抑制作用,根据公式(2)计算抑制率,其结果如表2。
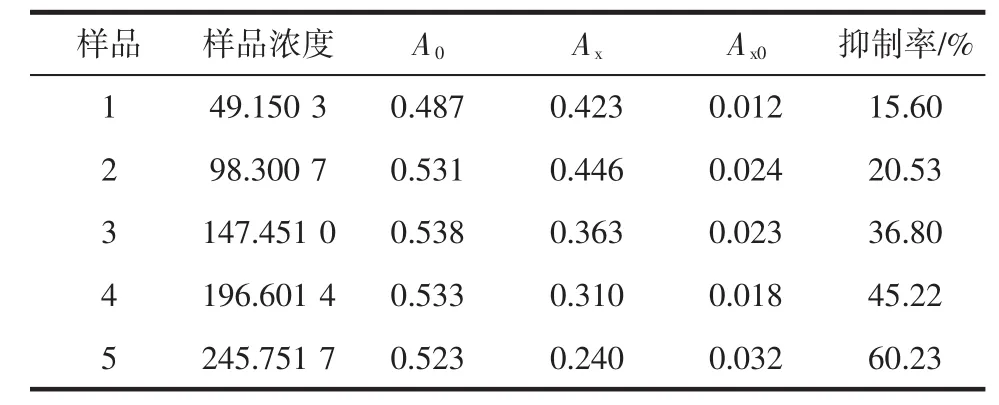
表2蕨菜多糖对·OH抑制作用的效果Table 2 Pteridium revolutum polysaccharide of·OH inhibition effect
蕨菜多糖对·OH抑制效果见图5。
从表2和图5可以看出蕨菜多糖提取液对羟基自由基也有抑制作用,且在提取液浓度为49.1503μg/mL 到245.751 7 μg/mL范围内,是随着浓度的增大,抑制率也增大,呈正相关,当浓度为245.751 7 μg/mL时,抑制率达到最大且为60.23 %。
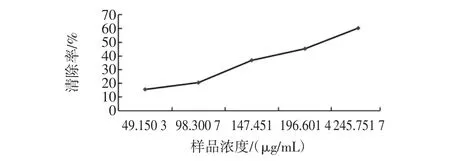
图5蕨菜多糖对·OH抑制作用的效果Fig.5 Pteridium revolutum polysaccharide of·OH inhibition effect
4 结论
试验对通过超声波提取的蕨菜多糖溶液的抗氧化性和抑菌作用进行研究。结果表明蕨菜多糖提取液对金黄色葡萄球菌、大肠杆菌和枯草芽孢杆菌均有抑菌作用,这与唐巧玉等[13](2008)关于蕨菜多糖抑菌能力的研究结果一致。且不同浓度的蕨菜多糖对清除DPPH自由基和抑制·OH都有明显的效果,且在一定的浓度范围内,蕨菜多糖的浓度与DPPH自由基的清除率和·OH的抑制率呈正相关。这为六盘水野生蕨菜资源的功能研究及进一步开发利用提供参考。
参考文献:
[1]张耀,郭衍银,王相友.野生蕨菜研究进展[J].长江蔬菜(学术版), 2008,9(18):1-4
[2]黄劲松,何竞旻,刘廷国.蕨菜研究进展综述[J].食品工业科技, 2011,32(7):455-457
[3]韩宏义,白鹏,迟鹤.多糖的研究进展[J].农业科技与信息,2008,4 (4):79-80
[4]余荣珍,柏华,王勤.信阳地区蕨菜的营养成分分析[J].信阳农业高等专科学校学报,2002, 12(1):20-21
[5]刘建本,张克梅,易海峰.几种野菜部分营养元素的测定及营养价值[J].食品科学,1993,1(11):61-62
[6]谭萍,张萍,王玉珠,李红宁.荞麦多糖的提取方法及含量测定[B].湖北农业科学,2008,47(8):954-956
[7]陈天寿.微生物培养基的制造与应用[M].北京:中国农业出版社, 1995:250-299
[8]胡东良,林雁春,刘佩红.乳及乳制品中金黄色我葡萄球菌的分布及其理化特性研究[J].食品科学,1996,17(1):69-73
[9]方允中,郑荣梁.自由基生物学的理论与应用[M].北京:科学出版社,2002:56-68
[10]张燕平.天然蜂胶对自由基的清除作用[J].食品与发酵工业,2002, 28(1):48-52
[11]谭萍,方玉梅,张春生,等.苦荞种子黄酮类化合物清除DPPH自由基的作用[J].食品研究与开发,2008(12):20-23
[12]汪河滨,白红进,王金磊,等.黑果枸杞色素清除自由基活性的研究[J].食品研究与开发,2006,27(11):8-10
[13]唐巧玉,朱玉昌,周毅峰,蕨菜中多糖含量及其活性分析[J].食品工业,2008,35(2):20-21
Study on Biological Activity of Polysaccharide in Liupanshui Wild Pteridium Revolutum
FANG Yu-mei,WANG Yi-hong,ZHANG Ping,TAN Ping,WANG Pan
(Liupanshui Normal College,Shuicheng 553004,Guizhou,China)
Abstract:The experimental determination of the antimicrobial effected by slip method,and the antioxidant ability by salicylic acid colorimetric method and DPPH method,to evaluate the biological activity of polysaccharide in Liupanshui wild pteridium revolutum. The results showed that:the polysaccharide in Liu Panshui wild pteridium revolutum had bacteriostasis to Staphylococcus aureus,Escherichia coli and Bacillus subtilis. Different concentrations of polysaccharide in Liupanshui wild pteridium revolutum had obvious effect scavenging rate of DPPH free radical and inhibition rate of·OH. And in a certain range of dilution,scavenging rate of DPPH free radical and inhibition rate of·OH,was positively related to concentration of polysaccharide in Liupanshui wild pteridium revolutum. To provide reference for further development and utilization of polysaccharide in Liupanshui wild pteridium revolutum.
Key words:pteridium revolutum;polysaccharide;bacteriostasis;DPPH free radical;·OH
收稿日期:2014-09-23
DOI:10.3969/j.issn.1005-6521.2016.02.009
作者简介:方玉梅(1982—),女(布依),副教授,硕士研究生,从事植物生理学与分子生物学的教学与研究。
基金项目:六盘水师范学院自然科学科研计划(lpssy201204);植物学省级重点支持学科(黔学位合字ZDXK[2014]24号)
