悬浮物对褐牙鲆抗氧化酶活性及相关基因表达的影响
2016-03-17肖广侠徐文远贾磊郑德斌韩现芹陈春秀
肖广侠,徐文远,贾磊,郑德斌,韩现芹,陈春秀
1. 天津渤海水产研究所,天津 300457 2. 临沂市罗庄区水务局,临沂 276000 3. 临沂出入境检验检疫局,临沂 276034
悬浮物对褐牙鲆抗氧化酶活性及相关基因表达的影响
肖广侠1,2,徐文远3,贾磊1,*,郑德斌1,韩现芹1,陈春秀1
1. 天津渤海水产研究所,天津 300457 2. 临沂市罗庄区水务局,临沂 276000 3. 临沂出入境检验检疫局,临沂 276034
为探究褐牙鲆(Paralichthys olivaceus)幼鱼抗氧化系统酶活力及相关基因表达在悬浮物胁迫下的变化情况,设计了浓度为5 000、10 000 mg·L-1悬浮物水体对褐牙鲆(14.53 cm±1.58 cm)肌肉、肝脏、鳃及血液总超氧化物歧化酶(T-SOD)、谷胱甘肽转移酶(GST)、过氧化氢酶(CAT)酶活力及SOD2、GST、CAT的mRNA转录水平表达变化情况。结果显示:在悬浮物胁迫24 h或者48 h时,4种组织3种酶活力具有升高的趋势(P<0.05);4种组织的T-SOD酶活力在96 h均高于对照组(P<0.05),肌肉、鳃丝及血液中SOD2基因相对表达量96 h实验组低于对照组(P<0.05);肌肉中CAT酶活力呈现先升高再降低趋势,鳃中CAT基因相对表达量呈现先降低、再升高、再降低的趋势;肝脏、鳃、血液中GST酶活力在悬浮物胁迫下呈现升高趋势,4种组织GST基因相对表达量在12~24 h时呈现升高趋势。研究表明:悬浮物对褐牙鲆抗氧化酶活力及相关基因的表达具有一定的影响,血液中3种酶活力变化幅度最大,鳃中3种基因相对表达水平变化幅度最大,这与血液及鳃参与呼吸作用过程有关;抗氧化酶活性及基因相对表达变化趋势并不完全一致。本研究可为揭示褐牙鲆应对悬浮物胁迫的耐受机制及褐牙鲆耐悬浮物品种选育提供基础数据。
悬浮物;褐牙鲆;抗氧化系统酶;基因表达
Received 20 April 2016 accepted 18 June 2016
褐牙鲆(Paralichthys olivaceus)隶属于鲽形目(Pleuronectiformes)、牙鲆科(Paralichthyidae)、牙鲆属(Paralichthys),是肉食性底栖鱼类,在发育中有变态过程。褐牙鲆主要分布于中国以及朝鲜、日本沿岸水域,是我国重要的海水增养殖品种[1]。近几年来,随着我国海洋经济的发展,港口码头建设、桥梁建设、填海造地及疏浚倾废等海洋工程越来越多,其施工过程中不可避免地产生水体底泥悬浮,造成附近海域悬浮物浓度大幅度升高,改变了水域的物理、化学环境[3],这对于海洋生物尤其是苗种的存活产生了显著的影响,生物机体如何对悬浮物的升高做出反应,在这方面报告较少。抗氧化系统酶是生物体内应对不利环境条件的重要物质,在生物处于不适宜的生存条件下,抗氧化系统各种酶的活力会发生变化,来应对外界的环境条件,这对环境污染有一定的生物指示作用[4]。目前针对胁迫褐牙鲆抗氧化系统酶活力的因子研究主要集中于重金属及环境因子[5-13],悬浮物对水产动物抗氧化系统酶的影响方面见于菲律宾蛤仔[14]及四角蛤蜊[15],蒋玫等[16]研究了底泥浸出液对脊尾白虾抗氧化解毒酶及相关基因表达的影响,但悬浮物对褐牙鲆抗氧化酶活性及相关基因方面的研究尚无报道。
针对以上2种情况,本实验以2种规格褐牙鲆幼鱼为实验材料,研究肌肉、鳃、肝脏及血液在2种悬浮物浓度下总超氧化物歧化酶(T-SOD)、谷胱甘肽S转移酶(GST)、过氧化氢酶(CAT)酶活力及SOD2、GST、CAT的mRNA转录水平表达变化情况,分析了褐牙鲆幼鱼底泥悬浮物的耐受免疫调节机制,以期为褐牙鲆的抗逆品种选育及增殖放流区域选择提供理论依据,为进一步评估海洋工程对养殖生物的损害情况提供参考依据。
1 材料与方法(Materials and methods)
1.1 实验材料
1.1.1 实验鱼
实验用褐牙鲆幼鱼取自于天津市兴盛水产有限公司。幼鱼体长14.53 cm±1.58 cm。挑选健康、活泼、大小均匀的个体用于实验。
1.1.2 实验用水
实验用水为高盐卤水与淡水混合溶液,经过沉淀、砂滤、次氯酸钠消毒、筛绢过滤等处理。水温为(22±1) ℃;盐度为25~28;pH为8.0~8.2;溶解氧(OD)为5.8~7.5 mg·L-1;NH4-N为0.012~0.248 mg·L-1;NO2-N为0.005~0.011 mg·L-1;NO3-N为0.287~0.363 mg·L-1;PO4-P为0.012~0.025 mg·L-1。
1.1.3 实验底泥
实验用悬浮物泥样采自天津大神堂海域(117°55′18″E;39°09′01″N,位于汉沽浅海生态系统海洋特别保护区,在整个保护区内具有代表性)的底泥表层,实验室内通风晾干,然后放于烘箱中(80 ℃)烘干至恒重,冷却后研磨处理,用100目筛绢过筛,放置于干燥器中低温保存。实验所用沉积物中各成分含量检测参照《海洋监测规范》(GB17378—2007)进行,分析结果见表1。其主要成分含量均符合《海洋监测规范》(GB 18668—2002)一类要求,不会对受试生物产生毒害作用。
1.2 实验方法
1.2.1 含悬浮物的悬浊液的配制方法
将烘干泥样与海水按所需浓度配制出含悬浮物的悬浊液,实验前充分搅拌,使底泥充分悬浮。
1.2.2 悬浮物粒径的测量
悬浮物粒径使用维纳2008D激光粒度仪测量,底泥粒径X80=12.70 μm,粒径X<5 μm=29.98%,具体粒度特征见表2。
1.2.3 暴露实验设计
暴露实验参照国家标准水质-物质对淡水鱼(斑马鱼)急性毒性测定方法[5]进行,褐牙鲆幼鱼暂养24 h后开始实验,含悬浮物的悬浊液浓度设置为5 000、10 000 mg·L-1,每个浓度均设置5个平行组,另外设置相应的对照组(不加泥样)。实验容器为15 L透明整理箱,每个整理箱加入各浓度含悬浮物的悬浊液10 L,放入实验鱼4尾,整个实验过程不投饵。采用充气及人工定时搅拌等方法,使底泥始终处于悬浮状态。实验期间不换水。悬浮物胁迫后24、48、72、96 h分别从每个实验组随机挑选3尾幼鱼取样。
1.2.4 样品处理
剪取褐牙鲆幼鱼鳃、背部肌肉及肝脏按照 1:10(W/V)加入预冷磷酸缓冲液(PBS)(pH 6.4)放置冰上以玻璃匀浆器匀浆,离心(4 ℃、800 g、10 min)取上清液置-80 ℃冰箱保存,抽取褐牙鲆幼鱼心脏血液并加入抗凝剂,用于T-SOD、GST、CAT抗氧化酶活性的测定,将鳃、背部肌肉、肝脏及心脏血液样本于-80 ℃冰箱保存,用于抗氧化酶相关基因表达的测定。
1.2.5 抗氧化酶活性的测定
T-SOD、GST、CAT酶活力测定均根据试剂盒说明书进行(试剂盒购自南京建成生物工程研究所)。其中37 ℃时,每分钟每毫克组织蛋白使反应体系的吸光度(OD)值每增加0.01时,定义为1个总抗氧化能力(T-SOD)单位;每毫克组织蛋白质,每分钟扣除非酶反应的作用,使反应体系中GSH浓度降低1 μmol·L-1为一个GST酶活力单位;每毫克组织蛋白每秒钟分解1 μmol的H2O2的量为1个CAT活力单位[17]。所有指标吸光值均使用UV-7504单光束紫外可见分光光度计测定。

表1 实验底泥主要成分含量Table 1 Contents of main components of the studied sediment
注:数据委托农业部渔业环境及水产品质量监督检验测试中心(天津)检测。Note: The data was provided by the Fisheries Environment and Aquatic Products Quality Supervision and Testing Center of Ministry of Agriculture (Tianjin).
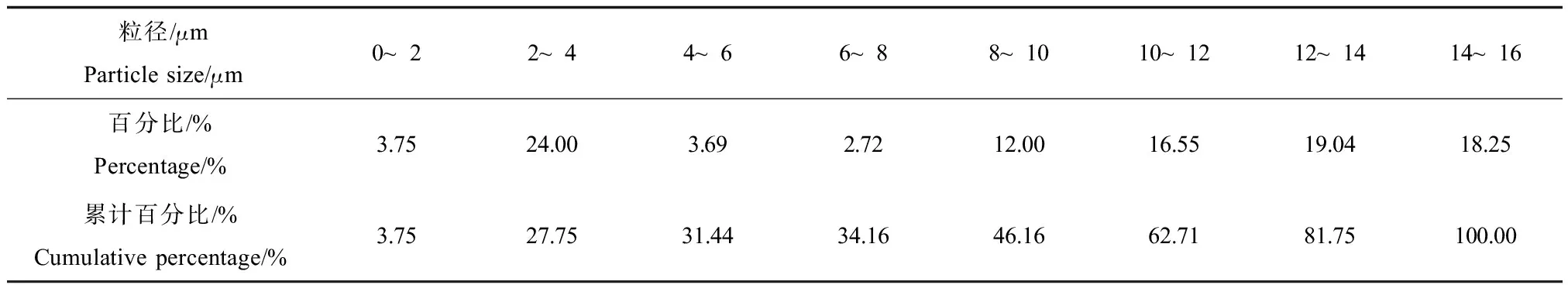
表2 实验用底泥粒径特征Table 2 Particular size distribution of the sediment used in the experiment
1.3 抗氧化酶基因的表达
1.3.1 引物设计
根据褐牙鲆SOD2、CAT、GST的cDNA序列,以Primer 5.0设计Real-time PCR扩增特异性引物,选择基因稳定表达及片段大小适合的β-actin为内参基因,引物序列详见表3。引物合成和cDNA序列测定委托上海生工生物工程有限公司完成。
1.3.2 总RNA提取cDNA第一链的合成
将保存于-80 ℃冰箱的样品取出后于冰上融化,并按照TRIZOL试剂说明书提取总RNA,RNA沉淀用RNAase的纯水溶解,用核酸定量仪(Thermo Scientific)测定260 nm和280 nm处的吸收值,检测RNA的产量和纯度,并使用1%琼脂糖凝胶进行RNA非变性电泳检测RNA的完整性。取等量(2 μg)的RNA,按照All-in-OneTMFirst-Strand cDNA Synthesis Kit (GeneCopoeia Cat. No. AORT-0050)说明书反转录各组织的总RNA,合成cDNA第一链。
1.3.3 Real-time PCR扩增
采用Real-time PCR(SYBR Green)2-△△Ct相对定量方法,按照Platinum®SYBR®Green qPCR SuperMix-UDG试剂盒说明书进行操作,反应体系如下:反应总体积共20 μL,SYBR®Premix Ex Super Mix (2×) 10.0 μL,Forward primer (10 μmol·L-1) 2.0 μL,Reverse primer (10 μmol·L-1) 2.0 μL,cDNA 1.0 μL,dd H2O 5.0 μL。将样品在PCR管内混匀后分装入96孔PCR板(Axygen)中,瞬时离心后放入ABI7500荧光定量PCR仪中进行PCR扩增,反应程序为:95 ℃预变性10 min;循环条件为95 ℃、15 s,60 ℃、30 s,72 ℃、30 s,共40个循环;熔解曲线条件为95 ℃、15 s,60 ℃、1 min,95 ℃、15 s,60 ℃、15 s。反应完成后,用ABI 7500 system分析软件分析结果。
1.3.4 Comparative Delta-delta Ct相对定量
由标准曲线可知,目的基因与内参扩增效率基本一致,均在95%以上,符合Comparative Delta-delta Ct相对定量计算要求,Comparative Delta-delta Ct相对定量参考Livak和Schmittgen的方法[18],计算公式如下:
目的基因的表达量定义为:待测样品与对照组表达差异倍数(Fold change)。
Fold change=2-ΔΔCt。
1.4 实验数据的处理
数据统计使用统计学软件SPSS 22.0进行,所得数据均以平均值±标准差(x±SD)表示,使用单因素方差分析ANOVA进行显著性检验(P<0.05)。
2 结果与分析(Results and analysis)
2.1 悬浮物胁迫对褐牙鲆幼鱼T-SOD酶及相关基因表达的影响
悬浮物对褐牙鲆幼鱼不同组织T-SOD酶活力及相关基因表达的影响见图1、图2,T-SOD酶活力以SOD2的mRNA表达为介导,随着悬浮物浓度的不同和胁迫时间的改变,这些指标都有显著变化。实验结果表明:肌肉及鳃中T-SOD酶活力呈现先升高、再降低、再升高的趋势,在10 000 mg·L-1实验组,鳃、背部肌肉、肝脏及心脏血液这4种组织的T-SOD酶活力在96 h达到峰值,与对照组差异显著(P<0.05),4种组织酶活性由高到低排序为,肝脏、血液、鳃及肌肉。在5 000 mg·L-1实验组,肝脏及鳃中SOD2基因相对表达量呈现先降低、再升高、再降低的趋势,分别在48 h、72 h达到峰值(P<0.05),在10 000mg·L-1实验组,鳃及血液中SOD2基因相对表达量呈现先降低、再升高、再降低的趋势,在72 h达到峰值(P<0.05)。

表3 Real-time PCR扩增的特异性引物Table 3 Primers used for real-time PCR amplification

图1 褐牙鲆不同组织T-SOD活性随悬浮物胁迫时间的变化注:A,肌肉;B,肝脏;C,鳃丝;D,血液。*表示与对照组相比差异显著(P<0.05)。Fig. 1 Changes of total superoxide dismutase activity in different P. olivaceus tissues after exposure to suspended substances (SS) stressNotes: A, Muscle; B, Livers; C, Gill; D, Blood. * means significant difference between SS stress groups and control group at 0.05 level.

图2 褐牙鲆不同组织SOD2基因相对表达量随悬浮物胁迫时间的变化注:A,肌肉;B,肝脏;C,鳃丝;D,血液。*表示与对照组相比差异显著(P<0.05)。Fig. 2 Changes of superoxide dismutase 2 gene expression in different P. olivaceus tissues after exposure to SS stressNotes: A, Muscle; B, Livers; C, Gill; D, Blood. * means significant difference between SS stress groups and control group at 0.05 level.
2.2 悬浮物胁迫对褐牙鲆CAT酶及相关基因表达的影响
悬浮物对褐牙鲆幼鱼不同组织CAT酶活力及相关基因表达的影响见图3、图4,CAT酶活力以CAT的mRNA表达为介导,随着悬浮物浓度的不同和胁迫时间的改变,这些指标都有显著变化。实验结果表明:在5 000 mg·L-1实验组,肝脏及血液中CAT酶活力均高于对照组(P<0.05),分别在24 h及48 h达到峰值,在10 000 mg·L-1实验组,肌肉和血液中CAT酶活力呈现先升高、再降低的趋势。在5 000 mg·L-1实验组,肌肉及肝脏中CAT基因表达量在24至72 h呈现先升高、再降低的趋势,并且在24 h达到峰值(P<0.05),在10 000 mg·L-1实验组,在肝脏及鳃中CAT基因表达量在48 h达到峰值(P<0.05)。
2.3 悬浮物胁迫对褐牙鲆GST酶及相关基因表达的影响
悬浮物对褐牙鲆幼鱼不同组织GST酶活力及相关基因表达的影响见图5及图6,GST酶活力以GST的mRNA表达为介导,随着悬浮物浓度的不同和胁迫时间的改变,这些指标都有显著变化。实验结果表明:肝脏、鳃及血液中实验组GST酶活力高于对照组(P<0.05),24至72 h肌肉中实验组GST酶活力高于对照组(P<0.05)。24至48 h 4种组织GST基因相对表达量,实验组高于对照组(P<0.05),分别在24 h或者48 h达到峰值(P<0.05),在5 000 mg·L-1实验组,肝脏及鳃中GST基因相对表达量呈现先升高、再降低、再升高的趋势,并且在24 h达到峰值(P<0.05)。
3 讨论(Discussion)
活性氧主要包括超氧阴离子(O2-·)、羟自由基和H2O2,其中超氧阴离子的寿命最长[19]。适量的活性氧对机体具有一定的保护作用,但过量的活性氧可导致氧化胁迫[20]。体内抗氧化系统由非酶类及酶促体系组成,后者包括过氧化氢酶、过氧化物还原酶等,机体通过抗氧化系统清除过量的活性氧,保护各组织免受氧化损伤[21]。
3.1 悬浮物对褐牙鲆总超氧化物歧化酶(T-SOD)活力及相关基因的影响
SOD能催化超氧化物阴离子自由基(O2-·)发生歧化反应,能及时清除生物体内的O2-·自由基,避免·OH的产生,避免机体受损伤,是机体内唯一以O2-·为底物的酶,在清除生物体内有害物质时发挥着重要的作用。已有研究表明,当生物体受到轻度逆境胁迫时,SOD活性往往升高;而当受到重度逆境胁迫下,SOD活性通常降低,使生物体内积累过量的活性氧,从而导致生物体的损伤[22-24]。

图3 褐牙鲆不同组织CAT活性随悬浮物胁迫时间的变化注:A,肌肉;B,肝脏;C,鳃丝;D,血液。* 表示与对照组相比差异显著(P<0.05)。Fig. 3 Changes of catalase activity in different P. olivaceus tissues after exposure to SS stressNotes: A, Muscle; B, Livers; C, Gill; D, Blood. * means significant difference between SS stress groups and control group at 0.05 level.

图4 褐牙鲆不同组织CAT基因相对表达量随悬浮物胁迫时间的变化注:A,肌肉;B,肝脏;C,鳃丝;D,血液。* 表示与对照组相比差异显著(P<0.05)。Fig. 4 Changes of catalase relative gene expression in different P. olivaceus tissues after exposure to SS stressNotes: A, Muscle; B, Livers; C, Gill; D, Blood. * means significant difference between SS stress groups and control group at 0.05 level.
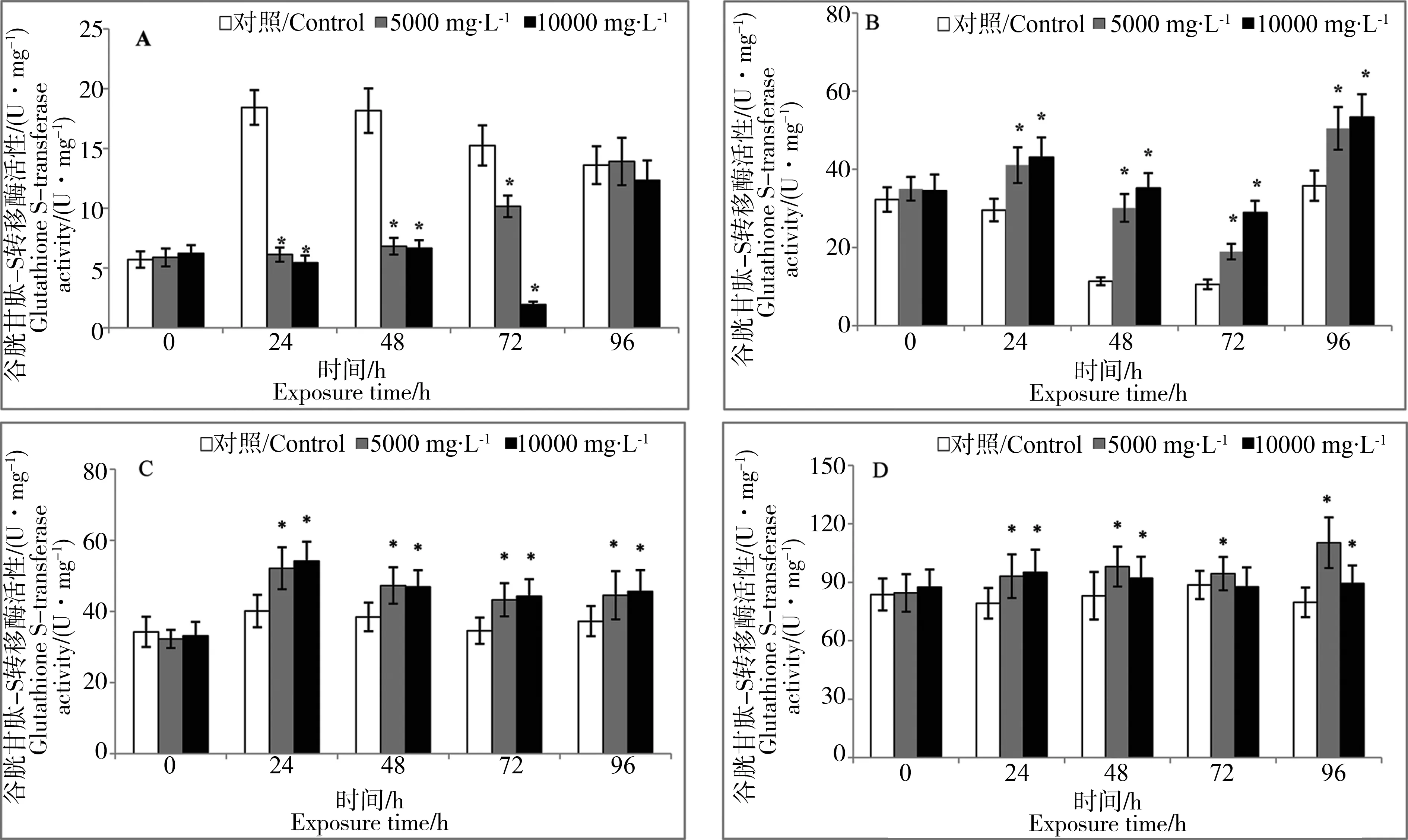
图5 褐牙鲆不同组织GST活性随悬浮物胁迫时间的变化注:A,肌肉;B,肝脏;C,鳃丝;D,血液。* 表示与对照组相比差异显著(P<0.05)。Fig. 5 Changes of glutathions S-transferase activity in different P. olivaceus tissues after exposure to SS stressNotes: A, Muscle; B, Livers; C, Gill; D, Blood. * means significant difference between SS stress groups and control group at 0.05 level.
图6 褐牙鲆不同组织GST基因相对表达量随悬浮物胁迫时间的变化注:A,肌肉;B,肝脏;C,鳃丝;D,血液。* 表示与对照组相比差异显著(P<0.05)。Fig. 6 Changes of glutathions S-transferase relative gene expression in different P. olivaceus tissues after exposure to SS stressNotes: A, Muscle; B, Livers; C, Gill; D, Blood. * means significant difference between SS stress groups and control group at 0.05 level.
本研究中对褐牙鲆4种组织的T-SOD酶活性进行研究,肌肉及鳃中T-SOD酶活力呈现先升高、再降低、再升高的趋势。开始可能是悬浮物胁迫诱导褐牙鲆肌肉及鳃中T-SOD酶活性,褐牙鲆组织反馈性增强抗氧化系统酶活力,以清除多余的活性氧;4种组织T-SOD酶活性在96 h达到峰值,4种组织酶活性大小不同,最高为肝脏,依次为血液、鳃,最后为肌肉,这可能与不同组织的功能定位有关。由于活性氧伴随物质代谢过程而产生,因此代谢强度愈大,产生的活性氧越多。肝脏是鱼类最主要的代谢器官,也是蛋白质、脂类等营养物质的代谢中心,需要更强的抗氧化体系清除肝脏中的多余活性氧,因此肝脏中T-SOD酶活性高于其他3种组织。T-SOD酶活性及基因表达在受到悬浮物胁迫后,4种组织中T-SOD酶活力在开始的24或者48 h内存在一定增加的倾向,这与Stebbing提出的“毒物兴奋效应”表现类似[25]。但是胁迫时间过长,如肌肉及鳃中T-SOD酶活力在72 h呈现下降趋势,实验组低于对照组,表明长时间悬浮物胁迫可能对褐牙鲆抗氧化系统酶活力产生抑制作用。
悬浮物胁迫能引发多种动物响应,包括调控基因表达。在转录水平上研究基因表达与动物抗氧化性的关系,能对抗氧化酶激活机制有更深入地了解,而不仅仅停留在酶活性方面,抗氧化酶活性的变化可能是由于相关基因的上调或下调引起的。实验组的鳃、5 000 mg·L-1实验组的肝脏及10 000 mg·L-1实验组的血液中SOD2基因相对表达量呈现先降低、再升高、再降低的趋势,分别在48 h、72 h达到峰值(P<0.05),这与组织中T-SOD酶活力的变化趋势不一致,推测原因如下:第一、mRNA水平与蛋白水平不一定完全一致,可能有时间上的差异;第二、检测蛋白的方法干扰有很多,检测方法的灵敏度不一样也有可能造成差异;第三、mRNA的表达与蛋白的表达水平的线性关系只有0.4~0.5左右,因为影响蛋白质半衰期的因素很多,mRNA转录后的调控、各种翻译后的修饰等都可能延长或者缩短其半衰期[26]。
3.2 悬浮物对褐牙鲆过氧化氢酶(CAT)活力及相关基因的影响
CAT能及时清除机体内的H2O2,阻断可产生活性极高的羟自由基(·OH)的Haber-Weiss反应[26],在外源因子胁迫下会造成细胞膜损伤和膜透性增加,最后使CAT活性下降,而细胞内H2O2的水平保持稳定或增加[26]。污染环境条件下,为减轻污染因子对机体伤害,生物体可调节抗氧化水平来清除机体中活性氧[27],·OH在体内具有极大危害性,SOD和CAT广泛存在于生物体的各种组织中[27]、能及时清除体内的·OH,它们在及时清除O2-·和H2O2的过程中占有重要地位,对阻断·OH的生成具有重要意义。
在5 000 mg·L-1实验组,肝脏及血液中CAT酶活力均高于对照组,表明在悬浮物胁迫下,褐牙鲆体内H2O2及羟自由基(·OH)的浓度升高,对生物体正常的体内环境造成了不利影响,为消除羟自由基(·OH)对生物体的损伤,褐牙鲆肝脏及血液中CAT酶活力被诱导,及时清除体内过多的羟自由基(·OH),这与国内其他研究人员的结果基本一致[28-29]。10 000 mg·L-1肌肉和血液中CAT酶活力呈现先升高、再降低的趋势,这与Stebbing提出的“毒物兴奋效应”表现类似[25]。短时间胁迫会诱导褐牙鲆幼鱼体内的CAT酶活力,产生较多的CAT酶,来减轻悬浮物胁迫因子对机体的伤害,清除体内由于悬浮物胁迫产生的过多活性氧。当胁迫时间超过一定的限度,有可能是褐牙鲆适应了胁迫环境,也可能是过长时间胁迫超过了褐牙鲆的耐受限度,造成了褐牙鲆CAT酶活力的下降。
在5 000 mg·L-1实验组的肌肉及肝脏中CAT基因表达量在24至72 h呈现先升高、再降低的趋势,并且在24 h达到峰值(P<0.05),这与Stebbing提出的“毒物兴奋效应”表现类似[25]。短时间胁迫会诱导褐牙鲆幼鱼体内的CAT基因相对表达量,产生较多的CAT酶,来减轻悬浮物胁迫因子对机体的伤害,清除体内由于悬浮物胁迫产生的过多活性氧。当胁迫时间超过一定的限度,有可能是褐牙鲆适应了胁迫环境,也可能是过长时间胁迫超过了褐牙鲆的耐受限度,造成了褐牙鲆CAT基因相对表达量的下降。5 000 mg·L-1实验组,肌肉中CAT酶活力与基因相对表达量变化趋势一致,都是呈现先升高、再降低的趋势。在悬浮物胁迫下,机体大量活性氧产生,致使CAT的基因的mRNA转录水平表达量迅速增加。但随着适应性地逐步增强,活性氧物质伴随代谢过程而产生,因此活性氧的量值下降,CAT酶参与氧代谢的量也逐步下降,使得表达量有所降低。CAT酶活性的升高,依赖基因转录与蛋白质合成。
3.3 悬浮物对褐牙鲆抗氧化酶(GST)活力及相关基因的影响
谷胱甘肽转移酶(GST)也是生物体内解毒酶系统的重要组成部分之一。GST参与机体的解毒代谢和抗氧化等过程,在生物体对内源性和外源性有毒物质的降解过程中均起着重要作用,其主要功能是催化谷胱甘肽(GSH)的巯基与一些亲电子类有毒物质(如杀虫剂、醌类化合物、α, β-不饱和羰基化合物及过氧化物等)进行轭合反应,从而保护一些蛋白质免受损伤,达到解毒目的[30-31]。
在本研究中,肝脏、鳃及血液中实验组GST酶活力高于对照组(P<0.05),24至72 h实验组的肌肉中GST酶活力高于对照组(P<0.05),表明在悬浮物的胁迫下,机体内产生了有毒物质(过氧化物),为消除有毒物质对生物体的损伤,4种组织中的GST酶活力被诱导,从而保护机体内的一些蛋白质不受损伤,这与蒋玫等[16]研究底泥浸出液对脊尾白虾CAT影响的结果一致。血液中GST酶活力显著高于其他3种组织,表明GST酶主要在血液中发挥消除有毒物质的功能。24至48 h 4种组织GST基因相对表达量,实验组高于对照组(P<0.05),分别在24 h或者48 h达到峰值(P<0.05),表明GST酶活力与基因相对表达水平在24至48 h变化趋势一致,在72、96 h 4种组织GST酶活力与GST基因相对表达变化趋势不一致,表明随着悬浮物胁迫时间增长,不同组织中GST基因相对表达产生了差异,这与不同组织的功能有关。鳃中GST基因相对表达水平高于其他3种组织,表明鳃对悬浮物胁迫的反应较为灵敏,悬浮物可影响水体生物的呼吸作用,而鳃作为呼吸的主要器官,反应最为灵敏。
[1] 王波, 张朝晖, 左言明, 等. 牙鲆属主要经济鱼类的生物学及养殖研究概况[J]. 海洋水产研究, 2004, 25(5): 86-92
Wang B, Zhang Z H, Zuo Y M, et al. The research introduction to biology and farming technology of main species of Parlchthys [J]. Marine Fisheries Research, 2004, 25(5): 86-92 (in Chinese)
[2] 于炜. 渤海表层悬浮物分布变异规律的研究[D]. 北京: 中国科学院研究生院, 2011: 1-5
Yu W. Study on distribution variation of surface suspended solids in Bohai [D]. Beijing: Graduate University of Chinese Academy of Sciences, 2011: 1-5 (in Chinese)
[3] 赵奎寰译. 海洋悬浮物的化学组成及物质来源[J]. 海岸工程, 1999, 15(3): 58-63
[4] 刘硕, 周启星. 抗氧化酶诊断环境污染研究进展[J]. 生态学杂志, 2008, 27(10): 1791-1798
Liu S, Zhou Q X. Research advances in antioxidant enzymes for diagnosing environmental contamination [J]. Chinese Journal of Ecology, 2008, 27(10): 1791-1798 (in Chinese)
[5] 王凡, 赵元凤, 吕景才, 等. 铜对牙鲆CAT、SOD和GSH-PX活性的影响[J]. 华中农业大学学报, 2007, 26(6): 836-838
Wang F, Zhao Y F, Lv J C, et al. Effect of Cu2+on CAT, SOD, GSH-PX of Paralichthys olivaceus [J]. Journal of Huazhong Agricultural University, 2007, 26(6): 836-838 (in Chinese)
[6] 王凡, 赵元凤, 刘长发. Cu2+对牙鲆肌肉抗氧化防御系统的影响[J]. 淡水渔业, 2007, 37(2): 27-29
Wang F, Zhao Y F, Liu C F. Effect of Cu2+on the antioxidative defense in muscle of Paralichthys olivaceus [J]. Freshwater Fisheries, 2007, 37(2): 27-29 (in Chinese)
[7] Huang W, Cao L, Ye Z J, et al. Antioxidative responses and bioaccumulation in Japanese flounder larvae and juveniles under chronic mercury exposure [J]. Comparative Biochemistry and Physiology Part C: Toxicology & Pharmacology, 2010, 152: 99-106
[8] Cao L, Huang W, Liu J H, et al. Accumulation and oxidative stress biomarkers in Japanese flounder larvae and juveniles under chronic cadmium exposure [J]. Comparative Biochemistry and Physiology Part C: Pharmacology, Toxicology and Endocrinology, 2010, 151: 386-392
[9] 王茂林, 张秀梅, 黄国强, 等. 不同钙、镁浓度对褐牙鲆幼鱼生长及SOD和CAT酶活力的影响[J]. 渔业科学进展, 2010, 31(3): 29-36
Wang M L, Zhang X M, Huang G Q, et al. Effects of Ca2+and Mg2+concentrations on growth, SOD and CAT enzymatic activity of juvenile Paralichthys olivaceus [J]. Progress in Fishery Sciences, 2010, 31(3): 29-36 (in Chinese)
[10] 柳意樊. 褐牙鲆(Paralichthys olivaceus)与杂交鲆(褐牙鲆P. olivaceus♀×大西洋牙鲆P. dentatus♂)幼鱼高温耐受性研究[D]. 北京: 中国科学院大学, 2014: 66-81
Liu Y F. Study on the thermal tolerance of juvenile Paralichthys olivaceus and the hybrids P. olivaceus♀×P. dentatus [D]. Beijing: University of the Chinese Academy of Sciences, 2014: 66-81 (in Chinese)
[11] 黄伟. 汞、铅、锌对褐牙鲆(Paralichthys olivaceus)早期发育过程毒理作用的研究[D]. 北京: 中国科学院研究生院, 2010: 45-57
Huang W. Toxic effects of mercury, lead and zinc on early life stages of flounder (Paralichthys olivaceus) [D]. Beijing: Graduate School of Chinese Academy of Sciences, 2010: 45-57 (in Chinese)
[12] Lou B, Xu D D, Xu H X, et al. Effect of high water temperature on growth, survival and antioxidant enzyme activities in the Japanese flounder Paralichthys olivaceus [J]. African Journal of Agricultural Research, 2011, 6(12): 2875-2882
[13] 徐冬冬, 楼宝, 詹炜, 等. 高温胁迫对褐牙鲆生长及肝脏抗氧化酶活性的影响[J]. 水产学报, 2010, 34(7): 1100-1106
Xu D D, Lou B, Zhan W, et al. Effect of high temperature stress on growth performance and activities of antioxidant enzymes in liver of olive flounder Paralichthys olivaceus [J]. Journal of Fisheries of China, 2010, 34(7): 1100-1106 (in Chinese)
[14] 张雪, 宋伦, 杨国军, 等. 悬浮物对菲律宾蛤仔超氧化物歧化酶活力的影响[J]. 水产科学, 2013, 32(6): 328-332
Zhang X, Song L, Yang G J, et al. Effect of suspended solids on superoxide dismutase activity in Manila clam Ruditapes philippinarum [J]. Fisheries Science, 2013, 32(6): 328-332 (in Chinese)
[15] 杨国军, 宋伦, 王年斌, 等. 悬浮物对四角蛤蜊生存和氧化酶活性的影响[J]. 生态学杂志, 2013, 32(8): 2097-2103
Yang G J, Song L, Wang N B, et al. Effects of suspended solid on the survival, growth, and antioxidant enzyme activities of Mactra veneriformis [J]. Chinese Journal of Ecology, 2013, 32(8): 2097-2103 (in Chinese)
[16] 蒋玫, 李磊, 沈新强, 等. 底泥浸出液对脊尾白虾抗氧化解毒酶及相关基因表达的影响[J]. 生态环境学报, 2013, 22(7): 1182-1186
Jiang M, Li L, Shen X Q, et al. Effects of lixivium from ooze mud exposure on activity of antioxidant enzymes and related genes expression of Exopalaemon carinicauda mysis larvae [J]. Ecology and Environmental Sciences, 2013, 22(7): 1182-1186 (in Chinese)
[17] 汪家政, 范明. 蛋白质技术手册[M]. 北京: 科学出版社, 2000: 42-47
[18] Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) method [J]. Methods, 2001, 25: 402-408
[19] 文春根, 代功园, 谢彦海, 等. 铅对背角无齿蚌抗超氧阴离子能力与抑制羟自由基的影响以及可溶性蛋白分析[J]. 南昌大学学报: 理科版, 2009, 33(4): 380-384
Wen C G, Dai G Y, Xie Y H, et al. Pb2+effect on superoxide anion and scavenging hydroxyl free radical and analysis soluble protein from Anodonta woodioma [J]. Journal of Nanchang University: Natural Science, 2009, 33(4): 380-384 (in Chinese)
[20] Franco R, Sánchezolea R, Reyes-Reyes E M, et al. Environmental toxicity, oxidative stress and apoptosis: Ménage à Trois [J]. Mutation Research: Genetic Toxicology and Environmental Mutagenesis, 2009, 674(1-2): 3-22
[21] 曹亮. 铜、镉对褐牙鲆(Paralichthys olivaceus)早期发育阶段的毒理效应研究[D]. 北京: 中国科学院研究生院, 2010: 95-114
Cao L. Toxic effects of cadmium and copper to early life stages of flounder (Paralichthys olivaceus) [D]. Beijing: Graduate University of Chinese Academy of Sciences, 2010: 95-114 (in Chinese)
[22] 刘存歧, 刘丽静, 张亚娟, 等. 基于卤水的养殖用水中Ca2+/Mg2+对凡纳滨对虾生长及体内SOD和AKP的影响[J]. 水产科学, 2007, 26(2): 67-69
Liu C Q, Liu L J, Zhang Y J, et al. Effect of Ca2+/Mg2+in brine water from saltworks on growth and activities of APK and SOD in white legged shrimp [J]. Fisheries Science, 2007, 26(2): 67-69 (in Chinese)
[23] 鲁双庆, 刘少军, 刘红玉. Cu2+对黄鳝肝脏保护酶SOD、CAT、GSH-PX活性的影响[J]. 中国水产科学, 2002, 9(2): 138-141
Lu S Q, Liu S J, Liu H Y. Effects of Cu2+on activities of protecting enzymes SOD, CAT and GSH-PX in liver tissue of Monopterus albus [J]. Journal of Fishery Sciences of China, 2002, 9(2): 138-141 (in Chinese)
[24] 杨丽华, 方展强, 郑文彪. 镉对鲫鱼鳃和肝脏超氧化物歧化酶活性的影响[J]. 安全与环境学报, 2003, 3(3): 13-16
Yang L H, Fang Z Q, Zheng W B. Experiment with effect of cadmium on activity of superoxide dismutase in gill and liver tissue of crucian [J]. Journal of Safety and Environment, 2003, 3(3): 13-16 (in Chinese)
[25] Stebbing A R D. Hormesis—The stimulation of growth by low levels of inhibitors [J]. Science of the Total Environment, 1982, 22(3): 213-234
[26] Mathews M, Sonenberg N, Hershey J. Translational Controls in Biology and Medicine [M]. Cold Spring Harbor Laboratory Press, 2007: 534-546
[27] 方允中, 李文杰. 自由基与酶基础理论及其在生物学和医学上的应用[M]. 北京: 科学出版社, 1989: 129-146
Fang Y Z, Li W J. Basic Theory of Free Radical and Enzyme and Its Application in Biology and Medicine [M]. Beijing: The Science Publishing Company, 1989: 129-146 (in Chinese)
[28] 冯涛, 郑徽云, 洪万树, 等. 苯并(a)花对大弹涂鱼肝脏抗氧化酶活性影响的初步研究[J]. 应用生态学报, 2001, 12(3): 442-448
Feng T, Zheng H Y, Hong W S, et al. Effect of benzo(a)pyrene on antioxidant enzyme activities in Boleophthalmus pectinirostris liver [J]. Chinese Journal of Applied Ecology, 2001, 12(3): 442-428 (in Chinese)
[29] 沈盎绿, 马胜伟, 贾秋红. 黑鲷受铜、镉胁迫的生理反应[J]. 海洋渔业, 2007, 29(3): 23-29
Shen A L, Ma S W, Jia Q H. Research on the physiological responses of Sparus macrocephalus stressed by Cu2+and Cd2+[J]. Marine Fisheries, 2007, 29(3): 23-29 (in Chinese)
[30] Masella R, Di Benedetto R, Var I R, et al. Novel mechanisms of natural antioxidant compounds in biological systems:Involvement of glutathione and glutathione-related enzymes [J]. The Journal of Nutritional Biochemistry, 2005, 16(10): 577-586
[31] Shimada T. Xenobiotic-metabolizing enzymes involved inactivation and detoxification of carcinogenic polycyclic aromatic hydrocarbons [J]. Drug Metabolism and Pharmacokinetics, 2006, 21(4): 257-276
◆
Effects of Suspended Substances Stress on Antioxidant System Enzyme Activities and Gene Expression ofParalichthysolivaceus
Xiao Guangxia1,2, Xu Wenyuan3, Jia Lei1,*, Zheng Debin1, Han Xianqin1, Chen Chunxiu1
1. Bohai Fisheries Research Institute of Tianjin, Tianjin 300457, China 2. Luozhuang Water Authority of Linyi, Linyi 276000, China 3. Linyi Entry-Exit Inspecting and Quarantine Bureau, Linyi 276034, China
Japanese flounder, Paralichthys olivaceus is an important enhancement species in Bohai Bay of China. The high suspended substances (SS) concentration of the seawater caused a serious impact on the survival and proliferation of P. olivaceus organisms. It is well known that environmental stress can induce oxidative stress. However, there is little information about the effects of SS changes on antioxidant system of Japanese flounder. In this study, Japanese flounder (14.53 cm±1.58 cm) were exposed to SS with the concentration of 5 000 mg·L-1and 10 000 mg·L-1. The activities of total superoxide dismutase (T-SOD), catalase (CAT), glutathions S-transferase and the relative expressions of SOD2, CAT and GST gene in muscle, liver, gill and blood were analyzed in Japanese flounder after 0 h, 24 h, 48 h, 72 h and 96 h exposure. The results showed that all enzyme activity in four tissues have a rising trend (P<0.05) after 24 h or 48 h exposure to SS. The T-SOD activity in four tissues after 96 h exposure were higher than control group (P<0.05), while the SOD2gene relative expression of muscle, gill and blood in exposure group are lower than the control group (P<0.05) after exposure to SS for 96 h. The CAT activity in muscle showed a trend of increasing first, then decreasing, while the CAT gene relative expression showed a trend of decreasing first, then increasing, and decreasing again. The GST activity of liver, gill and blood showed a trend of increasing after exposure to SS, and the GST gene expression of four tissues showed a trend of increasing after exposure to SS from 12 to 24 h. It is suggested that the SS has a certain effect on antioxidant enzyme activities and gene expressions of P. olivaceus. The variations of enzyme activities of blood and the variations of gene relative expressions of gill are larger than other tissues, which is associated with the fact that the blood and gills is involved in the respiration process. The variations of antioxidant enzyme activities are not entirely consistent with the variations of the relative gene expressions.
suspended substances (SS); Paralichthys olivaceus; antioxidant system enzyme; gene expression
国家鲆鲽类产业技术体系(CARS-50-z01);天津市科技计划项目(海珍品高效养殖技术集成与应用15zxbfnc00100);天津市水产局青年科技创新项目(悬浮物胁迫对褐牙鲆存活、抗氧化系统酶活力及基因表达的研究J2014-02);天津市农委农业科技合作项目(海水新品种的引进及示范201304070);天津市农业产业技术体系创新团队建设项目(海水鱼养殖岗位)
肖广侠(1984-),男,工程师,研究方向为水产动物遗传育种及增殖放流评估,E-mail: gxxiao@163.com;
*通讯作者(Corresponding author), E-mail: tianjinbohaisuo@163.com
10.7524/AJE.1673-5897.20160420001
2016-04-20 录用日期:2016-06-18
1673-5897(2016)6-266-11
X171.5
A
贾磊(1983—),男,水产养殖硕士,高级工程师,主要从事苗种培育及生态养殖研究,发表学术论文20余篇。
肖广侠, 徐文远, 贾磊, 等. 悬浮物对褐牙鲆抗氧化酶活性及相关基因表达的影响[J]. 生态毒理学报,2016, 11(6): 266-276
Xiao G X, Xu W Y, Jia L, et al. Effects of suspended substances stress on antioxidant system enzyme activities and gene expression of Paralichthys olivaceus [J]. Asian Journal of Ecotoxicology, 2016, 11(6): 266-276 (in Chinese)
