经皮肤暴露四溴双酚A对Wistar雄性大鼠的毒性效应
2016-03-17向明灯高丹丹李红艳李良忠于紫玲汪正东林必桂于云江
向明灯,高丹丹,李红艳,李良忠,于紫玲,汪正东,林必桂,于云江,*
1. 中国科学院广州地球化学研究所 有机地球化学国家重点实验室,广州 510640 2. 环境保护部华南环境科学研究所 国家环境保护环境污染健康风险评价重点实验室,广州 510535
经皮肤暴露四溴双酚A对Wistar雄性大鼠的毒性效应
向明灯1,2,高丹丹2,李红艳2,李良忠2,于紫玲2,汪正东2,林必桂2,于云江1,2,*
1. 中国科学院广州地球化学研究所 有机地球化学国家重点实验室,广州 510640 2. 环境保护部华南环境科学研究所 国家环境保护环境污染健康风险评价重点实验室,广州 510535
尘/土以及含阻燃剂产品的皮肤接触是四溴双酚A(TBBPA)重要的人体暴露途径。为研究TBBPA经皮肤亚慢性暴露毒性效应,选择无特定病原菌级别(SPF级)Wistar雄性大鼠作为受试生物,分别设空白对照组(K)、溶剂对照组(Z),以及20 mg·kg-1(A)、60 mg·kg-1(B)、200 mg·kg-1(C)、600 mg·kg-1(D)共4个不同剂量的TBBPA暴露组,采用皮肤接触的方式连续暴露90 d。暴露期间观察大鼠状态并称重,于第91天解剖大鼠,分离主要脏器称重计算脏器系数,并对暴露皮肤进行组织病理学检查。研究发现,经皮肤暴露TBBPA后,90 d暴露期间不同实验组Wistar大鼠在表观形态、行动、进食方面无差异,TBBPA暴露导致大鼠体重略微降低,但各处理组间大鼠体重无显著差异;90 d暴露后不同剂量组间大鼠的器官脏器系数没有显著的剂量-效应关系,不同剂量组大鼠皮肤暴露区域均有一定程度的炎症细胞浸润及部分组织胶原间隙增宽。研究结果表明,TBBPA 90 d亚慢性皮肤暴露对Wistar大鼠无明显毒性效应。
四溴双酚A;Wistar雄性大鼠;亚慢性毒性;皮肤暴露;生理损伤
四溴双酚A(tetrabromobisphenol A, TBBPA)是目前世界上使用量最大的溴系阻燃剂之一,广泛应用于电子、塑料、纺织以及建筑等材料和产品中。据国际溴科学与环境论坛(BSEF)统计,2007年全球TBBPA及其衍生物的年消费量在12~15万t,其中亚洲地区(中国、日本等)是TBBPA生产和消费的重点区域,其消费总量占全球80%以上[1]。目前TBBPA在很多国家和地区的土壤、沉积物、野生动物以及人体等非生物和生物介质中被广泛检出[2-5],且中国TBBPA的环境污染水平远高于欧美地区,部分地区甚至达到其他国家的几十甚至数百倍[6],如浙江省台州市室内外积尘中TBBPA浓度分别高达42.21~46 191 ng·g-1dw和42.45~28 993 ng·g-1dw[7],而英国伯明翰家庭和办公场地中浓度仅为n.d.~382 ng·g-1dw和n.d.~140 ng·g-1dw[8]。
TBBPA潜在的人体健康风险不容忽视。研究表明,TBBPA具有潜在肝肾、神经等毒性和内分泌干扰效应[9-13]。近期美国国家毒理学计划中(National Toxicology Program, NTP)关于TBBPA的系统研究显示[14],TBBPA暴露后的大鼠血清甲状腺素(T4)降低,500和1 000 mg·kg-1bw剂量的TBBPA暴露会导致大鼠肝脏、肾脏、脾脏重量增加,以及肾脏细胞质的空泡形成;为期2年的TBBPA致癌性研究发现,TBBPA经口暴露可能会导致雄性大鼠睾丸细胞腺瘤,并且有明确证据表明TBBPA暴露会增加雌性大鼠子宫肿瘤发生率。Wikoff等[15](2015)以基于NTP报告的子宫增生和子宫瘤发生作为效应终点,采用基准剂量法(BMD)得出TBBPA经口暴露的参考剂量(RfD)为0.6 mg·kg-1·d-1,其致癌强度系数高达3.15 E-3 (mg·kg-1·d-1)-1(高于BDE-209的7.00 E-4 (mg·kg-1·d-1)-1[16])。
研究显示,尘/土以及含阻燃剂的消费产品的皮肤接触是TBBPA等溴系阻燃剂的重要人体暴露途径[8,17-18]。然而,现有TBBPA毒性效应评估数据主要基于经口暴露的动物实验[9-10,12]或细胞体外实验[19-20]获得,关于TBBPA经皮肤暴露毒性效应评估的报道尚不多见。因此,本研究通过动物模拟实验,研究Wistar雄性大鼠90 d亚慢性经皮肤暴露TBBPA后的活动状态、体重、脏器系数以及皮肤组织病理学变化,评估探讨TBBPA经皮肤亚慢性暴露后的毒性效应,为进一步的TBBPA人体暴露健康风险评估研究提供基础数据。
1 材料与方法(Materials and methods)
1.1 实验材料与主要仪器
实验动物及饲养条件:实验选取雄性Wistar大鼠36只(6周,180 g±20 g),无特定病原体级(SPF级),由军事医学科学院实验动物中心提供,合格证号为SCXK(军)2007-004;实验大鼠平均分为6组,饲养于军事医学科学院无特殊病原菌级别(SPF级)实验动物房,动物饲养及实验操作均严格按照SPF级动物实验室操作规程执行。饲养室光照12 h,黑暗12 h,室温20~25 ℃,相对湿度40%~60%。实验大鼠置于饲养箱中常规饲养,自由饮水喂食。大鼠喂养饲料为北京科澳协力饲料有限公司提供的膨化鼠饲料,饲料合格证号为SCXK(京)2005-0007。大鼠喂养饮水为蒸馏水,每日更换。大鼠所用饲养箱、饲料、饮水瓶及垫料均需每日消毒、及时更换。
主要仪器包括:电子分析天平(瑞士Mettler Toledo,AB204-S),生物显微镜(德国Leica DM500/750),石蜡包埋机(德国leica EG1150H),切片机(德国leica RM2235),一次性无菌注射器(湖北福鑫医疗器械有限公司)。
主要试剂包括:TBBPA(纯度大于98%),购于梯希爱(上海)化成工业发展有限公司,并研磨至直径约30 μm颗粒以便皮肤吸收;戊巴比妥钠(优级纯),购于国药试剂公司;甲醛溶液(优级纯),购于北京化学试剂厂;苏木素-伊红染液(纯度大于98%),购于美国sigma公司。
1.2 实验方法
1.2.1 暴露剂量
为考察TBBPA对生物体亚慢性暴露的生物效应,暴露时间设置为90 d;暴露剂量的设置是在参考污染物的半致死剂量(LD50),同时参考实验动物品系、预期暴露时间以及相关文献等资料[21-22]的基础上确定的。本研究最终确定TBBPA暴露剂量如表1所示。
1.2.2 皮肤暴露方法
暴露实验开始前Wistar大鼠适应性饲养1周,开始暴露后每天染毒6 h,每周7 d,持续90 d。染毒前24 h,将动物躯干背部染毒区的被毛剔除(脱毛要求是不损伤脱毛区的表皮,剃毛频率依动物毛发生长情况而定)。皮肤暴露面积一般要求不小于动物体表面积的10%,本实验选择确定为6 cm×6 cm,于脱毛24 h后涂抹一定量的TBBPA(用生理盐水润湿),以保证受试物与皮肤有良好的接触[23-25]。涂抹过程中应尽可能地使受试物薄而均匀地涂敷于整个染毒区域。之后在染毒区域上依次覆一层玻璃纸,2~4层医用纱布,胶布固定好,以保证受试物与皮肤有良好的接触并防止动物舔食。溶剂对照组给予生理盐水涂敷,空白对照组无处理。
暴露6 h结束后,将大鼠染毒区域朝下,先用软毛刷将残留的TBBPA刷除,然后依次用中性肥皂水、清水清洗受试皮肤表面、纸巾擦干。暴露期间每天观察大鼠状态(皮肤和被毛改变、眼和结膜变化、运动和行为改变)并记录,分别于实验第0、1天,10~90 d(每隔10天)称量并记录大鼠体重,大鼠处死前禁食12 h,自由饮水。
1.2.3 大鼠组织样本的获取及组织病理学检查
实验第91天,腹腔注射戊巴比妥钠溶液(30 mg·kg-1)麻醉大鼠后,通过腹部主动脉采得全血。采血后颈椎离断处死大鼠,迅速解剖,立即分离主要脏器(心脏、肺、胸腺、肝脏、肾脏、脾脏、睾丸及脑),冷生理盐水清洗残留血液,滤纸吸干表面液体后称取组织湿重。脏器系数(%)=脏器湿重(g)/体重(g)×100%。

表1 四溴双酚A(TBBPA)皮肤暴露剂量Table 1 The dermal exposure dose of tetrabromobisphenol A (TBBPA)
无菌条件下取染毒部位皮肤,去除皮下结缔组织,并置于4%福尔马林溶液中固定;皮肤脱水后石蜡包埋,4 μm切片,苏木精-伊红(HE)染色,中性树胶封固后光学显微镜下观察。
1.3 数据统计与分析
采用GraphPad Prism 5软件进行数据统计;采用One way ANOVA分析TBBPA暴露组与对照组之间的差异,P < 0.05表示差异显著。
2 结果(Results)
2.1 大鼠的行为变化
本实验Wistar大鼠持续暴露90 d,实验前大鼠表观形态无差异,体毛柔软、毛色白、有光泽;实验开始后,各组大鼠毛色微黄,光泽度降低。由于纱布的包裹以及饲养笼空间较小,大鼠行动受到限制,实验初期大鼠反应强烈,出现极度烦躁,撕咬纱布、频繁洗脸、舔毛等现象;随着暴露时间的持续,大鼠逐渐适应,这一情况有所改善;实验初期大鼠进食量和饮水量较少,中期及后期饮食逐渐正常。K、Z、A、B、C、D各组间大鼠无明显差异。
2.2 大鼠体重的变化
90 d亚慢性暴露期间,K、Z、A、B、C、D各剂量组Wistar雄鼠体重随时间的变化如图1所示。可以看出,90 d暴露期间,空白组(K)大鼠体重及体重增长量均略高于其他处理组。经单因素方差分析(One way ANOVA)可知,TBBPA暴露组(A、B、C、D)与空白对照组(K)和溶剂对照组(Z)相比,均无显著性差异(P>0.05)。

图1 TBBPA亚慢性经皮肤暴露不同时间各剂量组大鼠体重变化趋势Fig. 1 The body weight of male Wistar rats in different groups following sub-chronic dermal exposure to TBBPA
2.3 经皮肤TBBPA暴露对大鼠脏器系数的影响
大鼠经皮肤亚慢性暴露TBBPA 90 d后,K、Z、A、B、C、D各剂量组Wistar雄鼠8种主要组织器官(胸腺、心、肺、肝、肾、脾脏、睾丸、脑)的脏器系数见表2。统计分析发现,K、Z、A、B、C、D各剂量组间的器官脏器系数没有显著的剂量-效应关系(P>0.05)。
2.4 暴露皮肤组织病理学检查
组织病理学检查结果显示,对照组K、Z和暴露组A、B、C、D染毒区域皮肤均有一定程度的炎症细胞浸润和组织胶原间隙增宽(图2),病变发生率如表3所示。可以看出,TBBPA暴露组(A、B、C、D)与空白对照组(K)和溶剂对照组(Z)相比,炎症细胞浸润发生率略高,但无统计学差异(P>0.05);组织胶原间隙增宽发生率无显著差异(P>0.05)。
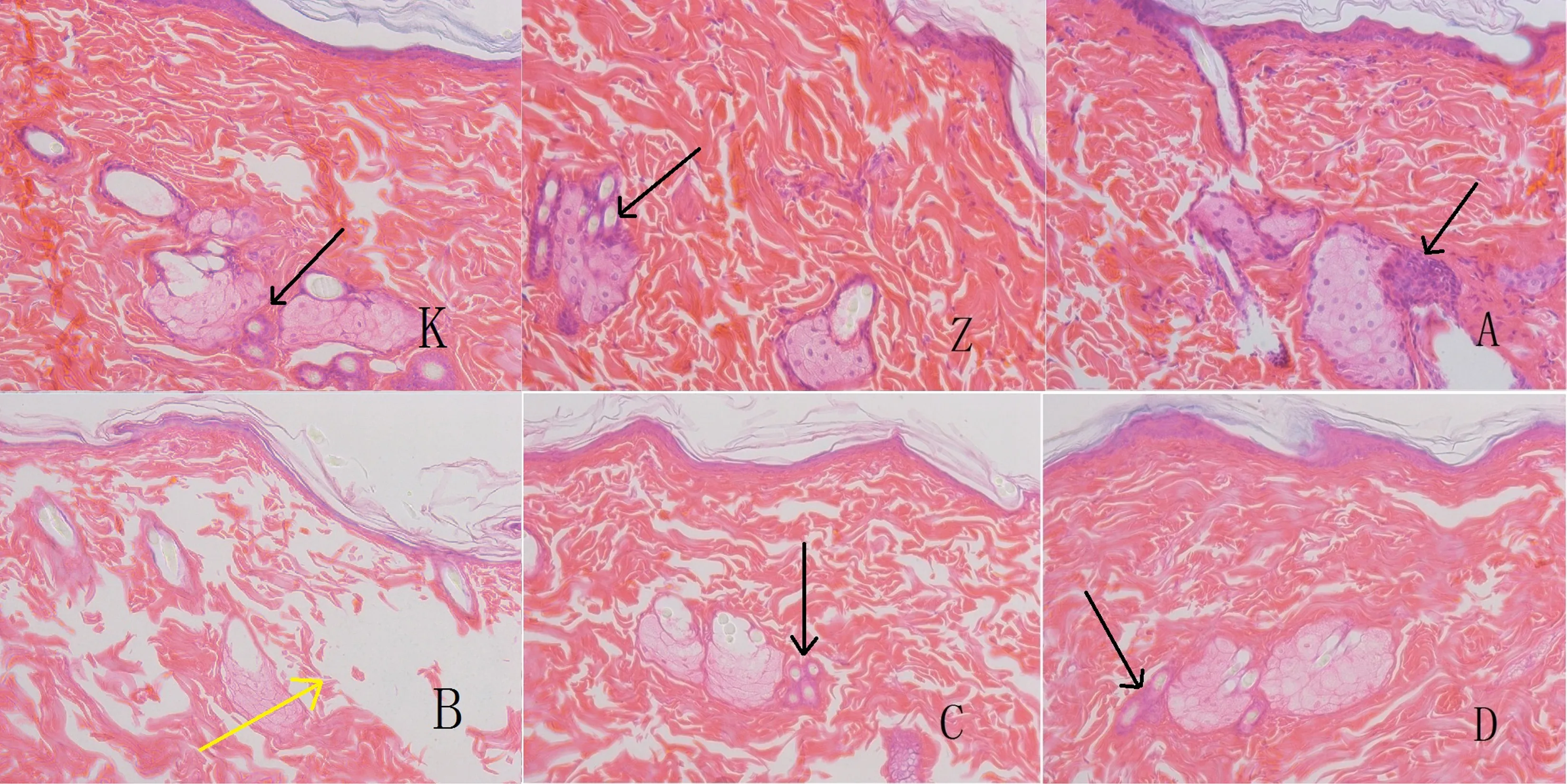
图2 大鼠TBBPA暴露区域皮肤切片病理图(×200倍)注:炎症细胞浸润,如黑色箭头所示;组织胶原间隙增宽,如黄色箭头所示。Fig. 2 Skin pathological section of TBBPA exposure area in male rats (×200)Note: black arrow indicates inflammatory cell infiltration, and yellow arrow indicates tissue collagen gap widened.
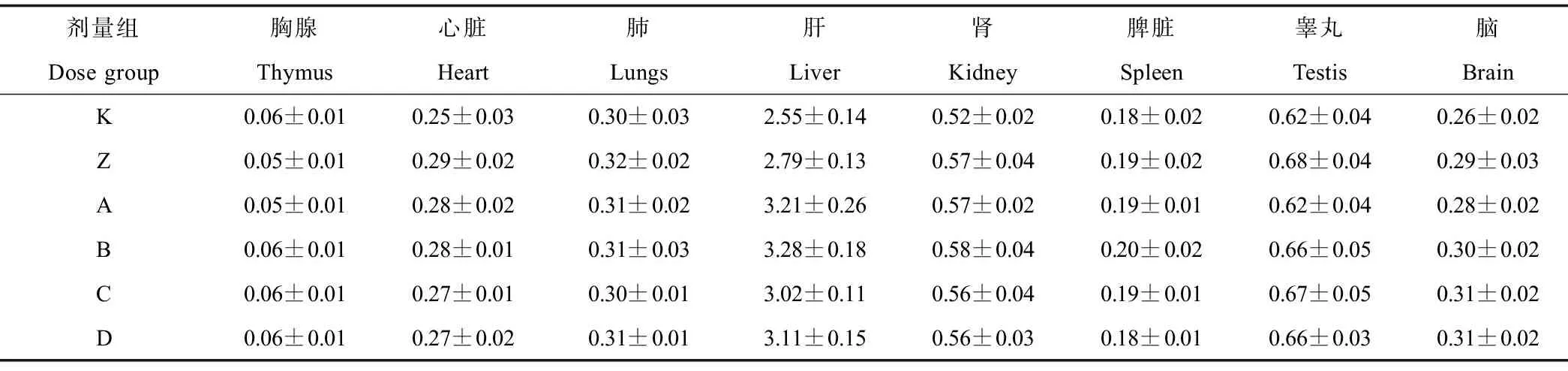
表2 TBBPA不同剂量组雄鼠各器官脏器系数Table 2 Organ coefficient of male rats in different TBBPA groups
注:脏器系数 (%)=脏器湿重/体重×100%;与空白对照组(K组)比较,* P<0.05,n = 6;与溶剂对照组(Z组)比较,#P<0.05,n = 6。
Note: Organ coefficient (%) = organ wet weight/final body weight×100%; compared with blank control, * P<0.05, n = 6; compared with vehicle control,#P <0.05, n = 6.

表3 各TBBPA剂量组大鼠染毒区域皮肤病变发生率Table 3 The incidence of skin lesions of TBBPA exposure area in male rats
注:分数表示病变发生率(皮肤病变大鼠数/受试大鼠总数)。
Note: Fraction represent incidence of lesions (The numbers of rats with skin lesions/The total numbers of experimental rats).
3 讨论(Discussion)
欧盟2006年关于TBBPA的调查表明,TBBPA的环境和人体健康风险可忽略[22],但该结论一直存在争议,大量学者针对TBBPA的毒性效应和人体暴露风险进行了研究[13]。然而,现有研究对于TBBPA经皮肤接触、儿童尘/土手-口接触等这些被认为是阻燃剂暴露的关键途径却少有涉及,其中经皮肤暴露的慢性或亚慢性毒性效应参数的缺乏,在一定程度上制约了TBBPA健康风险评价的开展并影响了评估的准确性[17]。本研究采用Wistar雄性大鼠为受试动物,初步评估了TBBPA经皮肤90 d亚慢性暴露的毒性效应,为后期进一步的剂量-效应关系研究提供基础数据。
整个实验过程中对大鼠行为状态的观察发现,由于对Z、A、B、C和D组实施纱布包裹以及饲养笼空间较小,大鼠的活动受到限制,造成大鼠一定程度的烦躁及撕咬纱布现象,但随着暴露时间的增加,大鼠逐渐适应了暴露环境,体重变化及精神状态趋于平稳[25]。体重是衡量实验动物健康的重要指标[25],90 d暴露期间,不同剂量暴露对大鼠体重的影响无显著的剂量-效应关系,表明TBBPA暴露没有造成大鼠严重消瘦。Tada等[9]给予怀孕ICR小鼠饲喂分别含有0.01%、0.1%和1.0%(质量分数)TBBPA的食物,并持续到子代小鼠断奶,结果发现,不同剂量组母鼠间体重无明显差异,不同剂量组子代体重呈下降趋势,但统计差异不显著。这与本实验结果一致,说明亚慢性TBBPA暴露不会对哺乳动物体重产生较大的毒性作用。
实验动物的脏器系数是药品或化学品长期毒性试验中必须检测的项目,能较好地反映化学物质对脏器的毒性综合情况,亦可旁证病理组织学改变的可能性,并可作为寻找毒物作用靶器官的重要线索[26]。本研究发现,暴露组(A、B、C、D)和对照组(K、Z)各剂量组间的器官脏器系数没有显著的剂量-效应关系,这与经口或经呼吸暴露的结果存在一定差异。经呼吸暴露研究发现,经亚慢性呼吸暴露TBBPA后,实验大鼠的肾脏和脾脏脏器系数有一定程度上的下降[27];经口途径暴露研究发现,Wistar大鼠在90 d的亚慢性经口暴露后,高剂量组大鼠肾脏组织有微弱的损伤[28]。这可能与TBBPA经皮肤暴露途径中,外暴露TBBPA经皮肤吸收进入体内的量较小,约为3.31%~11.21%,并且TBBPA具有较快的代谢速率,能很快经粪便排出体外有关[29],因此经皮肤暴露TBBPA对受试动物脏器系数影响较小。
组织病理学检查结果显示,对照组K、Z和暴露组A、B、C、D染毒区域皮肤均有一定程度的炎症细胞浸润和组织胶原间隙增宽。笔者分析,这可能与TBBPA皮肤暴露操作有关,由于染毒区域除涂敷用生理盐水润湿的TBBPA外,还需用多层纱布及医用胶带固定,易造成染毒区域皮肤空气流通不畅,且TBBPA粉末以及纱布会对染毒皮肤造成一定的摩擦,导致皮肤出现轻微红斑和水肿。关于TBBPA的皮肤毒性,欧盟2006年的TBBPA风险评估报告显示,对10只新西兰兔子以2 000 mg·kg-1的TBBPA剂量进行皮肤急性毒性试验,暴露24 h之后,只有一只皮肤出现轻微的红斑和水肿,在2周的观察期未发现动物死亡和其他中毒现象;另外一项研究对10只雌性兔子背部(去毛)敷以200 mg·kg-1的TBBPA,暴露24 h之后,所有受试动物均出现一定程度的红斑,但48 h之后,受试动物皮肤表面均恢复正常[22],最终欧盟TBBPA风险评估报告认为,TBBPA急性暴露不具有皮肤致敏性或刺激性。
综上,本实验采用Wistar雄性大鼠为受试动物,探索TBBPA经90 d亚慢性皮肤暴露的毒性效应。研究结果显示,Wistar大鼠经皮肤亚慢性暴露TBBPA后,不同实验组大鼠90 d暴露期间在表观形态、行动、进食方面无差异,TBBPA暴露导致大鼠体重略微降低,但各处理组间大鼠体重无显著差异;90 d暴露后,不同剂量组间大鼠的器官脏器系数没有显著的剂量-效应关系,不同剂量组(包括空白对照组和溶剂对照组)的大鼠皮肤暴露区域均有一定程度的炎症细胞浸润及部分组织胶原间隙增宽。研究结果表明,TBBPA 90 d亚慢性皮肤暴露对Wistar大鼠无明显毒性效应。本研究可为TBBPA经皮肤长期暴露的毒性参数研究和健康风险评估提供基础数据。
[1] Bromine Science and Environmental Forum (BSEF) [EB/OL]. (2013-12-20) [201611-15]. http://www.bsef.com
[2] Yu C, Hu B. Novel combined stir bar sorptive extraction coupled with ultrasonic assisted extraction for the determination of brominated flame retardants in environmental samples using high performance liquid chromatography [J]. Journal of Chromatography A, 2007, 1160: 71-80
[3] Feng A, Chen S, Chen M, et al. Hexabromocyclododecane (HBCD) and tetrabromobisphenol A (TBBPA) in riverine and estuarine sediments of the Pearl River Delta in southern China, with emphasis on spatial variability in diastereoisomer- and enantiomer-specific distribution of HBCD [J]. Marine Pollution Bulletin, 2012, 64(5): 919-925
[4] Herzke D, Berger U, Kallenborn R, et al. Brominated flame retardants and other organobromines in Norwegian predatory bird eggs [J]. Chemosphere, 2005, 61(3): 441-449
[5] Shi Z X, Wu Y N, Li J G, et al. Dietary exposure assessment of Chinese adults and nursing infants toterabromobisphenol-A and hexabromocyclododecanes: Occurrence measurements in foods and human milk [J]. Environmental Science & Technology, 2009, 43(12): 4314-4319
[6] Liu K, Li J, Yan S, et al. A review of status of tetrabromobisphenol A(TBBPA) in China [J]. Chemosphere, 2016, 148: 8-20
[7] Wu Y Y, Li Y Y, Kang D, et al. Tetrabromobisphenol A and heavy metal exposure via dust ingestion in an e-waste recycling region in Southeast China [J]. Science of the Total Environment, 2016, 541: 356-364
[8] Abdallah M A, Harrad S, Covaci A. Hexabromocyclododecanes and tetrabromobisphenol-A in indoor air and dust in Birmingham, U. K.: Implications for human exposure [J]. Environmental Science & Technology, 2008, 42: 6855-6861
[9] Tada Y, Fujitani T, Yano N. Effects of tetrabromobisphenol A, brominated flame retardant, in ICR mice after prenatal and postnatal exposure [J]. Food and Chemical Toxicology, 2006, 44(8): 1408-1413
[10] Nakajima A, Saigusa D, Tetsu N. Neurobehavioral effects of tetrabromobisphenol A, a brominated flame retardant, in mice [J]. Toxicology Letters, 2009, 189(1): 78-83
[11] Sun H, Shen O X, Wang X. Anti-thyroid hormone activity of bisphenol A, tetrabromobisphenol A and tetrachlorobisphenol A in an improved reporter gene assay [J]. Toxicology in Vitro, 2009, 23: 950-954
[12] Cope R B, Kacew S, Dourson M A. Reproductive, developmental and neurobehavioral study following oral exposure of tetrabromobisphenol A on Sprague-Dawley rats[J]. Toxicology, 2015, 329: 49-59
[13] Lai D Y, Kacew S, Dekant W. Tetrabromobisphenol A(TBBPA): Possible modes of action of toxicity and carcinogenicity in rodents [J]. Food and Chemical Toxicology, 2015, 80: 206-214
[14] National Toxicology Program (NTP). Technical Report on the toxicology studies of tetrabromobisphenol A (CASNO. 79-94-7) in F344/NTac rats and B6C3F1/N mice and toxicology and carcinogenesis study of tetrabromobisphenol A in Wistar Han [Crl:WI(Han)] rats and B6C3F1/N mice (gavage studies). NTP TR 587 [R]. Research Triangle Park, NC: National Toxicology Program, 2014
[15] Wikoff D, Thompson C, Perry C, et al. Development of toxicity values and exposure estimates for tetrabromobisphenol A: Application in a margin of exposure assessment [J]. Journal of Applied Toxicology, 2015, 35: 1292-1308
[16] U.S. EPA. Integrated risk information system [EB/OL]. (2008-06-30) [201611-15]. https://cfpub.epa.gov/ncea/iris2/chemicalLanding.cfm?substance_nmbr=35
[17] Abdallah M A, Pawar G, Harrad S. Evaluation of in vitro vs. in vivo methods for assessment of dermal absorption of organic flame retardants: A review [J]. Environment International, 2015, 74: 13-22
[18] Trudel D, Scheringer M, von Goetz N, et al. Total consumer exposure to polybrominated diphenyl ethers in North America and Europe [J]. Environmental Science & Technology, 2011, 45: 2391-2397
[19] Boecker R H, Schwind B, Kraus V, et al. Cellular disturbances by various brominated flame retardants [C]// The Second International Workshop on Brominated Flame Retardants in Stockholm, Abstract 2001, Part 3: Effects and metabolism. Stockholm: Stockholm University, 2001: 138-139
[20] Nakagawa Y, Suzuki T, Ishii H, et al. Biotransformation and cytotoxicity of a brominated flame retardant, tetrabromobisphenol A, and its analogues in rat hepatocytes [J]. Xenobiotica, 2007, 37(7): 693-708
[21] World Health Organization. Tetrabromobisphenol A and Derivatives. Environmental Health Criteria 172 [R]. International Programme on Chemical Safety, World Health Organization, 1995
[22] European Commission. European Union Risk Assessment Report on 2,2′,6,6′-tetrabromo-4,4′-isopropylidenediphenol (tetrabromobisphenol-A or TBBP-A). Part II, Human health, vol. 63 [R]. European Commission, Joint Research Centre, European Chemicals Bureau, 2006
[23] OECD. OECD Guideline for the Testing of Chemicals. No. 411. Subchronic Dermal Toxicity: 90-day Study [R]. Paris, France: OECD, 1981
[24] Schauer U M D, Völkel W, Heusener A, et al. Kinetics of 3-(4-methylbenzylidene) camphor in rats and humans after dermal application [J]. Toxicology and Applied Pharmacology, 2006, 216(2): 339-346
[25] 胡建华, 姚明, 崔淑芳. 实验动物学教程[M]. 上海: 上海科学技术出版社, 2009: 373-376
[26] 孙建新, 安娟, 连军. 影响实验动物脏器重量及脏器系数因素分析[J]. 实验动物科学, 2009, 26(1): 49-51
Sun J X, An J, Lian J. The discussion of influence factors on laboratory animal organ weight and coefficients [J]. Laboratory Animal Science, 2009, 26(1): 49-51 (in Chinese)
[27] 汪正东, 于云江, 向明灯, 等. 四溴双酚A亚慢性呼吸暴露对Wistar雄性大鼠的毒性效应[J]. 生态毒理学报, 2016, 11(1): 337-344
Wang Z D, Yu Y J, Xiang M D, et al. Toxicity effects of tetrabromobisphenol A in male wistar rats following subchronic inhalation exposure [J]. Asian Journal of Ecotoxicology, 2016, 11(1): 337-344 (in Chinese)
[28] 王琼. 经口摄入四溴双酚A(TBBPA)生物体内暴露及代谢特征研究[D]. 北京: 北京师范大学, 2013: 85-95
Wang Q. Study on the inner exposure and metabolic characteristics of tetrabromobisphenol A (TBBPA) in vivo after oral administration [D]. Beijing: Beijing Normal University, 2013: 85-95 (in Chinese)
[29] Yu Y, Xiang M, Gao D, et al. Absorption and excretion of tetrabromobisphenol A in male Wistar rats following subchronic dermal exposure [J]. Chemosphere, 2016, 146: 189-194
◆
Toxicity Effects of Tetrabromobisphenol A in Male Wistar Rats Following Dermal Exposure
Xiang Mingdeng1,2, Gao Dandan2, Li Hongyan2, Li Liangzhong2, Yu Ziling2, Wang Zhengdong2, Lin Bigui2, Yu Yunjiang1,2,*
1. State Key Laboratory of Organic Geochemistry, Guangzhou Institute of Geochemistry, Chinese Academy of Sciences, Guangzhou 510640, China 2. State Environmental Protection Key Laboratory of Environmental Pollution Health Risk Assessment, South China Institute of Environmental Sciences. MEP, Guangzhou 510535, China
Received 15 November 2016 accepted 20 December 2016
Dermal contact for dust and consumer products has been identified as the major exposure pathways to tetrabromobisphenol A (TBBPA). In order to reveal the subchronic toxic effects, the male Wistar rats were exposed for 90 days to TBBPA dosage varying at 20, 60, 200 and 600 mg·kg-1body weight, and the similar experiments were also conducted in blank control group and solvent control group. The results showed that within the 90-d dermal contact with TBBPA, the significant difference concerning animal growth, behaviour and feeding among all groups was not clearly observed (P>0.05), including the organ coefficients of thymus, heart, lung, liver, kidneys, spleen, ovary, and brain between treatment groups and the control or vehicle group, although a slight change in body weight and a certain degree of inflammatory cell infiltration and collagen gap widened was observed. It is indicated that the subchronic dermal exposure to TBBPA could not cause significantly toxicological effects.
tetrabromobisphenol A; male wistar rats; subchronic toxicity; dermal exposure; physiological damage
国家自然科学基金项目(21377045,U1401233,21607048)
向明灯(1982-),男,博士研究生,研究方向为环境与健康,E-mail: xiangmingdeng@scies.org
*通讯作者(Corresponding author), E-mail: yuyunjiang@ scies.org
10.7524/AJE.1673-5897.20161115001
2016-11-15 录用日期:2016-12-20
1673-5897(2016)6-338-07
X171.5
A
于云江(1964-),男,博士,研究员,主要研究方向为环境与健康,发表学术论文130余篇。
向明灯, 高丹丹, 李红艳, 等. 经皮肤暴露四溴双酚A对Wistar雄性大鼠的毒性效应[J]. 生态毒理学报,2016, 11(6): 338-344
Xiang M D, Gao D D, Li H Y, et al. Toxicity effects of tetrabromobisphenol A in male wistar rats following dermal exposure [J]. Asian Journal of Ecotoxicology, 2016, 11(6): 338-344 (in Chinese)
