水稻幼苗镉积累特征和离体叶片耐镉性的基因型差异
2016-03-17王龙杨益新高子平尹洁刘洋张长波汤继华刘仲齐
王龙,杨益新,高子平,尹洁,刘洋,张长波,汤继华,刘仲齐,*
1. 农业部环境保护科研监测所,天津 300191 2. 河南农业大学农学院,郑州 450002 3. 湖南省湘阴县农业局,湘阴 414600
水稻幼苗镉积累特征和离体叶片耐镉性的基因型差异
王龙1,2,杨益新3,高子平1,尹洁1,刘洋1,张长波1,汤继华2,#,刘仲齐1,2,*
1. 农业部环境保护科研监测所,天津 300191 2. 河南农业大学农学院,郑州 450002 3. 湖南省湘阴县农业局,湘阴 414600
水稻根系对镉(Cd)的富集能力和向地上部的转运效率直接决定着水稻地上部的Cd积累量,是影响稻米中镉含量的关键因素。提高水稻根系对Cd的阻控能力有助于降低南方稻区大米镉含量超标的风险。以水稻核心种质资源中的高Cd积累品种‘齐头白谷’和低Cd积累品种‘27760’的幼苗和离体叶片为材料,对其Cd吸收转运特性和耐镉能力进行了比较研究。结果表明,根系细胞壁和原生质体的Cd吸收动力学特征都符合米氏方程,‘齐头白谷’的Cd最大吸收速率Fmax显著大于‘27760’,Km值无显著差异。当根际环境中的Cd浓度高于0.89 μmol·L-1时,‘齐头白谷’的细胞壁和原生质体的Cd积累速率显著高于‘27760’。地上部细胞壁和原生质体的Cd吸收速率与根系可溶性组分中的Cd浓度呈显著的线性正相关。当根系可溶性组分中的Cd浓度相近时,‘齐头白谷’地上部细胞壁和原生质体的Cd积累速率显著高于‘27760’。在0.89~8.9 μmol·L-1的Cd溶液中,‘齐头白谷’离体叶片的失绿速度明显低于‘27760’。‘齐头白谷’具有耐Cd能力强、Cd积累速率快和转运效率高的特点。水稻离体叶片的耐Cd能力和幼苗根系的Cd积累能力以及幼苗的Cd转运能力高度相关,它们都可作为快速鉴定低Cd积累品种的生理指标。
镉(Cd);水稻;积累特性;亚细胞分布;离体叶片;叶绿素;基因型
近年来,随着工业化、城镇化进程的推进,矿产资源的过度开发,工业三废的不合理排放,化肥和农药的过量施用及不合标准的污水灌溉等引发的农田重金属污染现象日趋严峻[1-2]。农田一旦遭受重金属污染,不仅会使土壤质量退化,而且会影响农作物的生长和发育,进而影响农产品的产量和品质,最终通过食物链威胁人类健康和生命安全[3-5]。在所有重金属污染物中,镉以其高移动性、高毒性及污染面积最大而被列为“五毒之首”[6-7]。因此,镉污染已成为当今危害最大的环境问题之一,对现代农业可持续发展和土地资源可持续利用带来了严峻挑战。
水稻是我国第一大粮食作物也是耐镉性较强的植物之一,其根系对酸性土壤中低浓度的Cd具有很强的富集效率,并向茎、叶和籽粒转运,各器官的积累量在品种间有显著差异[8-10]。Cd在植物各器官中的分配比例由高到低顺序为:根系>茎叶>穗轴>籽粒[11-12]。一般来说,植物对Cd的耐性和解毒机制可通过2条基本途径实现,一是外部排斥机制,即避免过量Cd被吸收进入植物细胞,或者阻碍Cd在植物体内的运输;另一途径是内部耐受机制,即Cd在植物体内以不具生物活性的解毒形式存在,如结合到细胞壁上、主动运输进入液泡或与某些有机酸和蛋白质结合等[13-14]。
细胞壁作为植物细胞的第一道保护屏障,在维持细胞形态、提供植物直立生长的机械支撑、控制细胞生长、提高植物耐Cd能力等方面发挥着重要作用。一方面,细胞壁中的纤维素、果胶、半纤维素和糖蛋白等相互交错形成网孔大小不一的网架结构,能吸收和固定Cd;另一方面,细胞壁中这些物质含有大量羟基、羧基、醛基、胺基或磷酸基等配位基团,能与Cd结合并在细胞壁上形成沉淀[15-18]。根际环境中的Cd一部分沉积在细胞壁中,另一部分跨膜进入原生质体。Cd与细胞壁紧密结合而导致其移动性降低,从而阻止过多的Cd进入原生质体,以减轻其毒害。当Cd穿过细胞膜进入细胞后,一部分与谷胱甘肽(GSH)、半胱氨酸(Cys)、植物螯合态(PCs)和非蛋白巯基(NPT)结合,降低其在细胞质中的可移动性[19-22];一部分通过跨膜转运蛋白贮存在液泡中,减少Cd对细胞质基质及细胞器中各种生理代谢活动的伤害[23-25]。
水稻根系对Cd的富集能力和向地上部的转运效率直接决定着水稻地上部的Cd积累量,是影响稻米中的Cd含量的关键因素。提高水稻根系对Cd的阻控能力有助于降低南方稻区大米镉含量超标的风险。因此,本文从研究水稻幼苗根系和地上部的Cd吸收动力学特征入手,分析其亚细胞分布特征在基因型间的差异,以期为水稻低镉积累品种的筛选提供理论依据。
1 材料与方法(Materials and methods)
1.1 实验材料
将108份水稻核心种质种植在湖南某地Cd污染农田(耕层土壤Cd含量0.811 mg·kg-1),从中筛选出1份稻米Cd含量高(1.625 mg·kg-1)的云南地方粳稻品种‘齐头白谷’和1份稻米Cd含量低(0.185 mg·kg-1)的江苏地方粳稻品种‘27760’,两品种的生育期为(150±10) d。
1.2 培养与处理方法
挑选大小一致、颗粒饱满的水稻种子,用体积分数为5%的次氯酸钠溶液消毒15 min,先用自来水冲洗4~6次,然后用去离子水漂洗3次后均匀摆在铺有湿滤纸的培养皿中,之后放于28 ℃条件下的恒温培养箱中黑暗催芽24 h,将已露白的种子播种于已消毒的含蛭石的育苗盘中,并在人工气候室中进行培养。在水稻出苗后,用1/4浓度的Hoagland营养液进行浇灌培养,长至三叶一心期,挑选大小均匀一致的水稻幼苗移入装有去离子水的塑料盆中饥饿1 d(24 h),之后将幼苗用海绵固定移栽到装有8 L的塑料盆(长34 cm、宽25 cm、高12 cm)中,进行不同浓度的Cd胁迫处理,每个处理50株。各处理中加入一定量的CdCl2·2.5H2O溶液,使Cd浓度分别为0(对照)、0.27、0.53、0.89、2.67和4.45 μmol·L-1。每个处理设3次重复。培养期间,每2天更换一次处理液,并用0.1 mol·L-1HCl和0.1 mol·L-1NaOH调节pH值为5.5,每次换处理液时随机移动塑料盆的位置,以保证外界条件的一致性。所有实验均在模拟自然状态的人工气候培养室内进行,人工气候室条件:白天温度28 ℃,湿度80%,光照16 h,光照强度为400 μmol·m-1·s-1;夜间温度20 ℃,湿度70%,8 h黑暗。
1.3 样品采集与处理
培养5 d后收样。将根系浸泡于20 mmol·L-1的Na2-EDTA溶液中15 min,去掉根系表面残留的Cd,然后用超纯水清洗整个植株,用吸水纸吸干表面水分,将植株根系和地上部分离,准确称取1.0 g根系和茎叶鲜样直接用于亚细胞分布的测定,其余部分装入信封中,置于烘箱中105 ℃杀青20 min,再于75 ℃下烘至恒重,用万分之一分析天平称干重,记录地上部分和根系的重量,然后测定Cd含量。
1.4 镉的亚细胞分离
参照Weigle等[26]和Wang等[27]的方法,并略有改进,具体方法如下:将1.0 g鲜样置于50 mL离心管中,加入15 mL预冷的提取缓冲液匀浆,匀浆结束后,用缓冲液冲洗转头2~3次。提取缓冲液组成为:50 mmol·L-1Tris-HCl(pH 7.5),250 mmol·L-1蔗糖和1 mmol·L-1的二硫赤鲜醇。采用差速分级离心技术分离出各器官不同细胞组分。将匀浆液在3 000 r·min-1下离心15 min,沉淀即为细胞壁组分(F1),上清液在15 000 r·min-1下离心30 min,沉淀为细胞器组分(F2),上清液为胞液组分(F3)。并测定Cd全量计算回收率[28],回收率在90%~110%。实验均在4 ℃下进行操作,每步离心前用缓冲液补充至同一体积。将F1、F2、F3分别置于烘箱中60 ℃烘干,用于Cd含量的测定。
1.5 镉含量的测定
参照温娜等[29]的方法,将0.25 g样品与7 mL MOS级浓硝酸摇匀后过夜,用ED 54- iTouch电热消解仪消煮,消煮温度控制在110 ℃,2.5 h后加入1 mL H2O2,继续消煮1.5 h,消煮至溶液颜色变为无色冒白烟,最后赶酸至体积为1 mL左右,消煮完成后,用去离子水定容到25 mL,用原子吸收光谱仪-石墨炉法(AAS ZEEnit 700, Analytikjena, 德国)测定样品Cd含量,以国家标准物质进行质量控制。
1.6 光合色素含量的测定
参照张颖等[30]的方法并略有改进,选取正常生长的抽穗期的水稻叶片,将叶片剪成4 cm大小的片段,先用扩展剂浸泡1 min,去离子水冲洗干净,然后放入已添加20 mL处理液的培养皿中,处理液的Cd浓度分别为0(CK)、0.89、4.45和8.89 μmol·L-1,以CdCl2·2.5H2O的形式添加,每个处理设3次重复,放置于上述人工气候室中,5 d后拍照并取样,测定水稻叶片的光合色素含量。
参照高俊凤[31]的方法,将处理过的叶片迅速擦拭干净,准确称取0.1 g放入研钵中,用体积分数为95%乙醇研磨,将研磨液用滤纸过滤后,用95%的乙醇定容至25 mL。以95%的乙醇为空白,用紫外分光光度计(UV-2010型,美国)分别测定色素提取液在波长663、645、470 nm处的光密度OD值,计算各光合色素含量[32]。
1.7 数据分析
水稻对Cd吸收特性用Michaelis-Menten酶动力学方程F=Fmax×S/(Km+S)来描述[33],通过双倒数作图可计算出Fmax和Km值,式中,F为水稻对Cd的吸收速率,S为外液离子浓度,Fmax为离子最大吸收速率,Fmax值越大,说明根系吸收系统对该离子的吸收潜能越大;Km为米氏常数,Km值越小,说明根系吸收系统对该离子的亲和力越大。
所有数据采用Excel和SPSS 11.5进行统计分析,用单因素方差分析(One-way ANOVA)和Duncan multiple-range test多重比较检验差异的显著性(P≤0.05)。
2 结果与分析(Results and analysis)
2.1 水稻幼苗Cd吸收特性的基因型差异
水稻幼苗根系和地上部Cd吸收速率都随着环境Cd浓度的增大而不断增大并逐渐趋于饱和,当环境Cd浓度达到2 μmol·L-1时,根系和地上部对Cd的吸收速率不再随Cd浓度的增加而明显增加(图1)。水稻幼苗吸收的Cd绝大部分积累在根部,根系Cd吸收速率变化在5~59 nmol·g-1·h-1范围内,约是地上部Cd吸收速率的10~20倍,且品种‘齐头白谷’的Cd吸收速率要远大于品种‘27760’,说明根系和地上部对Cd的吸收都存在阻控机制。
利用Michaelis-Menten动力学方程能够很好地拟合水稻幼苗Cd吸收动力学曲线(R2>0.99),从图1可以看出,从环境到根系再到地上部,动力学参数Km在两品种间差异不显著,但品种‘齐头白谷’的Fmax值显著高于品种‘27760’。
2.2 水稻幼苗细胞壁和原生质体Cd吸收速率的基因型差异
水稻幼苗根系细胞壁和原生质体Cd吸收动力学特征都符合米氏方程(R2>0.94),品种‘齐头白谷’的Fmax显著大于品种‘27760’,而Km在两品种间差异不显著。当Cd浓度低于1 μmol·L-1时,随着外界Cd浓度的增大,根系细胞壁和原生质体的Cd吸收速率急剧增大,品种间无显著差异;当Cd浓度高于1 μmol·L-1时,随着外界Cd浓度的增大,根系细胞壁和原生质体的Cd吸收速率缓慢增大并逐渐趋于饱和,在此阶段,品种‘齐头白谷’的Fmax值和吸收速率显著高于品种‘27760’(图2A和B)。
根系细胞可溶性组分中的Cd,一部分被转运到液泡和其他细胞器中,另一部分继续向地上部转运。水稻幼苗地上部细胞壁和原生质体的Cd吸收速率随着根系可溶性组分中Cd浓度的增加而线性增加(R2>0.95),符合线性方程y=a+bx。环境中的Cd通过影响根系可溶性组分中的Cd浓度间接地影响地上部的Cd积累量。在外界浓度相同时,进入品种‘齐头白谷’根系可溶态的Cd含量高于品种‘27760’,同时品种‘齐头白谷’地上部细胞壁的Cd吸收速率也高于品种‘27760’(图2C)。品种‘齐头白谷’地上部原生质体的Cd吸收速率和b值均明显高于品种‘27760’(图2D),这说明品种‘齐头白谷’的Cd转运效率显著高于品种‘27760’。
2.3 Cd在水稻幼苗根系和地上部亚细胞组分中的分布
水稻根系中的Cd主要分布在细胞壁组分中,约占总量的55%,可溶性组分中的Cd约占35%,细胞器中的Cd只占10%左右(图3A)。地上部分的Cd主要分布于细胞壁组分中,约占总量的60%,其次为可溶组分,约占35%,细胞器组分中仅占5%左右(图3B)。随着外界Cd浓度的增加,根系和地上部分的Cd在细胞壁中所占的比例逐渐降低,可溶部分所占的比例却逐渐升高,这种变化趋势在2个水稻品种间无显著差异,但Cd在品种‘27760’的细胞器中所占的比例明显低于品种‘齐头白谷’。这些结果表明,品种‘27760’能将大部分的Cd分配到细胞壁中,致使细胞器中Cd浓度维持在较低水平,从而减轻其毒害。
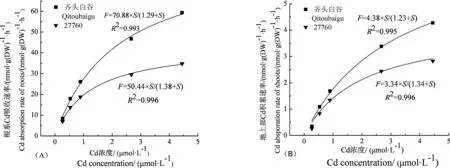
图1 水稻幼苗根系(A)和地上部(B)Cd吸收动力学特征Fig. 1 The kinetic characteristics of Cd absorption in roots (A) and shoots (B) of rice seedlings

图2 Cd胁迫对细胞壁和原生质体Cd吸收速率的影响注:图A和B分别为水稻根系细胞壁(A)和原生质体(B)对环境中Cd的吸收速率;图C和D分别为地上部细胞壁(C)和原生质体(D)对根系可溶态Cd的吸收速率。Fig. 2 Effects of Cd on Cd absorption rates into cell walls and protoplastsNote: A and B show the uptake rates of Cd in rice root cell wall (A) and protoplasts (B) respectively; C and D show the uptake rates of Cd (Cd in soluble fractions of roots) in rice shoot cell wall (C) and protoplasts (D) respectively.

图3 Cd在水稻幼苗根系(A)和地上部(B)的亚细胞分配比例注:F1、F2、F3分别代表细胞壁组分、细胞器组分和胞液组分;不同的小写字母表示不同处理的差异显著性(P<0.05);图例为Cd2+处理浓度(μmol·L-1)。Fig. 3 Percentages of subcellular distribution of Cd in roots (A) and shoots (B) of rice seedlingsNote: F1, F2 and F3 represents cell wall components, organelle components and cell sap components, respectively. Different lowercase letters indicate the significant difference among different treatments (P<0.05). The cutline represents the concentration of Cd2+ (μmol·L-1).
2.4 Cd胁迫强度对水稻离体叶片光合色素的影响
Cd胁迫下植物的光合系统I和II遭到破坏,从而使叶片发黄。由图4可知,随着环境中Cd浓度的增加,水稻离体叶片中叶绿素a、叶绿素b、总叶绿素和类胡萝卜素的含量均逐渐减少,但失绿速度在两品种间存在明显差异。当Cd浓度为0.89 μmol·L-1时,两品种的叶绿素a、叶绿素b、总叶绿素和类胡萝卜素含量差异不大,与对照相比,品种‘齐头白谷’叶绿素和类胡萝卜素的相对损失率较低,分别为3.85%和1.16%,而品种‘27760’的相对损失率较高,分别为8.77%和10.55%。当Cd浓度提高到8.89 μmol·L-1时,品种‘齐头白谷’叶绿素a、叶绿素b、总叶绿素和类胡萝卜素含量显著高于品种‘27760’;和对照相比,品种‘齐头白谷’的叶绿素a、叶绿素b、总叶绿素和类胡萝卜素含量分别下降了27.49%、33.71%、21.77%、16.16%,而品种‘27760’的含量分别下降了51.88%、64.02%、42.31%、38.88%。说明在Cd胁迫条件下,品种‘齐头白谷’失绿速度慢,耐Cd能力明显强于品种‘27760’。
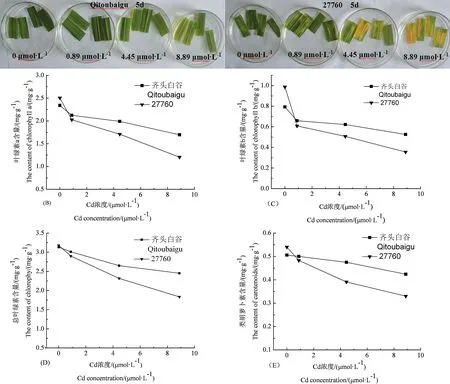
图4 Cd胁迫下水稻离体叶片颜色(A)及叶绿素a (B)、叶绿素b (C)、总叶绿素 (D)、类胡萝卜素 (E) 含量的变化Fig. 4 Changes of leaf color (A), as well as chlorophyII a (B), chlorophyII b (C), total chlorophyII (D),and carotenoids (E) contents in detached leaves under Cd stress
3 讨论(Discussion)
Epstein和Hagen[34]首次将酶促反应动力学方程应用于植物对离子吸收的动力学研究,发现大麦根系对K+的吸收存在2种不同的吸收机制,即低K+浓度下的高亲和吸收系统和高K+浓度下的低亲和吸收系统。之后的一系列相关研究分别为这2种机制提供了证据,并发现高亲和吸收系统中转运蛋白起了较为重要的作用,而在低亲和吸收系统中离子通道蛋白有重要的作用[35-36]。本研究发现,不同Cd积累特性的水稻幼苗根系的Cd吸收动力学特征都符合米氏方程(图1),即随着外界Cd浓度的增大,水稻对Cd的吸收速率不断增大,并逐渐趋于饱和,当溶液中Cd达到一定浓度时,水稻对Cd的吸收速率不再随Cd浓度的增加而明显增加,这与Sansoulet[37]和吴晓丽[38]的结果相似。说明根系存在阻控机制,只有当根系生长受到毒害,阻控机制才被激活,限制Cd的吸收和转运。这可能是因为水稻根系对低浓度的Cd主要通过共质体途径进行主动吸收[39],需要有转运体或者跨膜蛋白参与;当根系周围Cd浓度超过一定的临界值后,被动运输对根系内Cd的积累发挥了主导作用。
细胞壁是接触和响应环境因子的第一道屏障,也是结合金属离子的主要部位[18],因此,细胞壁在植物耐Cd胁迫中起到不可忽视的作用。本研究还发现,2个水稻品种根系细胞壁和原生质体对Cd吸收动力学特征都符合米氏方程(图2A和B),说明细胞壁和原生质体限制了根系对Cd的吸收。这可能是由于根系细胞壁具有大量的配位基团以及能吸附Cd的非可溶性物质,使细胞壁对Cd的吸收速率大大降低;透过细胞壁的Cd会与细胞膜上大量特异性不强的二价阳离子(特别是Ca2+、Zn2+、Fe2+、Mn2+)转运子竞争,限制了Cd进入细胞的速度[40-41]。根系从环境中吸收的Cd一部分以这种方式沉积在细胞壁中,另一部分跨膜进入原生质体。进入原生质体的Cd一部分与谷胱甘肽(GSH)、半胱氨酸(Cys)、植物螯合态(PCs)和非蛋白巯基(NPT)结合,一部分通过跨膜转运蛋白贮存在液泡中,降低其在细胞质中的可移动性,从而减少Cd对细胞质基质及细胞器中各种生理代谢活动的伤害。
离子吸收动力学参数可定量地描述作物根系吸收离子的效率以及建立数学模型来描述离子迁移,并为预测植物对离子的吸收提供依据[42]。本研究发现,品种‘齐头白谷’的最大吸收速率Fmax显著高于品种‘27760’,而Km值在两品种间无显著差异。说明品种‘齐头白谷’对Cd的耐性强于品种‘27760’。对于同一品种来说,根系Cd吸收速率约是地上部Cd吸收速率的10~20倍(图1),说明根系的“过滤”机制有效抑制了Cd向地上部分的转运,致使地上部的Cd积累速率大幅度下降。
环境中的Cd通过质外体和共质体途径进入根系组织后,受内皮层凯氏带和木栓层的阻碍,最后都要经过共质体系统的识别和转运,才能进入根系中柱的木质部[43],然后继续向地上部转运。本研究结果表明,地上部细胞壁和原生质体的Cd吸收速率随着根系可溶态Cd吸收速率的增加而线性增加(图2C和D),与环境中的Cd浓度无相关性,说明根系可溶态的Cd是地上部Cd吸收的直接来源。地上部的Cd积累量一方面取决于根系细胞中可以迁移的Cd浓度,另一方面取决于根系维管束组织向地上部转运的Cd效率[36]。从图2C和D可以看出,在外界浓度相同时,进入品种‘齐头白谷’根系可溶态的Cd含量高于品种‘27760’,同时品种‘齐头白谷’地上部细胞壁的Cd吸收速率高于品种‘27760’,说明品种‘齐头白谷’的转运效率高于品种‘27760’。分子生物学研究结果表明,许多金属离子通道基因和调控基因影响着不同水稻品种对Cd2+的吸收和转运[44-46],品种‘齐头白谷’和‘27760’ Cd转运效率的差异可能与它们拥有不同的离子通道基因有关。
根系和地上部吸收的Cd大部分都积累在细胞壁上,细胞壁所占的比例随环境Cd浓度的增大而逐渐减小,而原生质体所占的比例却逐渐增大,这种变化趋势在2个水稻品种间无显著差异(图3),该分布趋势与于辉等[47],王芳等[48]的结果一致。产生这种现象的原因可能是当环境Cd浓度较低时,根系吸收的Cd优先结合在细胞壁上,随着环境Cd浓度的增大,细胞壁的结合量逐渐达到饱和,大量的Cd进入细胞质,导致原生质体的比例逐渐升高。细胞器是植物细胞生命活动的主要场所,Cd在该部位积累量越低,细胞正常代谢受到Cd的破坏就越少。本研究还发现,水稻细胞器中的Cd所占的比例在5%~10%,与根系相比,地上部细胞器组分所占的比例更低;与品种‘齐头白谷’相比,Cd在品种‘27760’的细胞器中所占的比例也更低。说明品种‘27760’能将大部分的Cd分布在细胞壁和胞液中,致使细胞器中Cd浓度维持在较低水平,从而减轻其毒害。Sela等[49]通过X-射线微区分也证实大部分Cd积累于细胞壁中,还有研究表明,OsHMA3、AtCAX2、AtCAX4、NRT3和OsNRAMP5都能够将Cd转运至液泡[50]。
在逆境环境中植物的离体叶片受迫害程度在一定程度上能够反映植物的耐性能力,前人在杨树、棉花等的离体叶片研究中已有报道[30,51]。本研究结果表明,随着环境Cd浓度的增加,水稻幼苗离体叶片中光合色素的含量均逐渐减少(图4),说明Cd胁迫加速了光合色素的分解。与对照相比,品种‘27760’的叶绿素a、叶绿素b、总叶绿素和类胡萝卜素的相对损失率较高,而品种‘齐头白谷’具有更好的保绿作用,说明品种‘齐头白谷’的耐Cd性更强,可以利用离体叶片失绿进程快速鉴别耐Cd性水稻品种。因此,水稻离体叶片的耐Cd能力和幼苗根系的Cd积累能力以及幼苗的Cd转运能力高度相关,可作为快速鉴定低镉积累品种的生理指标。
[1] 黄益宗, 郝晓伟, 雷鸣, 等. 重金属污染土壤修复技术及其修复实践[J]. 农业环境科学学报, 2013, 32(3): 409-417.
Huang Y Z, Hao X W, Lei M, et al. The remediation technology and remediation practice of heavy metals-contaminated soil [J]. Journal of Agro-Environment Science, 2013, 32(3): 409-417 (in Chinese)
[2] 程金金, 宋静, 陈文超, 等. 镉污染对红壤和潮土微生物的生态毒理效应[J]. 生态毒理学报, 2013, 8(4): 577-586
Cheng J J, Song J, Chen W C, et al. The ecotoxicity effects of cadmium on microorganism in Udic-Ferrosols and Aquic-Cambosols [J]. Asian Journal of Ecotoxicology, 2013, 8(4): 577-586 (in Chinese)
[3] Vromman V, Saegerman C, Pussemier L, et al. Cadmium in the food chain near non-ferrous metal production sites [J]. Food Additives and Contaminants-Part A Chemistry, Analysis, Control, Exposure and Risk Assessment, 2008, 25(3): 293-301
[4] 吴婧, 董欣敏, 郑燕芳, 等. 镉致癌的分子机制研究进展[J]. 生态毒理学报, 2015, 10(6): 54-61
Wu J, Dong X M, Zheng Y F, et al. Recent research progress in molecular mechanisms of cadmium induced carcinogenesis [J]. Asian Journal of Ecotoxicology, 2015, 10(6): 54-61 (in Chinese)
[5] 罗琼, 王昆, 许靖波, 等. 我国稻田镉污染现状·危害·来源及其生产措施[J]. 安徽农业科学, 2014, 42(30): 10540-10542
Luo Q, Wang K, Xu J B, et al. Cadmium pollution situation, harm, source and production measures in paddy field of China [J]. Journal of Anhui Agricultural Sciences, 2014, 42(30): 10540-10542 (in Chinese)
[6] 程旺大, 姚海根, 张国平, 等. 镉胁迫对水稻生长和营养代谢的影响[J]. 中国农业科学, 2005, 38(3): 528-537
Cheng W D, Yao H G, Zhang G P, et al. Effect of cadmium on growth and nutrition metabolism in rice [J]. Scientia Agricultura Sinica, 2005, 38(3): 528-537 (in Chinese)
[7] 李婧, 周艳文, 陈森, 等. 我国土壤镉污染现状、危害及其治理方法综述[J]. 安徽农学通报, 2015, 21(24): 104-107
Li J, Zhou Y W, Chen S, et al. Actualities, damage and management of soil cadmium pollution in China [J]. Anhui Agricultural Science Bulletin, 2015, 21(24): 104-107 (in Chinese)
[8] 胡莹, 黄益宗, 段桂兰, 等. 镉对不同生态型水稻的毒性及其在水稻体内迁移转运[J]. 生态毒理学报, 2012, 1(6): 664-670
Hu Y, Huang Y Z, Duan G L, et al. Cadmium toxicity and its translocation in two ecotype rice cultivars [J]. Asian Journal of Ecotoxicology, 2012, 1(6): 664-670 (in Chinese)
[9] 王龙, 高子平, 李文华, 等. 水稻幼苗镉吸收动力学特性的遗传多样性分析[J]. 植物生理学报, 2016, 52(1): 125-133
Wang L, Gao Z P, Li W H, et al. Genetic diversity of cadmium absorption kinetic characteristics in rice (Oryza sativa) seedlings[J]. Plant Physiology Journal, 2016, 52(1): 125-133 (in Chinese)
[10] Liu Z Q. Research advance on the mechanism of cadmium transport in rice [J]. Meteorological and Environmental Research, 2014, 5(5): 48-52
[11] 唐非, 雷鸣, 唐贞, 等. 不同水稻品种对镉的积累及其动态分布[J]. 农业环境科学学报, 2013, 32(6): 1092-1098
Tang F, Lei M,Tang Z, et al. Accumulation characteristic and dynamic distribution of Cd in different genotypes of rice (Oryza sativa L.) [J]. Journal of Agro-Environment Science, 2013, 32(6): 1092-1098 (in Chinese)
[12] 文志琦, 赵艳玲, 崔冠男, 等. 营养器官镉积累特性对稻米镉含量的影响[J]. 植物生理学报, 2015, 51(8): 1280-1286
Wen Z Q, Zhao Y L, Cui G N, et al. Effects of cadmium accumulation characteristics in vegetative organs on cadmium content in gains of rice [J]. Plant Physiology Journal, 2015, 51(8): 1280-1286 (in Chinese)
[13] Kim D Y, Bovet L, Maeshima M, et al. The ABC transporter AtPDR8 is a cadmium extrusion pump conferring heavy metal resistance [J]. The Plant Journal, 2007, 50(2): 207-218
[14] 段德超, 明革, 积炎. 植物对铅的吸收、转运、累积和解毒机制研究进展[J]. 应用生态学报, 2014, 25(1): 287-296
Duan D C, Ming G, Ji Y. Research advances in uptake, translocation, accumulation and detoxification of Pb in plants [J]. Chinese Journal of Applied Ecology, 2014, 25(1): 287-296 (in Chinese)
[15] Leita L, De Nobili M, Cesco S, et al. Analysis of intercellular cadmium forms in roots and leaves of bush bean [J]. Journal of Plant Nutrition, 1996, 19(4): 527-533
[16] Haynes R J. Ion exchange properties of roots and ionic interactions within the root apoplasm: Their role in ion accumulation by plants [J]. The Botanical Review, 1980, 46(1): 75-99
[17] 刘清泉, 陈亚华, 沈振国, 等. 细胞壁在植物重金属耐性中的作用[J]. 植物生理学报, 2014, 50(5): 605-611
Liu Q Q, Chen Y H, Shen Z G, et al. Roles of cell wall in plant heavy metal tolerance [J]. Plant Physiology Journal, 2014, 50(5): 605-611 (in Chinese)
[18] 郑绍建. 细胞壁在植物抗营养逆境中的作用及其分子生理机制[J]. 中国科学, 2014, 44(4): 334-341
Zheng S J. The role of cell wall in plant resistance to nutritional stresses and the underlying physiological and molecular mechanisms [J]. Science China, 2014, 44(4): 334-341 (in Chinese)
[19] Cobbett C S. Phytochelatins and their roles in heavy metal detoxification [J]. Plant Physiology, 2000, 123(3): 825-832
[20] Clemens S. Evolution and function of phytochelatin synthases [J]. Journal of Plant Physiology, 2006, 163(3): 319-332
[21] Petraglia A, Benedictis M D, Degola F, et al. The capability to synthesize phytochelatins and the presence of constitutive and functional phytochelatin synthases are ancestral (plesiomorphic) characters for basal land plants [J]. Journal of Experimental Botany, 2014, 65(4): 1153-1163
[22] 陆仲烟, 刘仲齐, 宋正国, 等. 大麦中镉的亚细胞分布和化学形态及PCs合成的基因型差异[J]. 农业环境科学学报, 2013, 32(11): 2125-2131
Lu Z Y, Liu Z Q, Song Z G, et al. Subcellular distribution and chemical forms of Cd and the synthesis of phytochelatins (PCs) in different barley genotypes [J]. Journal of Agro-Environment Science, 2013, 32(11): 2125-2131 (in Chinese)
[23] Willats W G T, Knox J P, Mikkelsen J D. Pectin: New insights into an old polymer are starting to gel [J]. Trends Food Science & Technology, 2006, 17(3): 97-104
[24] Pelloux J, Rusterucci C, Mellerowicz E J. New insight into pectin methylesterase structure and function [J]. Trends in Plant Science, 2007, 12(6): 267-277
[25] Morel M, Crouzet J, Gravot A, et al. AtHMA3, a P1B-ATPase allowing Cd/Zn/Co/Pb vacuolar storage in Arabidopsis [J]. Plant Physiology, 2009, 149(2): 894-904
[26] Weigel H J, Jager H J. Subcellular distribution and chemical form of cadmium in bean plants [J]. Plant Physiology, 1980, 65(3): 480-482
[27] Wang X, Liu Y, Zeng G, et al. Subcellular distribution and chemical forms of cadmium in Bechmeria nivea (L.) Gaud [J]. Environmental & Experimental Botany, 2008, 62(3): 389-395
[28] 张雯, 林匡飞, 周健, 等. 不同硫浓度下叶面施硒对水稻幼苗镉的亚细胞分布及化学形态的影响[J]. 农业环境科学学报, 2014, 33(5): 844-852
Zhang W, Lin K F, Zhou J, et al. Effects of selenium foliar spray on subcellular distribution and chemical forms of cadmium in rice seedlings in different sulfur concentrations [J]. Journal of Agro-Environment Science, 2014, 33(5): 844-852 (in Chinese)
[29] 温娜, 王景安, 刘仲齐. 利用AMMI模型分析稻米镉含量的基因型与环境互作效应[J]. 农业环境科学学报, 2015, 34(5): 817-823
Wen N, Wang J A, Liu Z Q. Analysis of genotypic and environmental effects on cadmium content in rice by AMMI model [J]. Journal of Agro-Environment Science, 2015, 34(5): 817-823 (in Chinese)
[30] 张颖, 杨迎霞, 郏艳红, 等. 利用离体叶片鉴定杨树耐盐潜力[J]. 植物学报, 2011, 46(3): 302-310
Zhang Y, Yang Y X, Jia Y H, et al. Using leaf sections to identify different salt tolerance potential of poplar plants [J]. Chinese Bulletin of Botany, 2011, 46(3): 302-310 (in Chinese)
[31] 高俊凤. 植物生理学实验指导[M]. 北京: 高等教育出版社, 2006: 74-77
Gao J F. Plant Physiology Experiment Instruction [M]. Beijing: Higher Education Press, 2006: 74-77 (in Chinese)
[32] Linger P, Ostwald A, Haensler J. Cannabis sativa L. growing on heavy metal contaminated soil: Growth, cadmium uptake and photosynthesis [J]. Biologia Plantarum, 2005, 49(4): 567-576
[33] Degryse F, Shahbazi A, Verheyen L, et al. Diffusion limitations in root uptake of cadmium and zinc, but not nickel, and resulting bias in the Michaelis Constant [J]. Plant Physiology, 2012, 160(2): 1097-1109
[34] Epstein E, Hagen C E. A kinetic study of the absorption of alkali cations by barley roots [J]. Plant Physiology, 1952, 27(3): 457-474
[35] 王玉倩, 汪晓丽, 单玉华, 等. 环境因素对小麦根系非选择性阳离子通道(NSCCs)转运钾的影响[J]. 植物营养与肥料学报, 2010, 16(4): 913-917
Wang Y Q, Wang X L, Shan Y H, et al. Effects of environmental factors on nonselective cation channels mediated potassium uptake of wheat roots [J]. Plant Nutrition and Fertilizer Science, 2010, 16(4): 913-917 (in Chinese)
[36] 张参俊, 尹洁, 张长波, 等. 非选择性阳离子通道对水稻幼苗镉吸收转运特性的影响[J]. 农业环境科学学报, 2015, 34(6): 1028-1033
Zhang S J, Yin J, Zhang C B, et al. Effects of nonselective cation channels on accumulation and transfer of Cd in rice seedlings [J]. Journal of Agro-Environment Science, 2015, 34(6): 1028-1033 (in Chinese)
[37] Sansoulet J, Cabidoche Y M, Cattan P. Absorption and transport of nitrate and potassium in an Andosol under banana (Guadeloupe, French West Indies) [J]. European Journal of Soil Science, 2007, 58(2): 478-489
[38] 吴晓丽, 罗玉明, 徐迎春, 等. 狭叶香蒲吸收Cd2+的动力学特征[J]. 广西植物, 2008, 28(4): 511-514
Wu X L, Luo Y M, Xu Y C, et al. The kinetics characteristic of Cd2+absorption of Typha angustif olia [J]. Guihaia, 2008, 28(4): 511-514 (in Chinese)
[39] Uraguchi S, Mori S, Kuramata M, et al. Root-to-shoot Cd translocation via the xylem is the major process determining shoot and grain cadmium accumulation in rice [J]. Journal of Experimental Botany, 2009, 60(9): 2677-2688
[40] Roth U, von Roepenack-Lahaye E, Clemens S. Proteome changes in Arabidopsis thaliana roots upon exposure to Cd2+[J]. Journal of Experimental Botany, 2006, 57(15): 4003-4013
[41] Papoyan A, Pieros M, Kochian L V. Plant Cd2+and Zn2+status effects on root and shoot heavy metal accumulation in Thlaspi caerulescens [J]. New Phytologist, 2007, 175(1): 51-58
[42] 赵学强, 介晓磊, 李有田, 等. 不同基因型小麦钾离子吸收动力学分析[J]. 植物营养与肥料学报, 2006, 12(3): 307-312
Zhao X Q, Jie X L, Li Y T, et al. Study on potassium uptake kinetics by different genotype wheat [J]. Plant Nutrition and Fertilizer Science, 2006, 12(3): 307-312 (in Chinese)
[43] Tester M, Leigh R A. Partitioning of nutrient transport processes in roots [J]. Journal of Experimental Botany, 2001, 52: 445-457
[44] Sasaki A,Yamaji N, Yokosho K, et al. Nramp5 is a major transporter responsible for manganese and cadmium uptake in rice [J]. The Plant Cell, 2012, 24(5): 2155-2167
[45] Takahashi R,Ishimaru Y, Senoura T, et al. The OsNRAMP1 iron transporter is involved in Cd accumulation in rice [J]. Journal of Experimental Botany, 2011, 62(14): 4843-4850
[46] Pinto E, Ferreira I M. Cation transporters/channels in plants: Tools for nutrient biofortification [J]. Journal of Plant Physiology, 2015, 179: 64-82
[47] 于辉, 杨中艺, 杨知建, 等. 不同类型镉积累水稻细胞镉化学形态及亚细胞和分子分布[J]. 应用生态学报, 2008, 19(10): 2221-2226
Yu H, Yang Z Y, Yang Z J, et al. Chemical forms and subcellular and molecular distribution of Cd in two Cd-accumulation rice genotypes [J]. Chinese Journal of Applied Ecology, 2008, 19(10): 2221-2226 (in Chinese)
[48] 王芳, 丁杉, 张春华, 等. 不同镉耐性水稻非蛋白巯基及镉的亚细胞和分子分布[J]. 农业环境科学学报, 2010, 29(4): 625-629
Wang F, Ding S, Zhang C H, et al. Non-proteinthiols, subcellular and molecular distribution of cadmium in two rice cultivars with difference tolerance [J]. Journal of Agro-Environment Science, 2010, 29(4): 625-629 (in Chinese)
[49] Sela M, Tel-Or E, Fritz E, et al. Localization and toxic effects of cadmium, copper, and uranium in azolla [J]. Plant Physiology, 1988, 88(1): 30-36
[50] Ueno D, Yamaji N, Kono I, et al. Gene limiting cadmium accumulation in rice [J]. Proceedings of the National Academy of Sciences of the United States of America, 2010, 107(38): 16500-16505
[51] 吕素莲. 转bet A和TsVP基因提高棉花耐盐、抗旱性的研究[D]. 济南: 山东大学, 2008: 56-58
Lv S L. Study on the enhancement of salt and drought tolerance of cotton plants by transgene Bet A and TsVP [D]. Ji’nan: Shandong University, 2008: 56-58 (in Chinese)
◆
Genotypic Difference of Cadmium Accumulation Characteristics and Cadmium Tolerance in Detached Leaves of Rice (OryzasativaL.) Seedlings
Wang Long1,2, Yang Yixin3, Gao Ziping1, Yin Jie1, Liu Yang1, Zhang Changbo1, Tang Jihua2, #, Liu Zhongqi1,2,*
1. Agro-Environmental Protection Institute, Ministry of Agriculture, Tianjin 300191, China 2. College of Agronomy, Henan Agricultural University, Zhengzhou 450002, China 3. Xiangyin Bureau of Agriculture, Xiangyin 414600, China
Received 11 April 2016 accepted 1 August 2016
The uptake capability of cadmium (Cd) in roots and Cd transport efficiency from roots to shoots are the key factors affecting Cd accumulation in rice shoots. Increasing the inhibition of Cd uptake by rice roots is in advantage of reducing the risk to people health posed by high Cd content in rice grains in southern China. Here, seedlings from the core germplasms with high-Cd-accumulation, i.e., ‘Qitoubaigu’, and low-Cd-accumulation, i.e., ‘27760’, as well as their detached leaves were used to study the characteristics of Cd uptake and tolerance to Cd toxicity. Experimental results indicated that the Cdabsorption kinetic characteristics of root cell wall and protoplast were well described with Michaelis-Menten equations. The maximum Cd absorption rate Fmaxof ‘Qitoubaigu’ was significantly greater than that of ‘27760’, while Kmvalues were not significantly different between two rice varieties. The Cd accumulation rates in cell wall and protoplast of ‘Qitoubaigu’ were significantly higher than that of ‘27760’ when the concentration of Cd in rhizosphere environment was over 0.89 μmol·L-1. The Cd absorption rates in cell walls and protoplasts of aboveground parts were linearly increased with the Cdconcentrations in soluble fractions of root cells. ‘Qitoubaigu’ showed significantly higher Cd accumulation rates in cell walls and protoplasts of aboveground parts than ‘27760’ when their Cdconcentrations in soluble fractions of root cells were same. The detached leaves of ‘Qitoubaigu’ displayed lower chlorophyll decreasing rate than that of ‘27760’ when the detached leaves were maintained in Cd concentrations varied from 0.89 μmol·L-1to 8.9 μmol·L-1. ‘Qitoubaigu’ had strong tolerance to Cd, fast Cd accumulation rate and high transport efficiency. The Cd tolerance of rice detached leaves was closely associated with the Cd accumulation in seedlings roots and Cd transport efficiency from roots to shoots. These physiological traits can be used for fast identification of low-Cd-accumulation variety.
cadmium (Cd); rice; accumulation characteristics; subcellular distribution; detached leaves; chlorophy; genotypic difference
2016年中国农科院科技创新工程项目(2016-cxgc-lzq);公益性行业(农业)科研专项(201403015)
王龙(1988-),男,河南漯河人,硕士研究生,研究方向为作物育种原理与方法,E-mail: hnndwanglong@163.com;
*通讯作者(Corresponding author), E-mail: liuzhongqi508@163.com
10.7524/AJE.1673-5897.20160411002
2016-04-11 录用日期:2016-08-01
1673-5897(2016)6-187-10
X171.5
A
刘仲齐(1964-),男,博士,研究员,主要研究方向为植物营养与分子生物学。近年来在国内外核心刊物上发表论文80多篇。
汤继华(1969-),男,博士,教授,主要研究方向为植物分子生物学。近年来在国内外核心期刊上发表论文70多篇。
# 共同通讯作者(Co-corresponding author), E-mail: Tangjihua1@163.com
王龙, 杨益新, 高子平, 等. 水稻幼苗镉积累特征和离体叶片耐镉性的基因型差异[J]. 生态毒理学报,2016, 11(6): 187-196
Wang L, Yang Y X, Gao Z P, et al. Genotypic difference of cadmium accumulation characteristics and cadmium tolerance in detached leaves of rice (Oryza sativa L.) seedlings [J]. Asian Journal of Ecotoxicology, 2016, 11(6): 187-196 (in Chinese)
