玉米赤霉烯酮暴露对秀丽线虫生殖系统的损伤作用
2016-03-17杨振东王加生唐莉莉孙秀兰KathyXue
杨振东,王加生,,*,唐莉莉,,孙秀兰,Kathy S. Xue
1. 江南大学食品学院,无锡 214122 2. 美国佐治亚大学环境健康科学系,佐治亚雅典30602
玉米赤霉烯酮暴露对秀丽线虫生殖系统的损伤作用
杨振东1,王加生1,2,*,唐莉莉1,2,孙秀兰1,Kathy S. Xue2
1. 江南大学食品学院,无锡 214122 2. 美国佐治亚大学环境健康科学系,佐治亚雅典30602
环境雌激素玉米赤霉烯酮(ZEN)的生态安全性近年来受到越来越多的关注。以秀丽隐杆线虫(Caenorhabdites elegans)为模式生物研究ZEN对线虫的生殖损伤作用。在DIC显微镜下观察,48 h暴露后与对照组相比,暴露组线虫性腺臂明显萎缩,卵母细胞数目和大小均受到显著影响(P<0.01),并且可见部分暴露组线虫产卵器严重畸形。这均表明ZEN暴露对秀丽隐杆线虫生殖系统的发育和功能可产生损害作用。
玉米赤霉烯酮;秀丽隐杆线虫;生殖损伤
玉米赤霉烯酮(ZEN)是一种由禾谷镰刀菌、粉红镰刀菌、拟枝孢镰刀菌等多种镰刀菌代谢产生的具有雌激素生物活性的霉菌毒素[1]。因为首先从污染了禾谷镰刀菌的发霉玉米中分离得到,所以命名为玉米赤霉烯酮[2]。ZEN广泛存在于玉米、小麦、高粱、燕麦以及以这些谷物为原料的食品和饲料中[3],是世界上污染范围最广的一种霉菌毒素。目前的研究证明ZEN具有很强的雌激素效应,可以导致暴露动物生殖器官畸形、胎儿死亡、繁殖障碍,给畜牧业造成巨大的经济损失。实验表明ZEN可以通过胎盘,影响胚胎和母体之间的物质吸收、利用和与转运,间接地损害胚胎进而影响了后代的生长发育[4]。ZEN进入人体,还可能诱发肿瘤,给人类健康造成极大危害[5]。
秀丽隐杆线虫(Caenorhabditis elegans, C. elegans)是一种简单的多细胞生物,20世纪60年代分子遗传学专家Sydney Brenner利用其探索神经发育的遗传调控机制,逐渐引起科学家们广泛关注[6]。秀丽隐杆线虫可以在水中或者土壤中生存,虫体小,繁殖能力强,生命周期短,其全身透明方便显微镜观察。目前科学家们已经完成了对秀丽隐杆线虫基因测序,其基因组序列清晰且突变体资源丰富。当前秀丽线虫在环境毒理学、环境监测等领域已经得到广泛应用。有报道显示真菌毒素可以引起秀丽线虫寿命缩短[7]、虫体死亡和生殖能力降低[8]。笔者首次利用秀丽隐杆线虫作为模式生物,研究了ZEN对秀丽线虫生殖系统器官发育及其功能的影响。
1 材料与方法(Materials and methods)
1.1 试剂与线虫品系
玉米赤霉烯酮购自于Sigma-Aldrich公司。玉米赤霉烯酮粉末先溶解于二甲基亚砜(DMSO)制备成储备液,然后稀释为实验分析使用的浓度。
秀丽线虫品系为野生型N2,购买于国际线虫遗传中心(CGC)。线虫储备培养使用含有大肠杆菌OP50的线虫生长琼脂培养基[9]。用于指标测试的线虫培养使用含OP50的液体培养基L-broth[10]。所有线虫培养均在20 ℃条件下进行。
1.2 线虫同期化
将成虫线虫用K-medium冲洗转移到10 mL离心管中,3 000 r·min-1离心7 min,取沉淀加10 mL裂解液(8 mol·mL-1NaOH:NaClO = 5:1, V/V),静置5 min,2 000 r·min-1离心7 min留沉淀。继续加入10 mL K-medium轻轻混匀后2 000 r·min-1离心7 min,将沉淀接种到NGM培养板,20 ℃下培养。
1.3 暴露方法
使用12孔细胞板培养线虫,每孔滴入1 mL含有特定浓度ZEN的L-broth溶液。同期化线虫生长到L2期后,每孔转入20条线虫,20 ℃培养48 h。
1.4 单侧性腺臂卵母细胞体积和数目测定
将同期化的线虫在ZEN中暴露48 h,随机每组挑取6条线虫至载玻片上,用10%福尔马林溶液处死线虫,盖上盖玻片,使用显微镜DIC镜头观察拍照记录。使用Image-Pro®Express software进行卵母细胞体积测量。并统计线虫单侧性腺臂远端loop区到性腺臂近端储精囊之间的卵母细胞数目[11]。
1.5 统计学分析
实验结果均用SPSS 16.0软件进行分析。应用ONEWAY-ANOVA检验方法对数据间进行组间差异显著性分析。P<0.05为差异具有统计学意义。实验至少重复3次,结果以均值和标准差形式给出。
2 结果(Results)
2.1 ZEN暴露可以导致秀丽线虫性腺臂近端臂形态变化
性腺臂是秀丽线虫形成卵母细胞的场所,功能上与哺乳动物的卵巢相似,是线虫的重要生殖器官。图1结果显示同等放大比例下对照组的线虫单侧性腺臂呈U型弯曲,外观平滑粗壮,而ZEN暴露组线虫的性腺臂表现出明显退化萎缩,不但宽度变窄,长度也缩短。5 mg·L-1ZEN暴露组的线虫性腺臂还可见U型弯曲,长度和宽度已经明显缩小。随ZEN暴露浓度逐渐增加,10 mg·L-1暴露组线虫性腺臂已经不见U型弯曲,不可区分性腺臂远端和近端。80 mg·L-1ZEN暴露组的线虫,甚至在显微镜照片中观察不到明显的性腺臂轮廓。
2.2 ZEN暴露可以导致秀丽线虫卵母细胞形态变化
图2为不同浓度ZEN暴露组线虫卵母细胞与对照组对比图片。由图2可见对照组性腺臂内的卵母细胞排列整齐,细胞数目较多接触紧密,形状为饱满的椭圆形。而暴露组线虫的卵母细胞形状均由饱满变为瘦长型,并且排列松散。20 mg·L-1和50 mg·L-1暴露组线虫卵母细胞不再呈现规则椭圆,多为不规则形状,尺寸明显减小,并且原始生殖细胞与支持细胞排列散乱。暴露组线虫卵母细胞相较于对照组尺寸可见明显变化(如图3所示),并且呈现ZEN暴露浓度依赖关系。不同浓度ZEN暴露组的卵母细胞大小普遍小于对照组,5 mg·L-1暴露组即出现显著缩小现象,高浓度50 mg·L-1暴露组线虫的卵母细胞尺寸仅为对照组的44.5%。
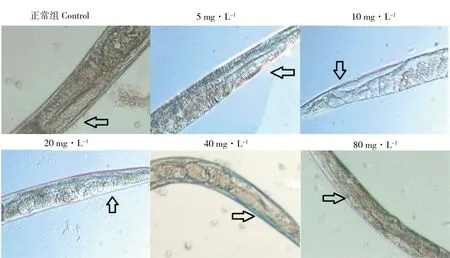
图1 不同浓度玉米赤霉烯酮(ZEN)暴露下秀丽线虫(C. elegans)的性腺臂形态对比注:箭头所指是性腺臂。Fig. 1 Comparison of gonad arm morphology of C. elegans under different ZEN concentrationNote: Arrow refers to the gonadal arm.
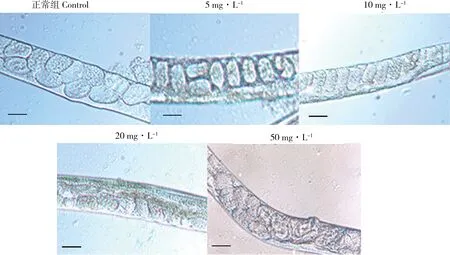
图2 不同浓度ZEN暴露下秀丽线虫的卵母细胞形态比较(标尺=50 μm)Fig. 2 Comparison of oocyte cells morphology of C. elegans under different ZEN concentration (scale bars, 50 μm)
2.3 ZEN暴露可以导致秀丽线虫卵母细胞数目减少
使用DIC镜头观察秀丽线虫单侧性腺臂并记录卵母细胞数目。如图4所示5 mg·L-1ZEN暴露组线虫单侧性腺臂卵母细胞数目无显著性变化,从10 mg·L-1暴露浓度线虫卵母细胞明显减少,并且表现出一定的浓度依赖性。50 mg·L-1暴露组线虫性腺臂内卵母细胞较之对照组显著减少,仅为对照组卵母细胞数目的39.17%。并且暴露48 h,对照组中成虫第1天的线虫已经有明显成熟的卵母细胞,但在80 mg·L-1暴露组同龄线虫并没有可观测到的卵母细胞。
2.4 ZEN暴露可以导致C.elegans产卵器畸形
如图5a中所示,对照组线虫产卵器由左右对称两组肌肉组成,肌肉之间自然存在狭缝,外观平滑没有明显凸起。而ZEN暴露组线虫产卵器出现多种畸形:狭缝消失(图5b)、产卵器肌肉组群不对称和肌肉凸起(图5c),有的甚至长出赘瘤(图5d)。这些畸变有可能导致线虫无法正常产出虫卵,虫卵在母体内孵化导致母体死亡(图e和f),这种现象通常被叫做“虫袋(worm bag)”[12]。
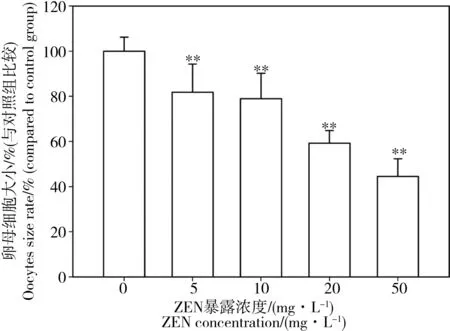
图3 不同ZEN浓度下秀丽线虫卵母细胞大小比较注:与对照组卵母细胞面积对比得出比率,**P<0.01。Fig. 3 Comparison of oocytes size rate of C. elegans under different ZEN concentrationsNote: The oocytes size rate is calculated as that exposed oocytes size is divided by normal oocytes size. **P<0.01.
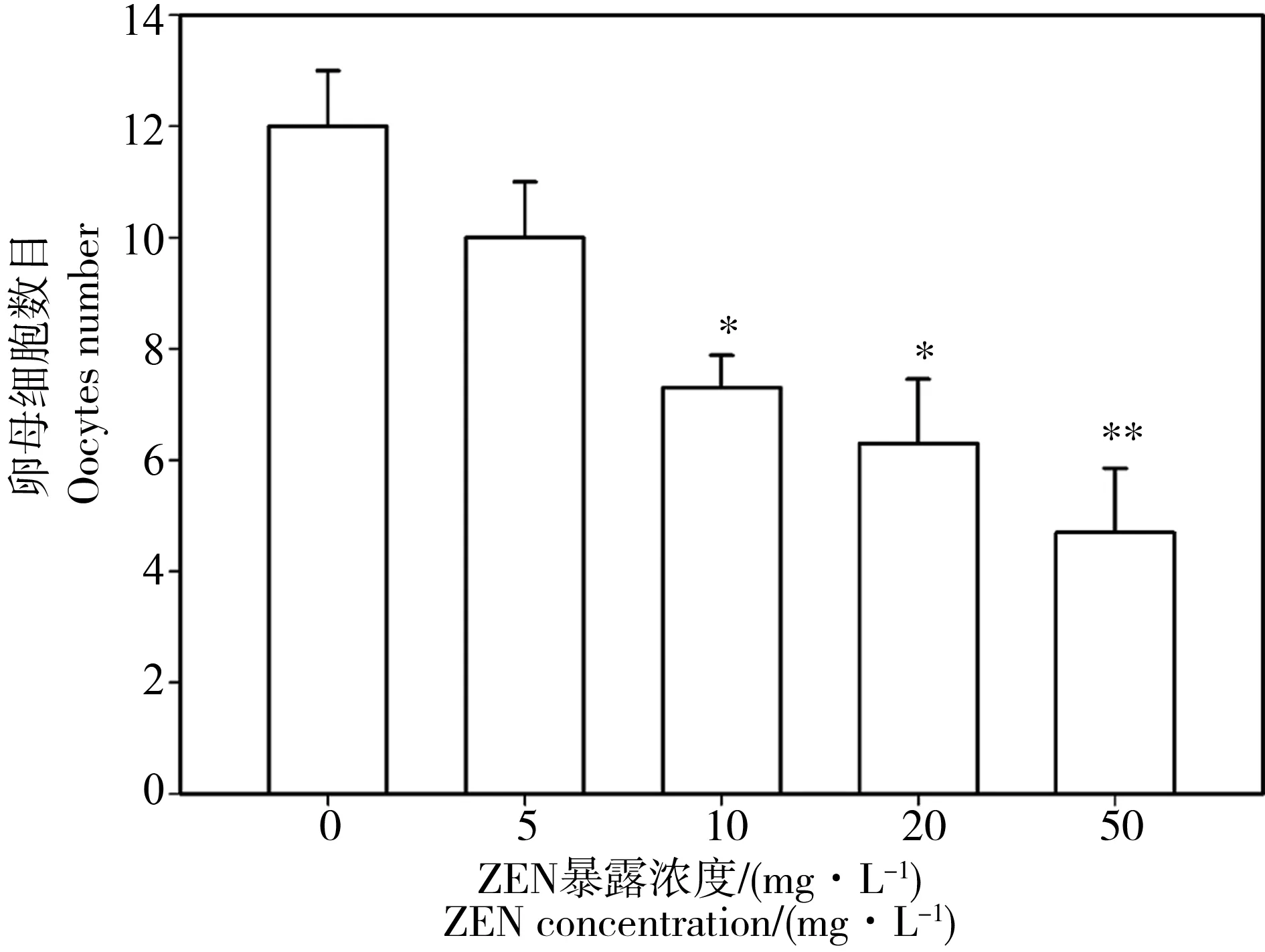
图4 不同ZEN浓度下秀丽线虫单侧性腺臂卵母细胞数目注:与对照组比较,*P<0.05,**P<0.01。Fig. 4 Comparison of oocytes number in gonad arm of C. elegans under different ZEN concentrationsNote: compared with the control, *P<0.05, **P<0.01.

图5 秀丽线虫产卵器形态比较(黑圈内为线虫产卵器)注:a,正常产卵器;b,狭缝消失;c,产卵器肌肉群不对称并且异常凸起;d,产卵器赘瘤;e,虫袋;f,虫袋。Fig. 5 Comparison of normal and abnormal vulva morphology of C. elegans under ZEN exposure (black circles point to vulva)Note: a, normal vulva morphology; b, disappeared vulva slit; c, asymmetrical and protruding vulva; d, vulva neoplasm; e, worm bag; f, worm bag.
3 讨论(Discussion)
秀丽线虫近几年成为科学研究的重要模式生物,它存活在土壤中,成虫体长仅1 mm,周身透明,以细菌为食。另外秀丽线虫有雌雄同体和雄性2种性别,但是绝大部分为雌雄同体,仅1%左右为雄性。雌雄同体个体既可以进行自体受精,也可以与雄性个体交配[13]。本实验以雌雄同体线虫为研究对象,观察ZEN暴露对秀丽线虫生殖系统发育和功能的影响。
雌雄同体线虫的生殖系统由一条左右对称的性腺臂(图6a)组成,单侧性腺臂可划分为近端臂和远端臂(图6b)。远端臂即为线虫的卵巢部分,卵子的产生和成熟都在此完成。远端臂是线虫排出卵子,形成受精卵和受精卵发育的场所。受精卵发育成熟后,由生在线虫腹部中部的产卵器排出[14]。本实验中对照组秀丽线虫卵母细胞从单侧性腺臂的远端臂到性腺臂近端储精囊之间是紧密排列并且与体细胞充分接触,随着靠近储精囊,卵子发育愈发成熟,体积会逐渐增大,形状大多为规则饱满的椭圆形。而ZEN暴露组线虫的卵母细胞不但数目减少,体积明显变小,形态也发生了变化,由椭圆发展为不规则形状,饱满变为瘦长,卵母细胞之间也不再紧密排列而是出现缝隙(图2)。这些现象体现ZEN暴露影响了秀丽线虫性腺臂生成正常卵母细胞的功能,导致卵母细胞数量减少,发育不完全。Wolke等[15]研究发现线虫卵母细胞的生长主要依靠性腺臂粗黑线区域细胞流(图6b)向近端臂的卵巢输送营养物质,而细胞间接触承担了营养输送功能。本研究中图1显示ZEN暴露使线虫性腺臂长度明显缩短,已经无法区分近端和远端性腺臂。这可能导致卵母细胞无法得到充足营养物质,影响正常发育。而卵母细胞不规则排列,细胞间间隙增大,也可能是阻碍营养正常运输的另一个原因,抑制卵母细胞发育,从而导致卵母细胞发育缓慢,体积缩小,子宫内受精卵数目减少[16]。

图6 秀丽线虫的生殖系统示意图注:a, 雌雄同体秀丽线虫的生殖系统示意图;b,单侧性腺臂的结构图。Fig. 6 Reproductive system structure of C. elegans Note: a, reproductive system for hermaphrodites; b, unilateral gonad arm structure.
秀丽线虫从胚胎发育成成虫,要经历4个阶段,而产卵期发育基本在第3阶段即可全部完成。本实验所用线虫均为L2期,L2到L3大概要经历10 h。尽管ZEN可产生影响的时间较短,图5依然显示秀丽线虫产卵器产生严重畸形。这些畸形对秀丽线虫的排卵功能可能造成一定程度的损伤,导致秀丽线虫排卵受阻。这种损伤会降低秀丽线虫的生殖能力,同时受精卵无法排出体外便会在虫体内孵化,导致秀丽线虫母体死亡(图5e和f)。据研究报道ZEN暴露可引起脊椎动物体内雌激素紊乱,母猪表现出阴户肿胀、乳腺增大等生殖器官异常现象[17],而秀丽线虫本身并没有成熟的生殖系统,仅有性腺臂和子宫、产卵器等简单生殖器官,是否由于ZEN的类雌性激素作用引起这种生殖器官畸形还有待进一步验证。
有研究证明ZEN可以通过p53依赖的线粒体信号通络,导致HepG2细胞凋亡,也可以使人肠细胞系细胞中的线粒体和溶酶体产生过氧化反应,使细胞器结构遭到破坏,导致细胞死亡[18]。另外ZEN导致卵母细胞的不正常发育在大鼠中也有发现,对大鼠腹腔注射ZEN,暴露96 h后剖杀观察其卵巢组织,可见其卵巢组织出现不同程度损伤,卵泡颗粒细胞畸形发育并可见凋亡[2]。ZEN可以通过影响性腺各组织的能量代谢导致细胞的死亡,使组织产生退行性病变,影响其正常的结构与功能,笔者因此推断这是ZEN暴露组线虫性腺臂退化、卵母细胞减少的原因(图1)。
综上所述,ZEN可以导致秀丽隐杆线虫生殖腺臂萎缩,卵母细胞数目减少、形状突变,诱发产卵器发育畸形,这表明ZEN对秀丽线虫具有生殖毒性。笔者的前期研究表明ZEN导致器官畸变从而诱发秀丽线虫死亡以及生殖能力下降[8]。秀丽线虫作为一种简单模式生物在生殖毒性实验中表现出易操作、短周期、高灵敏等独特的优势。这种优势奠定了它在环境毒性评价中的应用价值,可用于进行环境毒素毒性的快速筛检。不过本研究虽证明了ZEN暴露对秀丽线虫生殖系统可以产生不利影响,但其作用机理机制仍有待深入研究。
[1] Cortinovis C, Pizzo F, Spicer L J, et al. Fusarium mycotoxins: Effects on reproductive function in domestic animals—A review [J]. Theriogenology, 2013, 80(6): 557-564
[2] 周宏超, 郭良, 史嘉瑜, 等. 玉米赤霉烯酮中毒大鼠卵巢组织p53和NF-κB的表达[J]. 中国兽医学报, 2013, 33(8): 1278-1281
Zhou H C, Guo L, Shi J Y, et al. Expression of p5 and NF-κB of ovaries in SD rats with zearalenone mycotoxicosis[J]. Chinese Journal of Veterinary Science, 2013, 33(8):1278-1281 (in Chinese)
[3] Bakos K, Kovacs R, Staszny A, et al. Developmental toxicity and estrogenic potency of zearalenone in zebrafish (Danio rerio) [J]. Aquatic Toxicology, 2013, 136: 13-21
[4] Luo S, Kleemann G A, Ashraf J M, et al. TGF-β and insulin signaling regulate reproductive aging via oocyte and germline quality maintenance [J]. Cell, 2010, 143(2): 299-312
[5] 高凤, 刘晓芳. 玉米赤霉烯酮的毒理学研究进展[J]. 毒理学杂志, 2012, 26(1): 55-58
[6] 黄月娥, 姜玉新, 巩蔚, 等. 环境酸碱度对秀丽隐杆线虫生长发育及毒性试验的影响[J]. 热带病与寄生虫学, 2013, 11(2):197-203
Huang Y E, Jiang Y X, Gong W, et al. The influence of pH on the growth and development of Caenorhabditis elegans and the toxicity test [J]. Journal of Tropical Diseases and Parasitology, 2013, 11(2): 197-203 (in Chinese)
[7] Gowrinathan Y, Pacan J C, Hawke A, et al. Toxicity assay for deoxynivalenol using Caenorhabditis elegans [J]. Food Additives & Contaminants: Part A, 2011, 28(9):1235-1241
[8] Yang Z, Xue K S, Sun X, et al. Multi-toxic endpoints of the foodborne mycotoxins in nematode Caenorhabditis elegans [J]. Toxins (Basel), 2015, 7(12): 5224-5235
[9] Brenner S. The genetics of Caenorhabditis elegans [J]. Genetics, 1974, 77(1): 71-94
[10] Ma H B, Bertsch P M, Glenn T C, et al. Toxicity of manufactured zinc oxide nanoparticles in the nematode Caenorhabditis elegans[J]. Environmental Toxicology and Chemistry, 2009, 28(6): 1324-1330
[11] Ruan Q L, Ju J J, Li Y H, et al. Chlorpyrifos exposure reduces reproductive capacity owing to a damaging effect on gametogenesis in the nematode Caenorhabditis elegans[J]. Journal of Applied Toxicology, 2012, 32(7): 527-535
[12] Kumar S, Aninat C, Michaux G, et al. Anticancer drug 5-fluorouracil induces reproductive and developmental defects in Caenorhabditis elegans [J]. Reproductive Toxicology, 2010, 29(4): 415-420
[13] Corsi A K, Bruce W, Martin C. A transparent window into biology: A primer on Caenorhabditis elegans [J]. Genetics, 2015, 200(2): 387-407
[14] Hubbard E J, Greenstein D. Introduction to the germ line[EB/OL]. [2016-03-06]. http://www.wormbook.org/toc_devcontrolmech.html
[15] Wolke U, Jezuit E A, Priess J R. Actin-dependent cytoplasmic streaming in C. elegans oogenesis [J]. Development, 2007, 134(12): 2227-2236
[16] 李乃鹏, 梁琼麟, 罗国安, 等. 长期酒精暴露对秀丽隐杆线虫生殖能力的损伤作用研究[J]. 中国当代医药, 2013, 20(9):13-17
Li N P, Liang Q L, Luo G A, et al. Study of the reproductive injury of Caenorhabditis elegans induced by alcohol with a long-term exposure [J]. China Modern Medicine, 2013, 20(9):13-17 (in Chinese)
[17] Wang D F, Zhang N Y, Peng Y Z, et al. Interaction of zearalenone and soybean isoflavone in diets on the growth performance, organ development and serum parameters in prepubertal gilts[J]. Journal of Animal Physiology and Animal Nutrition, 2012, 96(5): 939-946
[18] Ayed-Boussema I, Bouaziz C, Rjiba K, et al. The mycotoxin zearalenone induces apoptosis in human hepatocytes (HepG2) via p53-dependent mitochondrial signaling pathway [J]. Toxicology in Vitro, 2008, 22(7): 1671-1680
◆
The Reproductive Toxic Effects of Zearalenone onCaenorhabditiselegans
Yang Zhendong1, Wang Jia-Sheng1,2,*, Tang Lili1,2, Sun Xiulan1, Kathy S. Xue2
1. School of Food Science and Technology, Jiangnan University, Wuxi 214122, China 2. Department of Environmental Health and Science, University of Georgia, Athens 30602, USA
Received 6 March 2016 accepted 3 April 2016
Ecological safety of zearalenone (ZEN), a potent environmental endocrine disruptor, has been a great concern. To study the reproductive toxic effects of ZEN, L2 Caenorhabdites elegans (C. elegans) were exposed to different doses of ZEN in various times. After 48 h exposure to ZEN, the morphology of the gonad arm, the vulva, and the oocytes in uterus was examined by DIC microscope. As compared to the control group, atrophic gonad arms, abnormal vulva structures and smaller oocytes were found with significantly statistical differences in worms treated with ZEN (P<0.01). The oocytes numbers and their size were significantly affected by ZEN. Worms in ZEN-treated group also showed abnormal vulva structures and defects. These results demonstrated severe damages of reproductive and developmental functions following ZEN exposure in C. elegans.
zearalenone; Caenorhabditis elegans; reproductive damage
国家自然科学基金联合基金项目(u1301214)
杨振东(1986-),女,博士,研究方向为真菌毒素毒性检测,E-mail: zdyang777@163.com;
*通讯作者(Corresponding author), E-mail: jswang@uga.edu
10.7524/AJE.1673-5897.20160306002
2016-03-06 录用日期:2016-04-03
1673-5897(2016)6-171-06
X171.5
A
王加生(1955-),男,分子流行病学博士,长江学者特聘教授,长期从事生物毒素分子生物标志物研究。
杨振东, 王加生, 唐莉莉, 等. 玉米赤霉烯酮暴露对秀丽线虫生殖系统的损伤作用[J]. 生态毒理学报,2016, 11(6): 171-176
Yang Z D, Wang J S, Tang L L, et al. The reproductive toxic effects of zearalenone on Caenorhabditis elegans [J]. Asian Journal of Ecotoxicology, 2016, 11(6): 171-176 (in Chinese)
