离子浓度大小比较题的突破
——以CH3C O OH与N a OH中和反应分析为例
2016-03-17湖南
湖南 龙 威
离子浓度大小比较题的突破
——以CH3C O OH与N a OH中和反应分析为例
湖南 龙 威
高考化学中对水溶液中离子浓度大小的比较,是很多考生非常头痛的难题之一。由于许多学生在学习选修四时没有完全掌握电离和水解的过程,特别是对众多离子存在时的浓度大小判断慌乱无措,成为高考化学的重要障碍。想要从容面对这类试题的解答,只有抓住核心规律,认真分析其过程,方能力克难题。
解决这类问题的基本原则为:①先分析反应完成后溶液的成分。②分析反应中存在哪些过程,且相对程度的大小,以确定溶液的酸碱性。③充分利用电荷守恒和物料守恒来进行判断。其具体过程还得从CH3C O OH与N a OH中和的例子说起。
一、中和过程的核心知识解读
以CH3C O OH滴加到N a OH溶液中为例,分析不同离子的浓度在反应过程中的变化关系。CH3C O OH刚滴入到N a OH溶液时,发生反应CH3C O OH+N a OH CH3C O ON a+H2O,导致OH-浓度降低,此时有c(N a+)>c(OH-),随着CH3C O OH的不断滴加,CH3C O O-浓度不断增大,会赶上或超过OH-浓度,也会赶上或超过N a+浓度,即离子浓度的大小会出现以下7种情况:
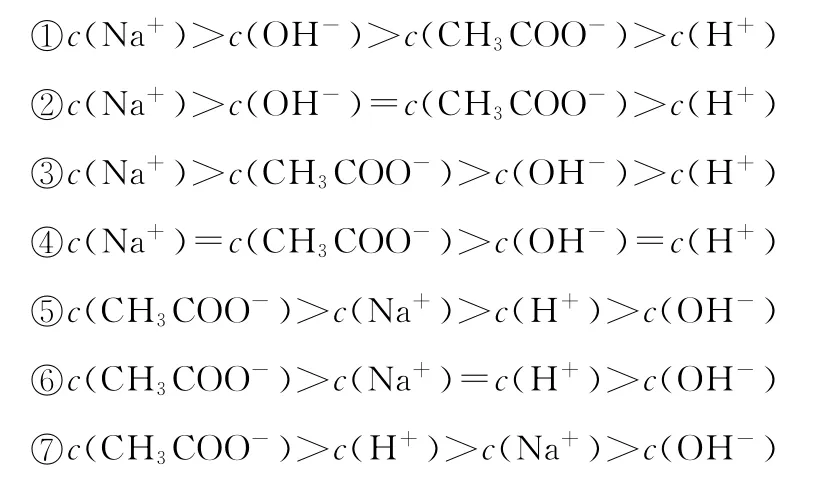
若是N a OH滴加到CH3C O OH溶液中,反应过程中离子浓度的大小,则会按上述表达式反向出现,即先出现⑦,再出现⑥等。常温下,上述表达式中,①②③三种情况的溶液的pH>7,溶液呈碱性;第④种情况的溶液的pH=7,溶液呈中性;⑤⑥⑦三种情况的溶液的pH<7,溶液呈酸性,随着酸的不断增加,H+的浓度会有赶超N a+的趋势。
二、特殊情况的分析
上例中第④种情况的离子浓度大小比较得出的依据是电荷守恒,此处有些学生容易与N a OH、CH3C O OH恰好完全反应混淆。恰好完全反应是指N a OH、CH3C O OH两者等物质的量时的反应,此时溶质为CH3C O ON a,由于CH3C O O-的水解,溶液呈碱性;当溶液呈中性时,此时CH3C O OH稍过量,即n(CH3C O OH)>n(N a OH)。
当N a OH、CH3C O OH两者反应溶液呈酸性时,有两种反应情况在试题中经常出现:

【解题要领】一抓反应前两者物质的量大小,判断何剩余;二抓何剩余显何性,电离远大于水解;三抓最大和最小,再推导中间;四抓反复检查,对比分析。
三、典型试题分析
例1 下图为向2 5m L 0.1m o l/L N a OH溶液中逐滴滴加0.2m o l/L C H3C O OH溶液过程中溶液pH的变化曲线:
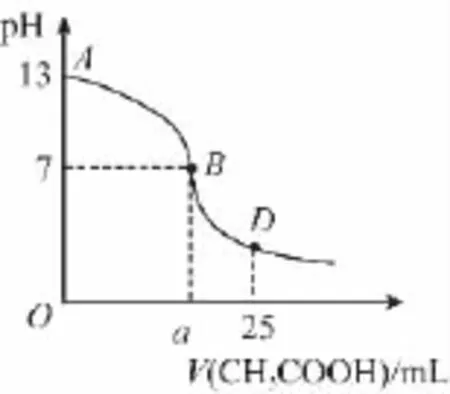
(1)在A B区间内,c(OH-)>c(H+),则c(OH-)与c(CH3C O O-)的大小关系是( )
A.c(OH-)一定大于c(CH3C O O-)
B.c(OH-)一定小于c(CH3C O O-)
C.c(OH-)一定等于c(CH3C O O-)
D.c(OH-)可能大于、小于或等于c(CH3C O O-)
(2)在D点时,溶液中c(CH3C O O-)+c(CH3C O OH)________(填“>”“<”或“=”)2c(N a+)。
【答案】(1)D (2)=
【解析】(1)随着CH3C O OH的不断增加,溶液由碱性逐渐变弱,最终变成酸性,从而pH的变化在图中显示,特别注意B点指的是溶液中和后pH=7即显中性的情况,恰好完全反应点应该在B点前。根据上述文中规律可知,OH-会不断减少,而CH3C O O-会不断增多,所以只能是D选项的情况。(2)D点是等体积混合的点,其CH3C O OH的总物质的量是N a OH的总物质的量的2倍,所以,这个关系是等于。此题在未理解其过程时看似很难,其实很简单。
例2 常温下,用0.1 0 m o l·L-1N a OH溶液滴定2 0.0 0m L 0.1 0m o l·L-1CH3C O OH溶液所得滴定曲线如图所示。下列说法正确的是( )
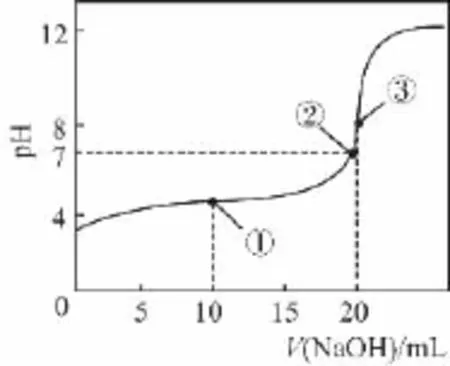
A.点①所示溶液中:
c(CH3C O O-)+c(OH-)=c(CH3C O OH)+c(H+)
B.点②所示溶液中:
c(N a+)=c(CH3C O OH)+c(CH3C O O-)
C.点③所示溶液中:
c(N a+)>c(OH-)>c(CH3C O O-)>c(H+)
D.滴定过程中可能出现:
c(CH3C O OH)>c(CH3C O O-)>c(H+)>c(N a+)>c(OH-)
【答案】D
【解析】本题是例1的过程变形,就是在弱酸中加入强碱,其中点①点是加入碱是酸的一半,点②是完全中和pH=7的点,点③是恰好完全反应的点。A选项的难度还是很大的,如果是电荷守恒,应该写成c(CH3C O O-)+c(OH-)=c(N a+)+c(H+);如果是CH3C O OH水溶液的质子守恒,应该写成c(CH3C O O-)+c(OH-)=c(H+),很显然由于CH3C O OH的电离会使它本身的浓度低于N a+的浓度,如A选项的关系应该是小于。B选项中不遵循物料守恒,要使得溶液呈中性,c(N a+)<c(CH3C O OH)+c(CH3C O O-)。C选项中恰好反应的情况中有c(OH-)<c(CH3C O O-),因为此时的OH-是由于CH3C O O-水解得到,水解过程毕竟是微小的。D选项中的结果是可能出现的,当加入的碱是微量的时候,正是D所述的关系。
【总结】我们应该学会分析中和过程中的几个点,明白酸碱性和离子大小浓度的决定因素,方能看穿其中的大小关系。
【自我巩固训练】
1.常温下,向1 0m L 0.1m o l·L-1N a OH溶液中逐滴加入0.1m o l·L-1醋酸溶液,所得滴定曲线如图所示。下列说法正确的是( )
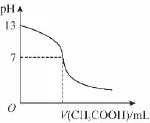
A.pH=7时,所加醋酸溶液的体积为1 0m L
B.pH<7时,溶液中:c(CH3C O O-)>c(N a+)
C.7<pH<1 3时,溶液中:c(N a+)>c(CH3C O O-)>c(OH-)>c(H+)
D.继续滴加0.1m o l·L-1醋酸溶液,溶液pH可以变为1
2.向体积Va的0.0 5m o l·L-1CH3C O OH溶液中加入体积为Vb的0.0 5 m o l·L-1N a OH溶液,下列关系错误的是( )
A.Va>Vb时:c(CH3C O OH)+c(CH3C O O-)>c(N a+)
B.Va=Vb时:c(CH3C O OH)+c(H+)=c(OH-)
C.Va<Vb时:c(CH3C O O-)>c(N a+)>c(OH-)>c(H+)
D.Va与Vb任意比时:c(N a+)+c(H+)=c(OH-)+c(CH3C O O-)
3.在1 0m L 0.1m o l·L-1N a OH溶液中加入同体积、同浓度CH3C O OH溶液,反应后溶液中各微粒的浓度关系错误的是( )
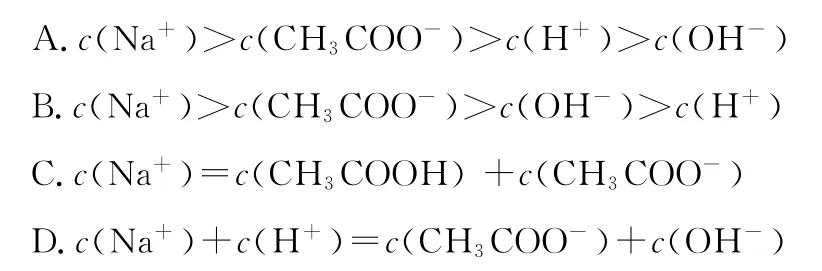
4.在2 5℃时将pH=3的CH3C O OH溶液与pH=1 1的N a OH溶液等体积混合后,下列关系正确的是( )
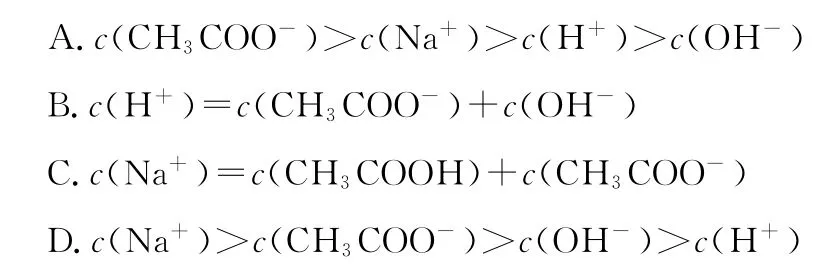
5.按照下列提示填空:
(1)将等体积等物质的量浓度的醋酸和氢氧化钠溶液混合后,溶液呈________(填“酸性”“中性”或“碱性”),溶液中c(N a+)_______(填“>”“=”或“<”)c(CH3C O O-)。
(2)pH=3的醋酸和pH=1 1的氢氧化钠溶液等体积混合后溶液呈________(填“酸性”“中性”或“碱性”),溶液中c(N a+)_______(填“>”“=”或“<”)c(CH3C O O-)。
(3)物质的量浓度相同的醋酸和氢氧化钠溶液混合后,溶液中醋酸根离子和钠离子浓度相等,则混合后溶液呈________(填“酸性”“中性”或“碱性”),醋酸体积________(填“>”“=”或“<”)氢氧化钠溶液体积。
(4)将mm o l/L的醋酸和nm o l/L的氢氧化钠溶液等体积混合后溶液的pH=7,则醋酸溶液中c(H+)________氢氧化钠溶液中c(O H-),m与n的大小关系是m________n。(填“>”“=”或“<”)
【答案】1.B 2.C 3.A 4.A
5.(1)碱性 > (2)酸性 < (3)中性 >(4)< >
【温馨提示】比较离子浓度大小的问题要多次用到假设法、反证法,灵活运用反向思维来推导结论,往往能迅速发现答案是否合理,加强练习,考试成绩会迅速提升。
(作者单位:湖南省湘乡市湖铁中学)
