化学反应速率和化学平衡考点解析
2016-03-17江西刘智勇
江西 刘智勇
化学反应速率和化学平衡考点解析
江西 刘智勇
化学反应速率和化学平衡是高考必考内容,难度较大,区分度好,选拔功能强,备受青睐。通过对近几年的高考试题的分析,影响化学反应速率和平衡的因素、化学图象、化学平衡常数的计算等是考试的热点,预计在未来的高考中,化学平衡常数、化学平衡移动原理在生产和生活中的应用仍然是命题的主要方向。
命题角度一:有关化学反应速率的考查
【高考真题】(2 0 1 5福建)在不同浓度(c)、温度(T)条件下,蔗糖水解的瞬时速率(v)如下表。下列判断不正确的是()
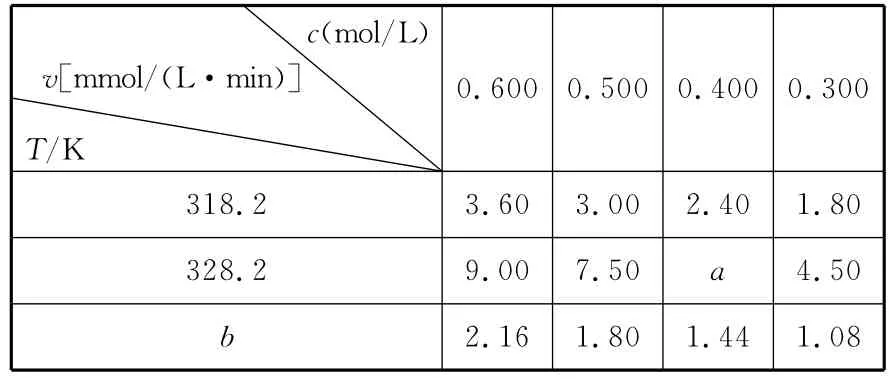
c(m o l/L)v[m m o l/(L·m i n)]T/K 0.6 0 0 0.5 0 0 0.4 0 0 0.3 0 0 ___________3 1 8.2 3.6 0 3.0 0 2.4 0 1.8 0 ___________3 2 8.2 9.0 0 7.5 0a2.1 6 1.8 0 1.4 4 1.0 8 4.5 0b
A.a=6.0 0
B.同时改变反应温度和蔗糖的浓度,v可能不变
C.b<3 1 8.2
D.不同温度时,蔗糖浓度减少一半所需的时间相同
【名师解析】A项,由表格数据可知:在温度不变的条件下,蔗糖蔗糖水解的瞬时速率随浓度的等差递减而呈等差递减,即9.0 0-7.5 0=7.5 0-a=a-4.5 0,可得a=6.0 0,正确;B项,温度和浓度均能改变化学反应速率,若升高温度同时减小浓度或降低温度同时增大浓度,使反应速率可能不发生改变,正确;C项,在浓度不变时,温度与水解速率呈正比。在浓度为0.6 0 0m o l/L时,温度是3 1 8.2K时水解速率是3.6 0mm o l/(L·m i n)>2.1 6mm o l/(L·m i n),说明反应温度低于3 1 8.2K。即b<3 1 8.2,正确。D项,不同温度,蔗糖水解的瞬时速率不同,故蔗糖浓度减少一半所需的时间不相同,错误。
【名师解读】本题以蔗糖的水解反应为载体,通过图表的形式呈现,考查学生的观察、分析、判断和应用的能力。解题的关键是观察数据的变化特点和掌握影响化学反应速率的因素。
【知识链接】
1.化学反应速率
(1)表示方法:通常用单位时间内反应物浓度的减少或生成物浓度的增加来表示。
(3)单位:一般是m o l·L-1·m i n-1或m o l·L-1·s-1。
(4)特点:①化学反应速率一般是平均速率,取正值。②固体或纯液体,其浓度视为常数,因此不用固体或纯液体表示化学反应速率。
(5)规律:同一反应中,用不同物质来表示反应速率,其反应速率之比等于化学计量数之比。
(6)化学反应速率大小的比较方法:①看单位是否统一;②换算成同一物质表示的速率,再比较数值的大小。
2.影响化学反应速率因素
(1)内因:参加化学反应的物质的性质。
(2)外因:①浓度:当其他条件不变时,增加反应物的浓度可以加快反应速率;②压强:当其他条件不变时,对于有气体参加的化学反应,增大压强,可以加快反应速率;③温度:当其他条件不变时,升高温度,可以加快反应速率;④催化剂:当其他条件不变时,加入催化剂可以加快反应速率;⑤其他因素:固体表面积、原电池原理等,也能影响化学反应的反应速率。
(3)注意事项:气体反应体系中充入“惰性气体”时,对反应速率的影响
①恒容:充入“惰性气体”→总压增大→浓度不变→反应速率不变。
②恒压:充入“惰性气体”→体积增大→浓度减小→反应速率减小。
命题角度二:有关化学平衡的考查
【高考真题】(2 0 1 5四川)一定量的C O2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+C O2(g)幑幐2 C O(g)。平衡时,体系中气体体积分数与温度的关系如下图所示,下列说法正确的是( )
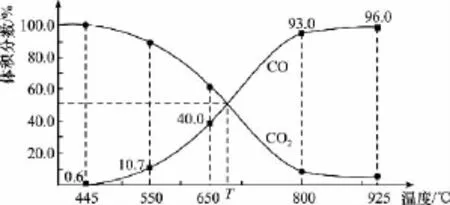
已知:气体分压(p分)=气体总压(p总)×体积分数。
A.5 5 0℃时,若充入惰性气体,v正,v逆均减小,平衡不移动
B.6 5 0℃时,反应达平衡后C O2的转化率为2 5.0%
C.T℃时,若充入等体积的C O2和C O,平衡向逆反应方向移动
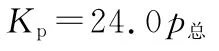
【名师解析】A项,反应容器是体积可变的,充入惰性气体,体积增大,相当于反应体系压强减小,平衡向正向移动,A错误;B项,设起始C O2的物质的量为1m o l,达到平衡后转化xm o l,利用三段式:
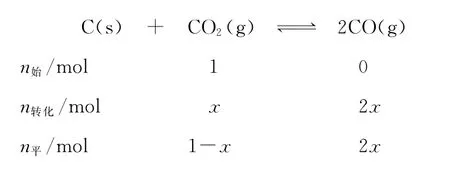
【名师解读】化学反应速率主要考查根据具体的化学反应计算各物质的平均速率,判断外界条件对反应速率的影响,根据浓度与时间的变化曲线图确定化学方程式,有关化学反应速率影响的实验探究。化学平衡主要考查判断可逆反应是否达到平衡状态,以图象为载体考查学生读图识图解决问题的能力,特别是近几年的全国课标Ⅰ新增了对化学平衡常数的考查,具体表现为表达式的书写、计算及影响其因素。
【知识链接】
1.影响化学平衡的因素
(1)浓度:在其他条件不变,增大反应物浓度或减小生成物浓度,平衡向正反应方向移动;减小反应物浓度或增大生成物浓度,平衡向逆反应方向移动。
(2)压强:在其他条件不变,增大压强,平衡向气体体积减小的方向移动;减小压强,平衡向气体体积增大的方向移动。
(3)温度:在其他条件不变,升高温度,平衡向吸热方向移动;降低温度,平衡向放热方向移动。
注意事项:①改变固体或纯液体的量,对化学平衡没影响。
②对于反应前后气体体积不变的反应,改变压强,平衡不移动。

2.化学平衡图象题的解题技巧
①弄清可逆反应的特点(即反应热、气体体积变化及体系物质状态等情况)。
②先拐先平,在含量(转化率)-时间曲线中,先出现拐点的则先达到平衡,说明该曲线反应速率快,表示温度较高、有催化剂、压强较大等。
③定一议二,当图象中有三个量时,先确定一个量不变,再讨论另外两个量的关系,同时需要作辅助线。
④三步分析法,一看反应速率是增大还是减小;二看v正、v逆的相对大小;三看化学平衡移动的方向。
命题角度三:有关化学平衡的计算考查
【高考真题】(2 0 1 5天津)某温度下,在2L的密闭容器中,加入1 m o l X(g)和2 m o l Y(g)发生反应:X(g)+mY(g)幑幐3 Z(g),平衡时,X、Y、Z的体积分数分别为3 0%、6 0%、1 0%。在此平衡体系中加入1m o l Z(g),再次达到平衡后,X、Y、Z的体积分数不变。下列叙述不正确的是( )
A.m=2
B.两次平衡的平衡常数相同
C.X与Y的平衡转化率之比为1∶1
D.第二次平衡时,Z的浓度为0.4m o l·L-1
【名师解析】反应达到平衡时,各组分的体积分数之比等于各组分的物质的量之比,即平衡时n(X)∶n(Y)∶n(Z)=3 0%∶6 0%∶1 0%=3∶6∶1,利用三段式计算,设第一次达到平衡时消耗X的物质的量为xm o l,

则(1-x)∶(2-m x)∶3x=3∶6∶1,得到x=0.1m o l,m=2,A项正确;因为平衡常数只与温度有关,温度不变,故平衡常数相同,B项正确;m=2,则起始量X与Y之比为1∶2,X与Y的化学计量数之比为1∶2,故X与Y的平衡转化率相同,C项正确;m=2,则该反应是反应前后气体体积不变的反应,故第二次平衡时Z的物质的量为(1+2+1)× 1 0%=0.4m o l,故Z的浓度为0.4m o l÷2L=0.2m o l/L,D项错误。
【名师解读】主要考查化学平衡移动原理及计算。涉及化学计量数的计算、转化率的计算、物质浓度的计算,平衡移动的判断等。
【知识链接】化学平衡的“三段式”计算:
对于反应:mA(g)+nB(g)幑幐pC(g)+qD(g),设A、B起始物质的量分别为a、b,达到平衡后,A的消耗量为m x,容器体积为VL。
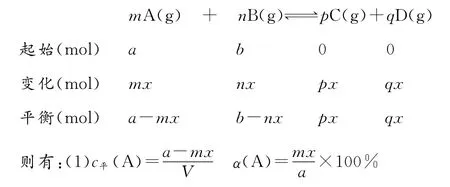
(2)p(始)∶p(平)=(a+b)∶[a+b+(p+q-m-n)x]。
(3)……
命题角度四:有关化学平衡常数的考查
【高考真题】(2 0 1 5新课标Ⅰ)B o d e n s t e i n s研究了下列反应:2 H I(g)幑幐H2(g)+I2(g)在7 1 6K时,气体混合物中碘化氢的物质的量分数x(H I)与反应时间t的关系如下表:
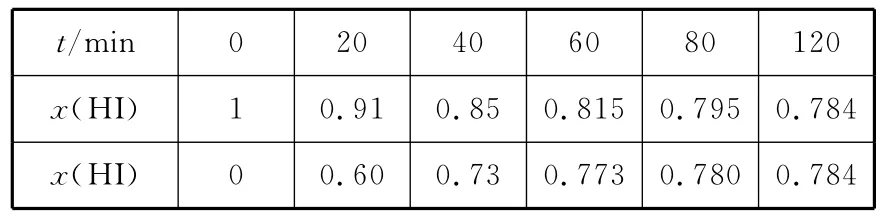
m i n 0 2 0 4 0 6 0 8 0 1 2 0 __x(H I)t/1 0.9 1 0.8 5 0.8 1 5 0.7 9 5 0.7 8 4 __x(H I)0 0.6 0 0.7 3 0.7 7 3 0.7 8 0 0.7 8 4
根据上述实验结果,该反应的平衡常数K的计算式:________。
【名师解析】由表中数据可知,该可逆反应在1 2 0m i n时达到平衡状态,设起始加入1m o l H I气体,利用三段式进行计算如下:

【名师解读】化学平衡常数的考查是近几年高考的热点之一,化学平衡常数是可逆反应限度的最根本体现,平衡常数的引入,很好地从定量角度判断化学平衡移动的方向。
【知识链接】
1.概念:在一定温度下,当一个可逆反应达到化学平衡时,生成物浓度幂之积与反应物浓度幂之积的比值是一个常数,用符号K表示。
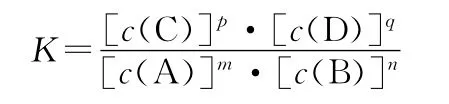
注意:固体和纯液体的浓度视为常数,通常不计入平衡常数表达式中。
3.特点:(1)K值越大,反应物的转化率越大,正反应进行的程度越大。
(2)K只与温度有关,与反应物或生成物的浓度变化无关。
(3)化学平衡常数是指某一具体反应的平衡常数,对于一个可逆反应,化学计量数不一样,化学平衡常数表达式也就不一样。
4.应用:(1)判断一个化学反应是否达到化学平衡状态

(2)判断可逆反应的反应热
若温度升高,K值越大,则正反应是吸热反应。
若温度升高,K值越小,则正反应是放热反应。
(3)计算反应物或生成物的平衡浓度及反应物的转化率。
(作者单位:江西省赣县中学)
