水溶液中的离子平衡
2016-03-17山东王淑芹
山东 王淑芹
水溶液中的离子平衡
山东 王淑芹
水溶液中的离子平衡,是高中化学对弱电解质概念更深入的分析,是对弱酸、弱碱及其中和产物——盐的性质的进一步研究,并揭示其性质之间相互关系的综合知识体系。高考对该部分的考查点,集中体现在:
①水溶液酸碱性及其强弱的判断;
②水溶液中离子浓度的大小关系;
③水溶液中平衡体系的相互影响,即平衡体系在外界条件下的移动。
在近几年乃至以后的高考中,对溶液中的多个平衡体系的综合考查会明显加强,尤其是不同平衡体系之间的相互影响引起的离子浓度变化和守恒关系的分析,给考生带来了不少的困扰。现就其知识体系梳理如下:
一、水溶液中的平衡体系
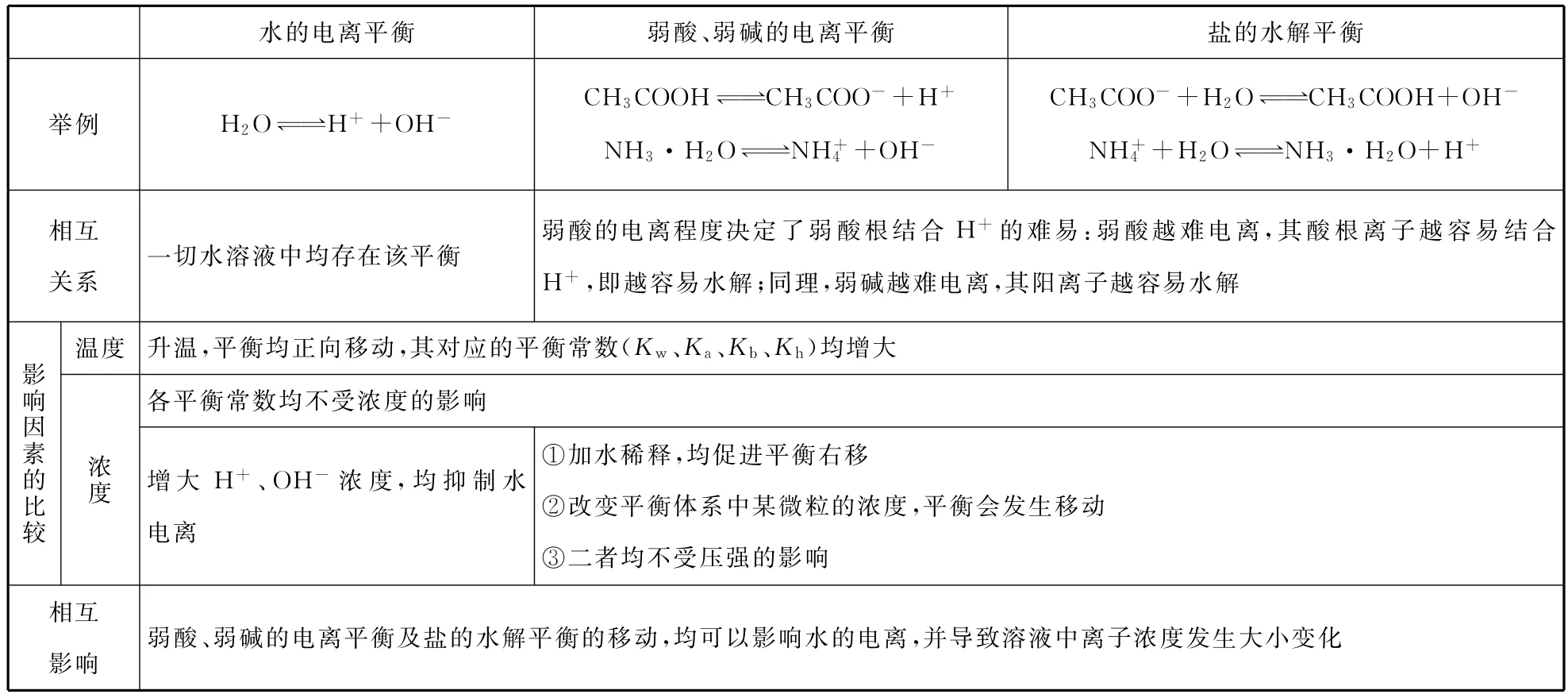
水的电离平衡弱酸、弱碱的电离平衡盐的水解平衡举例H2O 幑幐H++OHCH3幑幐C O OH CH3C O O-+H+NH3·H2O 幑幐NH+4+OHCH3C O O-+H2O 幑幐CH3C O OH+OHNH+4+H2O 幑幐NH3·H2O+H+相互关系一切水溶液中均存在该平衡弱酸的电离程度决定了弱酸根结合H+的难易:弱酸越难电离,其酸根离子越容易结合H+,即越容易水解;同理,弱碱越难电离,其阳离子越容易水解温度升温,平衡均正向移动,其对应的平衡常数(Kw、Ka、Kb、Kh)均增大影响因素的比较各平衡常数均不受浓度的影响浓度增大H+、OH-浓度,均抑制水电离①加水稀释,均促进平衡右移②改变平衡体系中某微粒的浓度,平衡会发生移动____________________________________________③二者均不受压强的影响相互影响弱酸、弱碱的电离平衡及盐的水解平衡的移动,均可以影响水的电离,并导致溶液中离子浓度发生大小变化
二、考生必须熟悉的几个基础知识模型
(一)关于盐溶液的酸碱性判断
1.单一溶液,如:
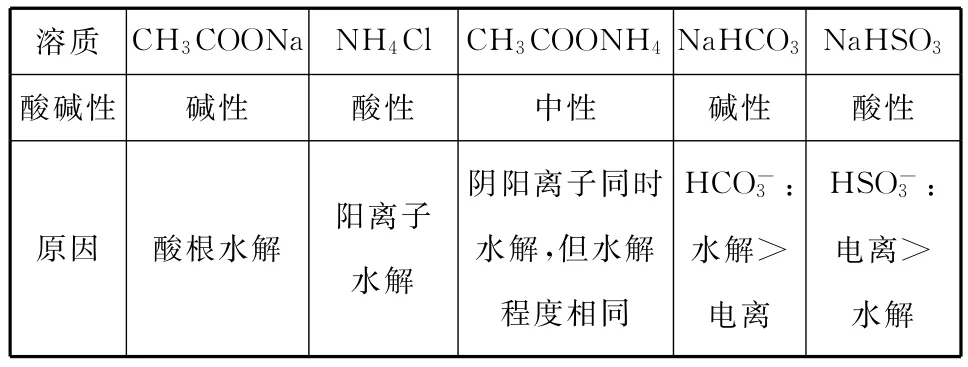
溶质CH3C O ON a NH4C l CH3C O ONH4N a HC O3N a H S O3酸碱性碱性酸性中性碱性酸性原因酸根水解阳离子水解阴阳离子同时水解,但水解程度相同HC O-3:水解>电离H S O-3:电离>水解
要点:把握水解基本原理,分清盐的类型,根据“谁弱谁水解,谁强显谁性”可直接判断:强酸弱碱盐溶液显酸性,强碱弱酸盐溶液显碱性;弱酸弱碱盐溶液的酸碱性决定于酸根离子和阳离子的水解程度,水解程度大的决定溶液的酸碱性;对弱酸的酸式盐溶液,关注酸根离子的电离程度和水解程度的相对大小(后两者可通过电离常数进行判断)。
2.混合溶液,如
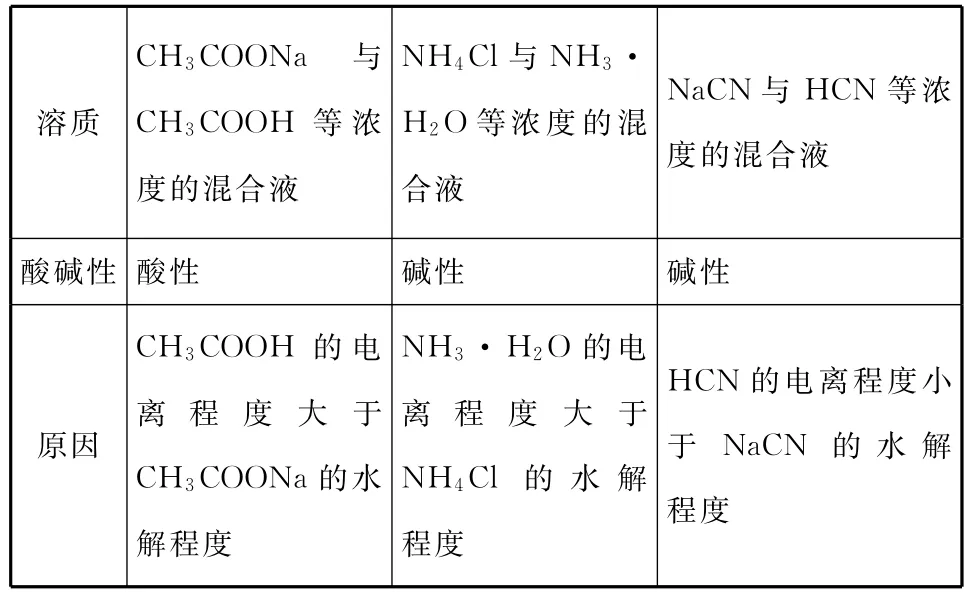
N a C N与HC N等浓溶质CH3C O ON a与CH3C O OH等浓度的混合液NH4C l与NH3· H2O等浓度的混合液度的混合液酸碱性酸性碱性碱性原因CH3C O OH的电离程度大于CH3C O ON a的水解程度NH3·H2O的电离程度大于NH4C l的水解程度HC N的电离程度小于N a C N的水解程度
要点:(1)弱酸或弱碱的电离程度越大,其对应离子的水解程度越小。
(2)对于Ka>Ka(CH3C O OH)的弱酸与其强碱盐或Kb>Kb(NH3·H2O)的弱碱与其强酸盐形成的缓冲溶液,溶液酸碱性由弱电解质的电离决定;对于Ka<Ka(HC N)的弱酸与其强碱盐形成的缓冲溶液,溶液酸碱性由对应盐的水解程度决定。
(二)关于溶液中的离子浓度关系
要熟练掌握几种代表物水溶液中的三大守恒关系:
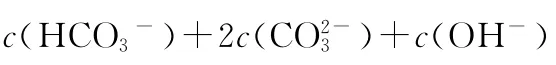
2.物料守恒:电解质溶液中由于电离或水解因素,离子会发生变化转变成其他离子或分子等,但离子或分子中某种特定元素的原子的总数是不会改变的。如
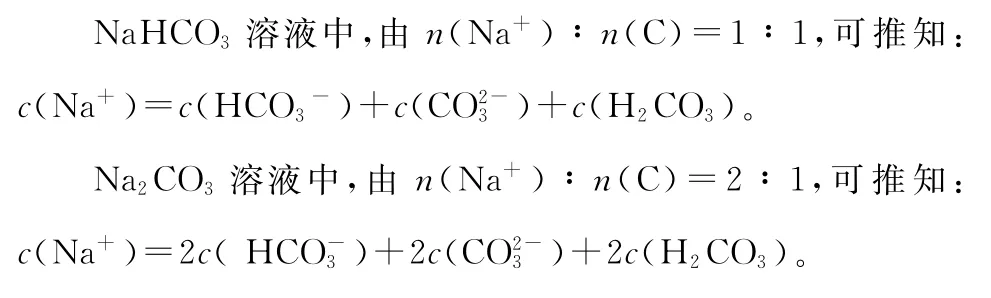
(3)质子守恒:质子守恒是指电解质溶液中粒子电离出的氢离子(H+)数等于粒子接受的氢离(H+)数加游离的氢离子(H+)数。
如N a2S水溶液中的质子转移可用下图表示如下:
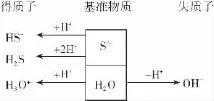
由上图可得N a2S水溶液中质子守恒式可表示为c(H3O+)+2c(H2S)+c(H S-)=c(OH-)或c(H+)+2c(H2S)+c(H S-)=c(OH-)。
质子守恒的关系式也可以由电荷守恒与物料守恒合并处理得到。
三、抓住要点,进行条件转化,解决离子平衡问题
要点一:排除干扰,明确溶液中的溶质及其性质,利用基础模型知识解决综合性问题。
例题1:(2 0 1 5四川)常温下,将等体积、等物质的量浓度的NH4HC O3与N a C l溶液混合,析出部分N a HC O3晶体,过滤,所得滤液pH<7。下列关于滤液中的离子浓度关系不正确的是( )
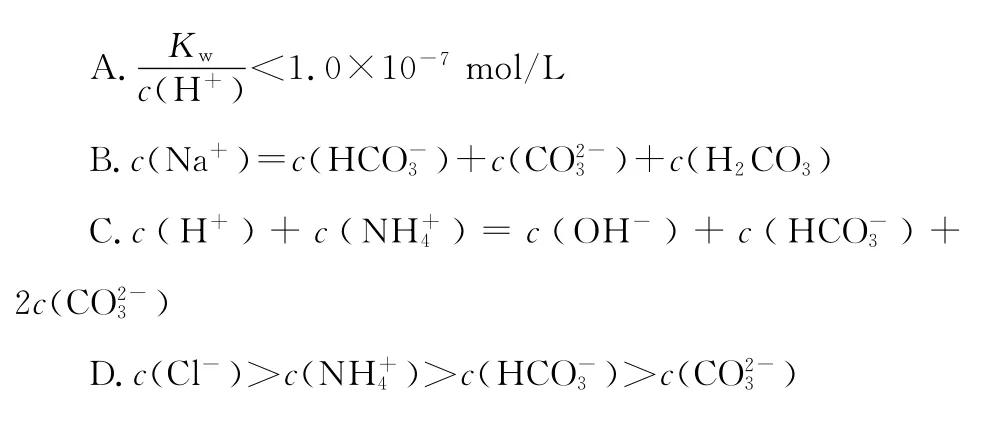
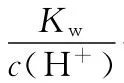
例题2:(2 0 1 6山东青岛模拟)在常温下,用0.1 0 0 0m o l/L盐酸滴定2 5m L 0.1 0 0 0m o l/L N a2C O3溶液,其滴定曲线如下图。下列有关说法正确的是( )
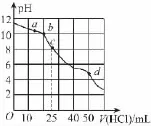
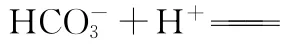
C.c点:c(OH-)+c(C O23-)=c(H+)+2c(H2C O3)
D.d点:c(N a+)+c(H+)=c(C l-)+c(OH-)
解析:由题意求得:n(N a2C O3)=2.5mm o l,滴定过程中,先后发生反应:
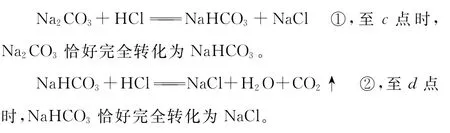
据c点时,溶液中N a HC O3的物质的量浓度为0.0 5m o l/L,结合pH知:

方法总结:关键在于抓住特殊点体现出的阶段性反应,确定特定点的溶质,灵活应用基础知识解决综合性问题。
要点二:关注溶质行为的同时,注意水的电离程度的变化及其应用。
例题3:(2 0 1 5北京西城一模)常温下,向1LpH=1 0的N a OH溶液中持续通入C O2。通入的C O2的体积(V)与溶液中水电离出的OH-浓度(φ)的关系如下图所示。
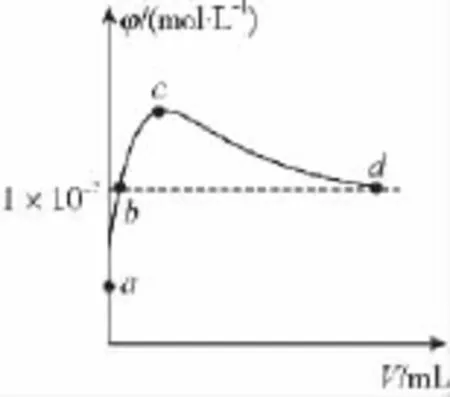
下列叙述不正确的是( )
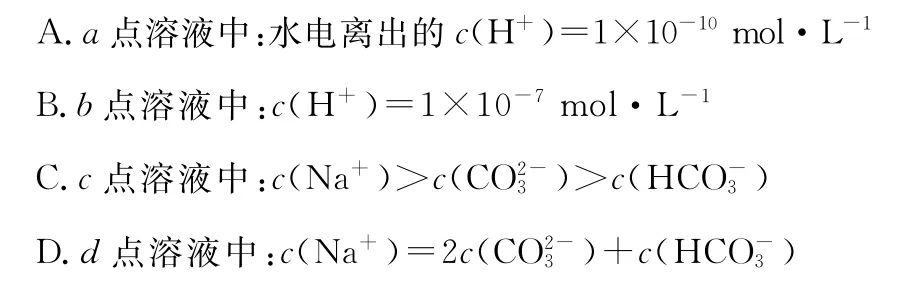
解析:a点溶液中c(OH-)=1×1 0-4m o l·L-1,溶液中的H+来源于水的电离,根据水的离子积常数可求得c(H+)=1×1 0-10m o l·L-1,A项正确;b点时的溶质为N a OH和N a2C O3,既存在N a OH对水电离的抑制作用,又存在N a2C O3对水电离的促进作用,但此时溶液的pH大于7,即c(H+)<1×1 0-7m o l·L-1,B项错误;c点时水的电离受到促进的程度最大,其溶质应为N a2C O3,在N a2C O3

方法总结:本题的判断要点在于,向N a OH溶液中持续通入C O2的过程中,水的电离程度先增大,后减小。增大是因为减小了N a OH浓度同时生成了碳酸钠,减小是因为N a2C O3又被转化为N a HC O3,进而生成H2C O3。因此,很容易判断出,水电离程度最大时,是恰好生成N a2C O3的时刻,即c点。那么,c点前后的反应及溶质就显而易见了。
要点三:关注平衡常数在解题过程中的应用。
例题4:(2 0 1 6山东青岛模拟,节选)天然气中含有H2S杂质,某科研小组用氨水吸收得到NH4H S溶液,已知T℃,K(NH3·H2O)=1.7 4×1 0-5,K1(H2S)=1.0 7×1 0-7,K2(H2S)=1.7 4×1 0-13,NH4H S溶液中所含粒子浓度大小关系正确的是( )
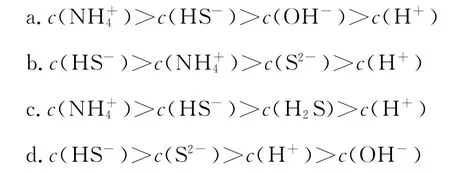
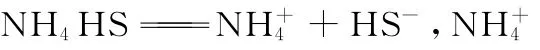
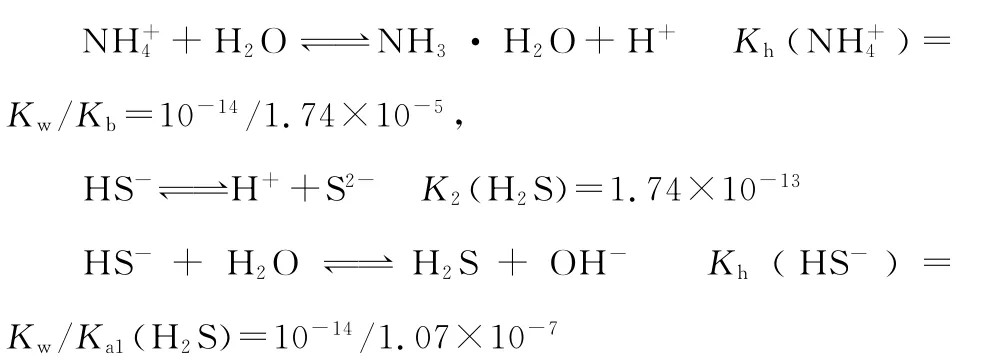
(作者单位:山东省德州市实验中学)
