有关非水体系的电化学试题赏析
2016-03-17江苏陈仕功
江苏 陈仕功
有关非水体系的电化学试题赏析
江苏 陈仕功
随着工业水平长足进步,原电池在电动车、移动通信网络、广播电视网络、潜艇、海上油气井方面的应用越来越广泛,其中非水体系的原电池更是凭借比能量高、使用寿命长、对环境友好、应用场合多等优点而声名鹊起。近年来,各省市高考命题中把应用于生产实际或正在研究的非水体系原电池进行简化、适度改编,突出其前瞻性、科学性、探究性,受到社会各界一致好评,成为高考试题中耀眼的明星,现将非水体系的电化学试题根据电解质不同做一归纳,以供参考。
一、熔融碳酸盐作为电解质
例1 (2 0 1 5·江苏)一种熔融碳酸盐燃料电池原理示意如图。下列有关说法正确的是( )
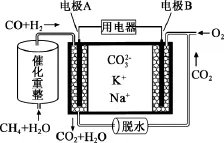
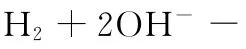
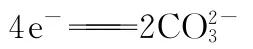
【答案】D
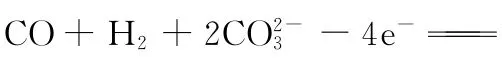
【背景知识】熔融碳酸盐燃料电池是由多孔陶瓷阴极、多孔陶瓷电解质隔膜、多孔金属阳极、金属极板构成的燃料电池,电解质是熔融态碳酸盐。它是一种高温电池,具有效率高、噪音低、无污染、燃料多样化(煤气、天然气和生物燃料等)、余热利用价值高和电池构造材料价廉等优点,是下一世纪的绿色电站。
二、固体金属氧化物作为电解质
例2 (2 0 1 5·浙江)在固态金属氧化物电解池中,高温电解H2O-C O2混合气体制备H2和C O是一种新的能源利用方式,基本原理如图所示。下列说法不正确的是( )
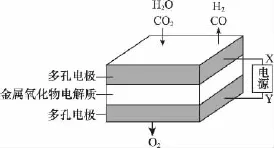
A.X是电源的负极
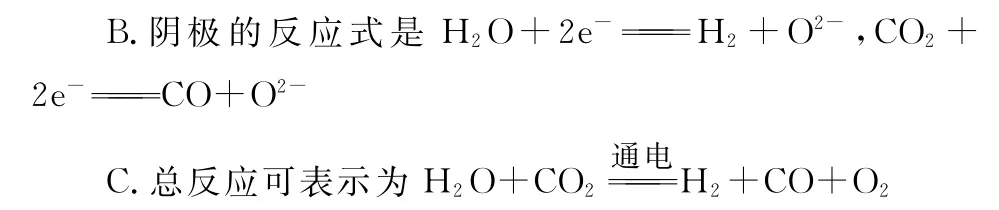
D.阴、阳两极生成的气体的物质的量之比是1∶1
【答案】D
【解析】与X相连的电极发生H2O→H2、C O2→C O的转化,均得电子,应为电解池的阴极,则X为电源的负极,A正确;阴极H2O→H2、C O2→C O均得电子发生还原反应,B正确;从图示可知,H2O→H2、C O2→C O转化的同时有O2生成,C正确;从总反应可知,阴阳极两极生成的气体物质的量之比2∶1,D不正确。
【背景知识】固体氧化物燃料电池是一种在中高温下直接将储存在燃料和氧化剂中的化学能高效、环境友好地转化成电能的全固态化学发电装置,属于高温燃料电池。由于该电池发电的排气有很高的温度,具有较高的利用价值,可以提供天然气重整所需热量,也可以用来生产蒸汽,更可以和燃气轮机组成联合循环,非常适合用于分布式发电。
三、锂盐的有机溶液作为电解质
例3(2 0 1 4·海南,节选)锂锰电池的体积小、性能优良,是常用的一次电池。该电池反应原理如图所示,其中电解质L i C l O4溶于混合有机溶剂中,L i+通过电解质迁移入M n O2晶格中,生成L i M n O2。回答下列问题:
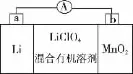
(1)外电路的电流方向是由_______极流向_______极。
(2)电池正极反应式为_____________________________。
(3)是否可用水代替电池中的混合有机溶剂?________(填“是”或“否”),原因是______________________________。
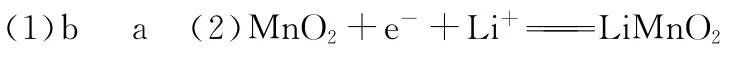

【背景知识】锂-二氧化锰电池以经过特殊工艺处理的二氧化锰为正极活性物质,以高电位、高比能量的金属锂为负极活性物质,电解液采用导电性能良好的有机电解质溶液。锂-二氧化锰电池的反应机理不同于一般电池,在非水有机溶剂中,负极锂溶解下的锂离子通过电解质迁移进入M n O2的晶格中,生成M n O2(L i+)。M n由+4价还原为+3价,其晶体结构不发生变化。
四、N a A l C l4熔盐作为电解质
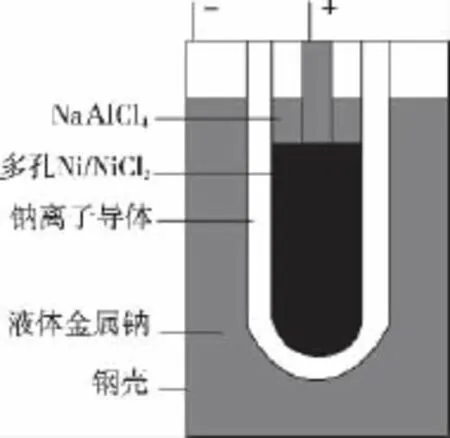
例4 (2 0 1 3·新课标Ⅱ)“Z E B R A”蓄电池的结构如图所示,电极材料多孔N i/N i C l2和金属钠之间由钠离子导体制作的陶瓷管相隔。下列关于该电池的叙述错误的是( )
A.电池反应中有N a C l生成
B.电池的总反应是金属钠还原三个铝离子
D.钠离子通过钠离子导体在两电极间移动
【答案】B
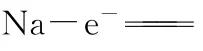
【背景知识】“Z E B R A”蓄电池正极为镍和氯化镍,在电池工作温度区域均为固态物质,为了便于发生在电池正极电化学反应过程中的钠离子进行迁移,添加一种在电池工作温度区域既能进行钠离子传导又不参与正常电极反应的第二液态电解质,即N a A l C l4熔盐电解质。电极反应过程是:放电时电子从负极钠通过外电路至正极氯化镍,钠离子通过固体电解质陶瓷管与氯化镍反应生成氯化钠和镍;充电时在外电源作用下电极过程与放电时相反。
五、熔融的锂盐作为电解质
例5 (2 0 1 3·安徽)热激活电池可用作火箭、导弹的工作电源。一种热激活电池的基本结构如图所示,其中作为电解质的无水L i C l-K C l混合物受热熔融后,电池即可瞬间输出电能。该电池总反应为P b S O4+2 L i C l+C a C a C l2+L i2S O4+P b。下列有关说法正确的是( )
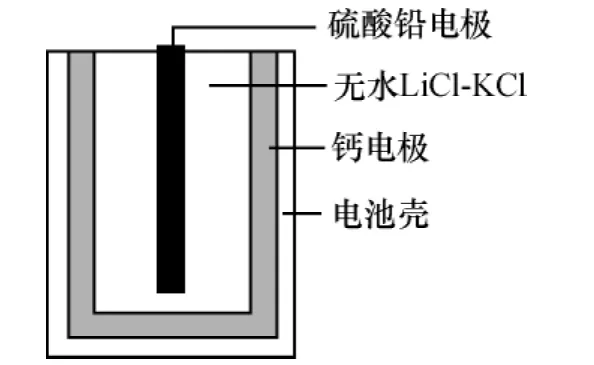
B.放电过程中,L i+向负极移动
C.每转移0.1m o l电子,理论上生成2 0.7g P b
D.常温时,在正负极间接上电流表或检流计,指针不偏转
【答案】D
【解析】正极发生还原反应,故为P b S O4+2 e-P b+S O2-4,A错误;放电过程为原电池,阳离子向正极移动,B错误;每转移0.1m o l电子,生成0.0 5m o l P b,为1 0.3 5g,C错误;常温下,电解质不能熔化,不能形成原电池,故指针不偏转,D正确。
【背景知识】热激活电池工作分两个过程:一个是电池的激活过程,另一个是电池的放电过程。激活时,电池内部工作温度从常温迅速上升到它的最高温度(5 5 0℃左右),随着电池的放电,电池内部温度随着放电的进行缓慢下降,电解质的离子导电性由强变弱,电池的内阻也相应变大,当温度下降到一定程度,电解质逐步凝固。
(作者单位:江苏省响水中学)
