硼元素及其化合物知识整合与迁移
2016-03-17安徽特级教师
安徽 汤 伟(特级教师)
硼元素及其化合物知识整合与迁移
安徽 汤 伟(特级教师)
高考试题、竞赛试题及自主招生命题中都特别注重能力测试,其中知识迁移能力是历年来高考考查的热点,试题常常借助一个陌生的情景,考查我们能否借助课本所学知识解答该看似陌生的问题。下面我们以硼元素为例,谈谈中学阶段如何借助知识迁移了解或理解硼元素的相关知识要点,并在此基础上通过例题分析,探究如何有效借助知识迁移,解答“硼元素及其相关的化合物”问题。
1.结构特点的考查
硼位于周期表中第2周期ⅢA族,与大家熟识的铝元素类似,最外层有3个电子,但与铝不同之处是,B元素属于非金属元素,与C元素相邻,与之相似,B元素一般更加容易形成共价化合物,但是B元素的化合物与C元素化合物不同,一般B是典型的缺电子原子,容易形成配位键,B的基态原子电子排布式为2 s22 p1,B原子常采用s p2杂化,如B C l3、B F3、B O3-3,微粒空间构型为平面三角形,若采用s p3杂化,如B F-4、B H-4,空间构型为正四面体形。另外,针对其相关的晶体结构,也是历年高考的热点话题。
例题1:正硼酸(H3B O3)是一种层状结构白色晶体,层内的H3B O3分子通过氢键相连(如图)。下列有关说法正确的是( )
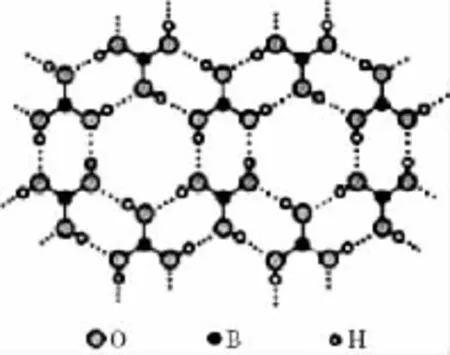
A.正硼酸晶体属于原子晶体
B.H3B O3分子的稳定性与氢键有关
C.分子中硼原子最外层为8 e-稳定结构
D.含1m o l H3B O3的晶体中有3m o l氢键
解析:正硼酸晶体中存在H3B O3分子,且该晶体中存在氢键,说明该晶体是分子晶体,原子晶体内只有共价键,不会存在氢键,A错误;分子的稳定性与分子内部的化学键强弱有关,物质的熔沸点高低才与氢键有关,B错误;分子中B原子只有6个电子,C错误;从图示上看,1个硼酸分子形成了6个氢键,但每个氢键是2个硼酸分子共用的,所以平均含3个氢键,则含有1m o l H3B O3的晶体中有3m o l氢键,D正确,答案:D。
例题2:硼酸是硼的氢氧化物,已知其结构为平面三角形结构。
(1)画出硼酸的结构式:___________________________。
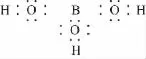
(2)硼酸为无色晶体,可溶于水,水溶液显弱酸性。已知硼酸本身不能电离出H+,它的电离必须有H2O参加,电离后形成正四面体形的硼酸根离子,试写出硼酸电离的方程式_____________________(以结构式表示)。
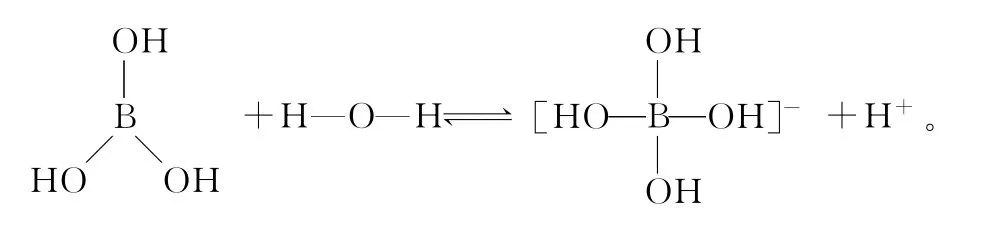
例题3:氮化硼(B N)晶体有多种相结构。六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,可作高温润滑剂。立方相氮化硼是超硬材料,有优异的耐磨性。它们的晶体结构如图所示。
(1)基态硼原子的电子排布式为____________________。
(2)关于这两种晶体的说法,正确的是___________(填序号)。
a.立方相氮化硼含有σ键和π键,所以硬度大
b.六方相氮化硼层间作用力小,所以质地软
c.两种晶体中的B—N键均为共价键
d.两种晶体均为分子晶体
(3)六方相氮化硼晶体层内一个硼原子与相邻氮原子构成的空间构型为________,其结构与石墨相似却不导电,原因是______________________________________________。
(4)立方相氮化硼晶体中,硼原子的杂化轨道类型为________。该晶体的天然矿物在青藏高原地下约3 0 0k m的古地壳中被发现.根据这一个矿物形成事实,推断实验室由六方相氮化硼合成立方相氮化硼需要的条件应是_______ _________________________________。
(5)NH4B F4(氟硼酸铵)是合成氮化硼纳米管的原料之一。1m o l NH4B F4含有________m o l配位键。
【思路分析】B位于第2周期ⅢA族,核外电子排布式1 s22 s22 p1,形成的六方相氮化硼,每一个B与3个N原子相连,每1个N原子与3个B原子相连,形平面三角形,向空间发展成层状结构。六方相氮化硼,不含π键,只含σ键,层与层之间通过范德华力结合在一起;B原子的电子全部成键,能源自由移动的电子,不导电。立方相氮化硼每个B原子与4个N原子相连,每个N与2个B原子相连,构成正四面体,向空间发展形成网状结构。B原子的杂化方式为s p3,由于六方相氮化硼比立方相氮化硼稳定,所以由六方相氮化硼合成立方相氮化硼需要的条件应是高温高压。根据配位键理论,NH4B F4有1个N—H和一个B—F属于配位键。
解析:(1)基态B原子核外有5个电子,分别位于1 s、2 s、2 p能级,根据构造原理容易得出基态B原子的电子排布式1 s22 s22 p1。(2)立方相氮化硼N原子和B原子之间存在共价单键,所以该化合物中含有σ键不存在π键,故a说法错误;六方相氮化硼与石墨相似,层间为分子间作用力,微粒间作用力较小,导致其质地软,故b正确;N原子和B原子两种非金属元素之间易形成共价键,故c正确;立方相氮化硼为空间网状结构,类似金刚石结构,不存在分子,为原子晶体,故d错误;答案为b c。(3)六方相氮化硼晶体层内一个硼原子与相邻氮原子形成3个共价单键,且B原子不存在孤电子对,所以构成的空间构型为平面三角形,该物质的层状结构中不存在自由移动的电子,所以不导电。答案为平面三角形;层状结构中没有自由移动的电子。(4)立方相氮化硼晶体中,硼原子和四个N原子形成4个共价单键,所以B原子的杂化轨道类型为s p3,在地壳内部,离地面越深,其压强越大、温度越高,根据题干知,实验室由六方相氮化硼合成立方相氮化硼需要的条件应是高温高压。(5)根据配位键理论,NH4B F4有1个N—H和一个B—F属于配位键。即1m o l NH4B F4含有2m o l配位键。
2.相关性质的考查
硼及其化合物相关的性质我们在教材中没有学习过,但是我们可以借助知识迁移,根据周期表中同一周期左、右关系,同一主族上、下关系及对角线规则,可以推理出硼及其化合物的相关性质。
硼B元素在自然界中主要以黄晶C a O·B2O3·2 S i O2、硼砂N a2B4O7·5 H2O、方硼石2M g3B8O15·M g C l2等形式存在。
硼的工业冶炼:硼镁矿→单质硼→精制硼,其具体生成过程中涉及的反应一般为:
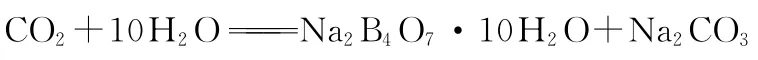

②与非金属反应:可以生成B C l3、B B r3、B2S3、B N,但不与H2反应;

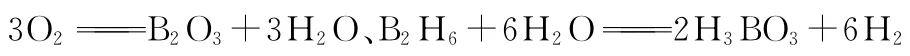
硼酸是一元弱酸,其电离不是自身电离出H+,而是因为P原子缺电子,与H2O结合反应,生成四羟基硼酸根离子和氢离子,硼酸加热可以脱水生成偏硼酸HB O2,最终生成硼酸酸酐B2O3,硼酸酸酐与水结合生成硼酸,硼酸酸酐可以作为吸水剂。
硼酸盐一般有如下几种:
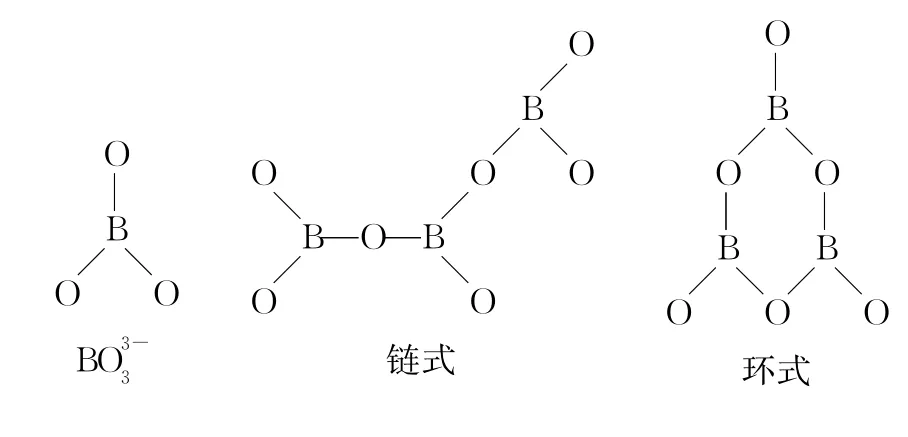
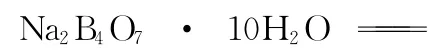
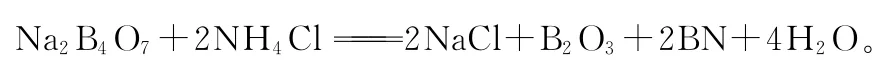
例题4:硼酸(H3B O3)分子的中心原子B最外层电子并未达到饱和,它在水中结合水分子电离出来的OH-使B原子最外层电子达到饱和,电离过程如下图所示:
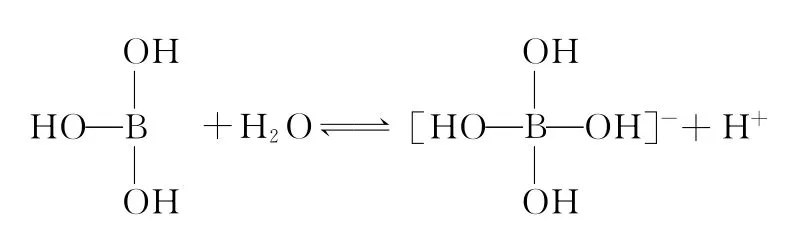
下列表述正确的是( )
A.硼酸加入水中抑制水的电离
B.硼酸是三元酸
C.硼酸与强碱在溶液中反应:H3B O3+OH-→[B(OH)4]-
D.硼酸是两性化合物

例题5:硼是第ⅢA族的元素,自然界中有许多硼化合物,如:
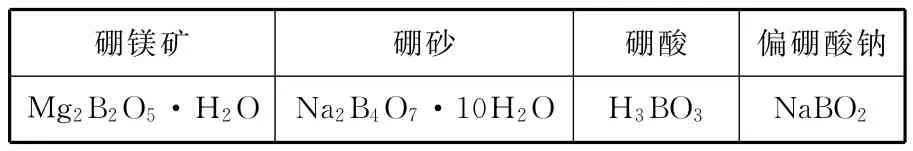
_____硼镁矿_____ ________硼砂硼酸偏硼酸钠M g2B2O5·H2O N a2B4O7·1 0 H2O H3B O3______N a B O2___
请回答下列问题:
(1)上述所列硼化合物中,硼的质量分数最高的是____ _____________。

(3)上述所得的粗硼与M g O混在一起,难以分离,工业上往往将粗硼与I2作用形成B I3(沸点2 1 0℃)然后与M g O分离,分离的方法是__________________;最后在1 0 0 0℃左右,通过B I3热分解而得到高纯度B。
(4)硼酸是一种一元弱酸,它与水作用时结合水电离的OH-而释放出水电离的H+,写出这一变化的化学方程式:_________________。皮肤上不小心碰到氢氧化钠溶液,一般先用大量水冲洗,然后再涂上硼酸溶液,写出硼酸与氢氧化钠反应的离子方程式:___________。
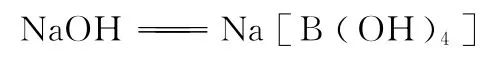
例题6:(2 0 1 5全国新课标Ⅰ卷)硼及其化合物在工业上有许多用途。以铁硼矿(主要成分为M g2B2O5·H2O和Fe3O4,还有少量Fe2O3、Fe O、C a O、A l2O3和S i O2等)为原料制备硼酸(H3B O3)的工艺流程如图所示:
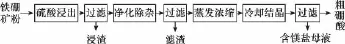
回答下列问题:
(1)写出M g2B2O5·H2O与硫酸反应的化学方程式:_____________。为提高浸出速率,除适当增加硫酸浓度浓度外,还可采取的措施有__________________________(写出两条)。
(2)利用_________的磁性,可将其从“浸渣”中分离。“浸渣”中还剩余的物质是________(化学式)。
(3)“净化除杂”需先加H2O2溶液,作用是__________ ______。然后在调节溶液的pH约为5,目的是___________ ______________________________________________________。
(4)“粗硼酸”中的主要杂质是________(填名称)。
(5)以硼酸为原料可制得硼氢化钠(N a B H4),它是有机合成中的重要还原剂,其电子式为________。
(6)单质硼可用于生成具有优良抗冲击性能硼钢。以硼酸和金属镁为原料可制备单质硼,用化学方程式表示制备过程:_____________________________________________。
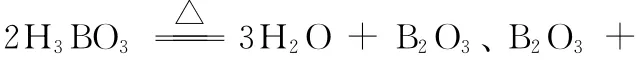
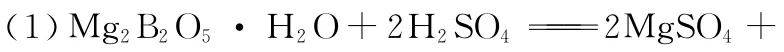
(2)Fe3O4S i O2
(3)氧化溶液中的Fe2+除去溶液中的A l3+和Fe3+
(4)硫酸钙
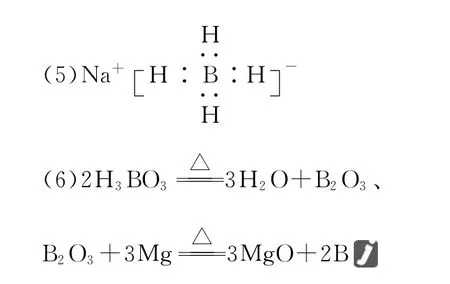
(作者单位:安徽省灵璧中学)
