聚焦热化学方程式高考考点
2016-03-17安徽
安徽 王 永
聚焦热化学方程式高考考点
安徽 王 永
热化学方程式是化学反应热的核心考点,也是近几年高考的高频考点,本文就热化学方程式的书写注意事项、高考常见题型进行分析说明,以期使大家能够高效备考、科学备考。
一、知识要点分析
1.热化学方程式书写注意事项
(1)注意标清物质的聚集状态,用“g、l、s、a q”分别表示“气体、液体、固体以及溶液中的溶质”。不用“↑”和“↓”表示,不同状态的同一物质能量不同:E(g)>E(l)>E(s),故必须标清物质的聚集状态。
(2)注意测定的条件,热化学方程式中不必写反应条件。若反应热ΔH是在2 5℃、1 0 1k P a条件下测定,ΔH后可不注明;否则需要注明,例如反应热ΔH是在3 5℃、1 0 1k P a条件下测定,必须写成ΔH(3 0 8 K1 0 1k P a)=ak J·m o l-1形式。
(3)注意反应热ΔH的符号和单位:吸热标“+”,放热标“-”,单位是k J·m o l-1。
(4)注意热化学方程式中的化学计量数,表示m o l,可以是整数也可以是分数,但要与反应热ΔH相一致:若计量数加倍,则ΔH也要加倍;正逆反应的反应热ΔH数值相等,但符号相反。
(5)注意具有同素异形体的物质,书写时除了要注明聚集状态还要注明物质的名称。
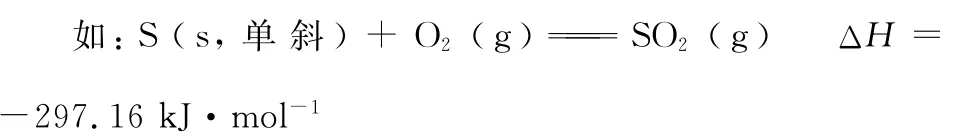
2.热化学方程式的意义
热化学方程式既能表示化学反应中物质的变化,又能表示能量变化。反应热ΔH单位中的“m o l-1”表明参加反应的各物质的物质的量与方程式中各物质的化学计量数相同。

3.燃烧热、中和热的热化学方程式书写
(1)燃烧热的热化学方程式书写
【注意事项】
①可燃物的燃烧必须在2 5℃、1 0 1k P a条件下进行;
②必须是1m o l可燃物而且生成稳定的化合物,包括物质和状态都要稳定;如:可燃物中C→C O2(g),H→H2O(l),S→S O2(g),P→P2O5(s)等。
③反应热ΔH为负值。
例如:表示甲烷燃烧热的热化学方程式

(2)中和热的热化学方程式书写
【注意事项】①以生成1m o l H2O(l)为基准;
②必须是酸和碱的稀溶液反应,因为浓酸或浓碱溶液稀释时会放出热量;
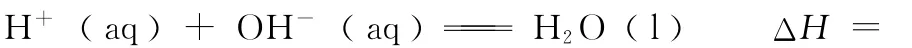
二、高频考点展示
1.以热化学方程式为载体,根据物质键能和反应焓变的关系:反应热ΔH=反应物键能之和-生成物键能之和,来计算某一化学键的键能或反应的反应热ΔH。
【解题策略】①计算清楚每一种物质所含有共价键的种类和个数,如:1 m o l金刚石(晶体硅)中含有2 m o l C—C(S i—S i),1m o l S i O2含有4m o l S i—O键,1m o l白磷含有6m o l P—P键等。
②带入计算时,键能要带单位,反应热ΔH要带“+、-”号和单位。
2.根据题目信息,直接书写热化学方程式。
【解题策略】①根据题目信息标清楚各物质的状态,并配平化学方程式;
②根据题目信息计算出与热化学方程式化学计量数相一致的反应热ΔH。
3.利用盖斯定律书写热化学方程式或计算某一反应的反应热ΔH。
【解题策略】①根据已知信息写出目标方程式;
②运用盖斯定律即通过已知方程式的代数运算(化学计量数的乘除,方程式的加减)得到目标方程式;
③反应热ΔH的计算与上述方程式的代数运算相一致。
三、高考真题赏析
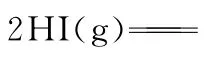
【解析】根据题意知,H—H、I—I键的键能分别是4 3 6k J·m o l-1、1 5 1 k J·m o l-1,设H—I键能为ak J·m o l-1
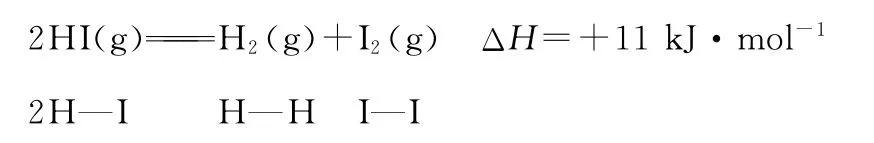
根据公式:反应热ΔH=反应物键能之和-生成物键能之和
即ΔH=+1 1 k J·m o l-1=2ak J·m o l-1-(4 3 6k J·m o l-1+1 5 1k J·m o l-1)
解得a=2 9 9。
【例2】(2 0 1 5新课标Ⅱ,9节选)甲醇既是重要的化工原料,又可作为燃料。利用合成气(主要成分为C O、C O2和H2)在催化剂的作用下合成甲醇,发生的主要反应如下:
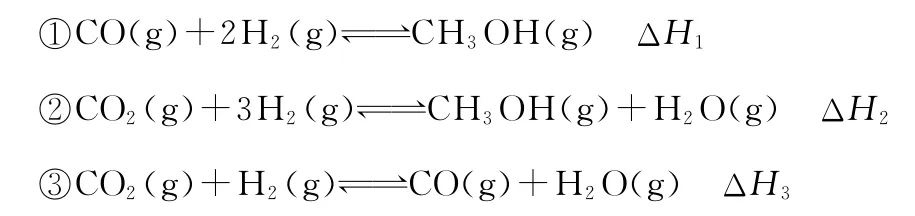
回答下列问题:
已知反应①中的相关的化学键键能数据如下:
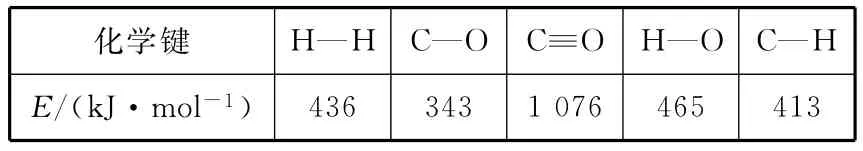
化学键H—H C—O C≡O H—O C—HE/(k J·m o l-1)4 3 6 3 4 3 1 0 7 6 4 6 5 4 1 3_
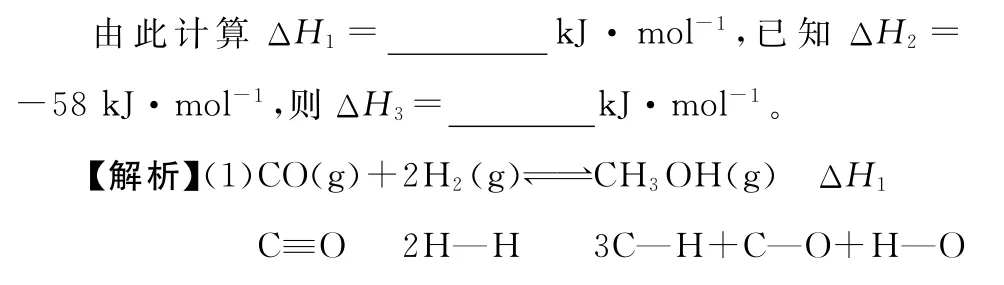
根据公式:反应热ΔH=反应物键能之和-生成物键能之和
即反应热ΔH1=1 0 7 6k J·m o l-1+2×4 3 6k J·m o l-1-(3×4 1 3+3 4 3+4 6 5)k J·m o l-1=-9 9k J·m o l-1。
(2)根据盖斯定律:反应②-反应①=反应③,解得ΔH3=ΔH2-ΔH1=-5 8k J·m o l-1-(-9 9k J·m o l-1)=+4 1k J·m o l-1。
【例3】(2 0 1 5安徽,2 7节选)N a B H4(s)与H2O(l)反应生成N a B O2(s)和H2(g),在2 5℃、1 0 1k P a下,已知每消耗3.8g N a B H4(s)放热2 1.6k J,该反应的热化学方程式是______________________________________________________。
【解析】先根据信息写出配平的化学方程式(标明各物质的聚集状态):

【例4】(2 0 1 5福建,9节选)已知:
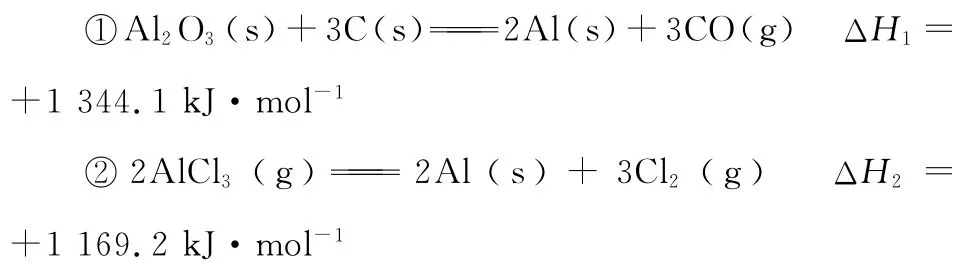
由A l2O3、C和C l2反应生成A l C l3的热化学方程式为____________。
【解析】先写出目标方程式并配平如下:
A l2O3(s)+3 C(s)+3 C l2(g)2 A l C l3(g)+3 C O(g)

(作者单位:安徽省灵璧县第一中学)
