深刺加电针对兔膝骨关节炎软骨的影响①
2016-03-16付妮妮李学智刘菲席小芳任毅杨晓光张愉
付妮妮,李学智,刘菲,席小芳,任毅,杨晓光,张愉
深刺加电针对兔膝骨关节炎软骨的影响①
付妮妮1,李学智1,刘菲1,席小芳1,任毅2,杨晓光1,张愉2
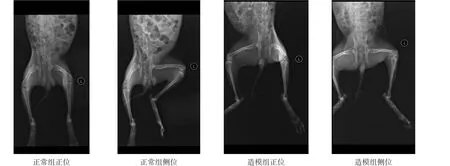
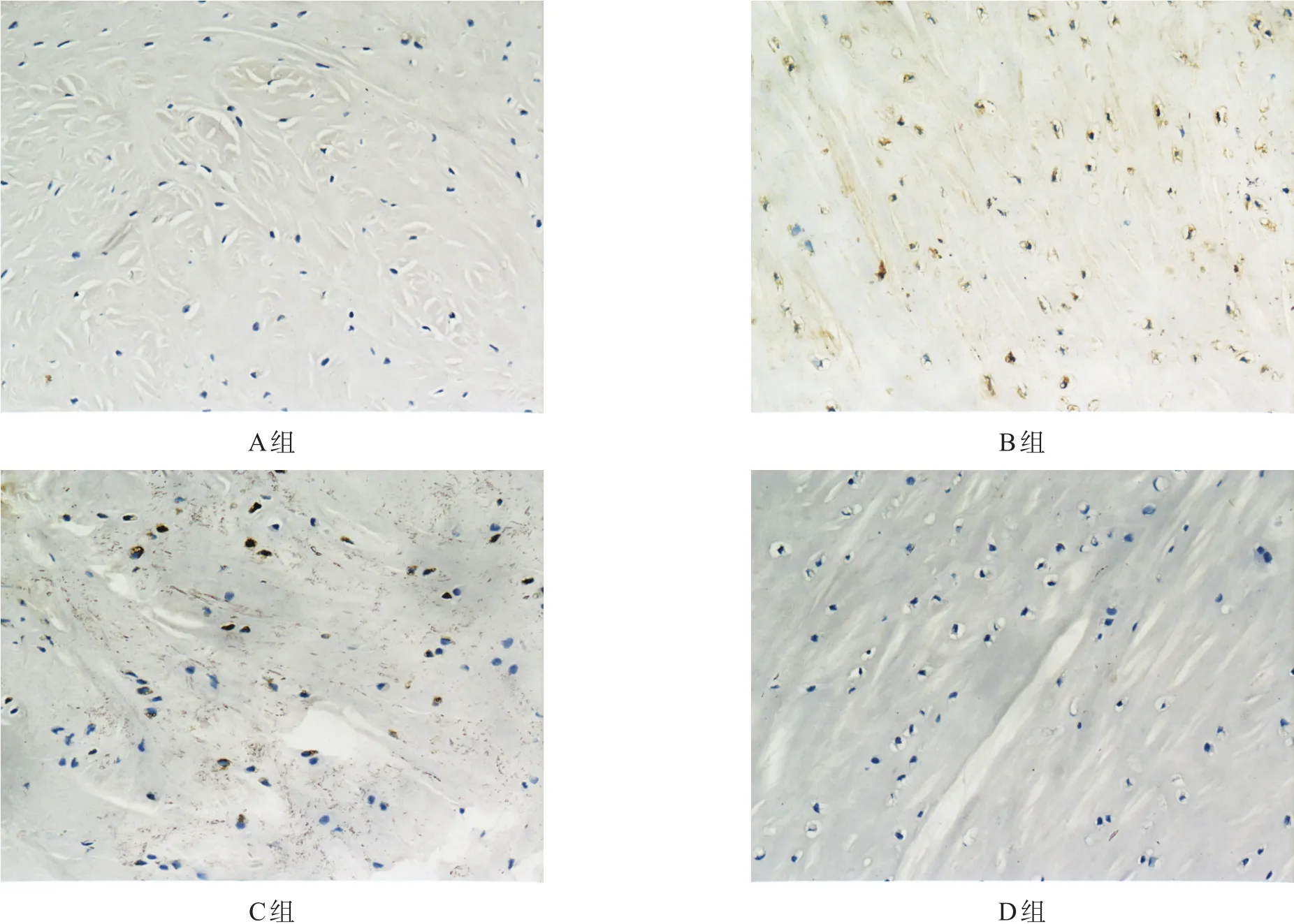
[摘要]目的观察深刺加电针对兔膝骨关节炎软骨组织的影响。方法新西兰兔40只随机分为正常组(A组)10只、造模组30只,后者以Hulth-Telhag法复制兔左膝骨关节炎模型,X线评价造模情况。造模成功后随机分为模型组(B组, n=10)、深刺加电针组(C组, n=10)和普通电针组(D组, n=10),造模后第6周开始对C组和D组进行治疗,共4周。治疗结束后检测关节液pH值,透射电镜下观察软骨细胞组织结构和病理学改变,检测软骨细胞凋亡指数,Western blotting检测软骨组织中酸离子敏感通道1(ASIC1)、p38丝裂原活化蛋白激酶(p38MAPK)的磷酸化水平和p53蛋白表达,免疫组织化学法检测软骨组织中ASIC1分布。结果关节液中pH值从高到低依次为A组=C组>D组>B组(P<0.01);A组、C组、D组膝关节软骨组织形态较B组完整,C组凋亡率低于B组和D 组(P<0.01),与A组无显著性差异(P>0.05);软骨组织中ASIC1和p53表达由低到高均为A组=C组 [关键词]膝骨关节炎;电针;深刺;凋亡;酸离子敏感通道1;p38丝裂原活化蛋白激酶;p53;兔 作者单位:1.重庆医科大学中医药学院,重庆市400016;2.汉中市中心医院,陕西汉中市723000。作者简介:付妮妮(1990-),女,山西长治市人,硕士研究生,主要研究方向:针灸治疗与中枢神经生物基础。通讯作者:李学智,女,博士,副教授,硕士生导师。E-mail: lixz999@126. com。 [本文著录格式]付妮妮,李学智,刘菲,等.深刺加电针对兔膝骨关节炎软骨的影响[J].中国康复理论与实践, 2016, 22(1): 38-45. CITED AS: Fu NN, Li XZ, Liu F, et al. Effects of deep electroacupuncture on cartilage in knee osteoarthritis rabbits [J]. Zhongguo Kangfu Lilun Yu Shijian, 2016, 22(1): 38-45. 骨关节炎(osteoarthritis, OA)是一种以炎症和关节疼痛为主要症状的慢性进行性关节疾病,多发于膝关节,以软骨变性和丢失以及关节边缘和软骨下骨质增生为特征,在老年人群中最为常见[1]。2010年,我国有关该疾病发布的统计结果表明,60周岁以上人群中,患有该病的患者多达0.78亿[2]。该病的最终致残率为53%,是导致残疾的主要原因之一[3],且在我国多数地区均有发病[4-6]。 针灸治疗该病临床疗效明确、便捷、经济、无毒副作用[7]。软骨细胞凋亡和细胞外基质降解是软骨退变的主要诱因。目前研究表明,针刺主要通过抑制凋亡因子的表达减少软骨细胞凋亡[8]。 本研究观察深刺加电针法对兔膝骨关节炎的疗效,包括形态学、软骨细胞凋亡情况、酸离子敏感通道1(acid-sensing ion channel 1, ASIC1)的表达、p38丝裂原活化蛋白激酶(p38 mitogen-activated protein kinases, p38MAPK)的磷酸化水平和凋亡因子p53表达,探讨深刺加电针法治疗骨关节炎的相关机制。 1.1实验动物 健康3月龄新西兰大白兔40只,雌雄不拘,体质量(2.1±0.3) kg,由重庆医科大学实验动物中心提供。动物生产许可证SYXK(渝)2012-0001,质量合格证0002541。实验过程中对动物的处置符合中华人民共和国科学技术部颁发的“关于善待实验动物的指导性意见”的要求。 将新西兰兔编号1~40,在随机数表,任意指定20 行20列,从左到右依次读取40个两位的随机数字,按随机数的大小顺序排列,如果随机数相同,按先后顺序,先出现的为小。序号为1~10对应正常组(A 组),11~40对应造模组。 1.2主要试剂及仪器设备 Anti-ASIC1、Anti-p38MAPK磷酸化、Anti-p53:北京博奥森生物科技有限公司。二抗:北京康为生物试剂公司。多聚甲醛:天津市福晨化学试剂厂。注射用青霉素钠:西南药业股份有限公司,国药准字H50020196。常规手术器械:上海手术器械厂。H-7500透射电镜:HITACH。pH电子测量笔:美国优特公司。电子天平、双蒸水仪器、离心机:长沙湘仪离心机仪器有限公司。电泳仪、石蜡切片机:LEICA。BX51TF光学生物显微镜:OLYMPUS。Gel Doc 2000凝胶成像系统:BIO-RAO。DR3000数字放射成像系统:柯达公司。 1.3模型建立 造模组采用Hulth-Telhag法[9]复制兔膝关节炎模型。3%戊巴比妥钠1 ml/kg耳缘静脉注射麻醉,仰卧于手术台上固定。左侧膝关节备皮,常规消毒,铺无菌巾,取关节内侧长2~3 cm纵切口,切断并剔除内侧副韧带组织0.5 cm。组织剪平行于关节间隙进入关节腔,探查关节腔内无原发病变后切断前后交叉韧带;组织剪平行进入半月板和平台间隙,完整切除内侧半月板,注意勿伤及关节软骨面。行抽屉实验阳性后,冲洗消毒关节腔。逐层缝合,无菌敷料包扎切口处,不予固定。 术后分笼饲养,肌注青霉素4×104U,每天1次,共7 d。每天驱赶新西兰兔活动1 h,连续6周。 A组不予任何处理。 6周对造模组左右后肢行X线检测。满足以下标准表明造模成功:关节间隙狭窄、骨赘形成、软骨下骨改变、膝关节对线不良。所有造模兔均造模成功(图1)。X线检测在重庆医科大学附属第一医院放射科进行。检测参数:照射电压60 kV,照射电流250 mA,照射量32 mAs,照射时间128 ms。 1.4分组及治疗 将造模成功的30只兔根据体重平均分为3组,每个区组编号1~3,再将每个区组中的实验兔编号1~ 10,然后从随机数表中任意选取一开始点,从左到右依次读取30个1位随机数字,按区组顺序和区组中实验兔顺序赋给每只实验兔,最终分为B组、C组、D组,每组10只。 C组动物四肢捆绑仰卧位固定行针刺。取内外膝眼、足三里、梁丘、血海、阴陵泉。内外膝眼用1.0寸毫针,向关节腔内斜刺进针0.8~1.0寸,针刺抵骨后停止进针;足三里穴较普通电针法更靠近胫骨边缘,贴骨进针,提插捻转1 min;梁丘与血海穴用1.5寸毫针斜刺进针,直刺至股骨,针尖穿过股骨骨膜,透刺血海。 D组同法针刺,取穴相同。各穴均用0.5寸针灸针,提插捻转,针刺深度不抵骨、不贴骨。 C组和D组均以电针仪通电留针20 min,一组电极连接内外膝眼,另一组电极连接同侧足三里和阴陵泉,疏密波,频率1.6~2 Hz,强度以保持针柄轻度震颤为度(电流强度1~3 mA,电压4~6 V)。 A组和B组同法抓取捆绑动物。 各组均每周治疗5 d,休息2 d,共4周。 图1 兔膝关节X线正侧位片 1.5检测方法 1.5.1pH测定 用5 ml一次性注射器抽取关节液,20℃下用pH值电子测量笔(精确到0.1)测量关节液pH值。 1.5.2透射电镜检测 各组运动治疗后,3%戊巴比妥钠1 ml/kg麻醉,解剖左后肢膝关节,切取胫骨平台关节面半月板和软骨,分为2份,一份立即放入液氮保存,一份取部分组织切成3块1×1×1 mm立方体,迅速置于2.5%戊二醛保存,其余组织置于4%多聚甲醛固定。置于2.5%戊二醛的标本送重庆医科大学生命科学院电镜室切片,铅铀双重染色,于透射电镜下观察。 1.5.3HE及TUNEL染色 置于4%多聚甲醛的标本固定72 h,常规脱水、透明,石蜡包埋,连续冠状切片,厚5 μm,行HE染色和TUNEL染色。光镜下观察。 TUNEL染色后,凋亡软骨细胞呈棕黄色颗粒,正常软骨细胞呈蓝色颗粒。选取5个凋亡细胞数最多的高倍视野(400×),计算500个细胞中阳性细胞所占的百分比(凋亡指数)。 1.5.4Western blotting 取液氮保存的软骨约40 mg,PBS缓冲液冰水浴匀浆,加RIPA蛋白裂解液,4℃1200 r/min离心10 min,取上清液,BCA蛋白定量法检测蛋白浓度。取蛋白样品50µg上样;行SDS-PAGE凝胶电泳:5%浓缩胶恒压100 V,约20 min;10%分离胶恒压120 V,约90 min。转膜至PVDF膜上;5%脱脂牛奶室温摇动封闭4 h,分别滴加ASIC1、p38MAPK、p53一抗(1∶1000),4℃孵育过夜,37℃复温30 min;滴加HRP标记的二抗(1∶1000),37℃孵育1 h。凝胶成像系统成像,以GAPDH为内参,以Quantity One 4.6图像分析软件进行相对灰度分析。 1.5.5免疫组化染色 取置4%多聚甲醛的标本固定24 h后,常规脱水、透明,石蜡包埋,连续冠状切片,厚5 μm。常规脱蜡1.5~2 h,枸橼酸缓冲液修复抗原,加入3% H2O2,正常山羊血清封闭,滴加ASIC1一抗(1∶50),生物素化二抗工作液,辣根酶标记链霉卵白素工作液,DAB显色,苏木素复染,脱水,透明,封片。用PBS代替一抗做阴性对照。 1.6统计学分析 所有数据采用SPSS 17.0统计软件进行分析。检测数据均以(±s)表示。经方差齐性和正态性检验服从正态分布,组间比较采用单因素方差分析,两两比较采用LSD法。显著性水平α=0.01。 2.1pH C组、D组pH明显高于B组(P<0.01);C组明显高于D组(P<0.01);C组与A组无显著性差异(P= 0.11)。见表1。 2.2透射电镜 A组细胞呈卵圆形,胞质内有丰富的粗面内质网和高尔基体、线粒体,胞浆内微丝丰富,环绕细胞核;细胞核完整类圆形,居细胞中央;未见细胞器水肿裂解及细胞核裂解,软骨陷窝清晰(图2)。B组细胞形态不规则,网膜溶解断裂,线粒体肿胀,胞浆内可见空洞;细胞核形态不规则,核内异染质较多(图2)。C组软骨细胞略萎缩,胞浆核完整,表面有许多微小突起,线粒体散在分布,核内染色质分布均匀(图2)。D组软骨细胞萎缩,胞核有溶解趋势,线粒体肿胀不 明显,线粒体分布相对均匀(图2)。 图2 各组膝关节软骨软骨细胞观察 2.3HE染色 A组膝关节软骨细胞排列均匀整齐,无增生,软骨细胞形态正常,细胞核居中,胞质均匀(图3);B组软骨细胞排列紊乱,粗糙不平,胞质中空泡明显,细胞核被压缩(图3);C组和D组软骨细胞排列较整齐,胞质无明显异常空泡,胞质均匀,细胞核居中(图3)。 2.4TUNEL染色 各组凋亡指数由低到高依次为A组=C组 2.5Western Blotting A组、C组和D组p38MAPK、ASIC1、p53表达均明显低于B组(P<0.01),C组明显低于D组(P< 0.01);C组ASIC1(P=0.018)和p53(P=0.031)与A组无显著性差异;C组p38MAPK明显高于A组(P<0.01)。见表1。 2.6免疫组化染色 C组、D组ASIC1散在阳性表达,着色较浅,明显低于B组(P<0.01);C组明显低于D组(P<0.01);C组与A组无显著性差异(P=0.746)。见图5、表1。 图3 各组软骨组织HE染色(200×) 图4 各组软骨组织TUNEL染色(40×) 图5 各组软骨组织ASIC1免疫组化染色(400×) 表1 各组测量参数比较 OA是以关节软骨退行性改变、继发性骨质增生、关节间隙狭窄、滑膜炎症增生为主要病理特征,以膝关节疼痛、肿胀、功能障碍为主要表现的常见疾病,是力学和生物学因素共同作用下,软骨细胞、细胞外基质和软骨下骨三者降解和合成偶联失衡的结果。胞外酸度是关节软骨基质代谢重要的调节剂,胞内酸中毒的直接作用可能是抑制基质合成代谢或者升高一些酶的活性[10]。 1980年,Krishtal等在神经元中首次发现酸诱导产生的膜电流,即ASICs,被认为是哺乳动物最重要的酸感受器;其中ASIC1可在软骨细胞中表达,且对调控细胞外基质降解进,而影响细胞凋亡具有重要意义[11]。ASIC1对酸敏感度居中,表达量较高,占软骨细胞中所有酸敏感离子通道的64%[12]。ASIC1属于Ca2+渗透性酸离子敏感通道,胞外酸化激活ASIC1开放,可介导胞外Ca2+内流[13-14]。 p38MAPK是一种分布于胞质中,具有丝氨酸和酪氨酸双重磷酸化能力的蛋白激酶,其信号转导途径是细胞外信号引起细胞内反应的通道之一,可被多种刺激因子激活,参与细胞的形成、生长、分化、凋亡等多种生理过程[15]。持续升高的胞质内Ca2+可以通过MAPKKK-MAPKK-MAPK通路激活p38MAPK,导致p38MAPK磷酸化[16];之后将信号传至细胞核内,介导相应的转录因子启动基因转录。最近报道,p38MAPK可以诱导凋亡因子p53活化,软骨细胞凋亡[17-19]。 正常情况下,关节液的pH为(8.5±0.3)[20];关节炎状态下,由于软骨细胞无氧酵解以及周围组织细胞产生炎症因子,软骨微环境酸化,局部pH降低[21-22],影响关节软骨细胞的代谢[23]。 综上所述,软骨组织酸化可引起软骨细胞表达ASIC1,介导胞外Ca2 +内流;持续升高的Ca2 +导致p38MAPK磷酸化,最终诱导凋亡因子p53表达,引起软骨细胞凋亡。这可能是导致OA发生或加重的重要诱因。 OA属中医学“痹症”“骨痹”范畴,病机为筋骨衰疲、肝肾亏虚、经络气血痹阻,治疗以补益肝肾、祛风散寒、活血化瘀、温经通络为法。 短刺法是治疗OA的重要手段。短为接近之意,深刺至骨,上下摩骨,可使硬化肿胀的筋膜软化,重新建立有效的血液循环,达到疏通经络、活血消肿止痛的目的,具有扶正祛邪、调和阴阳的作用。该法治疗骨关节炎副作用小,临床有效[24-26]。本研究根据近部选穴原则选取内外膝眼,针体可以直接进入关节腔,作用于软骨表面。足三里为足阳明胃经合穴,主治虚劳诸证、下肢痿痹;梁丘为胃经郄穴,主治怯寒症、膝痛、浮肿等。血海、阴陵泉为脾太阴经穴,阴陵泉为该经合穴,主治肌痹、膝痛;血海具有活血化瘀,养血和血的功效,可治疗膝关节疼痛。 本研究采用Hulth-Telhag法复制新西兰兔KOA模型,运用深刺加电针法,缓慢进针,摇动针身使针深刺至骨,在骨旁或骨缝间作提插捻转、摇动等“摩骨”手法。相比常规电针,能明显升高关节液pH,减少ASIC1和p53表达,p38MAPK磷酸化水平降低,达到降低软骨细胞凋亡,修复损伤软骨组织的作用。与汤剑斌等观察电针治疗OA软骨大体形态学变化一致[27]。这可能是深刺加电针法治疗OA的机制之一。 [参考文献] [1] Zamli Z, Robson Brown K, Tarlton JF, et al. Subchondral bone plate thickening precedes chondrocyte apoptosis and cartilage degradation in spontaneous animal models of osteoarthritis [J]. Biomed Res Int, 2014, 2014: 606870. [2]刘源,王伟,李沛.针灸治疗膝骨性关节炎概况[J].中医学报, 2011, 26(2): 236-238. [3]李宁华.中老年人群骨关节炎的流行病学特征[J].中国临床康复, 2005, 9(38): 402-405. [4]向珍蛹,茅建春,徐先国,等.膝骨关节炎中医证型分布的流行病学研究[J].上海中医药杂志, 2012, 46(12): 5-8. [5]张思恒,董晓梅,叶云凤,等.广州地区15岁及以上人群骨关节炎流行病学特征及危险因素分析[J].中华疾病控制杂志, 2015, 19(1): 9-12. [6]李玉飞.湖南省中老年膝骨关节炎的流行病学调查研究[D].长沙:中南大学湘雅医学院, 2014. [7]何天峰.火针配合毫针对膝骨关节炎患者生活质量的影响[J].上海针灸杂志, 2014, 33(12): 1156-1159. [8]陈后煌.电针调节骨关节炎软骨细胞功能的机制探讨[J].风湿病与关节炎, 2015, 4(6): 37-41. [9] Hulth A, Lindberg L, Telhag H. Experimental osteoarthritis in rabbits. Preliminary report [J]. Acta Orthop Scand, 1970, 41 (5): 522-530. [10] Pignatarog, Simon RP, Xiong ZG. Prolonged activation of ASIC1a and the time window for neuroprotection incerrbral ischaemia [J].Brain,2007,130(Pt1): 151-158. [11]张晨晨.酸敏感离子通道1a在酸诱导的大鼠关节软骨细胞自噬中的作用及其机制研究[D].合肥:安徽医科大学药学院, 2013. [12]郭英俊,毛海婷,聂林,等. ASICs的胞内分布及其功能调节机制的研究进展[J].现代生物医学进展, 2014, 16(47): 3177-3180. [13] Herrera Y, Katnik C, Rodriquez JD, et al. Sigma-1 receptor modulation of acid- sensing ion channel 1a (ASIC1a) and ASIC1a-induced Ca2+influx in rat cortical neurons [J]. J Pharmacol Exp Ther, 2008, 327(2): 491-502. [14] Rohner E, Detert J, Kolar P, et al. Induced apoptosis of chondrocytes by Porphyromonasgingivalis as a possible pathway for cartilage loss in rheumatoid arthritis [J]. Calcif Tissue Int, 2010, 87(4): 333-340. [15]王红林,王治伦,吴劲,等. p38MAPK信号转导通路参与NO诱导兔关节软骨细胞凋亡[J].中国地方病防治杂志, 2006, 21 (6): 332-335. [16]张礼菊,胡伟,唐杰,等. ASIC1a对大鼠关节软骨细胞基质代谢及MAPK信号通路表达的影响[J].中国药理学通报, 2014, 30(8): 1165-1170. [17]王红丽,胡永亮,胡美茹,等. IKKα通过激活p38K介导紫外线诱导的p53活化反应[J].军事医学, 2015, 39(5): 321-324. [18]张志宇,许珂,王静,等. p53在骨关节炎软骨组织中的表达及与关节软骨细胞自噬的关系研究[J].中国医学创新, 2014, 11 (15): 1-3. [19]荣超.酸敏感离子通道在酸诱导的大鼠关节软骨细胞凋亡中的作用及其线粒体途径机制研究[D].合肥:安徽医科大学药学院, 2012. [20]肖颖,张思容,唐志宏,等.膝关节液pH值与痛风结晶的形成[J].中国组织工程研究与临床康复, 2011, 15(26): 4857-4859. [21] Wu MH, Urban JP, Cui ZF, et al. Effect of extracellular phonmatrix synthesis by chondrocytes in 3D agarosegel [J]. Biotechnol Prog, 2007, 23(2): 430-434. [22] Verma RP, Hansch C. Matrix metalloproteinases (MMPs): chemical- biological functions and (Q)SARs [J]. Bioorg Med Chem, 2007, 15(6): 2223-2268. [23] Razaq S, Wilkins RJ, Urban JP. The effect of extracellular pH on matrix turnover by cells of the bovine nucleus pulposus [J]. Eur Spine J, 2003, 12(4): 341-349. [24]伏秀霞.短刺温针灸配合刺络拔罐治疗膝骨关节炎疗效观察[J].上海针灸杂志, 2011, 30(8): 564-565. [25]熊国平.短刺配合温针灸治疗膝关节骨性关节炎30例[J].中国针灸, 2011, 31(6): 551-552. [26]史中亚,胡奋强,陈勇.短刺配合功能训练治疗膝骨关节炎疗效观察[J].上海针灸杂志, 2012, 31(11): 826-828. [27]汤剑斌,圣小平,樊天佑.电针治疗对膝骨关节炎兔膝关节软骨细胞凋亡的影响[J].中医正骨, 2012, 24(4): 12-15. Effects of Deep Electroacupuncture on Cartilage in Knee Osteoarthritis Rabbits FU Ni-ni1, LI Xue-zhi1, LIU Fei1, XI Xiao-fang1, REN Yi2, YANG Xiao-guang1, ZHANG Yu2 Abstract:Objective To observe the effects of deep electroacupuncture on carlilage tissue in knee osteoarthritis (KOA) rabbits. Methods 40 New Zealand rabbits were randomly divided into normalgroup (A, n=10) and modelgroup (n=30). The modelgroup was modeled KOA with Hulth-Telhag way, and identified with X-ray. Then they were divided into no-treatedgroup (B, n=10), deep electroacupuncturegroup (C, n=10) and routine electroacupuncturegroup (D, n=10) randomly. Thegroups C and D accepted electroacupuncture since 6 weeks after modeling, for 4 weeks. They were measured with pH of joint fluid, observed structure and pathology of cartilage under transmission electron microscope, detected apoptosis index, and determined the expression of acid-sensing ion channel 1 (ASIC1), p38 mitogen-activated protein kinases (p38MAPK) and p53 with Western blotting, and distribution of ASIC1 with immunohistochemistry in cartilage tissue. Results The pHs of joint fluid from high to low were ranged as thegroups A=C>D>B (P<0.01). The cartilage structure was more complete in thegroups A, C and D than in thegroup B. The apoptosis rates from less to more were ranged as thegroups A=C Key words:knee osteoarthritis; electroacupuncture; deep acupuncture; apoptosis; acid-sensing ion channel 1; p38 mitogen-activated protein kinases; p53; rabbits (收稿日期:2015-09-17修回日期:2015-11-09) [中图分类号]R684.3 [文献标识码]A [文章编号]1006-9771(2016)01-0038-08 基金项目:重庆市卫生和计生委中医药科技项目(No.ZY201402117)。 DOI:10.3969/j.issn.1006-9771.2016.01.0081 材料与方法
2 结果




3 讨论
1. College of Traditionl Chinese Medicine, Chongqing Medical University, Chongqing 400016, China; 2. Central Hospital of Hanzhong, Hanzhong, Shaanxi 723000, China
Correspondence to LI Xue-zhi. E-mail: lixz999@126.com
