Mash-1转染对胚胎干细胞在小鼠脊髓损伤部位向神经细胞分化的促进作用①
2016-03-16徐乐勤李晓锋施杞王拥军周重建
徐乐勤,李晓锋,施杞,王拥军,周重建
Mash-1转染对胚胎干细胞在小鼠脊髓损伤部位向神经细胞分化的促进作用①
徐乐勤1,2,李晓锋2,施杞2,王拥军2,周重建2
[摘要]目的观察过表达Mash-1基因的胚胎干细胞在脊髓损伤部位向神经细胞分化的情况及其对脊髓神经损伤的修复作用。方法采用鼠干细胞病毒将Mash-1基因转染CE3小鼠胚胎干细胞稳转株。4周龄雄性SPF级昆明小鼠钳夹法建立急性脊髓损伤模型。造模后3 d向脊髓损伤部位注射生理盐水(模型组, n=12)、CE3胚胎干细胞(CE3组, n=12)、转染Mash-1基因的CE3小鼠胚胎干细胞(CE3-Mash-1组, n=12)。术后1 d、7 d、14 d、21 d、28 d检测小鼠后肢功能评分。术后14 d、28 d分别处死小鼠,HE染色观察脊髓剩余面积;CE3组、CE3-Mash-1组行Oct3/4、nestin、β-tubulinⅢ、神经胶质酸性蛋白(GFAP)免疫荧光染色,观察移植细胞的分化。结果与模型组比较,移植CE3和CE3-Mash-1细胞的小鼠运动功能均提高(F>84.471, P<0.05),脊髓剩余面积增加(F>49.990, P<0.05)。与移植CE3细胞相比,移植CE3-Mash-1细胞在损伤的脊髓部位Oct3/4阳性细胞数显著减少(t=5.439, P< 0.001),而nestin (t=-7.536, P<0.001)和β-tubulinⅢ(t=-9.941, P<0.001)阳性细胞数显著增加,GFAP阳性细胞数无显著性差异(t= 1.701, P=0.120)。结论过表达Mash-1基因可促进CE3细胞在脊髓损伤部位分化成神经元,促进小鼠后肢运动功能的恢复。
[关键词]脊髓损伤;胚胎干细胞;基因转染;Mash-1;神经分化;小鼠
作者单位:1.福建中医药大学附属厦门中医院,福建厦门市361009;2.上海中医药大学脊柱病研究所,上海中医药大学附属龙华医院,上海市200032。作者简介:徐乐勤(1981-),男,汉族,福建漳州市人,博士,主治医师,主要研究方向:中医药促进脊髓神经损伤修复。通讯作者:周重建(1953-),男,汉族,上海市人,博士,教授,主要研究方向:中医药促进脊髓神经损伤修复。E-mail: zhouchongjian@hotmail.com。
[本文著录格式]徐乐勤,李晓锋,施杞,等. Mash-1转染对胚胎干细胞在小鼠脊髓损伤部位向神经细胞分化的促进作用[J].中国康复理论与实践, 2016, 22(1): 46-52.
CITED AS: Xu LQ, Li XF, Shi Q, et al. Effects of transfection of Mash-1gene on neural differentiation of embryonic stem cell in spinal cord injury mice [J]. Zhongguo Kangfu Lilun Yu Shijian, 2016, 22(1): 46-52.
脊髓损伤是一种高致残率的中枢神经系统损伤,不仅给患者带来极大痛苦,也给家庭和社会带来沉重负担。临床采用的手术、药物和物理康复等手段都不能完全解决患者的截瘫问题[1]。
细胞移植是神经再生领域研究最多的治疗方法。当前可用于移植的细胞种类有诱导性多潜能干细胞、胚胎干细胞、神经干细胞、间充质干细胞、嗅鞘细胞、施万细胞等[2-4]。由于胚胎干细胞具有无限增殖和多向分化的能力,具有较大的治疗潜能;但其移植后的定向分化、成瘤危险以及存活数量少仍然是亟待解决的问题[2]。基因工程技术的应用可促进细胞的定向分化。Mash-1基因在哺乳动物的神经发生过程中起关键作用[5]。过表达Mash-1基因能使小鼠畸胎瘤P19细胞和胚胎前体皮层细胞向神经元方向分化[6]。我们前期体外实验结果也表明,过表达Mash-1基因可促进CE3小鼠胚胎干细胞在体外分化成神经细胞。
本研究进一步观察过表达Mash-1基因胚胎干细胞在体内的分化情况,以其对脊髓损伤的修复作用。
1 材料与方法
1.1动物
昆明小鼠,雄性,SPF级,体质量(20±2)g,购自上海斯莱克实验动物有限责任公司,许可证号SCXK(沪)2007-0005。饲养于上海中医药大学附属龙华医院SPF级动物实验室。
1.2试剂
DMEM、L-gul、β-mercaptoethanol、胰酶:GIBCO公司。FBS:BIOCHROM公司。LIF细胞因子:CHEMICON公司。逆转录试剂盒、荧光素酶:TAKARA公司。Oct3/4、nestin、β-tubulinⅢ和神经胶质酸性蛋白(glial fibrillary acidic protein,gFAP)一抗:ABCAM公司。红色荧光标记的山羊抗小鼠IgG二抗:KPL公司。293T细胞由上海中医药大学脊柱病研究所提供。CE3细胞购自中国科学院上海生命科学研究所。
1.3过表达Mash-1基因CE3稳转株的构建及细胞培养
待293T细胞生长达90%左右时,使用脂质体2000将鼠干细胞病毒(murine stem cell virus, MSCV)空载体质粒或MSCV-Mash-1转染到293T细胞。转染后24 h和48 h各取病毒上清,-80℃保存备用。
CE3细胞生长至70%~80%时,吸除细胞培养液,加入之前收集的病毒上清,4 h后换胚胎干细胞(embryonic stem cell, ESC)完全培养液培养;次日同法再感染1次。于末次感染后72 h,采用含潮霉素100 μg/ml的ESC完全培养液筛选阳性细胞。抽提感染MSCV-Mash-1和MSCV空载体的CE3细胞以及未经感染的CE3细胞的RNA,逆转录试剂盒将其逆转录成cDNA,聚合酶链反应(polymerase chain reaction, PCR)鉴定3种细胞Mash-1基因表达情况。
将CE3和CE3-Mash-1细胞培养于0.2%明胶包被过的培养皿中,采用ESC完全培养液培养,每天换液1次。待细胞生长至80%时,0.125%胰酶消化,1∶6传代。
1.4急性脊髓损伤模型建立及分组
小鼠适应性喂养3 d,以氯胺酮0.05 ml/10g腹腔注射麻醉。小鼠俯卧固定,背部备皮,碘伏常规消毒,背正中切口,分离棘突两侧椎旁肌,暴露棘突和椎板,以第13肋骨为标记,确定T13椎体位置。切断棘上和棘间韧带,用弯眼科剪从两侧椎板根部剪断椎板,暴露T13节段脊髓。Dumont 5号镊前后方向夹持脊髓15 s。无菌纱布轻轻压迫止血,缝合封闭皮下筋膜和皮肤,关闭切口[7]。次日将造模后的动物分为模型组、CE3组、CE3-Mash-1组,每组12只。另12只为假手术组,仅暴露脊髓,不予损伤。术后每天腹腔注射青霉素50,000 U/kg,共3 d;挤压膀胱辅助排尿至自身排尿反射恢复。
1.5移植细胞的制备和注射
常规培养和扩增CE3、CE3-Mash-1细胞。移植前0.125%胰酶消化,终止后吹打成单个细胞悬液,离心,磷酸盐缓冲液(phosphate buffered saline, PBS)洗2次,计数板计数确定细胞总数;生理盐水重悬,调整细胞浓度为5×104/μl,冰上保存。
造模后3 d,小鼠以氯胺酮0.05 ml/10g腹腔注射麻醉,俯卧固定,碘伏常规消毒,拆除背部缝线,直接暴露损伤节段。用10 μl微量进样器抽取细胞悬液2 μl,注射到损伤部位中心:垂直进针,深1.5 mm,缓慢注射,注射后留针2 min。
CE3组和CE3-Mash-1组分别注射CE3、CE3-Mash-1细胞悬液,假手术组和模型组分别注射等量生理盐水。
1.6功能评定
各组分别于术后1 d、7 d、14 d、21 d、28 d行小鼠后肢运动功能量表(Basso Mouse Scale, BMS)评分[8]。BMS通过观察小鼠后肢主动弯曲、着地,行走时躯干的平衡以及尾巴的活动情况,分为10个等级,0分为关节没有任何活动,9分为各关节活动均正常。
1.7取材与染色
分别于造模后14 d和28 d,每组取6只小鼠,10%水合氯醛1 ml腹腔注射处死。咬骨钳咬除椎板,暴露脊髓。切除损伤部位上下各0.5 cm脊髓段。脊髓标本4%多聚甲醛中固定16 h后,弃去多聚甲醛,清水冲洗,置15%蔗糖溶液中脱水24 h,25%蔗糖溶液再脱水24 h。去除蔗糖溶液,-80℃冰箱保存。
冰箱保存的脊髓组织置于切片机冰冻变硬,Oct胶包埋,切片,片厚5 μm。防脱载玻片粘取组织,室温通风晾干1 d,-20℃冰箱保存。
1.7.1HE染色
冰箱中取出切片,室温10 min;置于清水中5 min,苏木素2 min,清水冲洗;0.04%盐酸酒精分化5 s,清水冲洗;2%氨水返蓝10 min,清水冲洗;伊红2 min,清水冲洗;85%乙醇2 min,95%乙醇2 min,100%乙醇2min;二甲苯Ⅰ2 min,二甲苯Ⅱ2 min,二甲苯Ⅲ2 min;中性树胶封片;60℃烤箱过夜;相差显微镜观察。IPP 6.0软件横切面下测量面积。
1.7.2免疫荧光染色
冰箱中取出切片,PBS浸泡5 min,置于湿盒中,纸巾擦除周围水分,蛋白酶K消化10 min修复抗原,PBS洗2 min,共3次;0.5% PBST通透20 min,PBS洗2 min,共3次;5% BSA封闭20 min;14 d标本加Oct 3/4、nestin,28 d标本加β- tubulinⅢ、GFAP一抗(均1∶500),4℃过夜。37℃恒温箱孵育1 h,PBS洗5 min,共3次;加红色荧光标记的山羊抗小鼠IgG二抗,37℃避光孵育1 h,PBS洗5min,共3次,加入DAPI 1 μg/ml室温避光孵育10 min,PBS洗2 min,共3次,荧光显微镜观察。阴性对照用PBS代替一抗。计算阳性细胞率。
1.8统计学分析
2 结果
2.1功能评定
脊髓损伤小鼠后肢运动功能明显受损,爬行时出现拖拽后肢现象。术后1 d,各损伤小鼠评分值为0,假手术组功能无明显下降。
术后7 d、14 d、21 d、28 d,即注射后4 d、11 d、18 d、25 d,模型组、CE3组、CE3-Mash-1组评分均有提高,其中CE3组和CE3-Mash-1组评分高于模型组(P<0.05),CE3组与CE3-Mash-1组间无显著性差异(P>0.05);术后28 d,模型组BMS评分无明显改善,而CE3组和CE3- Mash- 1组评分改善,CE3-Mash-1组评分最高。见表1。
2.2HE染色
损伤14 d和28 d时,模型组脊髓剩余面积明显减少。CE3组和CE3-Mash-1组脊髓剩余均明显大于模型组(P<0.01);假手术组、CE3组和CE3-Mash-1组间脊髓剩余面积无显著性差异(P>0.05)。见图1、表2。
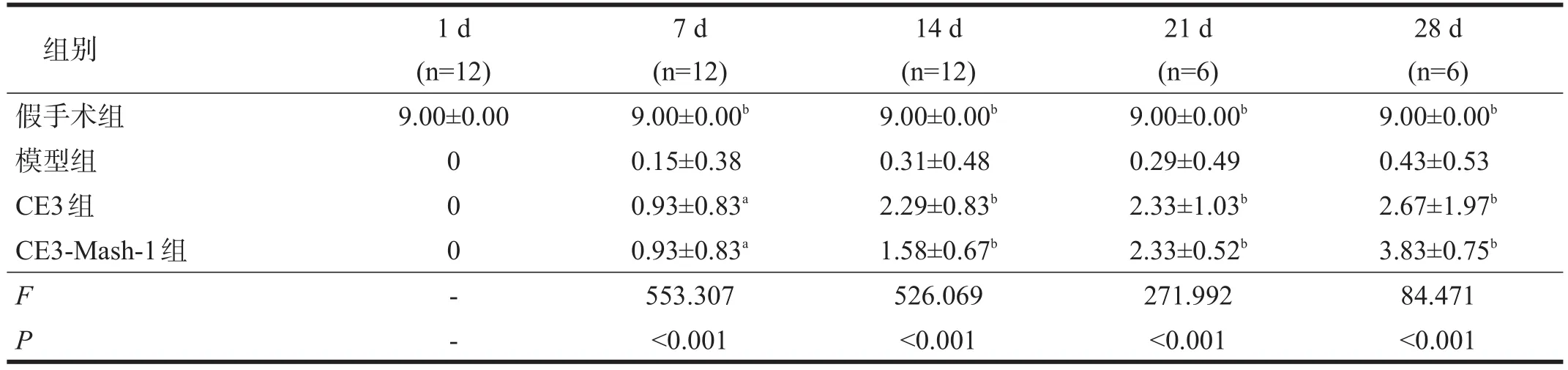
表1 各组BMS评分比较
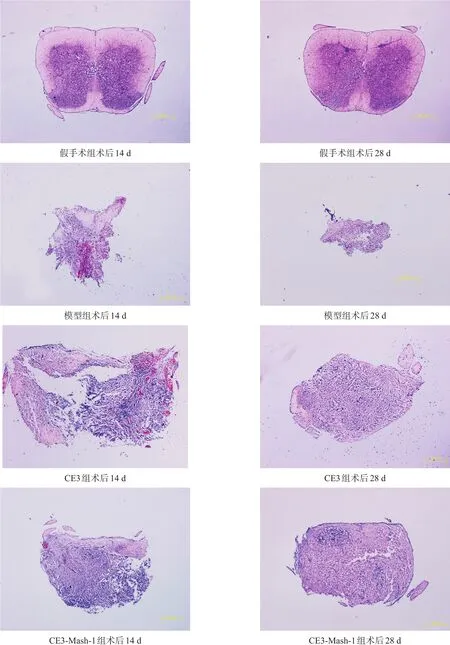
图1 各组脊髓横切面(HE染色, bar=500 μm)
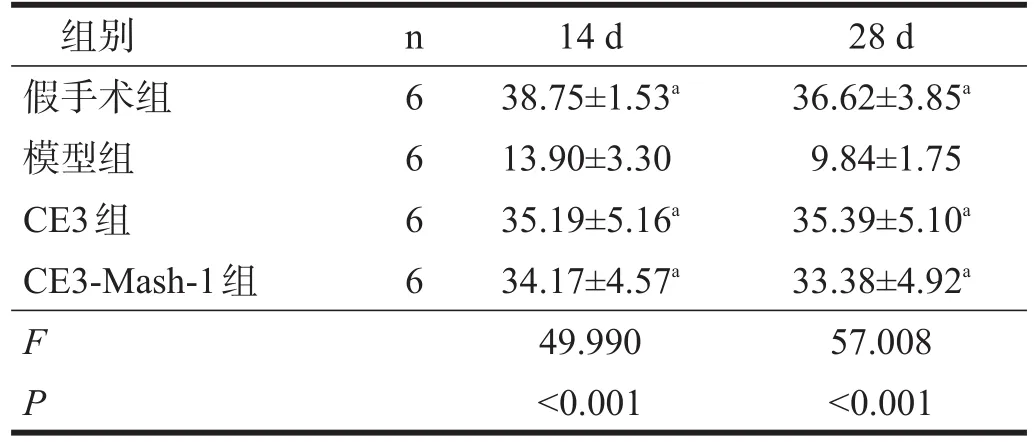
表2 各组脊髓横切面剩余面积(105μm2)
2.3免疫荧光染色
CE3组和CE3-Mash-1组损伤部位均可观察到移植细胞。术后14 d,CE3组Oct3/4阳性细胞数明显多于CE3-Mash-1组(P<0.01),nestin阳性细胞数明显少于CE3-Mash-1组(P<0.01)。见图2、表3。术后28 d,CE3-Mash-1组β-tubulinⅢ阳性细胞数明显多于CE3 组(P<0.01)。GFAP阳性细胞数两组间无显著性差异(P>0.05)。见图3、表3。
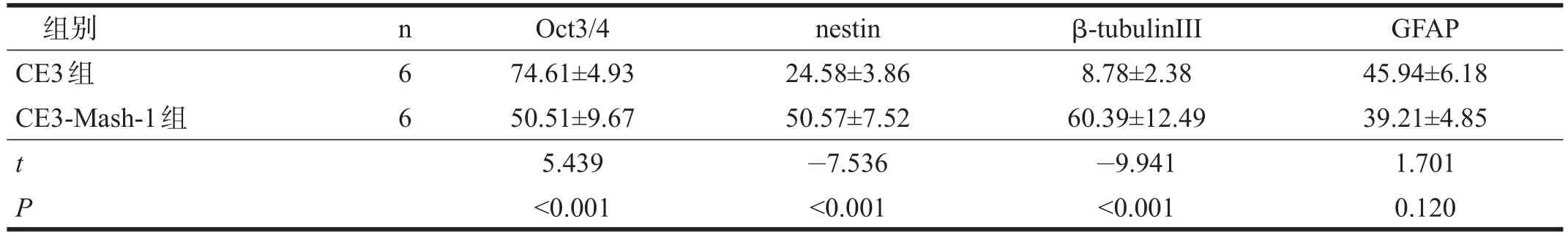
表3 CE3组和CE3-Mash-1组表面蛋白标记的表达(%)
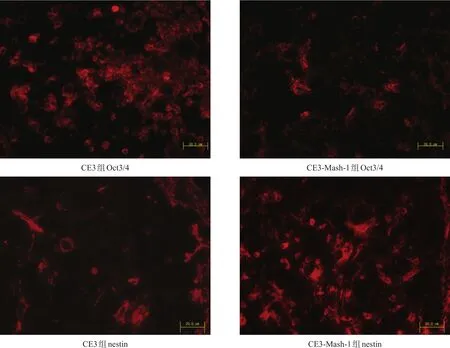
图2 CE3组和CE3-Mash-1组Oct3/4和nestin表达(免疫荧光染色, bar=50 μm)

图3 CE3组和CE3-Mash-1组β-tubulinⅢ和GFAP表达(免疫荧光染色, bar=50 μm)
3 讨论
脊髓损伤的主要造模方法有重物打击、半侧脊髓切断、钳夹损伤、牵拉损伤、光化学损伤、缺血损伤等[9]。钳夹法能较好保持硬脊膜的完整性,该方法造成的神经功能改变与临床上挫伤型脊髓损伤的病理改变非常相似。该方法由Rivlin报道[10];Fehlings等[11]和李刚等[12-13]验证了该方法的可重复性,认为该方法复制的脊髓损伤能较好模拟临床上的脊髓损伤。该模型引起脊髓损伤程度主要取决于夹持力量的大小和夹持时间的长短。此类动物模型多为闭合性损伤,方便进行神经功能评定和脊髓病理检测。2008年Plemel等提出小鼠钳夹脊髓模型[7]。该模型采用不同间隙Dumont 5号镊夹持脊髓15 s造成不同程度脊髓损伤,被广泛应用于脊髓损伤治疗和机理的研究中[14-16]。该方法复制的脊髓损伤模型死亡率25%左右,是一种成功率相对较高、造模简便的急性脊髓损伤模型,动物间损伤程度差异小、一致性强、可重复性好。
本研究采用间隙为0.25 mm的Dumont 5号镊,造模后小鼠后肢运动功能明显障碍,脊髓病理染色显示脊髓横切面剩余面积减少,损伤局部组织结构不清,细胞排列紊乱。
细胞移植后,移植的细胞可分化成神经元、少突胶质细胞,建立新的神经连接,保护或形成新的髓鞘,从而改善神经功能。McDonald等将小鼠的ESC诱导分化成的神经前体细胞后注射到22只损伤9 d的成年大鼠脊髓损伤部位,经过数周观察,发现移植细胞在大鼠受损脊髓部位进一步分化,形成少突胶质细胞、星形胶质细胞和神经元;移植的细胞从注射部位向两端迁移8 mm;步态分析仪分析发现,移植组比对照组(移植成年大鼠大脑皮质的神经细胞)的后肢功能有更好恢复[17]。另有报道,移植ESC来源的前体细胞可减少胶质瘢痕形成[18],促使中枢神经系统损伤后脱髓鞘的神经纤维髓鞘再生[19-20],产生新的郎飞结,减少脊髓损伤面积的丢失[21],使传导通路部分或全部恢复,促进动物前后肢的运动功能[22-23]。
Oct3/4是ESC细胞全能性标记蛋白之一,阳性表示移植的CE3细胞处于未分化状态;nestin是神经干细胞标记蛋白,β-tubulinⅢ是神经元标记蛋白,GFAP则为胶质细胞标记蛋白。
本研究显示,移植转染Mash-1基因的CE3细胞,在脊髓损伤部位能更多分化成nestin阳性的神经干细胞和β-tubulinⅢ阳性的神经元,而表达Oct3/4细胞数明显减少,表明Mash-1基因修饰可促进CE3细胞在损伤脊髓部位分化成神经元。运动功能评分显示,术后14 d,CE3组、CE3-Mash-1组后肢功能评分优于模型组,但两组间无显著性差异。CE3组21 d时1只小鼠功能评分恶化,并持续到28 d。实验结束后,我们对这只小鼠进行病理检查,移植细胞在损伤的局部聚集成团。
Bottai等直接移植未分化的ESC到损伤的脊髓部位,形成不对称的克隆[24];Howard等将ESC进行抗凋亡基因Bcl-2修饰后移植到大鼠的脊髓损伤部位,6周后在移植部位发现未分化的细胞团块[25]。提示直接移植未经合理修饰或未分化的ESC存在形成肿瘤的危险。移植经过Mash-1基因修饰的CE3细胞不但可以促进脊髓神经功能的恢复,也未发现移植细胞在体内形成团块。
综上所述,Mash-1基因转染小鼠CE3胚胎干细胞,可促进CE3细胞在脊髓损伤部位分化成神经细胞,促进脊髓损伤后小鼠后肢运动功能的恢复,可避免形成肿瘤的危险。
[参考文献]
[1]夏计划,邹国耀.脊髓损伤的治疗现状及进展[J].中国医药科学, 2013, 3(9): 46-47, 79.
[2]徐乐勤,丁道芳,李晓锋,等.胚胎干细胞移植治疗脊髓损伤的研究进展[J].中国康复理论与实践, 2011, 17(1): 51-53.
[3]张正丰.内源性神经干细胞与脊髓损伤的研究进展[J].中国康复理论与实践, 2010, 16(4): 344-346.
[4]吴卓,赵敏,王永红,等.细胞移植治疗脊髓损伤的研究进展[J].中国矫形外科杂志, 2015, 23(6): 537-540.
[5] Kageyama R, Ishibashi M, Takebayashi K, et al. bHLH transcription factors and mammalian neuronal differentiation [J]. Int J Biochem Cell Biol, 1997, 29(12): 1389-1399.
[6] Voronova A, Fischer A, Ryan T, et al. Ascl1/Mash1 is a novel target ofgli2 duringgli2-induced neurogenesis in P19 EC cells [J]. PLoS One, 2011, 6(4): e19174.
[7] Plemel JR, Duncang, Chen KW, et al. Agraded forceps crush spinal cord injury model in mice [J]. J Neurotrauma, 2008, 25(4): 350-370.
[8] Basso DM, Fisher LC, Anderson AJ, et al. Basso Mouse Scale for locomotion detects differences in recovery after spinal cord injury in five common mouse strains [J]. J Neurotrauma, 2006, 23(5): 635-659.
[9]田伟,张焱,孙岚,等.脊髓损伤动物模型的建立及其评价[J].中国康复理论与实践, 2010, 16(3): 221-223.
[10] Rivlin AS, Tator CH. Regional spinal cord blood flow in rats after severe cord trauma [J]. J Neurosurg, 1978, 49(6): 844-853.
[11] Fehlings MG, Tator CH, Linden RD. The effect of nimodipine and dextran on axonal function and blood flow following experimental spinal cord injury [J]. J Neurosurg, 1989, 71(3): 403-416.
[12]李刚,李新钢,吴承远,等.钳夹型大鼠脊髓损伤模型的建立及X线照射对损伤区组织结构恢复的影响[J].中华实验外科杂志, 2006, 23 (2): 248.
[13]李刚,李新钢,贾德泽,等.钳夹型大鼠脊髓损伤模型的建立及X线照射对损伤区组织结构恢复的影响[J].中华创伤杂志, 2006, 22(2): 146-147.
[14] Zhao Y, Zhang H, Zhang D, et al. Loss of microRNA-124 expression in neurons in the peri-lesion area in mice with spinal cord injury [J]. Neural Regen Res, 2015, 10(7): 1147-1152.
[15] Yao A, Liu F, Chen K, et al. Programmed death 1 deficiency induces the polarization of macrophages/microglia to the M1 phenotype after spinal cord injury in mice [J]. Neurotherapeutics, 2014, 11(3): 636-650.
[16]guo Q, Cheng J, Zhang J, et al. Delayed post-injury administration of C5a improves regeneration and functional recovery after spinal cord injury in mice [J]. Clin Exp Immunol, 2013, 174(2): 318-325.
[17] McDonald JW, Howard MJ. Repairing the damaged spinal cord: a summary of our early success with embryonic stem cell transplantation and remyelination [J]. Prog Brain Res, 2002, 137: 299-309.
[18] Vadivelu S, Stewart TJ, Qu Y, et al. NG2+ progenitors derived from embryonic stem cells penetrateglial scar and promote axonal outgrowth into white matter after spinal cord injury [J]. Stem Cells Transl Med, 2015, 4(4): 401-411.
[19] Iwai H, Shimada H, Nishimura S, et al. Allogeneic neural stem/progenitor cells derived from embryonic stem cells promote functional recovery after transplantation into injured spinal cord of nonhuman primates [J]. Stem Cells Transl Med, 2015, 4(7): 708-719.
[20] Yoo M, LeegA, Park C, et al. Analysis of human embryonic stem cells with regulatable expression of the cell adhesion molecule l1 in regeneration after spinal cord injury [J]. J Neurotrauma, 2014, 31(6): 553-564.
[21] Salewski RP, Mitchell RA, Shen C, et al. Transplantation of neural stem cells clonally derived from embryonic stem cells promotes recovery after murine spinal cord injury [J]. Stem Cells Dev, 2015, 24(1): 36-50.
[22] Yang JR, Liao CH, Pang CY, et al. Transplantation of porcine embryonic stem cells and their derived neuronal progenitors in a spinal cord injury rat model [J]. Cytotherapy, 2013, 15(2): 201-208.
[23] Sharp J, Frame J, Siegenthaler M, et al. Human embryonic stem cell-derived oligodendrocyte progenitor cell transplants improve recovery after cervical spinal cord injury [J]. Stem Cells, 2010, 28(1): 152-163.
[24] Bottai D, Cigognini D, Madaschi L, et al. Embryonic stem cells promote motor recovery and affect inflammatory cell infiltration in spinal cord injured mice [J]. Exp Neurol, 2010, 223(2): 452-463.
[25] Howard MJ, Liu S, Schottler F, et al. Transplantation of apoptosis-resistant embryonic stem cells into the injured rat spinal cord [J]. Somatosens Mot Res, 2005, 22(1-2): 37-44.
Effects of Transfection of Mash-1gene on Neural Differentiation of Embryonic Stem Cell in Spinal Cord Injury Mice
XU Le-qin1,2, LI Xiao-feng2, SHI Qi2, WANG Yong-jun2, ZHOU Chong-jian2
1. Xiamen Hospital of Traditional Chinese Medicine, Fujian University of Traditional Chinese Medicine, Xiamen, Fujian 361009, China; 2. Institute of Spine, Longhua Hospital, Shanghai University of Traditional Chinese Medicine, Shanghai 200032, China
Correspondence to ZHOU Chong-jian. E-mail: zhouchongjian@hotmail.com
Abstract:Objective To investigate the effects of overexpression of Mash-1gene on functional recovery and neural differentiation of embryonic stem cells in spinal cord injury mice. Methods CE3 cell line with overexpression of Mash-1gene wasgenerated with murine stem cell virus. Spinal cord injury model was established with forceps compression in 4-week-old KM mice. Normal saline (modelgroup, n= 12), CE3 cells with or without overexpression Mash-1gene (CE3-Mash-1 and CE3groups, n=12 respectively) were transplanted into the areas of injury 3 days after injury. They were assessed with the Basso Mouse Scale (BMS) 1, 7, 14, 21, and 28 days after injury. 6 mice from eachgroup were sacrificed 14 and 28 days after injury respectively. The spinal cord area remained were observed with HE stained, and the expression of Oct3/4, nestin,β-tubulin III andglial fibrillary acidic protein (GFAP) were detected with immunofluorescence in the injured spinal cord in the CE3 and CE3-Mash-1groups. Results The score of BMS significantly improved in CE3 and CE3-Mash-1groups compared with that of the modelgroup (F>84.471, P<0.05), with the more area of spinal cord remained (F>49.990, P<0.05). There were less Oct3/4 positive cells in the CE3-Mash-1group than CE3group (t=5.439, P<0.001), with more nestin (t=-7.536, P<0.001) and β-tubulin III (t=-9.941, P<0.001) positive cells. However, there was no significant difference ingFAP positive cells between CE3-Mash-1 and CE3groups (t=1.701, P>0.05). Conclusion Overexpression of Mash-1gene promotes CE3 cells to differentiate into neurons in spinal cord injury mice, and improve the motor function recovery.
Key words:spinal cord injury; embryonic stem cell;gene transfection; Mash-1; neural differentiation; mice
(收稿日期:2015-10-11修回日期:2015-11-12)
[中图分类号]book=47,ebook=52 R651.2
[文献标识码]A
[文章编号]1006-9771(2016)01-0046-07
基金项目:1.上海市教委创新基金项目(No.08-YZ56);2.国家自然科学基金面上项目(No.30973760);3.上海市科委非政府国际合作项目(No.10410702800)。
DOI:10.3969/j.issn.1006-9771.2016.01.009
