早期运动训练对大鼠局灶性脑缺血后运动功能及磁共振弥散张量成像的影响①
2016-03-16米海霞张通缪培张玉阁
米海霞,张通,缪培,张玉阁
早期运动训练对大鼠局灶性脑缺血后运动功能及磁共振弥散张量成像的影响①
米海霞,张通,缪培,张玉阁
[摘要]目的探究早期运动干预对大鼠局灶性脑缺血后运动功能的影响及脑机制。方法21只Sprague-Dawley雄性大鼠分为假手术组(n=7)、自然恢复组(n=7)和运动训练组(n=7),后两组线栓法复制局灶性脑缺血模型。运动训练组于造模术后24 h进行跑轮训练14 d。所有大鼠术后21 d行Rogers神经功能缺损评分及平衡木测试;各组选取行为学评分相近的4只大鼠行核磁共振弥散张量成像(DTI)扫描,测量脑缺血区域(L)及对侧相应区域(R)的部分各向异性(FA)和表观弥散系数(ADC)及其比值(r);弥散张量纤维束示踪(DTT)观察各组纤维束的形态。结果假手术组Rogers评分显著低于模型各组(Z=-0.786, P<0.001),运动训练组与自然恢复组无显著性差异(P>0.05)。自然恢复组平衡评分显著高于假手术组和运动训练组(F=38.11, P<0.001),运动训练组与假手术组间无显著性差异(P>0.05)。自然恢复组LFA与假手术组相比有显著性差异(P<0.05),而运动训练组与自然恢复组和假手术组均无显著性差异(P>0.05);自然恢复组rFA低于假手术组及运动训练组(F=19.30, P<0.05),而运动训练组与假手术组无显著性差异(P>0.05)。自然恢复组ADC和rADC与假手术组之间可能有显著性差异(P=0.056, P=0.057),运动训练组与另两组间无显著性差异(P>0.05)。LFA和rFA与各项行为学评分有较高相关性(r=-0.90~-0.70, P<0.01);LADC和rADC与平衡功能无相关性(P>0.05),与其他行为学评分有中等相关性(r=0.50~0.75, P<0.05)。DTT显示,运动训练组和自然恢复组纤维成分、疏密程度两侧不对称,病灶侧各方向纤维减少、部分缺失;运动训练组病灶侧神经纤维较自然恢复组密集,对称性及连续性好。结论早期进行运动训练能够促进大鼠局灶性脑缺血后运动功能恢复,可能与保护损伤侧神经纤维完整性有关。
[关键词]脑卒中;脑缺血;运动训练;弥散张量成像;神经纤维;大鼠
作者单位:1.首都医科大学康复医学院,北京市100068;2.中国康复研究中心北京博爱医院,北京市100068。作者简介:米海霞(1989-),女,瑶族,湖南辰溪县人,硕士研究生,主要研究方向:神经康复。通讯作者:张通,男,博士,主任医师,教授,博士生导师。E-mail: zt61611@sohu.com。
[本文著录格式]米海霞,张通,缪培,等.早期运动训练对大鼠局灶性脑缺血后运动功能及磁共振弥散张量成像的影响[J].中国康复理论与实践, 2016, 22(1): 1-7.
CITED AS: Mi HX, Zhang T, Miao P, et al. Effects of early exercise on motor function and diffusion tensor imaging in rats after focal cerebral ischemia [J]. Zhongguo Kangfu Lilun Yu Shijian, 2016, 22(1):1-7.
脑卒中已经成为第二大致死疾病及成年人致残的最常见原因[1]。我国每年约有160万人死于脑卒中,是最主要的致死性及成人致残性疾病[2]。每年约有250万新发脑卒中患者,在约750万脑卒中幸存者[3]中,约65%留有不同程度功能障碍[4]。
临床及动物研究证实,运动治疗可以通过调节炎症因子表达[5-6]、平衡氧化应激反应[7]、改善血脑屏障通透性[8]、增加脑血流量[9-10]、促进脑微血管新生[11]等途径,发挥神经保护、改善功能恢复的作用。但目前卒中后运动训练对脑结构的影响仍不很清楚。
弥散张量成像(diffusion tensor image, DTI)是基于组织中水分子弥散运动测量的成像方法,可无创监测脑组织微结构及纤维束的改变[12],为揭示卒中后白质纤维动态重塑提供了有效手段;还可利用DTI数据进行大脑或者脊髓白质弥散张量纤维束示踪(diffusion tensor tractography, DTT)[13]。本研究采用DTI探讨早期运动干预对大鼠局灶性脑缺血后运动功能影响的脑解剖机制。
1 材料与方法
1.1实验动物
成年雄性Sprague-Dawley大鼠21只,体质量250~280g,SPF级,饲养于北京友谊医院实验动物部动物屏障实验室,许可证号SYXK(京)2012-0023。分为假手术组(n=7)、自然恢复组(n=7)和运动训练组(n= 7)。
1.2模型制备
根据Longa改良线栓法[14]制备大鼠大脑中动脉闭塞(middle cerebral artery occlusion, MCAO)模型。自然恢复组和运动训练组大鼠10%水合氯醛3 ml/kg腹腔注射麻醉,颈正中切开,钝性分离,暴露左侧颈总动脉、颈外动脉和劲内动脉分岔处;结扎颈总动脉近心端及颈外动脉远心端,动脉夹临时夹闭颈内动脉,于颈总动脉远心端做一切口,插入相应直径的硅胶头线栓,沿颈总动脉进入颈内动脉,到达大脑中动脉起始部(有轻微阻力感,深度约1.8~2.0 cm)后固定线栓。检查无出血后缝合颈部皮肤。皮下注射生理盐水5 ml补充体液,连续3 d。
假手术组暴露动脉,不插线。其余损伤同上。
术后24 h采用Longa评分进行评定[14],1~2分为造模成功,纳入实验。
1.3跑轮训练
运动训练组术后24 h开始进行跑轮训练。采用YLS-15A大鼠转轮式跑步机(北京众实迪创科技发展有限责任公司),初始转速10 r/min;根据大鼠运动耐力调整跑步机速度;大鼠忍受10 s电击后,转轮停转,休息1 min后继续;如果10 min内大鼠连续休息3次或以上,下调跑笼速度。每次30 min,每天1次,连续14 d。
1.4行为学评价
术后21 d进行行为学功能评价。
1.4.1Rogers评分
轻提大鼠,将其悬至距地面1 m处,观察前肢弯曲状况,0分,大鼠双前肢伸向地面且无其他神经病学特征;1分,对侧前肢持续弯曲而无其他异常。2分,将大鼠置于软塑封纸上,使其前爪可以牢牢抓住,拉住鼠尾,在其肩后轻轻侧推直至前肢侧滑数英寸,瘫痪侧抵抗推力能力下降。3分,大鼠放在地面上,拉其尾时向瘫痪侧旋转;4分,大鼠放在地面上自由行动时向瘫痪侧旋转;5分,只在刺激时行走。6分,对刺激无反应,意识水平低。7分,死亡[15]。
1.4.2平衡木测试
0分,在平衡木上平稳步行;1分,稳定在横木上;2分,抓住横木一边;3分,抱着横木,一只爪掉下横木;4分,抱着横木,两只爪掉下横木,或者在横木上转圈,能待60 s以上;5分,在横木上待40~ 60 s;6分,在横木上待20~40 s;7分,20 s内掉下。
每只动物评估3次,取平均值。
1.5 DTI
术后21 d使用7.0 T MRI扫描仪(PharmaScan, Bruker Biospin, Rheinstetten,germany)对各组中行为学评分相近的4只大鼠进行扫描,包括定位图、T2WI、T2map及DTI。定位相序列RARE,层厚1 mm,扫描层数8层,TR 2000 ms, TE 32.2 ms,FA 180°,FOV 330×330 mm,矩阵256×256;T2WI序列RARE,层厚0.7 mm,扫描层数30层,TR 5000 ms,TE 36 ms,FA 180°,FOV 330×330 mm,矩阵256×256;DTI为单次激发自旋平面回波序列(SE-EPI),弥散敏感梯度为非共线且非共面的30个梯度方向,b=1000 s/mm2,同时包括5个b=0的DTI图像,层厚0.7 mm,扫描层数30层,TR =7500 ms,TE 25 ms,FA 90°,FOV 330×330 mm,矩阵256×256,相位编码方向为从左到右,平均激励次数4次。
数据由同一实验人员在工作站采集。在T2图像上选取最大梗死面积层面(第20~22层),画取皮质梗死区域(信号异常区),并在对侧皮质画出相应大小的感兴趣区;在部分各向异性(fractional anisotropy, FA)及表观弥散系数(apparent diffusion coefficient, ADC)图的相应层面读取感兴趣区的平均值。
采用MRIcon软件将核磁数据转换成NIfTI格式,用Diffusion Toolkit软件进一步处理,用Trackvis软件进行最终纤维束示踪。
1.6统计学分析
2 结果
2.1行为学评分
假手术组无神经功能缺损症状,Rogers评分与造模各组存在非常高度显著性差异(P<0.001);自然恢复组与运动训练组间无显著性差异(P>0.05)。
自然恢复组的平衡评分显著高于假手术组及运动训练组(P<0.001),运动训练组与假手术组间无显著性差异(P>0.05)。见表1。
2.2FA
自然恢复组与假手术组间,左侧感兴趣区FA有显著性差异(P<0.05),而运动训练组与自然恢复组及假手术组间均无显著性差异(P>0.05);各组间右侧感兴趣区FA无显著性差异(P>0.05)。自然恢复组左右FA比值(rFA)低于假手术组(P<0.001)和运动训练组(P< 0.05),运动训练组与假手术组间无显著性差异(P> 0.05)。见表2。
2.3ADC
各组间左侧感兴趣区ADC及左右侧比值rADC存在显著性差异(P<0.05),进一步行Bonferroni两两比较,各组间无显著性差异。见表3。

表1 各组行为学评分比较
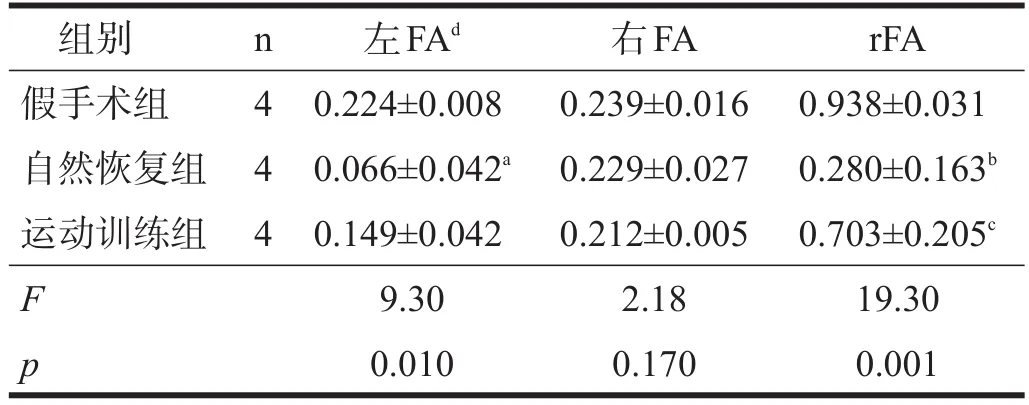
表2 各组FA比较
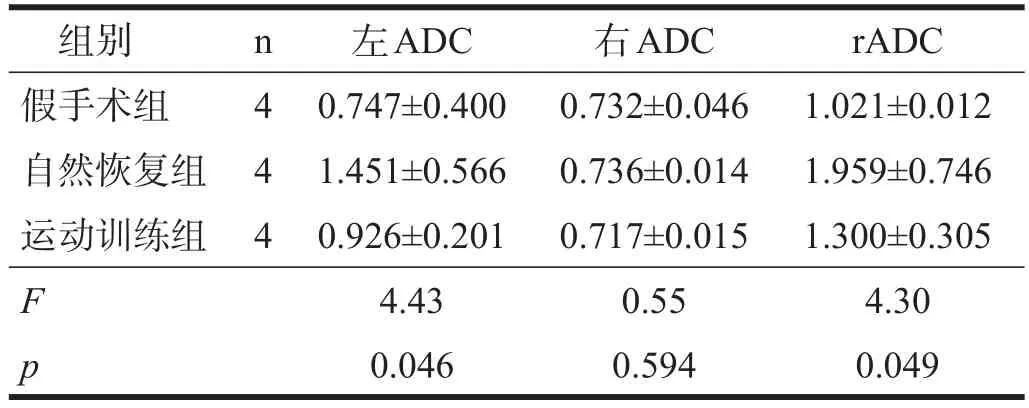
表3 各组ADC比较
2.4相关性分析
左侧FA和rFA与Rogers评分、平衡评分均呈负相关;左侧ADC与Rogers评分及平衡评分呈正相关;rADC与Rogers评分正相关,与平衡评分无显著相关性(P>0.05)。见表4。
2.5DTT
全脑DTT(图1)红色代表左右走向纤维,蓝色代表上下走向纤维,绿色代表前后走形纤维[16]。假手术组双侧纤维束走行、方向及疏密基本对称;自然恢复组左侧(病灶侧)各方向纤维稀少,部分缺失;运动训练组左侧横向纤维稀少,但较自然恢复组密集,前后及上下方向纤维保留较完整。
选取最大缺血层面DTT(图2),假手术组双侧纤维基本对称,纤维束密集,纤维间连续性良好;自然恢复组左侧纤维束明显减少,纤维束不连续,各方向纤维束稀薄;运动训练组可见左侧横向纤维减少,纵向纤维较对侧减少,但连续性较自然恢复组好,且纤维束较自然恢复组密集。

表4 DTI指标与行为学评分的相关性分析
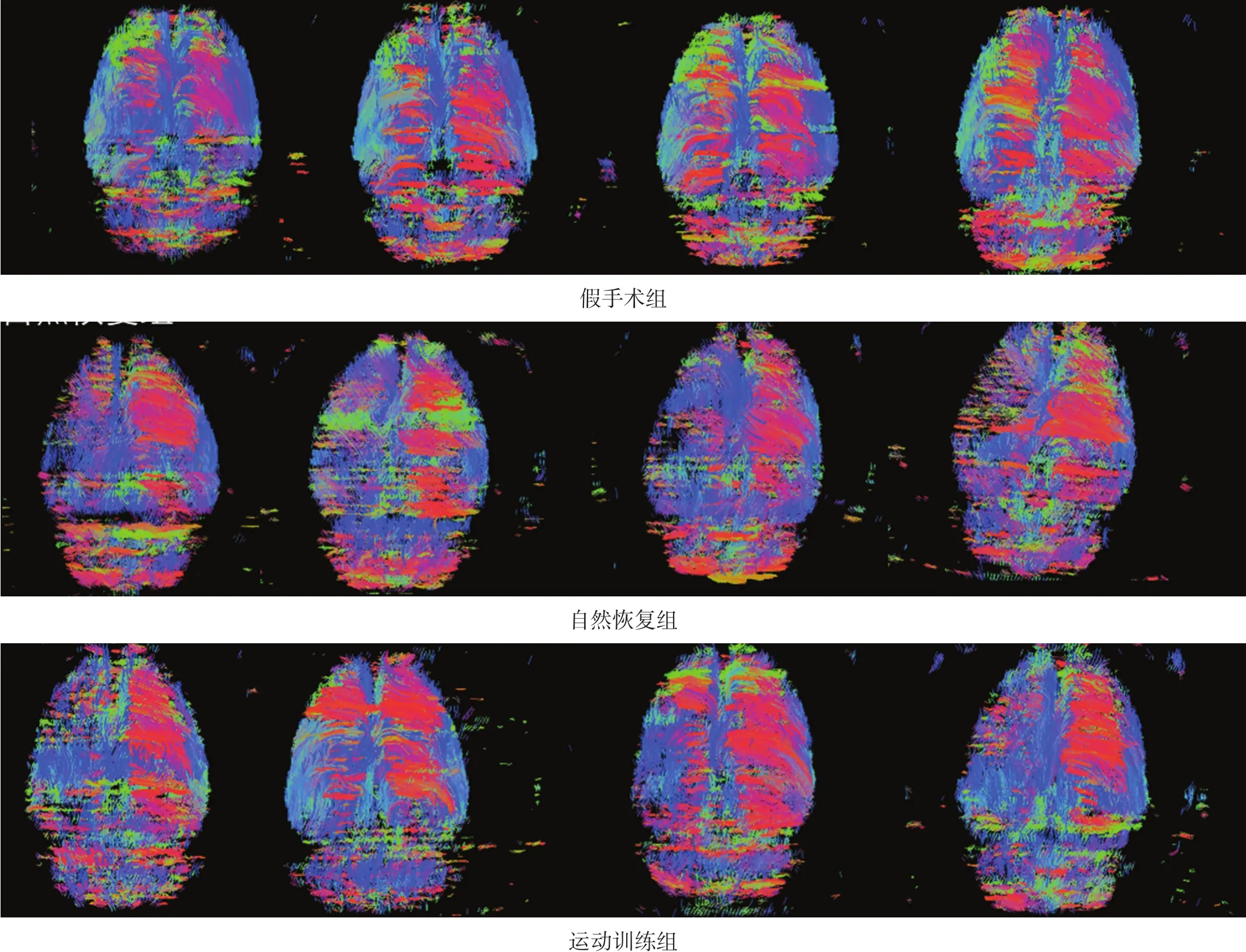
图1 全脑DTT
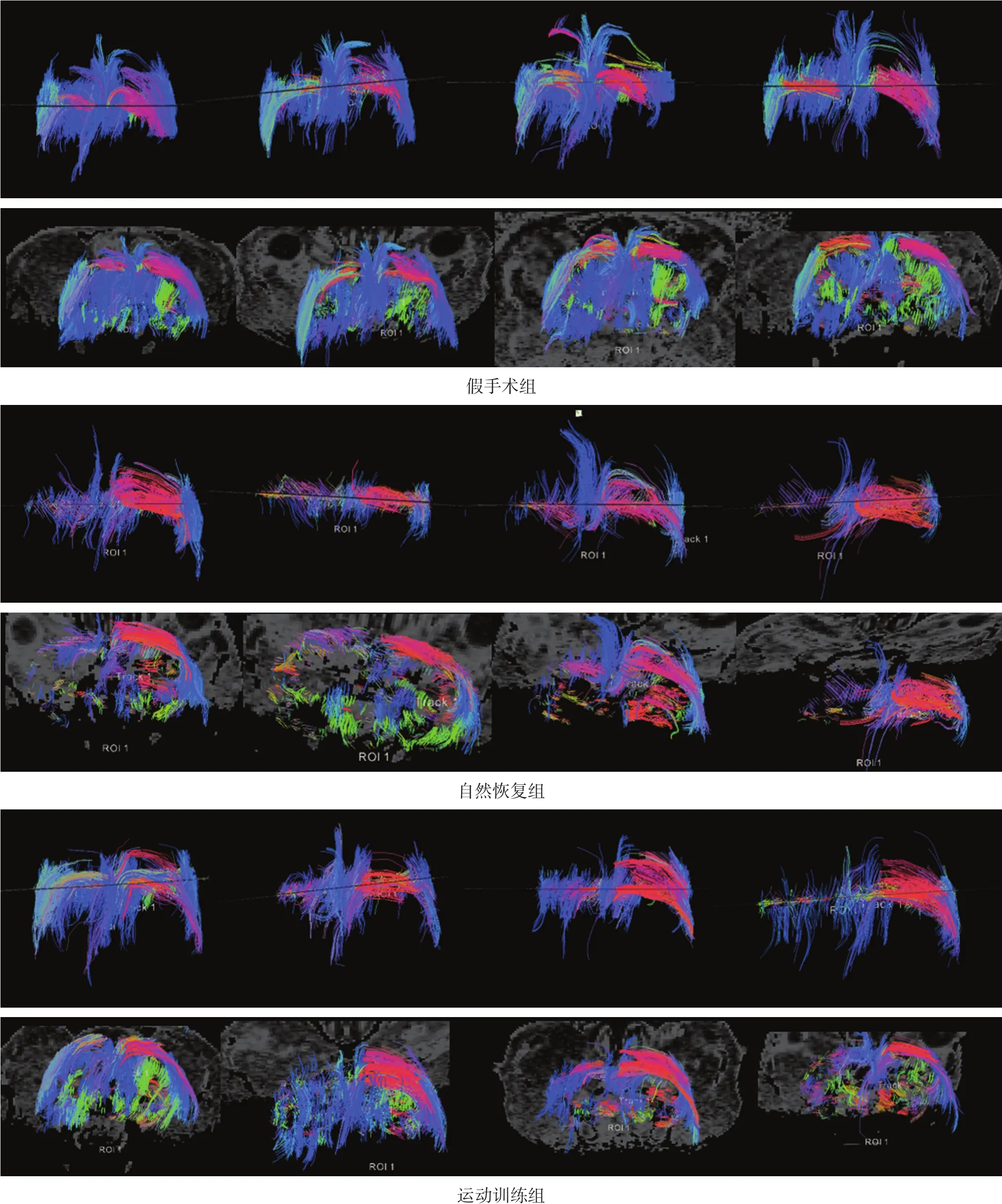
图2 最大缺血层面DTT
3 讨论
缺血性脑卒中时,局部脑血流供应中断,组织缺血缺氧引起一系列病理损伤,最终导致不可逆性脑神经损害。减少早期各种病理损害、降低继发损伤、提高神经元存活,有助于减轻神经功能损害。
脑毛细血管、神经胶质与神经元之间在细胞和功能水平相互作用,即“神经血管单元”,在卒中后维持脑微血管完整性及减少神经损伤中具有重要作用[17-18]。研究表明,运动训练可以通过减轻血脑屏障功能障碍、促进神经血管的完整性、抑制神经细胞凋亡及神经炎症反应、促进神经血管再生等,减轻神经损伤,实现神经功能重塑[8-9,19-21]。然而运动训练神经保护作用对结构重塑的影响研究仍然较少。
本研究显示,模型各组在术后3周内,神经功能缺损症状持续存在,模型制备成功。自然恢复组与运动训练组Rogers评分无显著性差异,可能与样本量少有关;运动训练组平衡评分优于自然恢复组,且与假手术无显著性差异,表明早期运动训练能够促进大鼠的运动功能恢复。这与其他研究结果一致[20-22]。
FA是水分子各向异性成分占整个弥散量的比例[23]。脑缺血时,神经纤维结构破坏,疏水的轴膜和髓鞘对水分子的限制减小或消失,水分子弥散特征可发生相应改变。高FA与神经纤维一致性及髓鞘增加相关,低FA可能表示神经纤维一致性降低,神经纤维损害或可能发生轴突出芽[24]。本研究显示,早期运动训练能够在一定程度上减轻脑缺血损害,保护神经纤维。本研究还显示,rFA能更敏感地反映损伤程度,这与一些临床研究结果相符[25]。
ADC反映水分子在单位时间内弥散的范围,用于描述组织中水分子弥散快慢。既往研究表明,脑梗死超急性期及急性期由于血管阻塞,细胞膜离子泵功能障碍,导致细胞毒性水肿,缺血区ADC下降;亚急性期由于血-脑屏障破坏,血管源性水肿与细胞毒性水肿并存,同时有不同程度的细胞膜破坏和组织坏死等,ADC图表现为低高信号;慢性期由于血管源性水肿,且组织坏死更明显,细胞结构崩解,部分液化形成软化灶,伴有胶质细胞增生,ADC图上升为高信号。
本研究中,自然恢复组和运动训练组病灶侧ADC高于假手术组,提示大鼠已趋于慢性期。各组间右侧ADC无显著性差异,左侧ADC及rADC有显著性差异,但两两比较时,组间差异不显著。提示卒中后早期运动训练可能通过降低急性期细胞毒性损害,改善血脑屏障功能障碍,进而减少亚急性期和慢性期的血管源性水肿以及细胞坏死。
相关性分析显示,缺血侧FA和rFA与行为学评分有较高的相关性,与其他研究的结果一致[24,26-27]。Song等报道,FA是脑卒中患者接受脑刺激治疗后一项有价值的内囊后肢微结构完整性的测量方式及有前途的示踪和预测运动功能恢复的生物指标[26]。DTI参数的患健侧比值与运动功能恢复显著相关,低弥散率和高FA与较好的功能恢复相关[25]。
DTT是近年来迅速发展起来的磁共振功能成像技术,它利用主要特征向量的数据,映射为不同颜色。本研究全脑及最大缺血层面DTT均显示,运动训练组和自然恢复组两侧纤维成分、疏密程度明显不对称,病灶侧各方向纤维减少、部分缺失;运动训练组病灶侧神经纤维较自然恢复组密集,对称性及连续性均较好。这与FA、rFA及运动评分一致。提示早期运动训练有助于维持神经纤维的完整性。
本研究的主要不足之处包括:①样本量偏少;②采用量表评分实现对大鼠局灶性脑缺血模型的均一性控制,准确性有待提高;③DT核磁成像技术对交错纤维、胶质瘢痕识别能力差,容易导致假阳性结果。
综上所述,大鼠局灶性脑缺血损伤后,早期进行运动训练能够促进大鼠运动功能、平衡及协调功能恢复,可能与保护维持纤维束的完整性有关。此外,患侧皮质FA及rFA与行为学评分具有高度相关性,有可能有效预测脑缺血后运动功能结局。
[参考文献]
[1] Mathers CD, Ezzati M, Lopez AD. Measuring the burden of neglected tropical diseases: theglobal burden of disease framework [J]. PLoS Negl Trop Dis, 2007, 1(2): e114.
[2] Liu L, Wang D, Wong KS, et al. Stroke and stroke care in China: huge burden, significant workload, and a national priority [J]. Stroke, 2011, 42(12): 3651-3654.
[3] Johnston SC, Mendis S, Mathers CD.global variation in stroke burden and mortality: estimates from monitoring, surveillance, and modeling [J]. Lancet Neurol, 2009, 8(4): 345-354.
[4] Wang Y, Liao X, Zhao X, et al. Using recombinant tissue plasminogen activator to treat acute ischemic stroke in China: analysis of the results from the Chinese National Stroke Registry (CNSR) [J]. Stroke, 2011, 42(6): 1658-1664.
[5] McFarlin BK, Flynn MG, Campbell WW, et al. Physical activity status, but not age, influences inflammatory biomarkers and toll-like receptor 4 [J]. Jgerontol A Biol Sci Med Sci, 2006, 61(4): 388-393.
[6] Park S, Kim da S, Kang S. Exercise training attenuates cerebral ischemic hyperglycemia by improving hepatic insulin signaling and beta-cell survival [J]. Life Sci, 2013, 93(4): 153-160.
[7] Cechetti F, Worm PV, Elsner VR, et al. Forced treadmill exercise prevents oxidative stress and memory deficits following chronic cerebral hypoperfusion in the rat [J]. Neurobiol Learn Mem, 2012, 97(1): 90-96.
[8] Zhang F, Wu Y, Jia J, et al. Pre-ischemic treadmill training induces tolerance to brain ischemia: involvement ofglutamate and ERK1/2 [J]. Molecules, 2010, 15(8): 5246-5257.
[9] Yang YR, Chang HC, Wang PS, et al. Motor performance improved by exercises in cerebral ischemic rats [J]. J Mot Behav, 2012, 44(2): 97-103.
[10] Tian S, Zhang Y, Tian S, et al. Early exercise training improves ischemic outcome in rats by cerebral hemodynamics [J]. Brain Res, 2013, 1533: 114-121.
[11] Zheng Q, Zhu D, Bai Y, et al. Exercise improves recovery after ischemic brain injury by inducing the expression of angiopoietin-1 and Tie-2 in rats [J]. Tohoku J Exp Med, 2011, 224 (3): 221-228.
[12] Assaf Y, Pasternak O. Diffusion tensor imaging (DTI)-based white matter mapping in brain research: a review [J]. J Mol Neurosci, 2008, 34(1): 51-61.
[13] Mori S, van Zijl PC. Fiber tracking: principles and strategiesa technical review [J]. NMR Biomed, 2002, 15(7-8): 468-480.
[14] Longa EZ, Weinstein PR, Carlson S, et al. Reversible middle cerebral artery occlusion without craniectomy in rats [J]. Stroke, 1989, 20(1): 84-91.
[15] Rogers DC, Campbell CA, Stretton JL, et al. Correlation between motor impairment and infarct volume after permanent and transient middle cerebral artery occlusion in the rat [J]. Stroke, 1997, 28(10): 2060-2065, 2066.
[16] O'Donnell LJ, Westin CF. An introduction to diffusion tensor image analysis [J]. Neurosurg Clin N Am, 2011, 22(2): 185-196, viii.
[17] del ZoppogJ, Mabuchi T. Cerebral microvessel responses to focal ischemia [J]. J Cereb Blood Flow Metab, 2003, 23(8): 879-894.
[18] Hawkins BT, Davis TP. The blood-brain barrier/neurovascular unit in health and disease [J]. Pharmacol Rev, 2005, 57(2): 173-185.
[19] Tahamtan M, Allahtavakoli M, Abbasnejad M, et al. Exercise preconditioning improves behavioral functions following transient cerebral ischemia induced by 4-vessel occlusion (4-VO) in rats [J].Arch Iran Med, 2013, 16(12): 697-704.
[20] Zhang P, Zhang Q, Pu H, et al. Very early-initiated physical rehabilitation protects against ischemic brain injury [J]. Front Biosci (Elite Ed), 2012, 4: 2476-2489.
[21] Chen MD, Rimmer JH. Effects of exercise on quality of life in stroke survivors: a meta- analysis [J]. Stroke, 2011, 42(3): 832-837.
[22]galvin R, Cusack T, O'grady E, et al. Family-mediated exercise intervention (FAME): evaluation of a novel form of exercise delivery after stroke [J]. Stroke, 2011, 42(3): 681-686.
[23] Yoo WK, Kim TH, Hai DM, et al. Correlation of magnetic resonance diffusion tensor imaging and clinical findings of cervical myelopathy [J]. Spine J, 2013, 13(8): 867-876.
[24] Sidaros A, Engberg AW, Sidaros K, et al. Diffusion tensor imaging during recovery from severe traumatic brain injury and relation to clinical outcome: a longitudinal study [J]. Brain, 2008, 131(Pt 2): 559-572.
[25] Song J, Nair VA, Young BM, et al. DTI measures track and predict motor function outcomes in stroke rehabilitation utilizing BCI technology [J]. Front Hum Neurosci, 2015, 9: 195.
[26] Song J, Young BM, Nigogosyan Z, et al. Characterizing relationships of DTI, fMRI, and motor recovery in stroke rehabilitation utilizing brain-computer interface technology [J]. Front Neuroeng, 2014, 7: 31.
[27] Puig J, Blascog, Daunis-I-Estadella J, et al. Decreased corticospinal tract fractional anisotropy predicts long- term motor outcome after stroke [J]. Stroke, 2013, 44(7): 2016-2018.
Effects of Early Exercise on Motor Function and Diffusion Tensor Imaging in Rats after Focal Cerebral Ischemia
MI Hai-xia, ZHANG Tong, MIAO Pei, ZHANG Yu-ge
1. Capital Medical University School of Rehabilitation Medicine, Beijing 100068, China; 2. Beijing Bo'ai Hospital, China Rehabilitation Research Center, Beijing 100068, China
Correspondence to ZHANG Tong. E-mail: zt61611@sohu.com
Abstract:Objective To explore the effects of early exercise on motor function and the mechanism in rats after focal cerebral ischemia. Methods 21 Sprague-Dawley male rats were divided into controlgroup (n=7), natural recoverygroup (n=7) and exercise traininggroup (n= 7), and the latter 2groups were modeled with middle cerebral artery occlusion. The exercise traininggroup received wheel running exercise 24 hours after modeling for 14 days. They were assessed with Rogers score and beam balance test 21 days after modeling. 4 rats in eachgroup received routine MRI and diffusion tensor imaging (DTI) scanning. The fractional anisotropy (FA) and apparent diffusion coefficient (ADC) of ischemic (L) and contralateral side (R) were measured, and the rate of them (L/R, r) was calculated. Results There was significant difference in Rogers score among thegroups (Z=-0.786, P<0.001), but no significant difference between the natural recoverygroup and the exercise traininggroup (P>0.05). Beam balance score of the natural recoverygroup was significantly different from the controlgroup and the exercise traininggroup (F=38.11, P<0.001), but there was no significant difference between the latters (P>0.05). The LFA of the natural recoverygroup was significantly different from the controlgroup (P<0.05), but not significantly different from the exercise traininggroup (P>0.05); while the rFA of the natural recoverygroup was significantly different from the controlgroup and the exercise traininggroup (F= 19.30, P<0.05). LADC and rADC might be different between the controlgroup and the natural recoverygroup (P=0.056, P=0.057), but not significantly different between the natural recoverygroup and the exercise traininggroup (P>0.05). LFA and rFA strongly correlated with all the behavior scores (r=-0.90--0.70, P<0.01); while LADC and rADC moderately correlated with the behavior scores (r=0.50-0.75, P
Key words:stroke; cerebral ischemia; exercise; diffusion tensor imaging; neural fibers; rats
(收稿日期:2015-10-09修回日期:2015-11-02)
[中图分类号]R743.32
[文献标识码]A
[文章编号]1006-9771(2016)01-0001-07
基金项目:“十二五”国家科技支撑计划项目(No.2011BAI08B11)。
DOI:10.3969/j.issn.1006-9771.2016.01.001
