骨保护素基因多态性与椎间盘退变的相关性研究
2016-03-11薛静波王文军晏怡果詹新立
薛静波,王文军,晏怡果,王 程,詹新立
基础研究
骨保护素基因多态性与椎间盘退变的相关性研究
薛静波,王文军,晏怡果,王 程,詹新立
目的探讨骨保护素基因3种常见位点多态性950T/C(rs2073617)、1181G/C(rs2073618)和163A/G(rs3102735)及骨保护素蛋白表达水平与椎间盘退变的相关性。方法选择2013年1月至2014年5月于南华大学附属第一医院就诊的200例椎间盘退变患者作为病例组,同期体检的200例健康志愿者作为对照组。采用PCR-RFLP法检测研究对象骨保护素基因rs2073617、rs2073618和rs3102735位点基因型和单倍型频率分布情况,运用ELISA法检测血清骨保护素水平。采用SPSS 22.0统计学软件进行数据分析。结果病例组和对照组骨保护素基因rs2073617多态性的等位基因和基因型频率比较,差异有统计学意义(P<0.05),携带C等位基因可能会增加椎间盘退变风险[OR=1.79(1.33~2.41),P<0.001],但两组rs2073618和rs3102735多态性等位基因和基因型频率差异均无统计学意义(均P>0.05)。携带骨保护素基因rs2073617多态性3种不同基因型(TT、TC和CC)椎间盘退变患者的血清骨保护素水平均明显高于健康对照组(均P<0.05);而携带rs3102735和rs2073618多态性不同基因型患者的血清骨保护素水平与对照组比较,差异均无统计学意义(均P>0.05)。单倍型分析结果显示,骨保护素基因T-G-A单倍型可能是椎间盘退变的保护性因素(OR=0.62,95%CI=0.41~0.94,P=0.020),而C-G-G单倍型可能为椎间盘退变的危险因素(OR=2.24,95%CI=1.09~4.60,P=0.020)。Logistic回归分析结果表明,低血清骨保护素水平与椎间盘退变发生风险呈正相关,而T-C-A、T-G-A和T-G-G单倍型与椎间盘退变发生风险呈负相关(均P<0.05)。结论骨保护素基因rs2073617多态性可能与椎间盘退变有关,但rs2073618和rs3102735多态性可能不是增加椎间盘退变易感性的主要危险因素;骨保护素基因T-C-A、T-G-A和T-G-G单倍型可能是椎间盘退变的保护性因素,低血清骨保护素水平则可能是椎间盘退变的危险因素。
椎间盘退变;骨保护素;多态现象,遗传;等位基因;基因型;基因频率;疾病遗传易感性;危险因素
椎间盘退变可表现为下腰痛、椎间盘突出及腰椎管狭窄,从而对患者的生活质量造成一定影响[1]。其确切的病理机制尚不十分清楚,但已知基因和环境因素扮演了重要角色[2]。作为肿瘤坏死因子超受体家族中的一员,骨保护素(osteoprotegerin,OPG)水平发生变化被认为可能是椎间盘退变的病因之一[3]。有研究证实,基因变异可导致OPG血清水平的改变,包括950T/C(rs2073617)、1181G/C(rs2073618)和 163A/G(rs3102735)基因多态性的变化;此外,研究还发现OPG基因多态性与骨密度之间有一定的相关关系[4-5]。但目前OPG基因多态性与椎间盘退变之间的联系并不明确。本研究探讨OPG基因3种常见位点多态性950T/C(rs2073617)、1181G/C(rs2073618)、163A/G(rs3102735)及OPG蛋白表达水平与椎间盘退变的相关关系,旨在为进一步探明椎间盘退变的遗传学发病机制提供依据。
1 资料与方法
1.1 研究对象
选择2013年1月至2014年5月于南华大学附属第一医院被诊断为椎间盘退变的200例患者作为病例组,男100例,女100例,年龄40~62岁,平均年龄(53±7)岁。纳入标准:有典型临床症状、体征及相应MRI表现,术后病理证实为椎间盘组织明显退变。排除标准:合并有腰椎管狭窄者。对照组为同期体检的200例健康成年志愿者,男100例,女100例,年龄42~62岁,平均年龄(52±5)岁,腰椎MRI正常。本研究经南华大学附属第一医院伦理委员会审批同意,所有受试者均签署知情同意书。病例组和对照组在年龄、性别、体质量指数、是否吸烟等方面比较,差异均无统计学意义(均P>0.05),具有可比性。
1.2 主要实验试剂及设备
主要实验试剂:全血基因组DNA提取试剂盒(北京天根生化科技有限公司);rs2073617引物、rs2073618引物、rs3102735引物(上海生工生物工程公司);特异性限制性内切酶(大连宝生物工程有限公司);TaqDNA聚合酶(北京天根生化科技有限公司)。主要设备:PCR板、PCR扩增试剂盒(上海生工生物工程公司);ELISA试剂盒(上海丽臣生物科技有限公司);9700 PCR仪、基因分析仪(ABI公司,美国);电泳仪(Bio-Rad公司,美国);分光光度计(Beckman公司,美国)。
1.3 标本采集
所有受试者空腹10~12 h,晨起抽取肘静脉血10 mL,取3 mL加乙二胺四乙酸(EDTA)抗凝,用全血基因组DNA提取试剂盒提取基因组DNA;其余血样不添加抗凝剂,静置1 h后常温下以3 000转/分离心10 min,提取血清置于-80℃冰箱保存备用。
1.4 单核苷酸多态性检测
采用PCR-RFLP法鉴定基因多态性,PCR引物用Primer Premier 5.0软件设计,引物由上海生物工程公司合成。PCR反应体系25 μL,包括基因组DNA 100 ng,上下游引物各125 ng,2×Taq Master Mix 12.5 μL,ddH2O 9.5 μL。PCR反应条件:95℃预变性5 min,94℃变性30 s,62℃退火45 s,72℃延伸60 s,共30个循环,最后72℃延伸10 min。使用特异性限制性内切酶HincII、XspI和AseI识别PCR产物特异性位点,然后通过凝胶电泳检测PCR产物,利用ABI370型DNA测序仪进行测序鉴定,以判断相应位点的基因型。引物序列及长度见表1。
1.5 蛋白检测
采用ELISA法测定血清OPG水平,严格按试剂盒说明书操作。450 nm波长依序测量各孔的吸光度(optical density,OD值),用标准品的浓度和OD值计算出标准曲线的直线回归方程式,以及对应的样品浓度。所有的标本测定2次,取其平均值,检测符合实验室质控标准。
1.6 单倍型构建
基于rs2073617和rs3102735两个多态位点均位于OPG基因启动子上,而rs2073618位于第一外显子,且相互毗邻,故运用以贝叶斯算法(Bayesian algorithm)为基础的PHASE 2.1软件,对3个多态性位点的基因型进行单倍体构建[6]。
1.7 统计学处理
采用SPSS 22.0软件进行统计学分析。对照组基因型及等位基因频率采用Hardy-Weinberg平衡分析确定研究样本的总体代表性。计量资料以()表示,组间计量资料的比较采用方差分析或t检验,如数据不符合正态分布,则采用非参数秩和检验。两组之间基因型、等位基因和单倍型频率分布采用χ2检验。通过Logistic回归分析来确定椎间盘退变的风险因素,各因素与椎间盘退变患病风险之间的相关性用比值比(odds ratios,OR)及其95%可信区间(confidence intervals,CI)表示。所有的统计检验均为双侧概率检验,P<

表1 PCR引物设计
0.05 为差异有统计学意义。
2 结果
2.1 基因分型
OPG rs2073617T/C基因多态性检测结果:855 bp处出现单个条带为野生TT纯合子,杂合子TC产生855 bp、460 bp和395 bp三条带;突变纯合子CC产生395 bp、460 bp两条带。rs2073618G/C基因多态性检测结果:野生型GG纯合子基因不被酶切,仍为570 bp处一条带,杂合子GC产生570 bp、522 bp和48 bp三条带,突变纯合子CC产生522 bp和48 bp两条带。rs3102735G/A野生型纯合子A/A为161bp和139 bp两条带,杂合子G/A为300 bp、161 bp和139 bp三条带,突变型纯合子G/G 300 bp一条带。DNA测序鉴定的结果亦证实上述rs2073617T/C、rs2073618G/C和rs3102735A/G位点3种基因型的存在(图1)。
2.2 等位基因和基因型分布
OPG基因rs2073617、rs2073618和rs3102735位点的基因型和等位基因频率均符合Hardy-Weinberg平衡法则,表明各基因频率已达遗传平衡,所选择的样本具有群体代表性(均P>0.05)。病例组和对照组OPG基因rs2073617多态性等位基因和基因型频率差异具有统计学意义(P<0.05),携带C等位基因可能会增加椎间盘退变风险[OR=1.79(1.33~2.41),P<0.001],但两组rs2073618和rs3102735多态性等位基因和基因型频率差异均无统计学意义(均P>0.05,表2)。
2.3 骨保护素表达
携带OPG基因rs2073617多态性3种不同基因型(TT、TC和CC)椎间盘退变患者的血清OPG水平均明显低于健康对照组(均P<0.05),且病例组中携带TC和CC基因型患者的OPG水平也明显低于TT基因型携带者(均P<0.05)。携带rs2073618和rs3102735多态性不同基因型患者的血清OPG水平与对照组比较,差异均无统计学意义(均P>0.05),见图2。
2.4 单倍型频率统计分析

图1 骨保护素基因型测序图

表2 病例组和对照组血清骨保护素基因3种不同位点基因型和等位基因频率比较
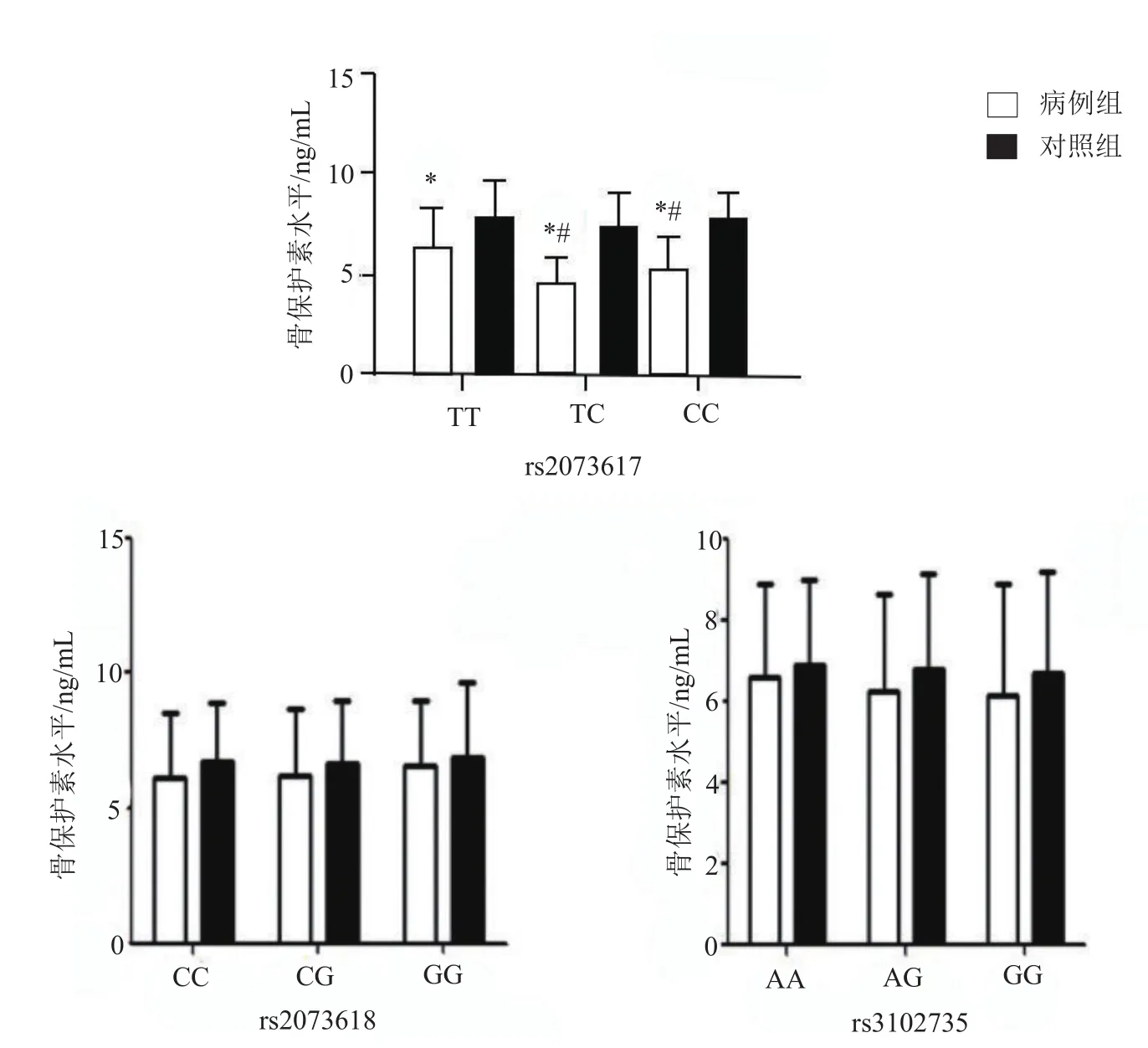
图2 病例组和对照组不同基因型血清骨保护素水平比较 注:与对照组比较,*P<0.05;病例组内比较#P<0.05
采用PHASE 2.1软件进行单倍体构建,共产生8种单倍体组合:T-C-A、T-C-G、C-C-A、C-C-G、T-G-A、T-G-G、C-G-A、C-G-G。单倍型分析结果显示,OPG基因T-G-A单倍型可能是椎间盘退变的保护性因素(OR=0.62,95%CI=0.41~0.94,P=0.020),而C-G-G单倍型可能为椎间盘退变的危险因素(OR=2.24,95%CI=1.09~4.60,P=0.020)。
2.5 Logistic回归分析
以椎间盘退变为因变量,OPG基因rs2073617、rs2073618和rs3102735 3个位点基因型及单倍型、体质量指数、吸烟、OPG水平、年龄、性别作自变量,进行Logistic多元逐步回归,并得出校正的比值比Exp(B)。分析结果表明:低血清OPG水平与椎间盘退变发生风险呈正相关,而T-C-A、T-G-A和T-G-G单倍型与椎间盘退变发生风险呈负相关(均P<0.05,表3)。
3 讨论
OPG是肿瘤坏死因子超受体家族的一种糖蛋白,同时也是一种破骨细胞形成抑制因子。研究证实其具有极为重要的调节骨质代谢的功能,能够抑制破骨细胞分化及骨吸收,促进骨形成,进而起到增加骨密度、防止骨质疏松发生的作用[6]。针对绝经后妇女的研究结果表明,血清OPG水平与骨密度值呈正相关关系,提示OPG/RANKL/ RANK系统参与了绝经后妇女骨质疏松的发生过程[7]。
此外,OPG与类风湿关节炎、骨性关节炎的发生发展也有密切的相关性。有研究证实OPG/ RANKL/RANK系统参与了类风湿关节炎中骨侵蚀的发生,而对OPG/RANKL/RANK通路进行有效干预后,RANKL/OPG比值降低,能够抑制破骨细胞的分化,从而阻断骨质破坏,减轻炎症反应[8-9]。亦有不同学者对大鼠骨关节炎模型进行研究,结果表明,OPG能够显著对抗软骨细胞凋亡,降低软骨蛋白聚糖酶表达水平,减轻软骨蛋白聚糖的降解作用,阻止软骨蛋白聚糖的丢失,从而减缓骨关节炎的病变过程[10-11]。
大多数学者认为椎间盘的退变可能是由于软骨终板增厚、钙化,导致椎间盘营养减少、髓核变性,最后发展到退变、钙化[12];而OPG能够阻止软骨终板中破骨细胞介导的骨吸收,从而保持软骨终板的完整性,减缓椎间盘退变的发生与进展[13]。人们在对人退变椎板的研究中发现血清OPG水平与椎间盘退变程度有显著相关性,也有力证实了OPG在椎间盘退变中所发挥的作用[14]。但目前OPG与椎间盘退变之间的关系还不十分明确,因此,本研究探讨OPG基因多态性与椎间盘退变的关系,试图从遗传基因学水平阐明椎间盘退变的发生机制。
我们发现OPG基因rs2073617多态性可能与椎间盘退变有关,但rs2073618和rs3102735多态性可能不是增加椎间盘退变易感性的主要危险因素;同时,我们还发现OPG 950T/C(rs2073617)多态性的C等位基因携带者较之T等位基因携带者罹患椎间盘退变的风险要高。如前所述,OPG基因在OPG/RANKL/RANK系统中的主要作用在于扰乱破骨细胞分化和刺激成骨细胞活动,这意味着血清OPG水平具有调节骨形成与吸收的作用[15];而破坏RANKL和OPG之间的平衡将使椎间盘在机械负荷的影响下出现软骨退化,这可能是椎间盘退变或骨关节炎进展的重要机制[10-11]。

表3 椎间盘退变风险因素的回归分析
单倍型分析结果显示,OPG基因T-C-A、T-G-A和T-G-G单倍型可能是椎间盘退变的保护性因素,而C-G-G单倍型可能为椎间盘退变的危险因素。另外,研究中发现携带OPG基因rs2073617多态性3种不同基因型(TT、TC和CC)椎间盘退变患者的血清OPG水平均明显低于健康对照组,提示这3种不同的基因型可能是椎间盘退变进展的危险因素。软骨终板是椎间盘重要的生物力学结构之一,椎间盘的新陈代谢取决于软骨终板与椎间盘之间的营养交换。推测OPG基因多态性可能通过影响血清OPG水平的方式在软骨终板及椎间盘的退变中发挥作用。结合本研究结果,我们推测,与OPG基因rs2073617多态性相关的血清OPG水平降低可能作用于骨代谢及软骨终板退变过程,最终导致椎间盘退变。
本研究亦有不足之处,病例组与对照组研究样本量较少,未开展相关动物实验,这也是我们下一步的研究计划和方向。
[1] SakaiD.Future perspectivesofcell-based therapy for intervertebral disc disease[J].Eur Spine J,2008,17(Suppl 4):452-458.
[2]Kalichman L,Hunter DJ.The genetics of intervertebral disc degeneration: familial predisposition and heritability estimation[J].Joint Bone Spine,2008,75(4):383-387.
[3] Liang QQ,Li XF,Zhou Q,et al.The expression of osteoprotegerin is required for maintaining the intervertebral disc endplate of aged mice[J].Bone,2011,48(6):1362-1369.
[4] Garcia-Unzueta MT,Riancho JA,Zarrabeitia MT,et al. Association of the 163A/G and 1181G/C osteoprotegerin polymorphism with bone mineral density[J].Horm Metab Res,2008,40(3):219-224.
[5]Vidal C,Formosa R,Xuereb-Anastasi A.Functional polymorphisms within the TNFRSF11B (osteoprotegerin)gene increase the risk for low bone mineral density[J].J Mol Endocrinol,2011,47(3):327-333.
[6]Grimaud E,Soubigou L,Couillaud S,et al.Receptor activator of nuclear factor kappaB ligand(RANKL)/osteoprotegerin (OPG)ratio is increased in severe osteolysis[J].Am J Pathol, 2003,163(5):2021-2031.
[7]Nabipour I,Larijani B,Vahdat K,et al.Relationships among serum receptor of nuclear factor-kappaB ligand, osteoprotegerin,high-sensitivity C-reactive protein,and bone mineral density in postmenopausal women:osteoimmunity versus osteoinflammatory[J].Menopause,2009,16(5):950-955.
[8]Oshita K,Yamaoka K,Udagawa N,et al.Human mesenchymal stem cells inhibit osteoclastogenesis through osteoprotegerin production[J].Arthritis Rheum,2011,63(6): 1658-1667.
[9]Oelzner P,Franke S,Lehmann G,et al.The balance between soluble receptors regulating IL-6 trans-signaling is predictive forthe RANKL/osteoprotegerin ratio in postmenopausal women with rheumatoid arthritis[J].Rheumatol Int,2012,32 (1):199-206.
[10]Shimizu S,Asou Y,Itoh S,et al.Prevention of cartilage destruction with intraarticular osteoclastogenesis inhibitory factor/osteoprotegerin in a murine model of osteoarthritis[J]. Arthritis Rheum,2007,56(10):3358-3365.
[11]Kadri A,Ea HK,Bazille C,et al.Osteoprotegerin inhibits cartilage degradation through an effect on trabecular bone in murine experimental osteoarthritis[J].Arthritis Rheum,2008, 58(8):2379-2386.
[12]Kepler CK,Ponnappan RK,Tannoury CA,et al.The molecular basis of intervertebral disc degeneration[J].Spine J,2013,13(3):318-330.
[13]Matzko ME,Bowen TR,Smith WR.Orthogenomics:an update[J].J Am Acad Orthop Surg,2012,20(8):536-546.
[14]Rutges JP,Duit RA,Kummer JA,et al.Hypertrophic differentiation and calcification during intervertebraldisc degeneration [J].Osteoarthritis Cartilage,2010,18(11): 1487-1495.
[15]Risbud MV,Shapiro IM.Role of cytokines in intervertebral disc degeneration:pain and disc content[J].NatRev Rheumatol,2014,10(1):44-56.
Associations between osteoprotegerin gene polymorphisms and intervertebral disc degeneration
XUE Jingbo*,WANG Wenjun,YAN Yiguo,WANG Cheng,ZHAN Xinli.*Department of Spine Surgery,the First Affiliated Hospital of Nanhua University,Hengyang,Hunan 421001,China
WANG Wenjun,E-mail:wwj1202@hotmail.com
Intervertebral disc degeneration;Osteoprotegerin;Polymorphisms,genetic;Alleles;Genotype; Gene frequency;Genetic predisposition to disease;Risk factors
R681.533,R394.3
A
1674-666X(2016)06-352-07
2016-10-20;
2016-11-22)
(本文编辑:白朝晖)
10.3969/j.issn.1674-666X.2016.06.006
421001湖南衡阳,南华大学附属第一医院脊柱外科(薛静波,王文军,晏怡果,王程);530000广西南宁,广西医科大学第一附属医院脊柱骨病科(詹新立)
王文军,E-mail:wwj1202@hotmail.com
【Abstract】Objective To investigate the correlations of osteoprotegerin(OPG)-950T/C(rs2073617),-1181G/ C(rs2073618),-163A/G(rs3102735)polymorphisms,serum OPG levels,and intervertebral disc degeneration (IDD).Methods A total of 200 IDD patients treated in the First Affiliated Hospital of Nanhua University from January 2013 to May 2014 were recruited as the case group,and 200 healthy volunteers were selected as the control group simultaneously.Genotype and haplotype frequency distributions of OPG polymorphisms were analyzed by PCR-RFLP assay,serum OPG levels were measured by ELISA.SPSS 22.0 software was used to analyze.Results Genotype and allele frequencies of OPG rs2073617 polymorphism were significantly higher in case group compared to those in control group(P<0.05).The C allele carriers showed a higher risk of IDD than T allele carriers[OR=1.79(1.33-2.41),P<0.001].The genotype and allele frequencies of two other gene polymorphisms,rs2073618 and rs3102735,showed no statistical differences between patients and controls(P>0.05).Furthermore,OPG serum levels in case group with TT,TC and CC genotypes in OPG rs2073617 polymorphism were markedly higher than those in control group(P<0.05);while there were no statistical differences of OPG serum levels between controls and IDD patients who carried different genotypes in OPG rs2073618 and rs3102735 polymorphisms.The haplotype analysis showed that T-G-A haplotype associated with protection against IDD(OR=0.62,95%CI=0.41-0.94,P=0.02),while C-G-G haplotype associated with elevated susceptibility to IDD(OR=2.24,95%CI=1.09-4.60,P=0.02).Logistic-regression analysis indicated that low serum levels of OPG positively correlated with IDD risk,while the T-C-A,T-G-A and T-G-G haplotypes negatively correlated with IDD risk(P<0.05).Conclusions OPG rs2073617 polymorphism is strongly connected with increased risk of IDD,but rs2073618 and rs3102735 might not be major risks of increasing IDD susceptibility.Low OPG serum level maybe increases IDD risk;By contrast,T-C-A,T-G-A and T-G-G haplotypes are protective factors for IDD probably.
