剪切体蛋白PRPF8的研究进展
2016-03-08曹涤非黄国庆薛佳莹王东凯刘兆良
曹涤非,姜 洋,黄国庆,薛佳莹,吴 琼,王 雷 ,孙 尧,王东凯,李 瑶,邢 言,刘兆良
(1.黑龙江省科学院高技术研究院,哈尔滨 150020; 2.哈尔滨医科大学,哈尔滨 150020)
剪切体蛋白PRPF8的研究进展
曹涤非1,姜 洋1,黄国庆1,薛佳莹1,吴 琼1,王 雷1,孙 尧1,王东凯1,李 瑶1,邢 言1,刘兆良2
(1.黑龙江省科学院高技术研究院,哈尔滨 150020; 2.哈尔滨医科大学,哈尔滨 150020)
真核生物中,mRNA前体的可变剪切是一个重要过程,在这过程中剪切体蛋白起到重要的作用。PRPF8是剪切体的核心蛋白,它的突变可引起一些模型细胞的死亡,并且与疾病的发生有重要的关系。
mRNA前体;可变剪切;PRPF8
真核生物中,绝大多数基因的初始转录产物前 mRNA(pre-mRNA)必须经过剪切等加工过程,才能形成成熟的mRNA。可变剪切是指同一种pre-mRNA具有多种剪切程序,形成不同的mRNA。pre-mRNA 的可变剪切是控制基因表达和产生蛋白质多样性的重要机制,在产生受体多样性、调节控制生长发育等方面起着决定性作用[1]。
1 mRNA前体可变剪切的机制
以外显子和内含子为单元的基因结构形式在真核生物中普遍存在,人类基因中的大多数都含有内含子。因此,通过切除内含子把外显子按一定的顺序拼接起来形成成熟的 mRNA,再经过翻译产生蛋白质就是一种最普遍的基因表达方式[2]。现已经知道,mRNA 的剪切是基于对剪切位点的识别基础上,由被称为剪切体的核酸蛋白复合物完成。剪切体包含了 5 种SnRNP 和超过200种的蛋白质因子,这些蛋白质因子有富含精氨酸和丝氨酸的SR 蛋白和非SR 蛋白,包括hnRNP、RNA螺旋酶、激酶等[3-4]。剪切复合体的形成开始于 U1snRNP 结合至 5′剪切位点和SF1(splicing factor 1)、U2snRNP 结合至 3′剪切位点处的分支点,U2snRNP的结合需要辅助因子U2AF。U2AF 由 65kDa 和 35kDa 两个亚基组成,U2AF65 识别多聚嘧啶区域,U2AF35 识别 3′剪接位点的AG,随后 U2snRNP 结合到分支点上,从而形成了剪切前体。最后 U5 和 U4/U6snRNP 的结合完成剪切体的组装,经过两个连续的转酯反应,完成了内含子的切除和外显子的连接[5]。
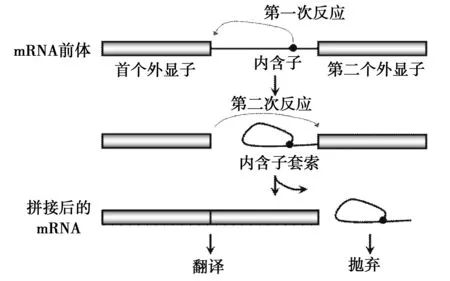
图1 剪切体剪切调控过程Fig.1 Regulation of splicing
2 剪切体蛋白PRPF8的生物学功能
PRPF8 是 U5snRNP 的重要组成成分,是剪切体的核心蛋白。它在剪切体的组装和催化两步的转酯化酶促反应中均发挥作用,是剪切体蛋白中在进化上最保守的蛋白之一[6]。酵母实验和哺乳动物细胞的体外实验证明了PRPF8 在剪切中不可或缺的作用[7]。但是关于这个蛋白的生理和细胞生物学功能却很少研究。模型动物中的有限研究表明:PRPF8 是维持生物生存的重要蛋白。酵母中 PRPF8 突变会引起温度敏感的细胞周期阻滞[7]。在线虫和斑马鱼中废除PRPF8 的表达会造成胚胎期的死亡[7]。在果蝇的 S2 细胞中沉默 PRPF8 可以引起大量的细胞死亡[8]。而PRPF8 调控细胞生存能力这一功能在哺乳动物细胞中也一样保守。小鼠中完全敲除 PRPF8 会引起小鼠胚胎的早期死亡[9]。在一个由欧盟资助的筛选与有丝分裂相关的基因的项目中(MitoCheck),在 Hela 细胞中用 4种不同的 siRNA 沉默 PRPF8均导致了细胞死亡。而相似的现象也在另外两个完全独立的实验中得到证实[10]。
在遗传性疾病中,PRPF8与常染色体显性遗传视网膜色素变性有关[11]。此外,在非转化的和转化的乳腺上皮细胞系(human mammary epithelial cells, HMEC)中,在利用乳腺癌细胞系 Cal51 和 HCC1954 中,在结肠癌细胞系 HCT116和 DLD1,沉默 PRPF8 都可以导致细胞死亡。这证明 PRPF8 是一个功能非常保守的,可以调节细胞生存能力的原癌基因[12-14],并且 PRPF8 可能在肿瘤的生长中发挥重要作用[15]。刘兆良等通过免疫印迹的方法检查了多个乳腺癌细胞系中 PRPF8的表达情况,发现与正常乳腺上皮细胞相比较,PRPF8 的表达在检测的所有的乳腺癌细胞中都有不同程度的上调。通过检索了肿瘤基因组图谱计划(the Cancer Genome Atlas, TCGA)的数据库,发现 PRPF8 在乳腺癌中频繁地发生突变、缺失和扩增。这些数据表明 PRPF8 作为一个剪切体的核心蛋白,对于细胞生长具有重要作用,可能在乳腺癌中发挥重要作用。
3 展望
可变剪切是真核生物细胞中不可或缺的过程,对基因的转录和蛋白的表达具有重要的调控作用。最近的研究表明,在可变剪切过程中的突变会导致许多疾病的发生,因此,从mRNA前体的剪切水平上寻找疾病发生的原因,有助于临床对疾病发病机制的深刻认识和对疾病靶向治疗的帮助。可变剪切将是今后临床医学研究的方向,剪切体蛋白的研究将成为热点。
[1] Alastair Thompson,Keith Brennan,Angela Cox,et al. Evaluation of the current knowledge limitations in breast cancer research: a gap analysis[J].Breast Cancer Res.,2008,10(2):R26.
[2] Scott,L. M. and V. I. Rebel. Acquired mutations that affect pre-mRNA splicing in hematologic malignancies and solid tumors[J]. J Natl Cancer Inst,2013,105(20):1540-1549.
[3] Naoki Sato,Masao Maeda,Mai Sugiyama,et al.Inhibition of SNW1 association with spliceosomal proteins promotes apoptosis in breast cancer[J].Cells.cancer medicine,2014,(09):80-84.
[4] Wahl,M. C.,Will,C. L.,& Lührmann,R. The spliceosome: design principles of a dynamic RNP machine[J].Cell,2009,136(4):701-718.
[5] Grainger,R. J., J. D. Beggs. Prp8 protein:at the heart of the spliceosome[J].RNA,2008,11(5):533-557.
[6] Keightley, M.-C. et al. In vivo mutation of pre-mRNA processing factor 8 (Prpf8) affects transcript splicing,cell survival and myeloid differentiation[J].FEBS Lett,2013,(587):2150-2157.
[7] Graziotto,J. J. et al. Three gene-targeted mouse models of RNA splicing factor RP show late-onset RPE and retinal degeneration[J].Invest. Ophthalmol. Vis. Sci,2011,(52):190-198.
[8] Rämet, M.,Manfruelli, P.,Pearson, A.,Mathey-Prevot,B. &Ezekowitz,R. A. B. Functional genomic analysis of phagocytosis and identification of a Drosophila receptor for E. coli[J].Nature,2002,(416):644-648.
[9] Rines,D. R.,M. A. Gomez-Ferreria,et al. Whole genome functional analysis identifies novel components required for mitotic spindle integrity in human cells[J].Genome Biol,2008,9(2):R44.
[10] Schlabach,M. R.,J. Luo,et al. Cancer proliferation gene discovery through functional genomics[J]. Science,2008,319(5863):620-624.
[11] Kessler,J. D.,K. T. Kahle,et al. A SUMOylation-dependent transcriptional subprogram is required for Myc-driven tumorigenesis[J].Science,2012,335(6066): 348-353.
[12] Garnett,M. J.,J. Mansfeld,et al. UBE2S elongates ubiquitin chains on APC/C substrates to promote mitotic exit[J].Nat Cell Biol,2009,11(11):1363-1369.
[13] Allende-Vega,N.,S. Dayal,et al. p53 is activated in response to disruption of the pre-mRNA splicing machinery[J].Oncogene,2013,32(1):1-14.
[14] Rines,D. R.,M. A. Gomez-Ferreria,et al. Whole genome functional analysis identifies novel components required for mitotic spindle integrity in human cells[J].Genome Biol,2008,9(2):R44.
[15] Kittler,R.,L. Pelletier,et al. Genome-scale RNAi profiling of cell division in human tissue culture cells[J].Nat Cell Biol,2007,9(12):1401-1412.
Study on spliceosome of PRPF8
CAO Di-fei1, JIANG Yang1, HUANG Guo-qing1, XUE Jia-ying1, WU Qiong1, WANG Lei1,SUN Yao1, WANG Dong-kai1, LI Yao1, XING Yan1, LIU Zhao-liang2
(1. Institute of Advanced Technology, Heilongjiang Academy of Sciences, Harbin 150020, China;2. Harbin Medical University, Harbin 150020, China)
In eukaryotes, alternative splicing of mRNA precursors is an important process, which plays an important role in this process. PRPF8 is the core protein of splicing, the mutation of which can cause the death of model cell, and it has an important relationship with the occurrence of the disease.
Pre-mRNA; Splicing; PRPF8
2016-09-12
项目来源:黑龙江省科学院预研项目(CX13H08)
曹涤非(1981-),女,博士,副研究员。
刘兆良(1975-),男,博士,副研究员。
R73-3
A
1674-8646(2016)23-0014-02
