宫颈癌调强放射治疗同步化学药物治疗骨髓抑制的相关因素分析
2016-03-07唐滟袁亚维湖南省湘潭市中心医院放疗科湖南湘潭400南方医科大学南方医院放疗科广东广州5055
唐滟,袁亚维(.湖南省湘潭市中心医院放疗科,湖南湘潭400;.南方医科大学南方医院放疗科,广东广州5055)
宫颈癌调强放射治疗同步化学药物治疗骨髓抑制的相关因素分析
唐滟1,袁亚维2
(1.湖南省湘潭市中心医院放疗科,湖南湘潭411100;2.南方医科大学南方医院放疗科,广东广州510515)
摘要:目的探讨调强放射治疗(IMRT)同步化学药物治疗(以下简称化疗)宫颈癌过程中出现严重骨髓抑制的相关因素。方法回顾性分析126例IMRT同步化疗的宫颈癌患者资料。纳入分析的因素包括年龄、肿瘤临床分期、体力状况、放化疗前血细胞计数、治疗前肌酐水平、放疗前是否接受化疗、是否有骨髓抑制、盆腔外照射总量、盆腔骨髓平均剂量、骨髓剂量体积(V30,V40和V50)及同步化疗方案与化疗周期。结果单因素分析显示,3、4度骨髓抑制与放疗前是否接受化疗、是否有骨髓抑制、盆腔骨髓平均剂量、V40及V50有关(P<0.05)。多因素分析显示,盆腔骨髓平均剂量[OR^=1.004(95%CI:1.001,1.007)]、V40(<41% vs≥41%)[OR^=0.123,(95% CI:0.031,0.487)]和V50(<9% vs≥9%)[OR^=0.040,(95%CI:0.013,0.128)]与3、4度骨髓抑制相关。结论盆腔骨髓V40<41%和V50<9%是宫颈癌患者同步放化疗(CCRT)3、4度骨髓抑制发生率降低的相关因素。盆腔骨髓平均剂量是骨髓抑制发生率增高的相关因素,盆腔骨髓平均剂量越高,骨髓抑制发生率越高。严格控制盆腔骨髓放疗照射的体积及剂量,能减少宫颈癌患者骨髓抑制的发生,是顺利完成IMRT同步化疗的保障。
关键词:宫颈癌;调强放疗;同步放化疗;骨髓抑制
宫颈癌是仅次于乳腺癌的女性第二常见的恶性肿瘤。1999年由美国放射肿瘤协作组(Radiation Therapy Oncology Group,RTOG)、妇科肿瘤学组(Gynecologic Oncology Group,GOG)、西南肿瘤协作组(South West Oncology Group,SWOG)发表的5个随机临床研究结果证实,同步放化疗(concurrent chemoradiotherapy,CCRT)可以明显降低宫颈癌局部复发及远处转移率,提高生存率,使患者死亡危险下降30%~50%,因此奠定同步放化疗在宫颈癌综合治疗中的地位。2008年Vale等[1]行Meta分析显示,同步放化疗的应用使宫颈癌患者5年生存率提高6%。2010年美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)推荐治疗宫颈癌采用顺铂单药、顺铂联合氟尿嘧啶或以铂类为基础的同步放化疗。同年,欧洲肿瘤内科协会(European Society for Medical Oncology,ESMO)推荐每周顺铂方案同步放射治疗(以下检测放疗),顺铂无明确推荐剂量,参考剂量40 mg/(m2·周),可在一定范围内进行调整。目前,以铂类为基础的同步放化疗已成为初次术后,有不良预后因素宫颈癌及局部晚期宫颈癌的标准治疗方案。
随着同步化学药物治疗(以下简称化疗)的广泛应用,其疗效得到肯定的同时,仍然存在许多不良反应,其中骨髓抑制最为明显。3、4度骨髓抑制可导致放疗中断或终止,从而影响治疗效果。近10余年来,随着放射治疗设备及技术的发展,调强放疗(intensity modulated radiotherapy,IMRT)已广泛应用于宫颈癌的治疗。其不良反应相对常规放疗同步化疗减少,但仍不可忽视,其中骨髓抑制最为明显。本研究回顾性分析宫颈癌IMRT同步化疗过程中出现的骨髓抑制的发生,患者的同步放化疗前的基线特征和治疗实施,探索3、4度骨髓抑制发生的相关因素,为预防和减轻IMRT同步化疗治疗过程中出现严重骨髓抑制提供理论依据。
1 资料与方法
1.1研究对象
选取2012年1月-2015年1月南方医科大学南方医院、中南大学第六临床学院(湘潭市中心医院)收治的126例接受IMRT同步化疗宫颈癌患者的病例资料。所有患者资料完整,病例经病理学证实为鳞癌,由2位有经验的主治医师以上妇科肿瘤医师进行妇科检查,按照国际妇产科联盟(International Federation of Gynecology and Obstetrics,FIGO)分期标准进行分期。126例患者中12例因大出血或病灶大,在IMRT同步化疗前行双侧子宫动脉灌注化疗,或者因考虑可能手术行新辅助化疗但最终未手术;12例患者中6例出现≥3度骨髓抑制;其余114例为初治患者。所有患者在接受IMRT同步化疗前满足以下条件:①体力状况(performance status,PS)评分≤2;②白细胞计数(white blood cell,WBC)≥3.5×109/L,中性粒细胞计数≥1.5×109/L,血小板≥80×109/L;③肝、肾功能正常。
1.2治疗方法
1.2.1放射治疗①调强放疗实施:患者定位前1 h排空膀胱后饮水800~1000ml(含有泛影葡胺20ml),憋尿扫描,热塑网膜固定,5 mm层厚增强CT扫描,扫描范围为T10下缘至股骨上端,扫描图像传至计划系统。放射肿瘤医生勾画靶区及危及器官(organat rist,OAR),宫颈肿瘤为大体肿瘤体积(gross tumor volume,GTV),盆腔转移淋巴结为GTVnd。根据肿瘤浸润范围及淋巴结的转移勾画临床靶区(clinical target volume,CTV),包括:子宫、宫颈、宫旁组织、部分阴道(视阴道侵及范围而定)、盆腔±腹主动脉旁淋巴结引流区。CTV在宫颈处外放15 mm,在子宫体处外放15 mm,其余CTV外放7 mm为计划肿瘤体积(planning tumor volume,PTV)。GTV外放10 mm为肿瘤计划靶区(planning gross tumor volume,PGTV);GTVnd外放5 mm PGTVnd;处方剂量:PTV 45 Gy,PGTV 50 Gy,PGTVnd 50~55 Gy,宫旁侵犯时补量10 Gy。危及器官勾画包括:小肠、结肠、直肠、膀胱、股骨头及盆腔骨髓。调强放疗计划一般设5~7个共面照射野,要求≥95%处方剂量线包绕计划靶区,常规剂量分割1.8~2.0 Gy/次,1次/d,5次/周。②腔内照射实施:采用192 Ir高剂量率腔内后装治疗,外照射结束后开始,每次A点剂量为500 cGy,5 Gy/次,每周2~3次,共5~6次,A点总剂量>80 Gy。放疗期间,每日行阴道冲洗。
1.2.2同步化疗外照射期间同步化疗采用顺铂(Dichlorodiamineplatinum,DDP)方案或顺铂/氟尿嘧啶(dichlorodiamineplatinum and fluorouracil,PF)方案。DDP方案:顺铂40 mg/m2静脉滴注,1次/周,化疗当天充分水化处理。PF方案:顺铂50~70 mg/m2,静脉滴注,第1天;氟尿嘧啶1 000 mg/m2,持续静脉泵入,第1~4天。PF方案每4周为1周期,疗程共2个周期。
1.2.3同步放化疗治疗终止标准同步放化疗期间每周查血常规,出现白细胞计数<2.0×109/L、中性粒细胞计数<1.0×109/L及血小板计数<50×109/L,则停止下次化疗,立即予集落刺激因子升白细胞、升血小板的对症处理。当白细胞>2.0×109/L、中性粒胞>1.5×109/L及血小板>80×109/L时继续放疗,并继续使用集落刺激因子;或因患者PS评分明显下降、自觉难以耐受同步化疗时,终止下周期同步化疗。
1.3不良反应标准
骨髓抑制评价标准主要采用的是常见不良反应事件(Common Terminology Criteria for Adverse Events,CTCAE)3.0版本评价标准。
1.4统计学方法
采用SPSS 13.0统计软件进行数据分析,计量资料以均数±标准差(±s)表示,用t检验,计数资料以率表示,用χ2检验,多因素分析用Logistics回归分析,P<0.05为差异有统计学意义。
2 结果
2.1临床特征
患者年龄(52.14±11.24)岁。PS评分:1分118例(93.65%),2分8例(6.35%);临床分期:ⅡA6例(4.76%),ⅡB84例(66.67%),ⅢA6例(4.76%),ⅢB30例(23.81%)。
2.2治疗完成
仅1例患者未完成放疗,该患者同步顺铂方案化疗,发生4度骨髓抑制,2个月后仍未恢复,终止放化疗。其余所有患者完成放疗。
2.3骨髓抑制发生
本研究中,宫颈癌同步放化疗患者的骨髓抑制发生率为89.7%(113/126),其中3、4度骨髓抑制的发生率高达47.6%(60/126),排除治疗前未接受介入栓塞动脉灌注化疗及新辅助化疗患者,首次接受IMRT同步化疗的宫颈癌患者3、4度骨髓抑制率为42.1%(48/114)。初治患者中,采用每周顺铂方案同步化疗的患者3、4度骨髓抑制率为43.8%(42/96),采用PF方案同步化疗的患者3、4度骨髓抑制率为33.3%(6/18)。6例治疗前化疗并出现骨髓抑制的患者,同步放化疗期间出现3、4度骨髓抑制。
2.4宫颈癌IMRT同步化疗骨髓抑制单因素分析
计量资料单因素分析,骨髓抑制的发生与盆腔骨髓平均剂量有关(P<0.05),与年龄、同步放化疗前WBC、血红蛋白(haemoglobin,HB)、血小板(Platelet,PT)、中性粒细胞水平(absolute neutrophil count,ANC)、治疗前肌酐水平、调强放疗盆腔外照射总量无关(P>0.05)(见表1)。计数资料单因素分析,骨髓抑制的发生与治疗前是否接受化疗及是否发生骨髓抑制、V40及V50相关(P<0.05);与肿瘤临床分期、PS评分、化疗方案及化疗周期及V30无关(P>0.05)(见表2)。
2.5宫颈癌IMRT同步化疗骨髓抑制多因素分析
表1 宫颈癌IMRT同步化疗骨髓抑制的单因素分析(±s)
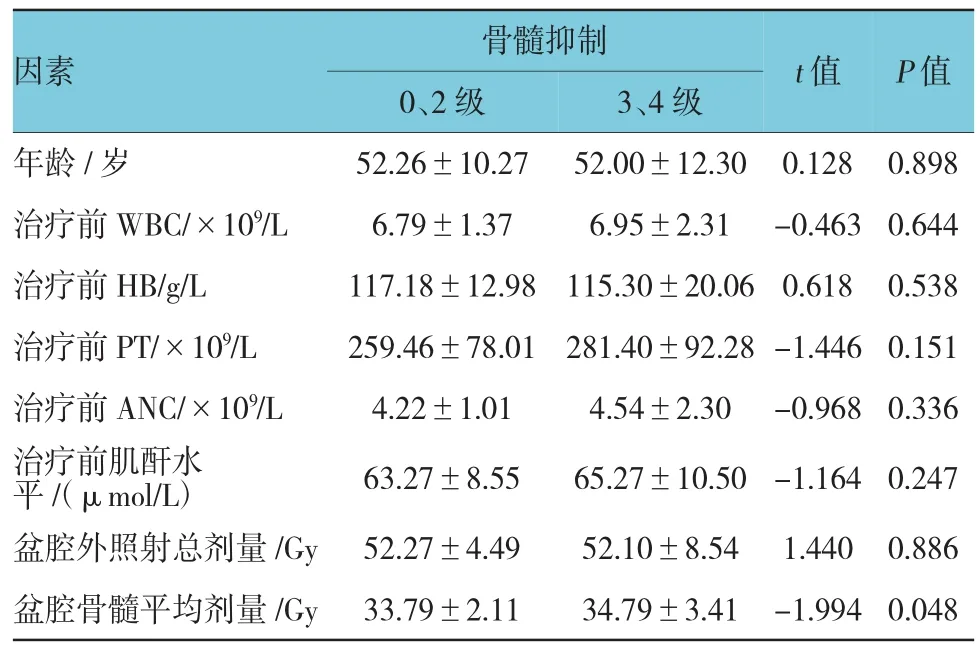
表1 宫颈癌IMRT同步化疗骨髓抑制的单因素分析(±s)
因素 骨髓抑制 t值P值0、2级 3、4级年龄/岁 52.26±10.27 52.00±12.30 0.128 0.898治疗前WBC/×109/L 6.79±1.37 6.95±2.31 -0.463 0.644治疗前HB/g/L 117.18±12.98 115.30±20.06 0.618 0.538治疗前PT/×109/L 259.46±78.01 281.40±92.28 -1.446 0.151治疗前ANC/×109/L 4.22±1.01 4.54±2.30 -0.968 0.336治疗前肌酐水平/(μmol/L) 63.27±8.55 65.27±10.50 -1.164 0.247盆腔外照射总剂量/Gy 52.27±4.49 52.10±8.54 1.440 0.886盆腔骨髓平均剂量/Gy 33.79±2.11 34.79±3.41 -1.994 0.048
选择单因素分析中的相关因素进行Logistics逐步回归多因素分析,结果显示,盆腔骨髓平均剂量、V40、V50与3、4度骨髓抑制相关(P<0.05)。随着盆腔骨髓放疗平均剂量增加,3、4度骨髓抑制发生率增加。盆腔骨髓V40<41%及V50<9%能降低宫颈癌IMRT同步化疗3、4度骨髓抑制的发生率。见表3。
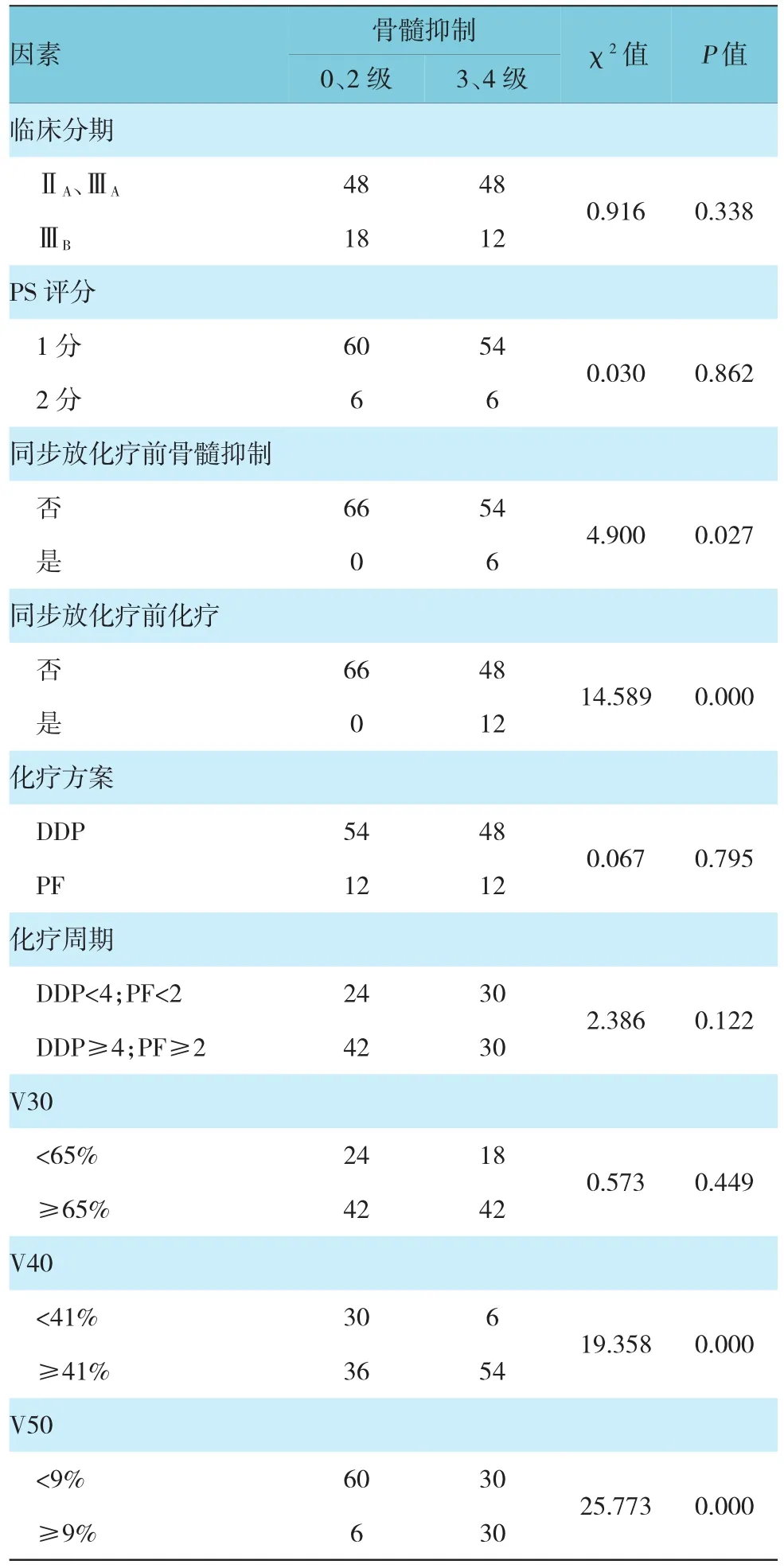
表2 宫颈癌IMRT同步化疗骨髓抑制的单因素分析 例
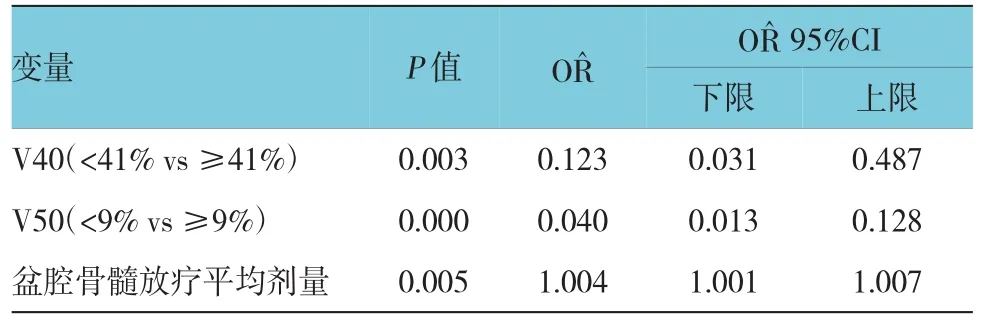
表3 宫颈癌IMRT同步化疗骨髓抑制的多因素分析
3 讨论
宫颈癌放疗的毒副反应主要表现为盆腔放疗对骨髓造血功能的影响,以铂类为基础的同步放化疗由于同步化疗而加重对骨髓造血功能的影响[2]。本研究发现,宫颈癌IMRT同步放化疗患者的骨髓抑制发生率为89.7%,其中3、4度骨髓抑制的发生率高达47.6%(60/126),远高于国内外其他文献报道[3-6]。本研究重度骨髓抑制发生率高的原因可能与纳入IMRT同步放化疗前接受子宫动脉灌注化疗及新辅助化疗的患者有关,6例治疗前化疗并出现骨髓抑制的患者,同步放化疗期间出现3、4度骨髓抑制。
剔除该部分病例,分析显示,宫颈癌IMRT同步化疗患者3、4度骨髓抑制率为42.1%(48/114),仍明显高于国内外其他学者的研究结果[3-6]。国内学者报道,宫颈癌患者IMRT同步周顺铂方案化疗3、4度骨髓抑制发生率为25%~30%,而本研究中,3、4度骨髓抑制率为43.8%(42/96)[3-4]。该差异可能与同步化疗方案的实施不同有关,上述研究中,顺铂剂量为25~30 mg/(m2·周),而本研究中顺铂剂量为40 mg/(m2·周)。西方学者报道,宫颈癌IMRT同步化疗3、4度骨髓抑制发生率约为20%,该研究中顺铂的剂量为40 mg/(m2·周),与本研究中使用顺铂的剂量相同[5-6]。骨髓抑制发生的差异可能是由于本研究对象为黄种人,而其他西方学者的研究对象为白种人。由于种族差异对顺铂的耐受性不同,导致结果明显不同。
本研究采用两种不同方案同步化疗,排除同步放化疗前接受化疗的患者,用顺铂方案[40 mg/(m2·周)]化疗的患者3、4度骨髓抑制率为43.8%(42/96),采用PF方案化疗的患者3、4度骨髓抑制率为33.3% (6/18),两种方案3、4度骨髓抑制比较,差异无统计学意义(P>0.05)。这可能是由于采用PF方案化疗的病例数较少(24例),且在这些患者中,6例患者在同步放化疗前接受过化疗。两种方案的疗效和包括骨髓抑制在内的不良反应差异,有待进一步研究。
对成年人来说,约50%具有造血活性的骨髓位于骨盆和脊柱下段。放疗和化疗都能导致骨髓抑制。单独接受盆腔放疗的患者很少发生重度骨髓抑制,因为其他部位骨髓代偿增加造血功能。但当同步化疗时,额外的骨髓损伤导致患者出现严重骨髓抑制。有报道称,如果骨髓接收剂量为30~50 Gy,则需要较长时间恢复;有时骨髓损伤是不可逆的[7]。高剂量放疗及铂类化疗,可在短时间内产生急性骨髓抑制,少数患者骨髓造血功能需几个月才能恢复,甚至难以恢复,造成骨髓损伤,导致放疗中断,影响疗效。Parker等[8]报道,宫颈癌同步放化疗后,远处转移更常见于因为急性血液学毒性延迟或中断化疗而使化疗周期减少的患者。Mell等[9]报道,IMRT相对常规放疗治疗宫颈癌可以减少骨髓接受高剂量的辐射量。通过IMRT技术减少骨髓损伤,可以提高患者同步化疗的耐受性,减少远处转移率。因此,减少骨髓照射量在宫颈癌治疗中具有重要地位。
IMRT属于精确放射治疗,可在不增加甚至减少周围正常组织受照剂量前提下,达到增加靶区剂量,提高治疗增益比的作用。以往研究表明,减少骨髓照射的放疗技术,如调强放射治疗,可以减少血液学毒性的发生率[1-2,10]。在接受IMRT同步化疗患者中,血液学毒性与盆腔骨髓接受10和20 Gy体积(V10,V20)相关。RTOG 0418的Ⅱ期临床试验显示,宫颈癌IMRT同步放化疗的血液学毒性与骨髓平均剂量及接受剂量>40 Gy的骨髓体积相关[5]。本研究分析盆腔骨髓的剂量学参数发现,随着盆腔骨髓放疗平均剂量的增加,3、4度骨髓抑制的发生率增加。V40<41%和V50<9%是宫颈癌同步放化疗3、4度骨髓抑制的保护性界限,能减少3、4度骨髓抑制的发生率。
如何预防及治疗宫颈癌同步放化疗相关的骨髓抑制成为大家共同关心的问题。笔者认为应当注意以下几点:①严格挑选适合同步放化疗的患者,避免过度治疗;②完善治疗前骨髓功能评估,尤其既往接受化疗并出现骨髓抑制的患者;③选择合适的化疗方案及剂量;④严密监测患者肾功能水平,警惕化疗药物的肾毒性;⑤优化放疗计划,严格限制骨髓剂量;⑥同步放化疗过程中密切监测血象变化,及时停止化疗。
本实验仅对资料回顾性分析宫颈癌IMRT同步化疗期间骨髓抑制的相关因素,尚需进一步提高临床研究等级以证明其可靠性,需通过长期、大样本及前瞻性多中心随机研究进一步证实。
参考文献:
[1] Vale C, Tierney Jf, Stewart LA, et al. Reducing uncertainties about the effects of chemoradiotherapy for cervical cancer: a systematic review and meta-analysis of individual patient data from 18 randomized trials[J]. Clin Oncol, 2008, 26(35): 5802-5812.
[2]胡群超.宫颈癌同步放化疗研究现状[J].肿瘤基础与临床, 2011, 24(5): 453-455.
[3] Hui B, Zhang Y, Shi F, et al. Association between bone marrow dosimetric parameters and acute hematologic toxicity in cervical cancer patients undergoing concurrent chemoradiotherapy[J]. Int J Gynecol Cancer, 2014, 24(9): 1648-1652.
[4] Chen CC, Wang L, Lin JC, et al. The prognostic factors for locally advanced cervical cancer patients treated by intensity-modulated radiation therapy with concurrent chemotherapy[J]. J Formos Med Assoc, 2015, 114(3): 231-237.
[5] Klopp AH, Moughan J, Portelance L, et al. Hematologic toxicity in RTOG 0418: a phase 2 study of postoperative IMRT for gynecologic cancer[J]. Int J Radiat Oncol Biol Phys, 2013, 86(1): 83-90.
[6] Albuquerque K, Giangreco D, Morrison C, et al. Radiation-related predictors of hematologic toxicity after concurrent chemoradiation for cervical cancer and implications for bone marrow-sparing pelvic IMRT[J]. Int J Radiat Oncol Biol Phys, 2011, 79(4): 1043-1047.
[7] Rose BS, Aydogan B, Liang Y, et al. Normal tissue complication probability modeling of acute hematologic toxicity in cervical cancer patients treated with chemoradiotherapy[J]. Int Radiat Oncol Biol Phys, 2011, 79(3): 800-807.
[8] Parker K, Gallop-Evans E, Hanna L, et al. Five years experience treating locally advanced cervical cancer with concurrent chemoradiotherapy and high-dose-rate brachytherapy: results from a single institution[J]. Int J Radiat Oncol Biol Phys, 2009, 74(1): 140-146.
[9] Mell LK, Schomas DA, Salama JK, et al. Association between bone marrow dosimetric parameters and acute hematologic toxicity in anal cancer patients treated with concurrent chemotherapy and intensity-modulated radiotherapy[J]. Int J Radiat Oncol Biol Phys, 2008, 70(5): 1431-1437.
[10] Mell LKK, Tiryaki H, Ahn KH, et al. Dosimetric comparison of bone marrow-sparing intensity-modulated radiotherapy versus conventional techniques for treatment of cervical cancer[J]. Int J Radiat Oncol Biol Phys, 2008, 71(5): 1504-1510.
(童颖丹编辑)
Factors associated with bone marrow suppression in concurrent chemotherapy and IMRT for cervical cancer
Yan Tang1, Ya-wei Yuan2
(1. Department of Radiotherapy, Xiangtan Central Hospital, Xiangtan, Hunan 411100, China; 2. Department of Radiation Oncology, Nanfang Hospital of Southern Medical University, Guangzhou, Guangdong 510515, China)
Abstract:Objective To study the factors associated with bone marrow(BM) suppression during concurrent chemotherapy and intensity modulated radiotherapy (IMRT) for cervical cancer. Methods A total of 126 cervical cancer patients treated with concurrent chemotherapy and pelvic IMRT were retrospectively analyzed. The variables in this study included age, Eastern Cooperative Oncology Group performance status, clinical stage, physical condition, initial white blood cell count, absolute neutrophil count, hemoglobin, platelet count, initial serum creatinine, chemotherapy before concurrent chemoradiotherapy (CCRT), BM suppression before CCRT, total dose of external beam radiotherapy, mean dose of radiation to pelvic bone marrow (PBM), dosevolume parameters of PBM, chemotherapy regimens, and cycles of chemotherapy. Univariate and multivariate analyses were performed to evaluate the known and hypothesized factors associated with bone marrow suppression. Results Univariate analysis showed that mean dose to PBM, the volume of PBM receiving 40 and 50 Gy (V40 and V50), chemotherapy before CCRT, and BM suppression before CCRT were associated with severe bone marrow suppression (P<0.05). By multivariate analysis, mean dose to PBM [OR^= 1.004, (95%CI: 1.001,book=111,ebook=1171.007)], V40 (<41% vs≥41%), [O= 0.123, (95%CI: 0.031, 0.487)] and V50 (<9% vs≥9%), [O= 0.040, (95%CI: 0.013, 0.128)] were factors significantly correlated with grades 3 and 4 bone marrow suppression. Conclusions V40<41% and V50<9% are factors associated with low incidence of grades 3 and 4 bone marrow suppression in concurrent chemotherapy and IMRT for cervical cancer. Mean dose to PBM is a factor correlated with high incidence of bone marrow suppression. As the mean dose to bone marrow increases, the incidence of grades 3 and 4 BM suppression rises. Strictly controlling the irradiated volume of PBM and the dose of IMRT to PBM can reduce the occurrence of BM suppression and ensure cervical cancer patients finishing CCRT.
Keywords:cervical cancer; intensity modulated radiotherapy; concurrent chemoradiotherapy (CCRT); bone marrow suppression
收稿日期:2015-09-08
文章编号:1005-8982(2016)03-0110-05
DOI:10.3969/j.issn.1005-8982.2016.03.023
中图分类号:R737.33
文献标识码:B
