苦参碱诱导人乳腺癌Bcap-37细胞发生自噬与自噬相关蛋白mTOR相关性研究
2016-03-07任莉莉王霖玲王晓稼
任莉莉王霖玲王晓稼
苦参碱诱导人乳腺癌Bcap-37细胞发生自噬与自噬相关蛋白mTOR相关性研究
任莉莉1王霖玲2王晓稼1
目的探讨苦参碱是否可通过抑制mTOR活性阻断PI3K/Akt信号通路,诱导人乳腺癌Bcap-37细胞自噬发生。方法苦参碱(终浓度为0、1、2mg/mL)±氯喹(chloroquine)(自噬抑制剂)处理乳腺癌Bcap-37细胞24h,运用免疫印迹(Western-blot)法检测PI3K/Akt信号通路自噬相关蛋白mTOR、p-mTOR、p70S6K、p-p70S6、eIF4E表达。苦参碱(终浓度为0、1、2mg/mL)±BafilomycinA1(自噬抑制剂)/Rapamcin(自噬诱导剂)处理乳腺癌Bcap-37细胞24h,Western-blot法检测eIF4E蛋白的表达。结果苦参碱剂量依赖性抑制mTOR、p70S6k磷酸化,同时降低eIF4E蛋白表达;当苦参碱联合氯喹(CQ)作用于乳腺癌Bcap-37细胞时,则对上述蛋白表达均无明显抑制作用。苦参碱联合BafilomycinA1作用于Bcap-37细胞时,eIF4E蛋白表达同样无明显改变;苦参碱联合Rapamcin时,eIF4E蛋白表达则呈剂量依赖性降低。结论苦参碱可通过抑制mTOR活性阻断PI3K/Akt信号通路,从而诱导人乳腺癌Bcap-37细胞自噬发生。
苦参碱;Bcap-37细胞;自噬;mTOR;p70S6K;eIF4E
苦参碱(matrine,MAT)是从豆科植物苦参(sophora flavescens ait)的干燥根中提取的一种生物碱,属于四环的喹嗪啶类。近年来有关其抗肿瘤机制的研究正逐渐成为抗癌中药研究的一个热点。我们课题组在前期研究中已证实苦参碱可诱导人乳腺癌Bcap-37细胞发生自噬[1]。本实验进一步采用免疫印迹(Western-blot)法检测PI3K/Akt信号通路上的自噬相关蛋白mTOR、p-mTOR、p70S6K、p-p70S6、eIF4E的表达,明确苦参碱诱导Bcap-37细胞自噬发生是否与通过抑制mTOR活性阻断PI3K/Akt信号通路相关。
1 材料与方法
1.1 材 料 人乳腺癌Bcap-37细胞株(中国科学院上海细胞库);DMEM培养基(杭州宏博生物);苦参碱(悦康药业集团悦康甘乐);氯喹(浙江大学附属邵逸夫医院韩卫东博士馈赠);BafilomycinA1(美国INDOFINE-SB);Rapamcin(美国MCE);DMSO(美国Sigma);PBS缓冲液(PH7.2~7.4);兔抗人单克隆抗体mTOR(华安生物);兔抗人单克隆抗体p70s6k(上海安研商贸有限公司);兔抗人单克隆抗体eIF4E(华安生物);凝胶成像系统;电泳仪;电泳转印槽。
1.2 细胞培养 用含10%胎牛血清的DMEM高糖培养液,于37℃、5%CO2的孵箱中培养人乳腺癌Bcap-37细胞,至细胞铺满瓶底约80%~90%,用0.25%胰蛋白酶-EDTA消化液消化,加入DMEM培养液吹打制成细胞悬液,以1:2~1:3传代,取对数生长期的细胞进行实验。
1.3 Western-blot法检测mTOR/p-mTOR/p7Os6k/pp7Os6k蛋白表达 将Bcap-37细胞接种于6孔板中,待细胞贴壁后加入浓度为0、1、2mg/mL苦参碱,作用24h后收集细胞,PBS洗涤3次。按照蛋白提取试剂盒说明进行操作,得到蛋白提取物,用BCA法测定蛋白浓度。选择15%的SDS-PAGE分离胶、4%的浓缩胶,恒压80V/120V,待溴酚蓝至分离胶底部时,停止电泳。将活化的PVDF膜和胶置入转膜装置,恒流250mA转膜1.5~2h。用5%脱脂牛奶室温封闭PVDF膜1h。一抗4℃度过夜,TBST室温下脱色摇床上洗3次,再用TBS洗1次。二抗室温孵育1h,再用TBST洗脱。加ECL避光,化学发光荧光影像分析仪显影,保存图像进行分析。
1.4 Western-blot法检测mTOR/p7Os6k/p-p7Os6k蛋白表达 将Bcap-37细胞接种于6孔板中,待细胞贴壁后加入浓度为0、1、2mg/mL苦参碱,同时加入自噬抑制剂CQ(10μmol),作用24h后收集细胞,PBS洗涤3次。按上述方法提取蛋白并检测。保存图像进行分析。
1.5 Western-blot法检测 eIF4E蛋白表达 将Bcap-37细胞接种于6孔板中,待细胞贴壁后加入浓度为0、1、2mg/mL苦参碱,分别加入自噬抑制剂CQ、BafilomycinA1及自噬诱导剂Rapamcin,作用24h后收集细胞,PBS洗涤3次。余实验方法同上。
1.6 统计学方法 实验数据应用SPSS17.0软件进行统计分析,对结果进行Spearman相关分析,检验水准a=0.05。
2 结果
2.1 MAT剂量依赖性抑制mTOR磷酸化 Western-blot结果显示,苦参碱作用于人乳腺癌Bcap-37细胞24h后,mTOR蛋白印迹条带灰度未出现明显改变,提示该蛋白表达并未随着苦参碱浓度的增加而变化。当苦参碱联合自噬抑制剂CQ同时作用于Bcap-37细胞24h后,mTOR的蛋白表达同样未出现明显变化,见图1。

图1 苦参碱±CQ作用于人乳腺癌Bcap-37细胞24h后mTOR蛋白表达
2.2 Western-blot结果 在浓度为0、1、2mg/mL的苦参碱作用24h后,p-mTOR蛋白印迹条带灰度逐渐下调,提示该蛋白表达随着苦参碱浓度的增加而降低,呈剂量依赖性。但是当苦参碱联合自噬抑制剂CQ同时作用于该细胞24h后,其蛋白表达变化却并不明显(见图2)。
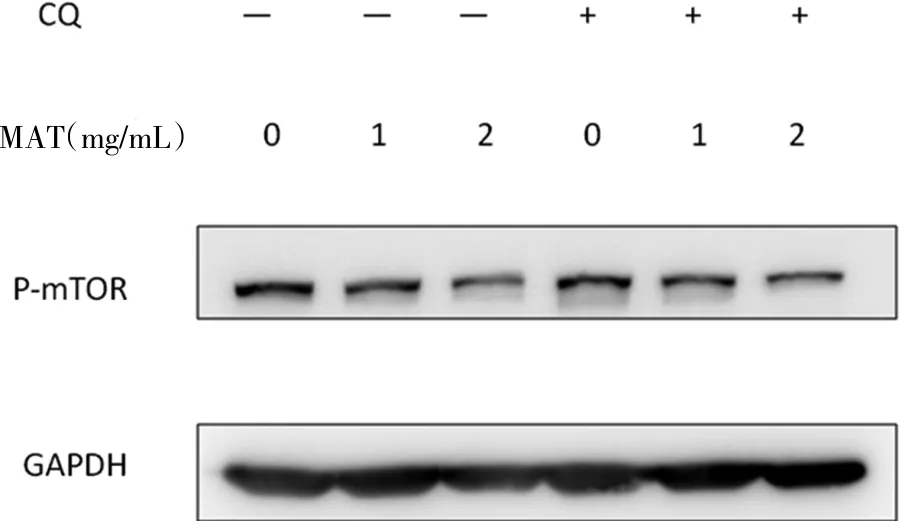
图2 苦参碱±CQ作用于人乳腺癌Bcap-37细胞24h后pmTOR蛋白表达
2.3 MAT剂量依赖性抑制p-70s6k磷酸化 苦参碱(0、1、2mg/mL)作用人乳腺癌Bcap-37细胞24h后,Western-blot法检测p70S6k蛋白印迹条带灰度略有下调,提示该蛋白表达降低但不明显。而pp70S6k蛋白印迹条带灰度明显下调,提示该蛋白表达则随着苦参碱浓度的增高而显著下降,呈剂量依赖性(见图3)。当苦参碱联合自噬抑制剂CQ后,p70S6k/p-p7S6k蛋白表达均未出现明显变化,见图4。

图3 苦参碱作用人乳腺癌Bcap-37细胞24h后下调pp70S6K蛋白表达

图4 苦参碱联合CQ作用于人乳腺癌Bcap-37细胞24h后下调p-p70S6K蛋白表达
2.4 MAT作用人乳腺癌Bcap-37细胞24h后eIF4E蛋白表达的变化 苦参碱(0、1、2mg/mL)作用人乳腺癌Bcap-37细胞24h后,Western-blot法检测eIF4E蛋白印迹条带灰度逐渐下调,提示该蛋白表达随着苦参碱浓度的增高而下降,呈剂量依赖性。当在此基础上联合自噬抑制剂氯喹(chloroquine,CQ)或巴弗洛霉素A1(bafilomycinA1,bafA1)后,EIF4E的蛋白表达未出现明显变化。当苦参碱联合自噬诱导剂雷帕霉素(Rapamcin,RAPA)作用于Bcap-37细胞24h后,Western-blot法检测eIF4E蛋白印迹条带灰度明显下调,提示该蛋白表达随着苦参碱浓度的增高而逐渐下降,呈剂量依赖性(见图5)。

图5 苦参碱联合CQ/bafA1/RAPA作用于人乳腺癌Bcap-37细胞24h后eIF4E蛋白表达改变
3 讨论
据文献[2]报道,哺乳动物细胞在应激情况下的自噬调节有很多不同的信号通路参与。其中,PI3K/ Akt/mTOR/p70S6K信号通路被认为是负性调控自噬启动的经典通路[3]。mTOR(丝氨酸/苏氨酸蛋白激酶)是哺乳动物PI3k/Akt信号传导通路的下游效应物,其分子量为289kDa,是磷脂酰肌醇激酶相关激酶(phosphatidylinositol kinase-related kinase,PIKK)蛋白质家族的成员。其下游的核糖体蛋白激酶S6K活性受mTOR的调节,被mTOR磷酸化激活后抑制自噬现象的发生[4]。eIF4E也是mTOR的下游信号,是蛋白质生物合成、翻译起始的重要调控点。刺激因素使mTOR磷酸化激活,并通过激活eIF4E而促进mRNA翻译和蛋白质合成。mTOR和eIF4E是组成此信号传导途径的关键控制点和限速点[5]。mTOR主要通过磷酸化40S核糖体S6蛋白激酶(p70 ribosomal protein S6 kinases,p70S6K)来调节下游蛋白质翻译[6]。同时,也能够通过调节Atgl/ULK等细胞自噬复合物之间的关系,发挥对细胞自噬的负性调控作用,抑制自噬活性[7-10]。mTOR存在两种不同的复合物形式,即mTORC1(mTOR complex 1)和mT0RC 2,其中mTORC1对雷帕霉素(rapamcin)敏感[11-12]。核糖体蛋白质p70S6K、eIF4E位于mTOR信号途径下游,其活性受mTOR调节[13]。因而检测p70S6K、EIF4E是否活化可以评估mTOR受抑制程度。本研究主要探讨苦参碱诱导的人乳腺癌Bcap-37细胞自噬效应的调节通路是mTOR依赖性的,抑或是mTOR非依赖性的。
本研究结果显示,苦参碱能够剂量依赖性地抑制mTOR、p70S6k磷酸化,同时抑制eIF4E蛋白的活化。p-mTOR表达降低的同时,p-p70S6k、eIF4E表达也相应降低,这正符合mTOR是p70S6k、eIF4E的上游激活信号的理论。由此我们得出结论:苦参碱通过抑制mTOR蛋白磷酸化,进而抑制其下游p70S6k蛋白的磷酸化和eIF4E蛋白活化,最终解除PI3K/Akt/ mTOR信号通路对自噬现象发生过程的负性调节作用。这与许多自噬相关文献报道结论一致[3,14-16]。
当苦参碱诱导的自噬被氯喹(CQ)抑制时,因其对mTOR磷酸化抑制作用大大减弱,故其下游的p70S6k、eIF4E蛋白表达均未受到明显抑制。BafilomycinA1是液泡性ATP酶(vacuolar-type ATPase)抑制剂,能阻止自噬体和溶酶体的融合,从而抑制自噬体的降解[17]。同理,苦参碱联合BafilomycinA1作用于Bcap-37细胞,eIF4E蛋白表达亦无明显改变。而当苦参碱联合自噬诱导剂Rapamcin时,因其对mTOR磷酸化抑制作用增强,进而其下游的eIF4E蛋白表达受到明显抑制,呈剂量依赖性降低。
综上所述,体外实验苦参碱通过抑制mTOR活性阻断PI3K/Akt信号通路,从而诱导人乳腺癌Bcap-37细胞自噬发生。
[1]任莉莉,蓝天,王晓稼.苦参碱诱导人乳腺癌Bcap-37细胞自噬及凋亡作用研究[J].中华中医药学刊,2014,32 (11):2756-2759.
[2]Kroemer G,Marino G,Levine B.Autophagy and the integrated stress response[J].Molecular Cell,2010,40(2):280-293.
[3]Wang K,Liu R,Li J,et al.Quercetin induces protective autophagy in gastric cancer cells:involvement of Akt-mTOR-and hypoxia-induced factor lalpha-mediated signaling[J]. Autophagy,2011,7(9):966-978.
[4]Klionsky DJ,Meijer AJ,Codogno P.AutoPhagy and P 70S6 kinase[J].AutoPhagy,2005,1(1):59-60.
[5]Bjormsti MA,Houghton PJ.The TOR Pathway:a target for cancer therapy[J].Nat Rev Cancer,2004,,4(5):335-348.
[6]陈洪菊,屈艺,母得志.mTOR信号通路的生物学功能[J].生命的化学,2010,30(4):555-561.
[7]Annovazzi L,Mellai M,Caldera V,et al.mTOR,S6 and AKT expression in relation to proliferation and apoptosis/autophagy in glioma[J].Anticancer Research,2009,29(8):3087-3094.
[8]Jerry J,Eric T,Luigi M,et al.The role of mTOR inhibition in augmenting radiation induced autophagy[J].Technology in Cancer Research and Treatment,2007,6(5):443-447.
[9]Liu SY,Lin MH,Hsu YR,et al.Arecoline and the 30-100 kDa fraction of areca nut extract differentially regulate mTOR and respectively induce apoptosis and autophagy:a pilot study[J].Journal of Biomedical Science,2008,15(6):823-831.
[10]Nicklin P,Bergman P,Zhang B,et al.Bidirectional transport of amino acids regulates mTOR and autophagy[J]. Cell,2009,136(3):521-534.
[11]Huang J,Manning BD.A complex interplay between Akt,TSC2 and the two mTOR complexes[J].Biochem Soc Trans,2009,37(1):217-222.
[12]Guertin DA,Sabatini DM.Defining the role of mTOR in cancer[J].Cancer Cell 2007,12(1):9-22.
[13]Funda Meric-Bernstam,Ana Maria Gonzalez-Angulo.Targeting the mTOR Signaling Network for Cancer Therapy [J].Journal of Clinical Oncology,2009,27(13):2278-2287.
[14] Wang N,Feng Y,Zhu M,et al.Berberine induces autophagic cell death and mitochondrial apoptosis in liver cancer cells:the cellular mechanism[J].Journal of Cellular Biochemistry,2010,111(6):1426-1436.
[15]Le XF,Mao W,Lu Z,et al.Dasatinib induces autophagic cell death in human ovarian cancer[J].Cancer,2010,116 (21):4980-4990.
[16]Mujumdar N,Mackenzie TN,Dudeja V,et al.Triptolide induces cell death in pancreatic cancer cells by apoptotic and autophagic pathways[J].Gastroenterology,2010,139 (2):598-608.
[17]Klionsky DJ,Baehrecke EH,Brumell JH,et al.A comprehensive glossary of autophagy-related molecules and processes(2nd edition)[J].Autophagy,2011,7(11):1273-1294.
(收稿:2016-03-13 修回:2016-05-11)
Relationship Between Matrine Induced Autophagy and mTOR in Human Breast Cancer Bcap-37 Cells
RENLili1,WANG Linling2,WANG Xiaojia1.1 Department of Integrated Chinese and Western Medicine,Zhejiang Provincial Tumor Hospital,Hangzhou(310022),China;2 Zhejiang Chinese Medical University,Hangzhou(310053),China
ObjectiveTo investigate whether the matrine induce autophagy in human breast cancer Bcap-37 cells by down-regulating PI3K/Akt signal pathway via inhibition of mTOR or not.MethodsHuman breast cancer Bcap-37 cells were cultured in vitro and treated by different final concentrations(0,1,2 mg/mL)of matrine± chloroquine(autophagy inhibitor),then cultured for 24 h.Western-blot assay was used to detect the protein expression level of mTOR,p-mTOR,p70S6K,p-p70S6,eIF4E,which were related to PI3K/Akt signaling pathway.The same cells were cultured in vitro and treated by matrine(0,1,2 mg/mL)±bafilomycinA1(autophagy inhibitor)/ rapamcin(autophagy revulsant)for 24 h.Western-blot assay was used to detect the level of eIF4E.ResultsThe expression of p-mTOR,p-p70S6k and eIF4E proteins down-regulated after Bcap-37 cells were treated with matrine at 0,1,2 mg/mL for 24 h in a does-dependent manner,but had no obvious changes after Bcap-37 cells were treated with matrine+chloroquine for the same while.The expression of eIF4E protein also had no obvious change after Bcap-37 cells were treated with matrine+bafilomycinA1 for 24 h,however the expression of eIF4E protein down-regulated after the cells were treated with matrine+rapamcin in a does dependent manner.ConclusionThe molecular mechanism of autophagy induced by the effect of matrine in human breast cancer Bcap-37 cells may be via down-regulating PI3K/Akt/mTOR signaling pathway.
matrine;Bcap-37 cells;autophagy;mTOR;p70S6K;eIF4E
浙江省医药卫生科技计划项目(No.2013KYB04)
1浙江省肿瘤医院中西医结合科(任莉莉),肿瘤内科(王晓稼)(杭州310022);2浙江中医药大学(杭州 310053)
王晓稼,Tel:13906500190;E-mail:wxj88851@yahoo.com.cn
