人参总皂苷与三七总皂苷中枢神经系统活性比较*
2016-03-06朱珂璇赵玉男
张 蔷,邵 晓,朱珂璇,赵玉男
(南京中医药大学基础医学院实验研究中心 南京 210046)
人参总皂苷与三七总皂苷中枢神经系统活性比较*
张 蔷,邵 晓,朱珂璇,赵玉男**
(南京中医药大学基础医学院实验研究中心 南京 210046)
人参总皂苷和三七总皂苷在组成成分、原人参二醇型原人参三醇型的比值(PPD/PPT)存在差别,不过两者在抗脑缺血再灌注损伤、促智、抗帕金森、抗老年性痴呆以及抗抑郁等方面均表现出相同的活性,但目前活性的强弱并不清楚,两者活性的不同之处在于三七总皂苷还有抗炎、抗凋亡活性。在作用机制方面,两者也表现出相似的作用机理。活性强弱以及作用机制的差异将可能影响两者在治疗神经系统疾病方面的精准应用范围。此外,这些差异是否与特有成分三七皂苷R1,或二者的PPD/PPT比值有关尚有待研究。本课题组将对两者的活性以及机制进行对比性研究,并采用成分敲除技术阐述两者的药效物质基础差异,将有助于两者在临床上更精准的应用以及制定更合理的质量控制标准。
人参总皂苷三七总皂苷中枢神经系统
人参为五加科植物人参Panax ginseng C. A. Mey.的干燥根和根茎,其药用历史已有4 000余年。中国历史上第一部药学典籍《神农本草经》明确记载人参“主补五脏,安精神,定魂魄,止惊悸,除邪气,明目开心益智,久服轻身延年”,是扶正固本中药。有关人参的开发研究一直以来都是热点,1854年,学者从人参根部分离出生物活性物质——皂苷组分,1963年Shibata等成功地从人参根部分离出人参皂苷并确定了化学结构[1]。
三七是五加科植物三七Parmx notoginseng(Burk.)F. H. Chen的干燥根和根茎,首载于李时珍的《本草纲目》:“南人军中用为金疮要药,云有奇功……能治一切血病”。三七与人参相似,也富含皂苷类成分,是人参属中皂苷类分子多样性最丰富、含量最高的植物药材。
清朝药学著作《本草纲目拾遗》记载:“人参补气第一,三七补血第一。”既表现出二者在中国传统医药中的地位,也说明在应用中二者有很大的区别。植物化学研究发现,人参和三七都含皂苷类成分,但在成分组成及含量上存在差别。现代药理学研究发现,人参总皂苷与三七总皂苷在中枢神经系统呈现相同或类似的药理作用。由此引起如下思考,人参与三七在治疗中枢神经系统疾病时是否可以相互替代?是否可以打破传统用药思维,使药物获得药用价值利用最大化?是否可以制定相同的质量控制标准?另外,由于人参的稀有与贵重,三七是否可以在临床替代人参的神经活性作用,也成为一个具有巨大经济价值的课题。
1 人参总皂苷与三七总皂苷化学成分的异同点
从水参或生晒参中共分离鉴定的53种人参皂苷分为3类:齐墩果酸型(Oleanane,OA)、原人参二醇型(Protopanaxadiol,PPD)、原人参三醇型(Protopanaxatriol,PPT)。其中,人参皂苷 Rb1、Rb2、Rc、Rd、Re、Rg1为主要成分,其含量占人参总皂苷的90%以上。随着分离技术和化合物结构鉴定水平的不断提高,新的人参皂苷被越来越多地分离、鉴定出来,但因其含量甚微,可能对总皂苷生物活性的发挥并不重要[2]。
三七总皂苷是一种典型的多组分中药成分,含有三七皂苷R1、人参皂苷Rg1、Rb1、Rd、Re等多种皂苷成分,其中三七皂苷R1、人参皂苷Rg1、Rb1约占三七总皂苷含量的60%,主要是以人参皂苷Rb1为代表的20(S)-PPD型和以人参皂苷Rg1为代表的20(S)-PPT型结构为主,未发现含有OA型皂苷,而三七皂苷R1是三七总皂苷区别于人参皂苷的代表性活性成分[3]。其他特有皂苷成分还包括三七皂苷R2、R4、R6、Fa、Fc、Fe等[4]。此外,鱼红闪等[5]实验测定三七及人参各部位PPD/PPT的比值,发现三七根中原人参三醇型皂苷含量较高,人参根中原人参二醇型皂苷含量较高。
2 二者对神经系统疾病作用的异同点
2.1 抗脑缺血-再灌注损伤作用
樊兴娟等[6]通过观察人参总皂苷对局灶性脑缺血再灌注大鼠的神经保护作用,发现人参总皂苷可以改善脑缺血再灌注后24 h的神经行为学评分,并增加缺血侧顶叶皮层神经细胞存活率。总体上,人参总皂苷抗脑缺血再灌注损伤的研究很少,更多的是人参皂苷单体抗大鼠脑缺血再灌注损伤的研究。比如:人参皂苷Rd可显著提高缺血再灌注损伤后大鼠的行为评分、脑梗死体积、缺血后的神经元存活率,其作用机制是通过抑制N-甲基-D-天冬氨酸受体NR2B亚基的磷酸化[7]。人参皂苷Rg1可改善神经损伤,脑梗塞体积和血脑屏障通透性,其作用机制与下调水通道蛋白4的表达,及抑制蛋白酶激活受体-1的表达有关[8,9],还可通过激活核因子E2相关因子2/血红素加氧酶1(Heme Oxyge-nase 1,HO-1)信号途径,发挥抗氧化损伤的作用[10]。另有实验表明,人参皂苷Rg1通过抑制细胞外信号调节激酶(Extracellular Signal Regulated Protein Kinases,ERK)信号通路参与脑缺血耐受的神经保护作用[11]。人参皂苷Rg3可抑制神经元凋亡,其作用与降低钙蛋白酶和半胱天冬酶-3的表达有关[12]。
三七总皂苷抗脑缺血再灌注损伤的研究较为丰富[13-16],抗损伤的作用机制表现在多个方面,比如促进神经干细胞的增殖和分化、抗凋亡、抑制氧化应激以及抗炎等。首先,三七总皂苷可以促进全脑缺血后大鼠侧脑室室管膜(Subventricular Zone,SVZ)区神经再生,加速SVZ区神经祖细胞和星形胶质细胞增殖和分化,减少脑梗死体积[17-19]。三七总皂苷可通过促进干细胞因子的表达,将骨髓间充质干细胞从骨髓动员到外周血中,帮助神经细胞修复[20]。其次,三七总皂苷可抑制Caspase-1和Caspase-3的表达[21];上调Bcl-2/Bax的比值[15];促进凋亡抑制蛋白XIAP的表达和抑制促凋亡蛋白Smac的表达[22];从而抑制细胞凋亡,改善梗死周围区神经元的恢复,保护脑组织。第三,三七总皂苷可抑制脑缺血再灌注后谷胱甘肽过氧化物酶(Glutathione Peroxidase,GSH-Px)的失活,增加超氧化歧化酶活性,提高机体清除氧自由基的能力,从而保护神经元[23,24]。第四,三七总皂苷可抑制脑组织TNF-α、IL-1β和IL-1R的表达,从而减轻脑缺血导致的脑损伤,减少神经元凋亡[16]。
最后,三七总皂苷还可通过降低基质金属蛋白酶(MMP)-2、MMP-9和转录因子HIF-1α的表达,防止血脑屏障受损,从而减轻缺血后的脑水肿[25,26];通过诱导脑源性神经营养因子(Brain Derived Neurotrophic Factor,BDNF)表达升高与其特异性受体TrkB相结合,多层面抑制缺血再灌注后的各种级联反应,以保护缺血神经元[27];以及通过阻滞 L 型钙离子通道,抑制线粒体膜通透性升高和线粒体膜渗透转换孔道(MPTP)开放,从而减轻脑缺血后脑组织细胞受损[28]。
2.2 促智作用
海马结构中的突触传递长时程增强现象与多种形式的学习记忆活动密切相关。实验表明,人参总皂苷具有促智作用,其机制可能与中枢突触传递功能的增强有关[29];还可能通过调节神经生长相关因子的表达,改善神经干/祖细胞的增殖[30]。陈霁等[31]发现人参总皂苷对记忆的改善作用,与其提高血中雌激素水平和脑中神经生长因子(Nerve Growth factor,NGF)及BDNF的表达有关。用代谢组学方法评估人参总皂苷对模拟失重大鼠记忆力的影响,发现其促智的机制与调节神经递质、氨基酸、胆碱、犬尿氨酸和鞘脂的代谢有关[32]。
三七总皂苷也有促智的药效,其能通过易化和维持CA1区锥体神经元的长时程增强效应,从而改善信息的输入,促进短时记忆的形成[33]。三七总皂苷可防止糖尿病继发性脑病小鼠学习记忆功能的受损[34];改善东莨菪碱诱导的小鼠学习记忆障碍,机制与抑制小鼠脑内乙酰胆碱酯酶活性有关[35]。三七总皂苷还可改善老年大鼠的学习能力和记忆力,其能调节海马神经元内多巴胺、肾上腺素和五羟色胺的浓度,以及增加神经递质受体的浓度[36]。
2.3 抗帕金森作用
王莎莉等[37,38]将人参总皂苷体外作用于神经干细胞后,植入帕金森病(Parkinson Disease,PD)模型小鼠脑内。结果显示,各实验组PD小鼠的自发活动明显增多,记忆功能明显改善,震颤麻痹的症状明显减轻。同时观察到移植神经干细胞数量上明显增多,并有大量酪胺酸羟化酶阳性细胞广泛分布在纹状体,神经元之间建立了一定的联系,提示部分神经干细胞可能已分化为多巴胺能样神经元,并有一定的功能表达。说明人参总皂苷在神经干细胞移植治疗帕金森病中发挥促进作用,其机制可能是通过协同细胞因子和神经生长因子间接诱导神经干细胞的增殖分化;或人参总皂苷能改善脑内的微环境,激活脑组织中的修复机制,从而使多巴胺能神经元得到一定的保护,从整体上使症状得到改善。
三七总皂苷也有类似的药效,柯春龙等[39]将三七总皂苷作用于6-羟基多巴胺建立的PD大鼠模型,免疫组织化学染色显示:酪氨酸羟化酶染色阳性细胞数在三七总皂苷组大鼠的纹状体移植区明显增多。提示三七总皂苷具有提高多巴胺能神经元移植PD大鼠后移植细胞的存活率。梁建庆等用同样方法制备PD大鼠模型,发现三七总皂苷治疗PD的作用机制与海马多巴胺转运体mRNA、脑源性神经营养因子前体以及胶质细胞源性神经营养因子的表达增加有关[40]。
2.4 抗阿尔茨海默病
阿尔茨海默病(Alzheimer disease,AD)是老年人常见的中枢神经系统退行性疾病,针对β-淀粉样蛋白(Amyloid-β Protein,Aβ)的生成和沉积、胆碱能神经系统、Tau蛋白磷酸化以及对抗自由基等方面的药物研发均是研究热点。β-淀粉样肽(β-amyloid Peptide,β-AP)是老年斑的一种重要组成成分, 张丹参等[41]采用一次性侧脑室注射凝聚态的β-AP (25-35)制作早老性痴呆动物模型,并观察人参总皂苷的保护作用,发现人参总皂苷对β-AP (25-35)引起的学习记忆障碍有改善作用。总体上,人参总皂苷抗AD的研究很少,更多的是人参皂苷单体抗AD的研究。比如,人参皂苷Rg1可改善去卵巢结合D-半乳糖腹腔注射所致AD模型大鼠的学习和记忆能力,作用机制可能是抑制Tau蛋白磷酸化及促进脑内乙酰胆碱转移酶的表达[42,43]。Rg1体外具有抗Aβ 25-35致原代培养大鼠皮层神经元损伤的作用,机理可能是通过抑制线粒体凋亡通路,上调Bcl-2/Bax的比值实现的[44]。
三七总皂苷抗AD的研究相对较多,比如,黄金兰等[45-47]发现三七总皂苷可通过调节α,β,γ-secretase三种分泌酶的活性减少快速老化模型小鼠(Senescence Accelerated Mouse P8,SAMP8)脑组织内Aβ的含量,并通过上调去整合素-金属蛋白酶9mRNA的表达,促进淀粉样肽前体蛋白(Amyloid Precursor Protein,APP)以α-分泌酶方式进行剪切,抑制APP以β-分泌酶方式进行剪切[48,49],从而改善SAMP8小鼠的学习记忆能力[50]。
此外,三七总皂苷可改善鹅膏蕈氨酸(Ibotenic Acid,IBA)所致痴呆大鼠被动回避性学习能力,保护AD大鼠大脑胆碱能神经元[51-54],作用机制可能是提高AD大鼠脑皮质内能维护记忆与正常智能递质的含量,如去甲肾上腺素(Noradrenaline,NE),多巴胺(Dopamine,DA)以及5-羟色胺[55]。
2.5 抗抑郁作用
人参总皂苷在小鼠“行为绝望”模型以及慢性应激导致的抑郁模型中,均有一定的抗抑郁作用,其可缩短小鼠在强迫游泳和悬尾实验中的不动时间,阻止慢性应激诱导的大鼠糖水偏好程度的降低,作用机制可能与海马单胺类神经递质浓度和BDNF表达的增强有关[56,57]。人参总皂苷在皮质酮诱导的抑郁模型中也有抗抑郁作用,机理与对抗皮质酮诱导的海马星形胶质细胞结构可塑性损伤[58],以及促进环磷腺苷效应元件结合蛋白(Cyclophosphate Element Binding Protein,CREB)上游抑制性信号分子糖原合成酶激酶-3β的失活,从而提高BDNF的表达有关[59]。
三七总皂苷在小鼠“行为绝望”模型中也有抗抑郁的活性,能明显降低小鼠在强迫游泳和悬尾实验中的不动时间,且不影响其自发活动,机理可能是增加中枢神经系统中5-HT和NE的浓度,以及影响DA的合成或分解[60]。三七叶总皂苷可抗慢性应激导致的大鼠抑郁样行为,机制与调控cAMP、蛋白激酶A(Protein Kinase A,PKA)以及BDNF的水平有关[61]。
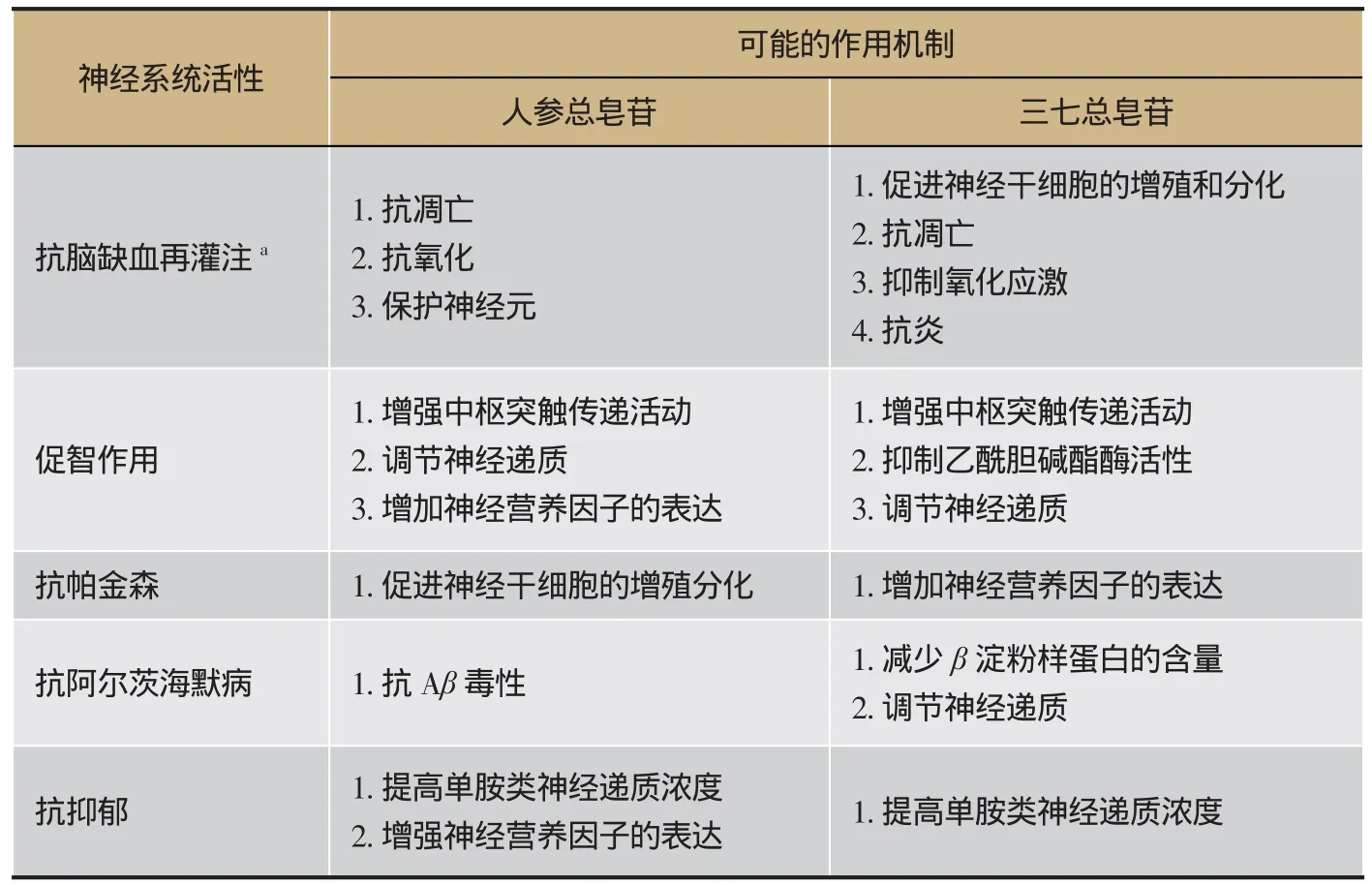
表1 人参总皂苷与三七总皂苷中枢活性作用机制的比较
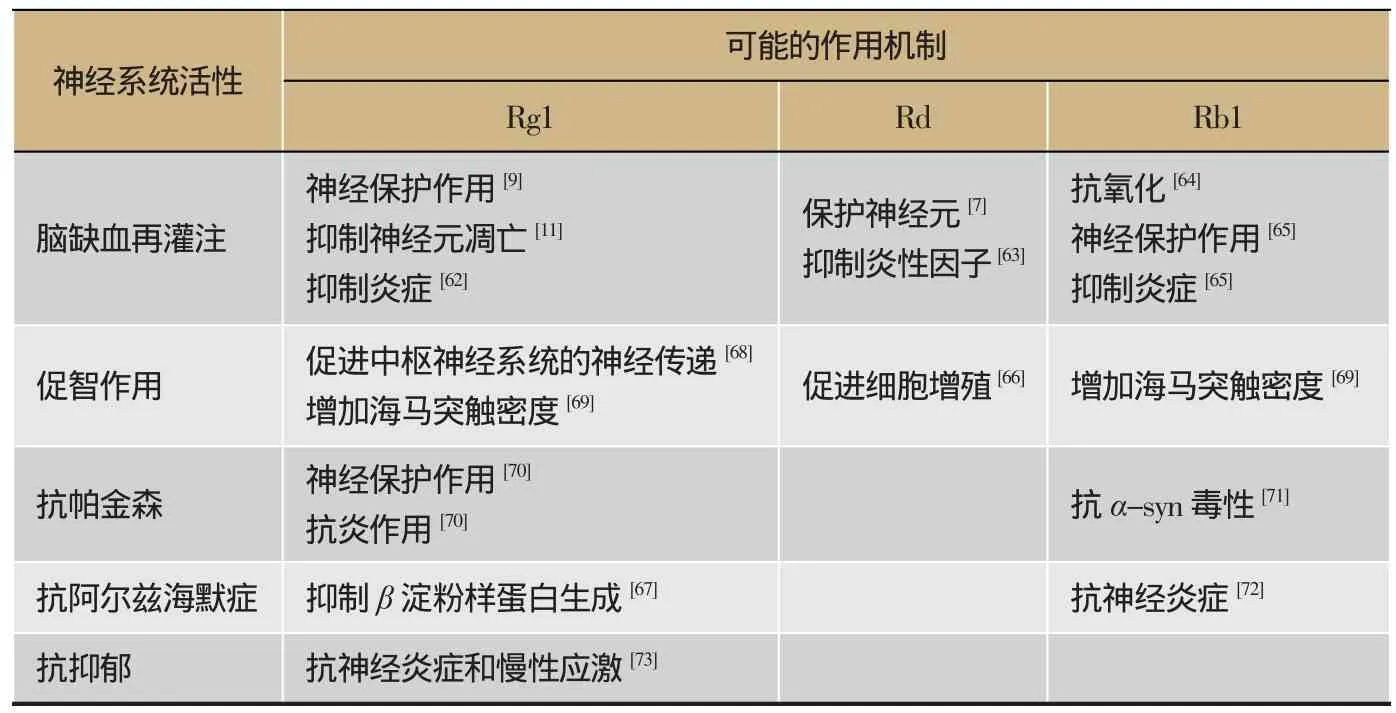
表2 人参皂苷单体对中枢活性作用机制的比较
3 小结
人参补气、三七活血,两者在传统医药运用中有较大区别。活性成分研究发现,两者都含皂苷类成分,人参总皂苷中原人参二醇型皂苷的含量较高,而三七总皂苷中原人参三醇型皂苷含量较高。尽管两者在成分组成及含量上存在差别,不过截至目前的实验研究发现,人参总皂苷与三七总皂苷在抗脑缺血再灌注损伤、促智、抗帕金森、抗老年性痴呆以及抗抑郁等方面均表现出相同的活性。对比两者神经活性可能的作用机制(表1),除了抗凋亡、抗炎外,两者也表现出大体相似的作用机理,比如增加神经营养因子的表达、促进神经干细胞的增殖和分化、增强中枢突触传递活动、调节神经递质等。
另外,对二者共存的单体皂苷简单对比中不难发现,它们共同的作用机制很有可能是通过共有的单体皂苷而发挥的(表2),但在目前为止的研究中仍然保留许多空白,特别是二者不同的作用机制如何发生还有待进一步研究。
然而,截至目前并没有在同一个实验中对两者的活性和机理有对比性的研究。因此,两者虽然有相同的神经活性,但活性的强弱差异并不清楚。如果两者在神经活性上存在强弱差异,那么这种差异是否与成分组成或PPD/PPT的比值有关均值得进一步研究。三七总皂苷抗凋亡和抗炎作用活性也存在类似的疑问。未来两者的活性对比性研究,并采用成分敲除技术阐述两者的药效物质基础差异,不仅对两者未来在临床上更科学、合理、有效的应用具有重要的指导意义,而且在两者质量标准的精确界定上将发挥重要作用。
1 Dong-Hyun Kim. Chemical Diversity of Panax ginseng, Panax quinquifolium, and Panax notoginseng. J Ginseng Res, 2012, 36(1):1– 15.
2 杨鑫宝,杨秀伟,刘建勋.人参中皂苷类化学成分的研究.中国现代中药,2013,15(5):349-358.
3 王海燕,容蓉,吕青涛,等.三七总皂苷中活性单体的检测及体内代谢研究进展.辽宁中医药大学学报,2013,15(2):93-95.
4 占颖,刘春生,刘洋洋,等.人参和三七活性成分与药理作用对比研究进展. 中国中医药科技,2014,21(6):711-712.
5 鱼红闪,陈琪,金凤燮.不同种类人参及其各部位中皂苷组成和比例的研究.食品与发酵工业,2002,28(2):24-28.
6 樊兴娟,姜正林,王国华,等.人参总皂苷对大鼠脑缺血再灌注的神经保护研究[J].交通医学,2006,20(6):662-664.
7 Xie Z, Shi M, Zhang C, et al. Ginsenoside Rd Protects Against Cerebral Ischemia-Reperfusion Injury Via Decreasing the Expression of the NMDA Receptor 2B Subunit and its Phosphorylated Product. Neurochem Res, 2016, 41(8):2149-2159.
8 Xie C L, Li J H, Wang W W, et al. Neuroprotective effect of ginsenoside-Rg1 on cerebral ischemia/reperfusion injury in rats by down regulating protease-activated receptor-1 expression. Life Sci, 2015, 121:145-151.
9 Zhou Y, Li H Q, Lu L, et al. Ginsenoside Rg1 provides neuroprotection against blood brain barrier disruption and neurological injury in a rat model of cerebral ischemia/reperfusion through downregulation of aquaporin 4 expression. Phytomedicine, 2014, 21(7):998-1003.
10 吴露,黄小平,邓常清,等. 人参皂苷Rg1对小鼠脑缺血再灌注后脑组织损伤及Nrf2/HO-1途径的影响中国病理生理杂志, 2013,29(11):2066-2071.
11 张青萍,黄德庆,刘泰. ERK信号通路在中药诱导脑缺血耐受中的研究进展[J]. 世界科学技术-中医药现代化,2015,21(2):411-415.
12 He B, Chen P, Yang J, et al. Neuroprotective effect of 20(R)-ginsenoside Rg(3) against transient focal cerebral ischemia in rats. Neurosci Lett, 2012, 526(2):106-111.
13 杨鹏飞,宋修云,陈乃宏.三七总皂苷抗脑缺血再灌注损伤的药理研究进展. 药学学报,2016,51(7):1039-1046.
14 姜丽,宁可,包怡敏.三七总皂苷抗缺血再灌注损伤机制研究进展.中华中医药学刊,2016,34(2):267-270.
15 翟晓晨,吴捷.三七总皂苷对脑缺血/再灌注损伤保护机制的研究进展. 中国药学杂志,2016,51(1):6-9.
16 王海芳.三七总皂苷保护脑缺血再灌注脑损伤机制的实验研究进展.山西中医学院学报,2014,15(2):73-75.
17 He X, Deng F J, Ge J W, et al. Effects of total saponins of Panax notoginseng on immature neuroblasts in the adult olfactory bulb following global cerebral ischemia/reperfusion. Neural Regen Res, 2015, 10(9):1450-1456.
18 贺旭,葛金文,黄俊,等.三七总皂苷对全脑缺血成年大鼠侧脑室室管膜区神经再生的影响.中草药,2016,9:1535-1540.
19 贺旭,葛金文,邓长青,等.三七总皂苷抑制大鼠全脑缺血后海马CA1区神经元凋亡及其机制研究.中草药,2016,8:1337-1344.
20 张宝霞,张金生,杜梅梅,等.三七总皂苷对脑缺血再灌注损伤模型骨髓间充质干细胞动员作用的实验研究.北京中医药大学学报,2014,37(6):387-392.
21 Li H,Deng CQ.Total saponins of Panax notoginseng modulate the expression of caspases and attenuate apoptosis in rats following focal cerebral ischemia-reperfusion. J Ethnopharmacol, 2009, 121(3): 412-420.
22 王琼,孙湛,买买提祖农·买苏尔,等. 三七总皂苷对大鼠脑缺血再灌注损伤后脑组织的凋亡抑制作用. 现代生物医学进展,2013,15(6):2804-2808.
23 龙梅,王琼,闫玉仙,等.三七总皂苷对缺血再灌注损伤后大鼠脑组织的MDA、GSH-Px表达的影响.现代生物医学进展,2013,13(12):2257-2260.
24 寇幸福,王志方.三七总皂苷对大鼠脑缺血再灌注损伤保护作用及机制的实验研究.河南中医学院学报,2008,23(6):22-23.
25 徐士欣,马惠宁,王成益,等.三七总皂苷对脑缺血再灌注损伤大鼠缺氧诱导因子1α和基质金属蛋白酶表达的影响.中华老年心脑血管病杂志,2016,18(8):859-862.
26 王一,赵彤,于蓓蓓,等.中药作用于血脑屏障的研究进展. 世界科学技术—中医药现代化,2015,32(7):1525-1529.
27 张永全,莫国焕,陈明,等.三七总皂苷对脑缺血再灌注大鼠BDNF表达的影响.中成药,2008,30(7):958-961.
28 刘旺华,李花,周小青,等.三七总皂苷对大鼠脑缺血再灌注海马细胞 Ca2+及线粒体膜电位的影响.中华中医药学刊,2009,27(1):99-101.
29 张丹参,张均田.人参总皂苷对大鼠海马齿状回突触传递活动的影响.药学学报,2000,35(3):185-188.
30 Hu B Y, Liu X J, Qiang R, et al. Treatment with ginseng total saponins improves the neurorestoration of rat after traumatic brain injury. J Ethnopharmacol, 2014, 155(2):1243-1255.
31 陈霁,贡岳松,张均. 17-B-雌二醇和人参总皂苷对去卵巢大鼠记忆障碍的改善作用.中国药学杂志,2001,36(8):522-526.
32 Feng L, Yue X F, Chen Y X. LC/MS-based metabolomics strategy to assess the amelioration effects of ginseng total saponins on memorydeficiency induced by simulated microgravity. J Pharm Biomed Anal, 2016, 125:329-338.
33 周燕,宋慧,宁宗,等.三七总皂苷对海马CA1区长时程增强效应的影响. 药学学报,2007,42(11):1137-1141.
34 廖冬燕,屈泽强,钟振国,等.三七总皂苷对糖尿病小鼠空间认知功能改善及海马神经的保护作用研究.广西中医药,2014,37(6):66-70.
35 汪忠波,郑清平.PNS对小鼠学习记忆及脑内乙酰胆碱酯酶的影响.湖北职业技术学院学报,2009,12(4):100-103.
36 徐扬,闰中瑞.三七总皂苷对老年大鼠学习能力、记忆力及海马神经元凋亡的影响研究.实用心脑肺血管病杂志,2014,22(8):30-31.
37 王莎莉,李英搏,王亚平. 人参总皂苷在神经干细胞移植治疗帕金森病模型小鼠中的作用. 中国临床康复,2006,10(41):19-21.
38 李英博,王莎莉. 人参总皂苷在神经干细胞移植治疗帕金森模型小鼠中的体内作用. 中国应用生理学杂志,2009,25(1):133-137.
39 柯春龙,陈白莉,郭少雷,等. 三七总皂甙对神经干细胞诱导分化多巴胺能神经元移植帕金森病大鼠的影响研究. 中国老年学杂志,2008,28(19):1881-1883.
40 梁建庆,何建成,王政.三七总皂苷治疗帕金森病大鼠的作用靶标研究. 中华中医药杂志, 2015, 30(5):1575-1579.
41 张丹参,张均田,等.人参总皂苷对β-淀粉样肽致小鼠记忆障碍的影响. 中国药理学通报, 2000, 16(4):422-425.
42 张潇丹.人参皂苷Rg1对阿尔兹海默病大鼠认知功能障碍的作用及机制研究.济南:山东大学博士学位论文,2013:1-17.
43 李源,刘颖,袁海峰,等. 人参皂苷Rg1对阿尔茨海默病模型大鼠脑片磷酸化Tau蛋白及胆碱乙酰基转移酶表达的影响.中国老年学杂志, 2015, 35(5):1640-1641.
44 卞俊,陈海飞,鲍蕾蕾. 人参皂苷Rg1预防阿尔茨海默病药理机制研究进展. 海军医学杂志, 2015, 36(1):91-93.
45 廖冬燕. PNS对SAMP8小鼠脑内Aβ沉淀及记忆相关信号通路的影响. 广州:广州中医药大学, 2015: 1-116.
46 Zhong Z G, Lv L, Chai L M, et al. Effect of Panax notoginseng saponins on APP gene transcription in the brain tissue of SAMP8. Zhong Yao Cai, 2011, 34(1):77-80.
47 钟振国,吴登攀,王进声,等. 三七总皂苷对老年性痴呆动物模型快速老化小鼠大脑AB1-40、AB1-42表达的影响. 中药材,2009,32(1):82-85.
48 黄金兰,李霏,吴登攀,等.三七总皂苷对快速老化SAMP8小鼠大脑α-分泌酶 mRNA表达的影响. 中国中药杂志, 2012, 37(14):2127-2129.
49 黄金兰,陆璐,黄丹,等.三七总皂苷对快速老化模型小鼠大脑β-分泌酶活性及含量的影响.中国中西医结合杂志, 2013, 33(7): 944-947.
50 黄金兰,吴登攀,景鑫,等. 三七总皂苷对快速老化痴呆模型小鼠 SAMP8脑组织中 NF-κB/p50 表达的影响. 山东医药, 2015, 55(43):29-30.
51 Zhong Z G, Wu D, Lü L, et al. Effect of Panax notoginseng saponins on the expression of beta-amyloid potein in the cortex of the parietal lobe and hippocampus,and spatial learning and memory in a mouse model of senile dementia. Neural Regen Res, 2008,3(12):1297-1303.
52 易辉. 三七提取液对阿尔茨海默病模型小鼠的保护作用研究. 中国药房, 2011,22(39):3667-3668.
53 钟振国,屈泽强,王乃平,等. 三七总皂苷对阿尔茨海默病大鼠脑胆碱能神经的保护作用. 中国临床康复, 2006, 10(19): 174-176.
54 郭长杰,伍杰雄,李若馨.三七总皂苷对痴呆大鼠模型学习记忆行为的影响及其机理探讨. 中国药房, 2014,15(10): 598-600.
55 郭长杰,伍杰雄,李若馨.三七总皂苷对痴呆模型大鼠大脑皮质内神经递质含量的影响. 中国临床药学杂志, 2004, 13(3):150-152.
56 陶震,鲁毅,司梁宏,等.人参总皂苷对小鼠的抗抑郁作用. 药学与临床研究, 2010, 18(4):360-362.
57 Dang H, Chen Y, Liu X, et al. Antidepressant effects of ginseng total saponins in the forced swimming test and chronic mild stress models of depression. Prog Neuropsychopharmacol Biol Psychiatry, 2009, 33(8):1417-1424.
58 张绘宇. 人参总皂苷抗应激小鼠海马星形胶质细胞结构可塑性损伤的机制研究.南京:南京中医药大学博士学位论文, 2014: 1-83.
59 陈琳. 基于CREB信号转导通路研究人参总皂苷抗抑郁模型小鼠海马结构可塑性损伤的机理.南京:南京中医药大学博士学位论文, 2014: 1-84.
60 付珊,杨贞. 三七皂苷对急性和慢性应激抑郁模型大鼠抗抑郁样作用的研究. 中国医药指南,2012,10(19):113.
61 张华林,周中流,杨红艳,等. 三七叶总皂苷对慢性应激抑郁大鼠行为学及海马体cAMP、PKA、BDNF的影响. 现代食品科技, 2015,31(3):1-5.
62 Yang Y, Li X, Zhang L, et al. Ginsenoside Rg1 suppressed inflammation and neuron apoptosis by activating PPARγ/HO-1 in hippocampus in rat model of cerebral ischemia-reperfusion injury. Int J Clin Exp Pathol, 2015, 8(3):2484-2494.
63 Zhang G, Xia F, Zhang Y, et al. Ginsenoside Rd Is Efficacious Against Acute Ischemic Stroke by Suppressing Microglial Proteasome-Mediated Inflammation. Mol Neurobiol, 2016, 53(4):2529-2540.
64 Dong X, Zheng L, Lu S, et al. Neuroprotective effects of pretreatment of ginsenoside Rb1 on severe cerebral ischemia-induced injuries in aged mice. Involvement of anti-oxidant signaling. Geriatr Gerontol Int, 2015,29.
65 Chen W, Guo Y, Yang W, et al. Protective effect of ginsenoside Rb1 on integrity of blood-brain barrier following cerebral ischemia. Exp Brain Res, 2015, 233(10):2823-2831.
66 Lin T, Liu Y, Shi M, et al. Promotive effect of ginsenoside Rd on proliferation of neural stem cells in vivo and in vitro. J Ethnopharmacol, 2012,142(3):754-761.
67 Chen L M, Lin Z Y, Zhu Y G, et al. Ginsenoside Rg1 attenuates β-amyloid generation via suppressing PPARγ-regulated BACE1 activity in N2a-APP695 cells. Eur J Pharmacol, 2012, 675(1-3):15-21.
68 Liu Z J, Zhao M, Zhang Y, et al. Ginsenoside Rg1 promotes glutamate release via a calcium/calmodulin-dependent protein kinase II-dependent signaling pathway. Brain Res, 2010, 1333:1-8.
69 Mook-Jung I, Hong H S, Boo J H, et al. Ginsenoside Rb1 and Rg1 improve spatial learning and increase hippocampal synaptophysin level in mice. J Neurosci Res, 2001,63(6):509-515.
70 Heng Y, Zhang Q S, Mu Z, et al. Ginsenoside Rg1 attenuates motor impairment and neuroinflammation in the MPTP-probenecid-induced parkinsonism mouse model by targeting α-synuclein abnormalities in the substantia nigra. Toxicol Lett, 2016,243:7-21.
71 Ardah M T, Paleologou K E, Lv G, et al. Ginsenoside Rb1 inhibits fibrillation and toxicity of alpha-synuclein and disaggregates preformed fibrils. Neurobiol Dis, 2015,74:89-101.
72 Wang Y, Liu J, Zhang Z, et al. Anti-neuroinflammation effect of ginsenoside Rbl in a rat model of Alzheimer disease. Neurosci Lett, 2011, 487(1):70-72.
73 Zheng X, Ma S, Kang A, et al. Chemical dampening of Ly6C(hi) monocytes in the periphery produces anti-depressant effects in mice. Sci Rep, 2016, 6:19406.
The Bioactivity Comparison of Ginseng Total Saponins and Notoginseng Total Saponins in the Central Nervous System (CNS)
Zhang Qiang, Shao Xiao, Zhu Kexuan, Zhao Yunan
(Research Center, Basic Medical College, Nanjing University of Chinese Medicine, Nanjing 210046, China)
There are overt differences between ginseng total saponins and notoginseng total saponins, including the constituents and the ratio of protopanaxdiol (PPD) / protopanaxatriol (PPT). Both of them have shown the same activity in anti-cerebral ischemia reperfusion injury, promoting intelligence, anti-Parkinson, anti-Alzheimer's disease and anti-depression. However, it hasn’t been clear for the content contrast of their bioactivities. In general, both of them have similar findings in the action mechanisms, while the notoginseng total saponins present anti-inflammatory and anti-apoptotic effects. The differences between bioactivities and mechanisms may influence the accurate clinical application of ginseng and notoginseng in treating CNS diseases. Additionally,whether these differences related to notoginsenoside R1 or the PPD/PPT ratio still needs exploring. In the future,the comparative studies of their bioactivities, mechanisms, and pharmacodynamic material base must be integral using component knockout technology, which would beneficial to more accurate clinical application and the development of more reasonable quality control.
Ginseng total saponins, notoginseng total saponins, central nervous system
10.11842/wst.2016.09.025
R966
A
(责任编辑:马雅静,责任译审:朱黎婷)
2016-09-19
修回日期:2016-09-19
* 国家自然科学基金委青年基金项目(81303246):脑局部糖原代谢在人参总皂苷抗应激致海马结构可塑性损伤中的作用研究,负责人:赵玉男;江苏高校优势学科建设工程资助项目(中西医结合),负责人:黄熙。
** 通讯作者:赵玉男,副教授,主要研究方向:中药药理学。
