人参总皂苷抗皮质酮诱导的海马星形胶质细胞可塑性损伤的作用研 究*
2016-03-06朱珂璇黄玉芳赵玉男
王 昕,朱珂璇,陈 琳,黄玉芳,赵玉男
(南京中医药大学基础医学院实验研究中心 南京 210046)
人参总皂苷抗皮质酮诱导的海马星形胶质细胞可塑性损伤的作用研 究*
王 昕,朱珂璇,陈 琳,黄玉芳,赵玉男**
(南京中医药大学基础医学院实验研究中心 南京 210046)
目的:观察人参总皂苷(GTS)对皮质酮(CORT)诱导的小鼠抑郁样行为以及海马星型胶质细胞(AS)可塑性损伤的影响,探讨GTS抗抑郁的作用机理。方法:60只C57BL/6N小鼠随机分成6组,即Control、CORT、阳性药、低剂量GTS、中剂量GTS以及高剂量GTS。CORT组连续5周皮下注射CORT制备小鼠抑郁模型,各给药组在模型复制的后3周灌胃给予低剂量GTS(GTSL,每日12.5 mg·kg-1)、中剂量GTS(GTSM, 每日25 mg·kg-1)、高剂量GTS(GTSH,每日50 mg·kg-1)和氟西汀(Flu,每日10 mg·kg-1)。在用药处理3周之后,进行行为学试验和血清CORT测定,并采用Western-blot法检测海马胶质细胞源性神经营养因子(GDNF)、胶质纤维酸性蛋白(GFAP)蛋白的表达水平,采用免疫组化染色和体视学方法定量海马(GFAP)阳性细胞的数目。结果:与对照组相比,CORT组在行为学检测中,静止不动时间明显增加,GDNF、GFAP蛋白表达水平及海马GFAP阳性细胞数目显著下调。GTS各组均能改善模型小鼠的抑郁样行为,上调GDNF 、GFAP蛋白水平,增加海马GFAP阳性细胞的数目。结论:GTS对CORT诱导的小鼠抑郁样行为及海马AS可塑性损伤均有改善作用。
星形胶质细胞 可塑性 人参总皂苷 胶质纤维酸性蛋白 胶质细胞源性神经营养因子
慢性应激可以诱导下丘脑-腺垂体-肾上腺皮质轴(Hypothalamus Pituitary Adrenalcortex Axis,HPAA)亢奋,促使糖皮质激素水平持续增高,导致中枢神经损伤从而诱发情感、行为异常,表现出抑郁样行为[1]。研究表明,星形胶质细胞(Astrocyte,AS)是应激的主要靶点,慢性应激或长期皮质酮注射可以导致大脑前额皮质、海马以及杏仁体的AS形态学及其特定的胶质纤维酸性蛋白(GFAP)表达发生改变,这些改变与应激导致的抑郁样行为密切相关[2]。此外,通过药物改善AS的可塑性可有效避免因应激引起的抑郁样行为[3,4]。
人参总皂苷(Ginseng Total Saponins,GTS)是人参的主要活性成分,有广泛的神经活性,并在抗抑郁方面具有一定疗效。Kang A等[5]采用强迫游泳、强迫悬尾以及蔗糖水偏好评估GTS干预脂多糖诱导的抑郁样行为,实验结果表明,GTS具有抗抑郁效果。在慢性应激导致的抑郁模型中,GTS也具有抗抑郁的效果[6]。本研究基于长期皮质酮注射诱导的抑郁模型,进一步评价其抗抑郁的效果,并从海马AS可塑性角度探讨其抗抑郁的可能机制。
1 材料
1.1 实验动物
健康雄性C57BL/6N小鼠60只,体重18-21 g,购于江苏大学,许可证号SCXK(苏)2013-0011,饲养于南京中医药大学动物实验中心动物房。
1.2 药物与试剂
人参Panax ginseng C. A. Meyer的生药购自南京市先声再康药店。皮质酮(Corticosterone,CORT)(美国Sigma公 司,批号:C2505)。CORT ELISA测定试剂盒(Biovalue,批号:15063001)。氟西汀(Fluoxetine,FLU)(苏州制药有限公司,批号:8146B)。胶质纤维酸性蛋白(Collagen Fibre Acidic Protein,GFAP)、胶质源性神经营养因子(Glial Derived Neurotrophic Factor,GDNF)单克隆抗体(美国Santa Cruz公司,批号分别是SC65343、SC13147)。 辣 根 过 氧 化 物 酶(Horse Radish Peroxidase,HRP)标记的山羊抗小鼠IgG及山羊抗兔IgG(北京博奥森生物技术有限公司,批号:C-0029)。二步法免疫组化检测试剂盒PV-9000(北京中杉金桥生物技术有限公司,批号:K166722D)。其他试剂均为分析纯,购自南京化学试剂公司。
1.3 仪器设备
Spectramax M5多功能酶标仪(美国Molecular Devices公司),U3000超高效液相色谱仪(美国戴安公司),Western-blot套装,包括DYY-5D电泳仪电源,DYCZ-25D垂直电泳仪,DYCZ-40G转印电泳仪(北京市六一仪器厂),Tanon 4200全自动化学发光图像分析系统(上海天能科技有限公司),Milli-Q Advantage A10超纯水仪(美国Millipore公司),CM1950冰冻切片机(德国莱卡仪器有限公司),MBF-NL/SI体视学分析系统(Stereo Investigator,4.04,澳大利亚MBF公司)。
2 方法
2.1 动物模型的制备
CORT致动物抑郁模型参考Zhao Y等的研究[7]。首先将CORT 500 mg溶解于5 mL二甲基亚枫DMSO中,配置成100 mg·mL-1的CORT母液。使用前用生理盐水稀释50倍制成2 mg·mL-1的CORT工作液。造模组随机时间点给予皮下注射CORT,注射剂量为20 mg·kg-1·d-1。
2.2 GTS的制备及给药剂量
GTS的制备方法参照Zhao Y N等的研究[8],人参水煎液经大孔吸附树脂D101,再联用阴阳离子交换树脂得到高纯度的GTS,香草醛-浓硫酸比色法测得总皂苷含量为101.8±2.5%。高效液相色谱法测定GTS中Rg1、Re、Rd的含量分别为9.20±0.69%、7.52±0.36%、2.89±0.23%。给药剂量由人临床常规用量换算成小鼠用量,设置3个剂量组:低剂量GTSL(每日12.5 mg·kg-1)、中剂量GTSM(每日25 mg·kg-1)、高剂量GTSH(每日50 mg·kg-1)。阳性药物氟西汀剂量组(每日10 mg·kg-1)。
2.3 动物分组
60只C57BL/6N小鼠随机分成6组:Control、CORT、CORT+FLU、CORT+ GTSL、CORT+GTSM以及CORT+GTSH,每组10只。除Control组给予相同剂量的生理盐水外,其他各组小鼠均连续给予5周的CORT皮下注射,后3周开始灌胃给药(FLU或GTS),Control和CORT组给予相同剂量的蒸馏水。给药第20天和21天分别进行强迫游泳实验(Forced Swimming Test,FST)和强迫悬尾实验(Tail Suspension Test,TST),第22天对每只小鼠进行眼眶取血,4℃离心(3 000 rpm,10 min),取上清液于-20℃保存,待测血清CORT水平。第23天将每组动物随机分成两小组,每组5只,一小组心脏灌注后取脑,用于GFAP免疫组化染色。另一小组处死小鼠,取海马组织装入EP管中,放入液氮缸中,用于检测GFAP和GDNF蛋白的表达水平。
2.4 行为学实验
2.4.1 小鼠强迫游泳
采用Porsolt等人报道的方法[9]进行FST实验:将小鼠分别放入加有20 cm水深的5 L烧杯中,水温为20℃。小鼠游泳6 min,记录小鼠在实验最后4 min内累计不动时间。不动的判定标准为无主动逃避行为,如跳跃、探查、游泳、躬起身体等。每只动物实验后更换器皿内的水,保持水的清洁,消除动物粪便及气味的干扰。
2.4.2 小鼠强迫悬尾
TST采用Steru L等[10]报道的方法。在结束FST后小鼠休息24 h,小鼠头部离台面 25 cm,用胶带和小钩对折小鼠尾尖部约 1 cm 处,使动物呈现悬空倒挂状,每只小鼠悬挂5 min,记录实验后4 min小鼠累计不动时间,不动的判定标准是小鼠在空中仅有细小的肢体动作或停止挣扎。
2.5 血清CORT的检测
采用CORT ELISA检测试剂盒,严格按照说明书操作检测。
2.6 Western-blot实验
取海马组织,加入预冷的l mL的RIPA 组织裂解缓冲液,用匀浆机冰浴匀浆2 min至组织完全裂解,放入4℃离心(12 000 rpm,10 min),吸取上清液,转移至新预冷的EP管中置于冰上,即为蛋白样品。样品加入4倍量的上样缓冲液,按1:3比例混匀,置100℃金属浴中变性15 min,4℃冷却样品。变性样品经10% SDS-PAGE凝胶电泳后,湿法将胶上的蛋白转移到PVDF膜上。转膜成功后切断电源,取出杂交膜。将膜用4mL TBST漂洗干净后,浸于封闭液(1% BSA TBST液)中,37 ℃轻摇1 h。封闭结束后,一抗4 ℃ 摇床过夜。次日,用TBST 漂洗3次后,加入HRP标记的TBST 稀释的二抗(1:2 000),室温孵育膜1 h。TBST 再次漂洗3次,采用化学发光法,将膜平铺放入化学发光底物孵育,进行曝光(时间约3-15 min不等)显影。最后,将膜上目的条带扫描进电脑,用Bandscan 软件进行灰度分析,以各样本灰度值与内参β-actin灰度值的比值作为所测样品中目的蛋白相对含量。
2.7 小鼠脑组织灌注固定
5%水合氯醛深度麻醉小鼠后,打开胸腔,迅速暴露心脏,由左心室心尖处进针,右心耳剪一缺口,先灌注0.1 mol·L-1PBS 20 mL做心脏灌流,随后灌注由0.01M PBS(pH=7.4)配制的4%多聚甲醛20 mL,先快后慢,至动物全身僵硬、肝脏变白,用时10-15 min。灌注结束后,迅速取脑,放入4%多聚甲醛溶液中进行外固定24 h。利用小鼠脑模具,取前囟后方1.5-5.0 mm脑组织,将其浸入30%蔗糖溶液于4℃冰箱中直至沉底。应用-20℃恒冷冰冻切片机制作连续切片,每张切片厚度为60 μm,收集小鼠完整海马连续切片约为24张,用于GFAP免疫组化染色。
2.8 GFAP免疫组化染色
取出切片用0.01M PBS(pH=7.4)清冼3次,每次2 min;用3% H2O2处理切片10 min,以阻断内源性过氧化物酶;用PBS冲洗切片3次,按照比例加入一抗GFAP(1:400)孵育液,于4℃冰箱中置摇床上孵育过夜;次日取出切片,用PBS漂洗3次后,用0.3% Triton X-100处理切片20 min,以增加细胞和组织的通透性,有利于抗原抗体结合;按比例滴加二抗过氧化物酶标记羊抗小鼠/兔Ig G(1:100)聚合物,室温置摇床上孵育20 min;DAB显色5-10 min(DAB 1:100),在显微镜下观察染色程度。用自来水终止染色后,常规脱水、透明、中性树胶封片、镜检。GFAP染色后AS呈棕黄色,清晰可见细胞体及突起的形态(图1)。
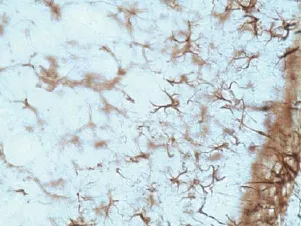
图1 星形胶质细胞GFAP免疫组化染色
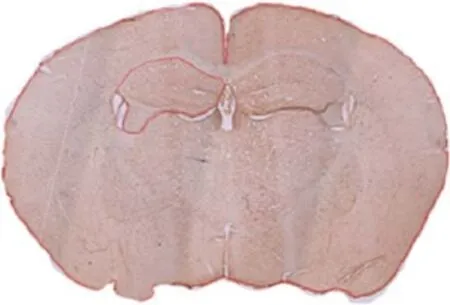
图2 星形胶质细胞计数的海马区域
2.9 海马AS数量的体视学测量
GFAP染色的24张海马连续切片,每隔4张取1张,共6张纳入AS体视学计数。采用Czéh B等[11]报道的方法,应用光学体视框(50 μm×50 μm)测定AS总数。采用半自动的系统建立设置,在4倍镜下选定海马区域(图2),在40倍的镜下获取GFAP阳性AS的图像,通过显微镜输出到电脑显示屏上,形成一个三维光学解剖计数X Y Z轴的立体图像。在40倍的镜下聚焦,从光学体视框的最顶部到最底部由Stereo Investigator 4.04软件测量6张切片的实际厚度,计算平均厚度。根据测量的平均厚度,设置保护区域为15 μm。
无偏计数框的计数原则:能观察到细胞核仁地聚焦,且完全落在计数框内或只与绿线相交而不与红线相交(图3)。海马AS总细胞数的计算公式:误差系数来表示(Error Coefficient,EC)。
2.10 数据处理
用SPSS 16.0统-计软件对实验数据进行统计学分析,计量资料用(x ±s)表示,多组比较采用单因素方差分析,组间两两比较采用LSD检验,P<0.05、P<0.01具有统计学意义。Ntotal =∑Q_×1/ssf×A(x, y step)/a(frame)×t/h
其中,∑Q_是计数AS数量;ssf是截面取样率(1/4);A(x, y step)与 每 个500 μm×500 μm区域相关联的X,Y运动(取样区);a(frame)是50 μm×50 μm的计算框架的区域;t是切片的实测厚度;而h的密度计的高度(20 μm))。数量估计的精度用
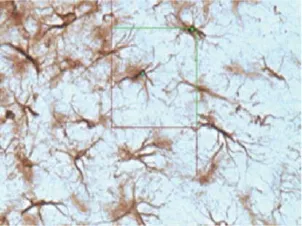
图3 星形胶质细胞体视学测量
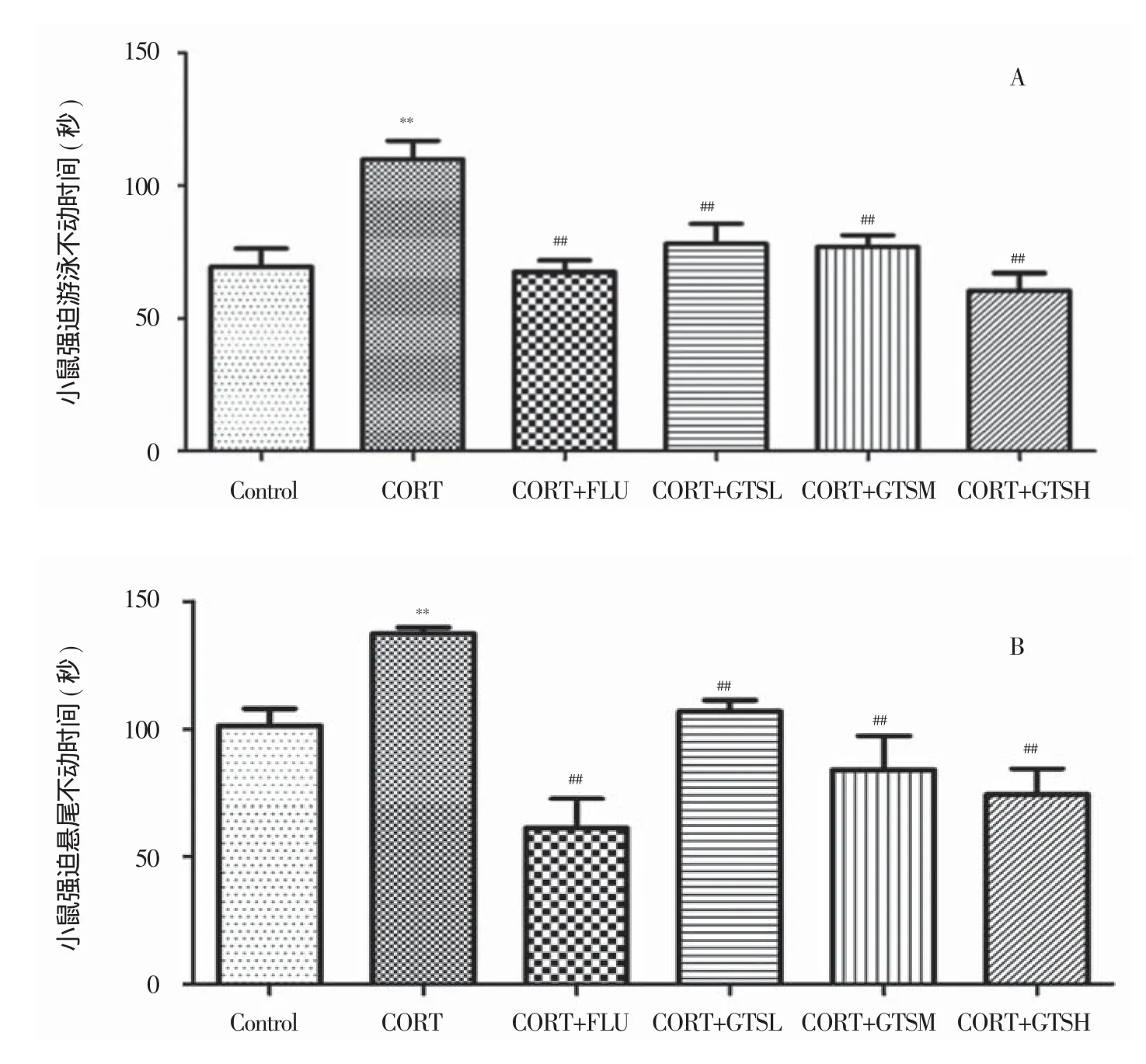
图4 GTS对抑郁模型小鼠在强迫游泳实验(A)和悬尾实验(B)中不动时间的影响(n=10)
3 结果
3.1 行为学实验
单因素方差分析表明:FST(F(5,54)=5.707,P<0.01)和TST(F(5,54)=9.059,P<0.01)组间存在显著性差异(图4a和b);进一步两两比较发现:在FST中,CORT组小鼠静止不动时间比Control组显著增加(P<0.01),FLU、GTS 3个剂量组均能明显拮抗CORT组小鼠静止不动时间的延长(P<0.01)。在TST中,统计结果与FST类似。
3.2 血清CORT水平
单因素方差分析表明,组间血清CORT的水平存在明显差异(F(5.54)=112.747,P<0.01)。进一步两两比较发现,与Control组相比,模型组小鼠血清CORT的浓度显著升高(P<0.01),给药对模型小鼠CORT的浓度无显著性影响(图5)。
3.3 海马GFAP、GDNF蛋白含量
3.3.1 GFAP蛋白
单因素方差分析表明海马GFAP蛋白的表达组间存在显著性差异(F(5,24)=10.348,P<0.01);进一步两两比较发现,与Control组相比,CORT组小鼠海马组织内的GFAP蛋白表达明显下调(P<0.01),FLU、GTS 中剂量和高剂量均能显著上调CORT组小鼠海马组织内GFAP蛋白的表达(P<0.01)(图6b)。
3.3.2 GDNF蛋白
单因素方差分析表明海马GDNF蛋白的表达组间存在显 著 性 差 异(F(5,24)=8.781,P<0.01);进一步两两比较发现,与Control组相比,CORT组小鼠海马组织内该蛋白表达明显下降(P<0.01),FLU(P<0.01)和 GTS 3个 剂 量(P<0.05)均能显著拮抗CORT组小鼠海马组织内GDNF蛋白的表达下调(图6c)。
3.4 海马GFAP阳性AS的体视学计数
每组每只小鼠海马AS数目的体视学测定结果详见表1。单因素方差分析表明:海马GFAP阳性AS的数目组间存在显著性差异(F(5,24)=9.142,P<0.01)。进一步两两比较发现:与Control组比,CORT组小鼠海马GFAP阳性细胞数明显下降(P<0.01);与CORT组比,CORT+FLU、CORT+GTSM、CORT+GTSH组的GFAP阳性细胞数目明显上调(P<0.01)。
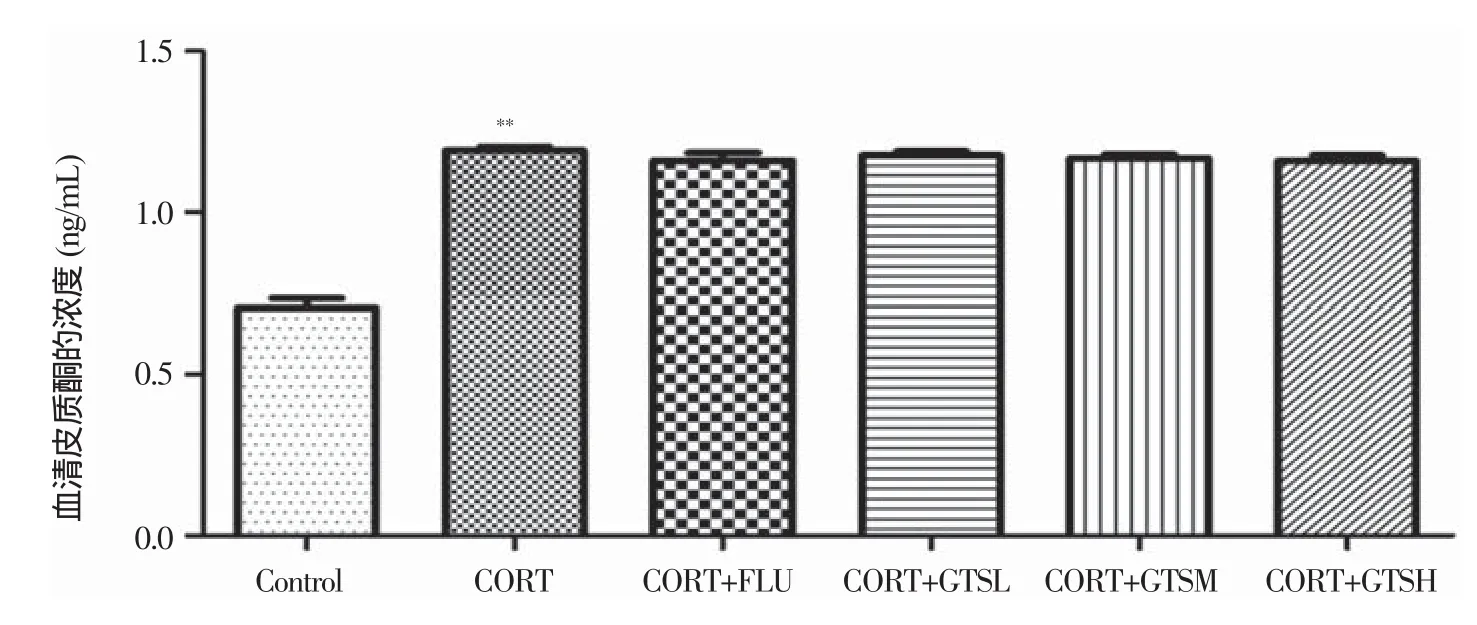
图5 GTS对抑郁模型小鼠血清CORT水平的影响(n=10)
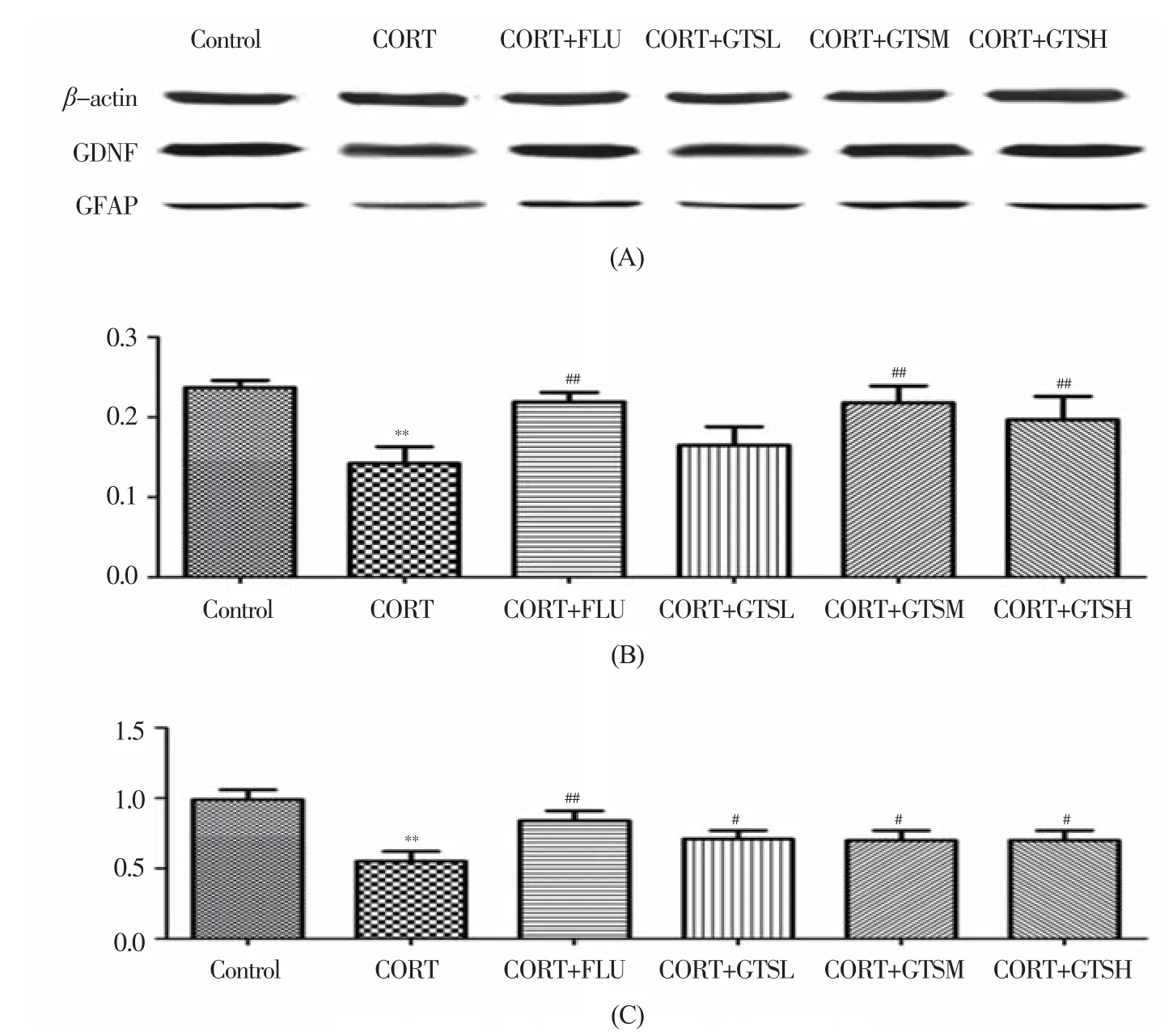
图6 GTS对抑郁模型小鼠海马GFAP(b)和GDNF(c)蛋白含量的影响(n=5)
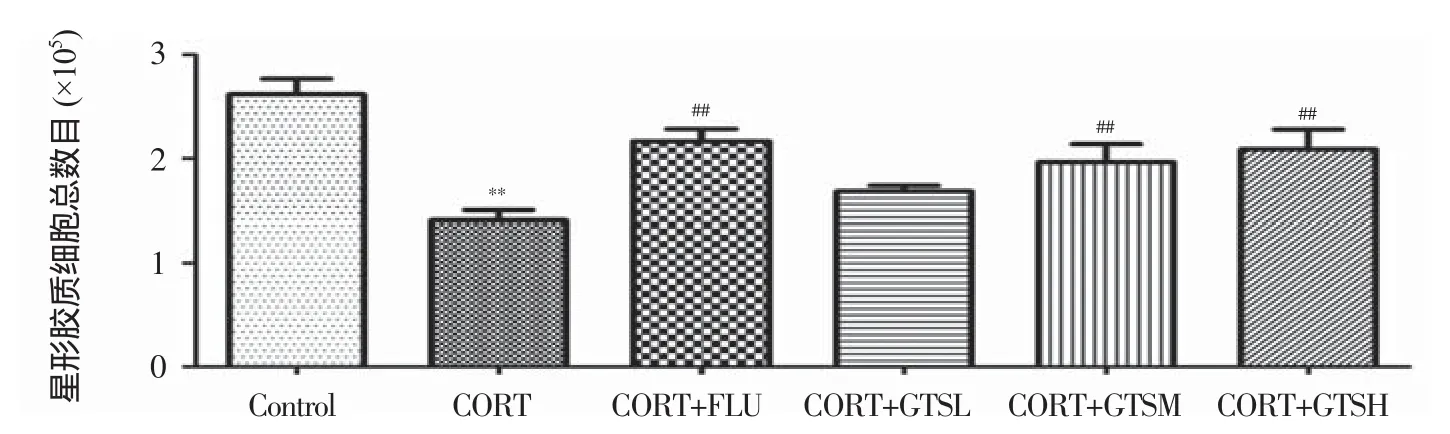
图7 GTS对抑郁模型小鼠海马AS数目的影响(n=5)
4 讨论
4.1 GTS抗抑郁的作用
本实验采用长期皮质酮注射致抑郁动物模型,观察GTS抗抑郁的作用。早前Iijima M等[12]对该模型进行了药理学特性评价,已被国内外多个研究团队用于抗抑郁药物或机理的研究。本实验的行为学检测结果显示:与Control组相比,CORT组小鼠静止不动的时间明显延长,与Zhao Y等的研究结果一致,说明CORT组小鼠出现抑郁样行为,造模成功。与CORT组相比,GTS各组长期给药均能使模型动物静止不动的时间缩短,表现出抗抑郁活性,与其它研究人员得到的结果类似。如GTS能显著改善模型小鼠抑郁行为及生化指标[13]。GTS可明显改善小鼠在“行为绝望”模型中的运动能力,具有一定抗抑郁作用[14]。血清CORT结果分析发现GTS对改善外源性CORT所致的抑郁样行为并非通过降低血清CORT水平,可能是通过中枢机制保护神经元不受损伤。为此,本文进一步从海马AS可塑性角度,探讨 GTS改善抑郁样行为的作用机制。
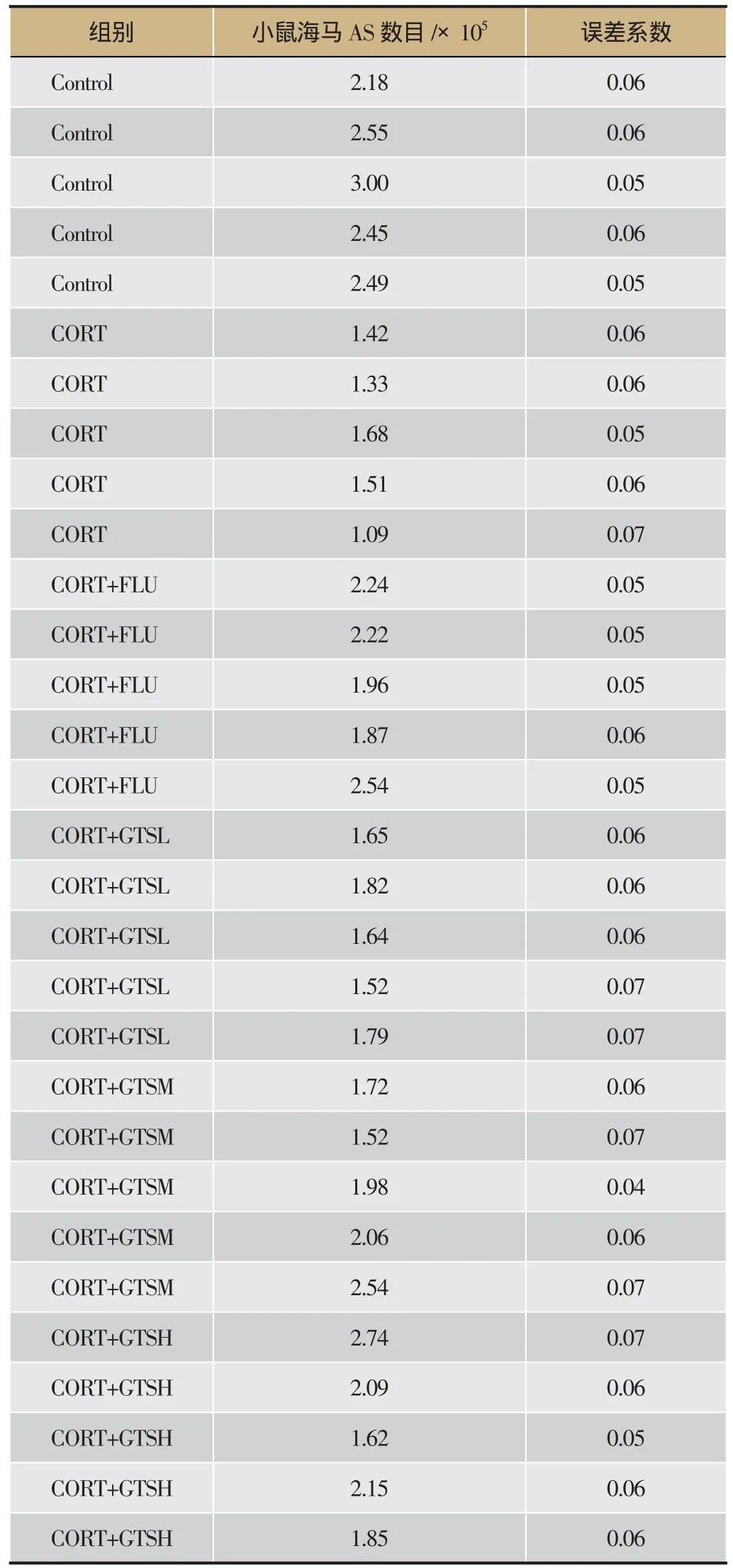
表1 GTS对抑郁模型小鼠海马AS数目的影响
4.2 GTS拮抗皮质酮诱导的海马AS可塑性损伤
海马AS可塑性是在内外环境变化的刺激下,在整个生命过程中,能改变其自身特性,其表型上呈现出很大程度的可变性或通过改变自身特性适应损伤刺激的能力,包括结构可塑性和功能可塑性。AS结构可塑性表现在As数目、As胞体体积以及突起的变化[15];AS通过其形态学上的变化,改变其与神经元之间的空间体积、排布及覆盖情况,从而不同程度地抑制或加强突触的形成。AS功能可塑性主要表现为As活性的改变,尤其是GFAP mRNA转录和相关蛋白表达量的高低改变等。GFAP蛋白表达升高,其AS活化;反之表现为AS功能下降。GFAP在维持AS的结构和运动能力、AS和神经元之间信号转导、神经元可塑性及血脑屏障等方面都发挥着重要作用。GDNF是由AS释放的一种特异性保护神经元损伤的神经营养因子,在中枢神经系统发育中存在多种相互关联的信号传导通路,能够促进发育中神经元的存活、分化及正确迁移,与应激导致的神经元损伤的关系较为密切[19]。
体视学分析结果显示:与Control组比,CORT组小鼠AS数目明显下降,表明长期注射CORT可使海马GFAP阳性的AS数目减少,该实验结果与Czéh B等[11]、Tynan R J等[16]、Liu Q等[17]以及Zhang H等[18]的发现一致。与CORT组相比,GTSM、GTSH组均能提高模型小鼠海马AS数目,提示GTS可拮抗CORT诱导的海马结构可塑性损伤。Westernblot结果显示:与Control组相比,CORT组小鼠GFAP、GDNF蛋白表达均显著下降;与CORT组相比,GTSM、GTSH组均能上调模型小鼠海马组织内GFAP、GDNF蛋白的表达,提示GTS可拮抗CORT诱导的海马功能可塑性损伤。大量研究表明:海马AS的可塑性在动物抑郁样行为中扮演重要角色[2,11,17,20-22],因此GTS抗长期皮质酮注射导致的抑郁样行为的作用机制可能是通过调节海马AS的结构和功能可塑性而实现的。
综上所述,GTS有如下特点:①具有抗抑郁样行为作用;②提高小鼠海马GFAP阳性细胞数目,改善海马AS可塑性;③上调GDNF、GFAP蛋白表达,保护海马神经元。本研究认为,GTS抗抑郁的作用可能与改善AS的可塑性有关。
参考文献
1 Zhao Y, Xie W, Dai J, et al. The varying effects of short-term and longterm corticosterone injections on depression-like behavior in mice. Brain Res, 2009, 1261:82-90.
2 Bender C L, Calfa G D, Molina V A. Astrocyte plasticity induced by emotional stress: A new partner in psychiatric physiopathology? Prog Neuropsychopharmacol Biol Psychiatry, 2016, 65:68-77.
3 王敏建, 况利, 李大奇. 抗抑郁药物对抑郁模型大鼠海马星形胶质细胞的作用. 重庆医科大学学报,2006,31(4):509-512.
4 黄倩,楚世峰,连晓媛,等. 人参皂苷Rg1的抗抑郁作用及其作用机制. 神经药理学报,2013,3(1):1-11.
5 Kang A, Hao H, Zheng X, et al. Peripheral anti-inflammatory effects explain the ginsenosides paradox between poor brain distribution and anti-depression efficacy. J Neuroinflammation, 2011, 8:100-113.
6 Dang H, Chen Y, Liu X, et al. Antidepressant effect of ginseng total saponins in the forced swimming test and chronic mild stress models of depression. Prog Neuropsychopharmacol Biol Psychiatry, 2009, 33(8):1417-1424.
7 Zhao Y, Ma R, Shen J, Su H, Xing D, et al. A mouse model of depression induced by repeated corticosterone injections. Eur J Pharmacol, 2008, 581(1-2):113-120.
8 Zhao Y N, Wang Z L, Dai J G, et al. Preparation and quality assessment of high-purity ginseng total saponins by ion exchange resin combined with macroporous adsorption resin separation. Chin J Nat Med, 2014, 12(5): 382-392.
9 Porsolt R D, Anton G, Blavet N, et al. Behavioral despair inrats: a new model sensitive to antidepressant treatments. Eur J Pharmacol, 1978, 47(4):379-391.
10 Steru L, Chermat R, Thierry B, et al. The tail suspension test: a new method for screening antidepressants in mice. Psychopharmacology (Berlin), 1985, 85(3):367-370.
11 Czéh B, Simon M, Schmelting B, et al. Astroglial plasticity in the hippocampus is affected by chronic psychosocial stress and concomitant fluoxetine treatment. Neuropsychopharmacology, 2006, 31(8):1616–1626.
12 Iijima M, Ito A, Kurosu S, et al. Pharmacological characterization of repeated corticosterone injection-induced depression model in rats. Brain Res, 2010, 1359:75-80.
13 刘丽琴,罗艳,张瑞睿,等. 人参皂苷对慢性应激抑郁模型大鼠行为学及HPA轴、BDNF的影响. 中国中药杂志,2011,36(10):1342-1347.
14 陶震,鲁毅,司梁宏,等. 人参总皂苷对小鼠的抗抑郁作用. 药学与临床研究,2010,18(4):360-362.
15 姚君茹,潘三强,吕来清. 星形胶质细胞的可塑性. 解剖学研究,2002,24(1):49-51.
16 Tynan R J, Beynon S B, Hinwood M, et al. Walker FR chronic stressinduced disruption of the astrocyte network is driven by structural atrophy and not loss of astrocytes. Acta Neuropathol, 2013, 126(1):75-91.
17 Liu Q, Li B, Zhu H Y, et al. Glia atrophy in the hippocampus of chronic unpredictable stress-induced depression model rats is reversed by electroacupuncture treatment. J Affect Disord, 2011, 128(3):309-313.
18 Zhang H, Zhao Y, Wang Z. Chronic corticosterone exposure reduces hippocampal astrocyte structural plasticity and induces hippocampal atrophy in mice. Neurosci Lett, 2015, 592:76-81.
19 陈琳,戴建国,王中立,等. 脑内胶质细胞源性神经营养因子及其受体复合物研究进展. 中国药理学通报,2013,29(3):315-318.
20 Banasr M, Duman R S. Glial loss in the prefreontal cortex is sufficient to induce depressive-like behaviors. Biol Psychiatry, 2008, 64(10):863-870.
21 Domin H, Szewczyk B, Woźniak M, et al. Antidepressant-like effect of the mGluR5 antagonist MTEP in an astroglial degeneration model of depression. Behav Brain Res, 2014, 273:22-33.
22 Sun J D, Liu Y, Yuan Y H, et al. Gap junction dysfunction in the prefrontal cortex induces depressive-like behaviors in rats. Neuropsychopharmacology, 2012, 37(5):1305-1320.
Effects of Ginseng Total Saponins on Hippocampal Astrocytes Plasticity Impairment Induced by Repeated Corticosterone Injection
Wang Xin, Zhu Kexuan, Chen Lin, Huang Yufang, Zhao Yunan
(Research Center, Basic Medical College, Nanjing University of Chinese Medicine, Nanjing 210046, China)
This study aimed to probe the effects of ginseng total saponins (GTS) on the plasticity impairment of hippocampal astrocyte (AS) stimulated by corticosterone (CORT) and to elucidate the antidepressant mechanisms of GTS. Sixty male mice were divided into six matched groups: the control group, the CORT group, the lowdose GTS (12.5 mg·kg-1) plus CORT (GTSL) group, the moderate-dose GTS (25 mg·kg-1) plus CORT (GTSM) group, the high-dose GTS (50 mg·kg-1) plus CORT (GTSH) group, and the fluoxetine plus CORT (FLU) group.CORT had been subcutaneously administered once a day for 5 weeks. 2 weeks after CORT injection, GTS and FLU had been intragastrically administered daily for 3 weeks. After the 3 weeks’ treatment, the depression-like behavior of the mice was noted and serum CORT concentration was detected. Western blot was adopted to analyze the protein expression of hippocampal glial derived neurotrophic factor (GDNF) and glial fibers acidic protein (GFAP). The stereology in combination with immunohistochemical staining was used to quantify GFAP-positive cells in the hippocampus. As a result, compared with the control group, the immobility time of the CORT group significantly increased, and the protein level of GDNF and GFAP and the GFAP-positive cell count significantly decreased. GTS reversed the changes of depression-like behavior, GDNF and GFAP protein expressions, and the number of GFAP-positive cells stimulated by CORT. In conclusion, it was demonstrated that GTS suppressed the depression-like behavior of the mice and the plasticity impairment of AS in the hippocampus induced by CORT.
Astrocyte, plasticity, ginseng total saponins, glial fibrillary acidic protein, glial cell line-derived neurotrophic factor
10.11842/wst.2016.09.023
R965
A
(责任编辑:马雅静,责任译审:朱黎婷)
2016-09-19
修回日期:2016-09-19
* 国家自然科学基金委青年基金项目(81303246):脑局部糖原代谢在人参总皂苷抗应激致海马结构可塑性损伤中的作用研究,负责人:赵玉男;江苏省高校优势学科建设工程资助项目(中西医结合),负责人:黄熙。
** 通讯作者:赵玉男,副教授,主要研究方向:中药药理学。
