补肾抗衰片对EA.hy 926细胞过氧化损伤的影响*
2016-03-06张光银马惠宁李南南王爱迪张军平
张光银,马惠宁,李南南,王爱迪,张军平
(天津中医药大学第一附属医院 天津 300193)
补肾抗衰片对EA.hy 926细胞过氧化损伤的影响*
张光银,马惠宁,李南南,王爱迪,张军平**
(天津中医药大学第一附属医院 天津 300193)
目的:观察补肾抗衰片对EA.hy 926细胞氧化应激损伤的影响。方法:采用过氧化氢(H2O2)诱导EA.hy 926细胞损伤建立EA.hy 926细胞过氧化模型,以CCK-8法评价模型。实验分为空白对照组、实验对照组、H2O2过氧化损伤模型组以及补肾抗衰片干预组,利用CCK-8法测定各组细胞活力,采用流式细胞术检测EA.hy 926细胞内的总氧化水平(ROS),采用免疫荧光法检测HO-1蛋白水平。结果:补肾抗衰片具有抗H2O2诱导的EA.hy 926细胞过氧化损伤,维持细胞氧化还原平衡状态的效应。结论:补肾抗衰片抗氧化损伤,维持细胞氧化还原平衡可能与调节HO-1蛋白水平有关。
补肾抗衰片 氧化应激 EA.hy 926细胞 动脉粥样硬化
补肾抗衰片是国医大师阮士怡先生治疗动脉粥样硬化性疾病的经典名方,以“益肾健脾涤痰散结”法立方,由党参、丹参、杜仲、桑寄生、龟板、淫羊藿、何首乌、石菖蒲、茯苓、砂仁、夏枯草、海藻等药物组成,组方严谨,配伍独特,临床应用30余载,疗效卓著。近年来,本课题组对补肾抗衰片进行了系统科学的临床及实验研究[1-3],探讨其组方原理与作用机制,从氧化应激、炎症等多个角度阐释了此方的药理机制。
血红素加氧酶-1(HO-1)是血红素降解的限速酶,能降解血红素生成Fe2+、一氧化碳(CO)和胆红素,其在多种疾病中发挥细胞保护作用。前期研究表明,补肾抗衰片介导的脑保护作用与其上调HO-1活性密切相关[4]。因此,本实验通过建立过氧化氢(H2O2)诱导的EA.hy 926细胞氧化应激损伤模型,观察补肾抗衰片对EA.hy 926细胞氧化应激损伤的影响。
1 材料与方法
1.1 主要仪器
FACS Calibur流式细胞仪(美国BD公司),Multiskan MK3酶标仪(芬兰雷勃-赛默飞世尔公司),INCO2108 型CO2培养箱(德国Memmert公司),CK-40 型倒置相差显微镜(日本Olympus公司)。
1.2 药物及试剂
补肾抗衰片(由丹参、何首乌、夏枯草、茯苓、海藻、龟版、石菖蒲、砂仁、淫羊藿、桑寄生等组成),0.5 g/片,每片含生药3 g(天津中医药大学第一附属医院提供,批号:071105);高糖DMEM培养基、FBS胎牛血清((Hyclone公司,批号分别是:AXH43870、NVJ0313),二甲基亚砜(Dimethyl Sulfoxide)、含铁血红素(美国西格玛奥德里奇有限公司,批号分别是D2650、51280);PBS、D-PBS、胰蛋白酶、青霉素及链霉素混合液等(北京索莱宝科技有限公司);分析纯过氧化氢(北京化学试剂公司);羊HO-1多克隆抗体、驴抗羊FITC-IgG(美国圣克鲁斯生物技术公司,批号分别是sc-7695、sc-2024);细胞增殖与毒性检测试剂盒(上海七海复泰生物科技有限公司,批号:CCK-8),活性氧检测试剂盒(碧云天生物技术研究所,批号:S0033)。
1.3 细胞株
人脐静脉细胞融合细胞EA.hy926(No.CRL-2922)购自ATCC细胞库。
2 方法
2.1 细胞培养
EA.hy926细胞常规培养于含10%(V/V)胎牛血清的高糖DMEM培养基中,置于37℃、5% CO2、饱和湿度的培养箱中。细胞融合80%-90%时进行传代,利用细胞计数法测定细胞生长曲线,每2-3天以1:2进行传代1次,取对数生长期细胞用于实验。
2.2 含药血清的制备
补肾抗衰片每克以蒸馏水5 mL溶解,按照体表面积法折算,给健康大耳白兔每12 h灌胃一次,连续灌服96 h;最后一次给药1 h后心脏采血,按常规方法制作药物血清,过0.22 μm微孔滤膜;同时采集家兔未服药的血液,制作对照组血清。
2.3 建立EA.hy926过氧化损伤模型
参照文献方法建立EA.hy926过氧化损伤模型[5]。以1×105个/孔将细胞接种于96孔板,以含10% FBS的DMEM培养24 h后,换做1% FBS全培培养24 h同步化后再分别以0.00、0.05、0.10、0.20、0.50、1.00、2.00、20.00 mM H2O2干预细胞2、6、12、24 h,以CCK-8法测量不同浓度H2O210% FBS全培干预下各时间点的OD值,以出现细胞LD50的10% FBS全培H2O2终浓度和干预时间作为EA.hy926细胞氧化损伤模型建立的最佳浓度和时间。
2.4 CCK-8法测定细胞增殖活力
取对数生长期的EA.hy 926细胞按1×105个/mL接种于96孔板,每孔总体积200 μL,均置于37℃,5%CO2培养箱中培养24 h。实验分组如下:①空白对照组:10% FBS正常培养细胞;②实验对照组:10%兔正常血清培养细胞;③H2O2过氧化损伤组:EA.hy926细胞以10% 兔空白血清干预24 h后再以200 μM终浓度的H2O2干预12 h。④补肾抗衰片组:EA.hy 926细胞以10%补肾抗衰片含药血清干预24 h后再以200 μM终浓度的H2O2干预12 h。干预完毕后,按照CCK-8试剂盒操作说明书要求,将10 μL/孔CCK-8(5 mg·mL-1)试剂加至相应实验孔中,根据颜色变化情况和细胞生长情况继续孵育4 h,然后每孔内加入150 μL DMSO,振荡15 min,将孔板置于酶标仪于490 nm波长处读取吸光度(A)值;实验重复3次。
2.5 荧光探针法检测氧自由基水平
收集对数生长期EA.hy926细胞,在6孔培养板内以5×108cells/L的密度种植,加入1 mL含10% FBS的DMEM培养24 h,换1 mL含1% FBS的DMEM再培养12 h。并以补肾抗衰片含药血清作用后,用PBS冲洗细胞3次,各孔分别加入浓度为10 μM的荧光探针(DCFH-DA),37℃孵育各组细胞3 h后,以Hanks液洗涤2次,每次2 min后用消化收集细胞,以Hanks液洗涤2次,加入400 μL Hanks液重悬细胞,按流式细胞仪检测要求处理细胞并检测105个细胞内DCF的荧光强度(激发波长488 nm,发射波长530 nm),反映细胞内ROS生成量。
2.6 免疫荧光法检测HO-1蛋白的表达
置有细胞爬片的24孔板吸取完上清液后,小心用镊子将爬片取出,用玻璃胶粘贴于载玻片上,细胞面向上。将玻片置于37℃ PBS中洗3次,每次3-5 s,然后在4%多聚甲醛中固定15 min;PBS漂洗;1%BSA封闭30 min;加入1% BSA稀释的羊HO-1多克隆抗体,置于保湿盒中于4℃杂交过夜;PBS漂洗;加入1% BSA稀释的驴抗羊FITC-IgG于室温杂交3 h;PBS漂洗后用30%的甘油封片,于荧光共聚焦扫描显微镜下观察荧光物质的强度,激发波长为494 nm,发射波长为518 nm,并照相。
2.7 统计学处理-
3 结果
3.1 H2O2诱导的EA.hy926细胞过氧化损伤
由图1可知,不同浓度H2O210% FBS全培干预下各时间点的OD值不同,长时间、高浓度H2O2的氧化作用会对细胞造成不可逆损伤,甚至造成细胞死亡。CCK-8法测量不同浓度H2O210% FBS全培干预下各时间点的OD值显示,0.20 mM H2O2干预12 h时的浓度为细胞半致死量(LD50);当H2O2浓度大于0.50 mM时,几乎没有贴壁细胞。故以10%补肾抗衰片含药血清孵育24 h后,再以200 μmol·L-1H2O2干预12 h可作为过氧化损伤模型,此时的细胞存活率没有显著降低,而细胞出现了显著性损伤(见图1)。
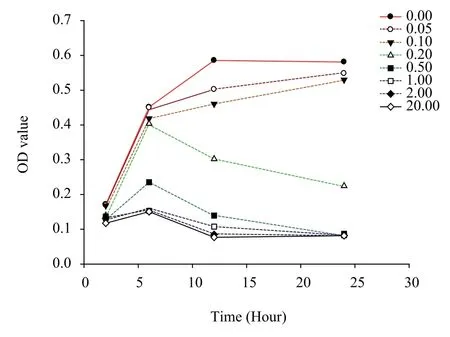
图1 不同浓度H2O2分别诱导2、6、12、24 h对EA.hy926细胞的影响
不同H2O2浓度干预12 h时相差显微镜下观察,正常EA.hy926细胞贴壁生长,呈铺路石状镶嵌排列。细胞为扁平多角形,边界清楚,胞浆丰富。H2O2损伤后,细胞形态改变成团簇状,界限不清,细胞间隙增大,某些融合部分断裂,部分区域脱落,较正常细胞有明显改变,且发现,H2O2浓度越高,脱落细胞越明显(见图2)。
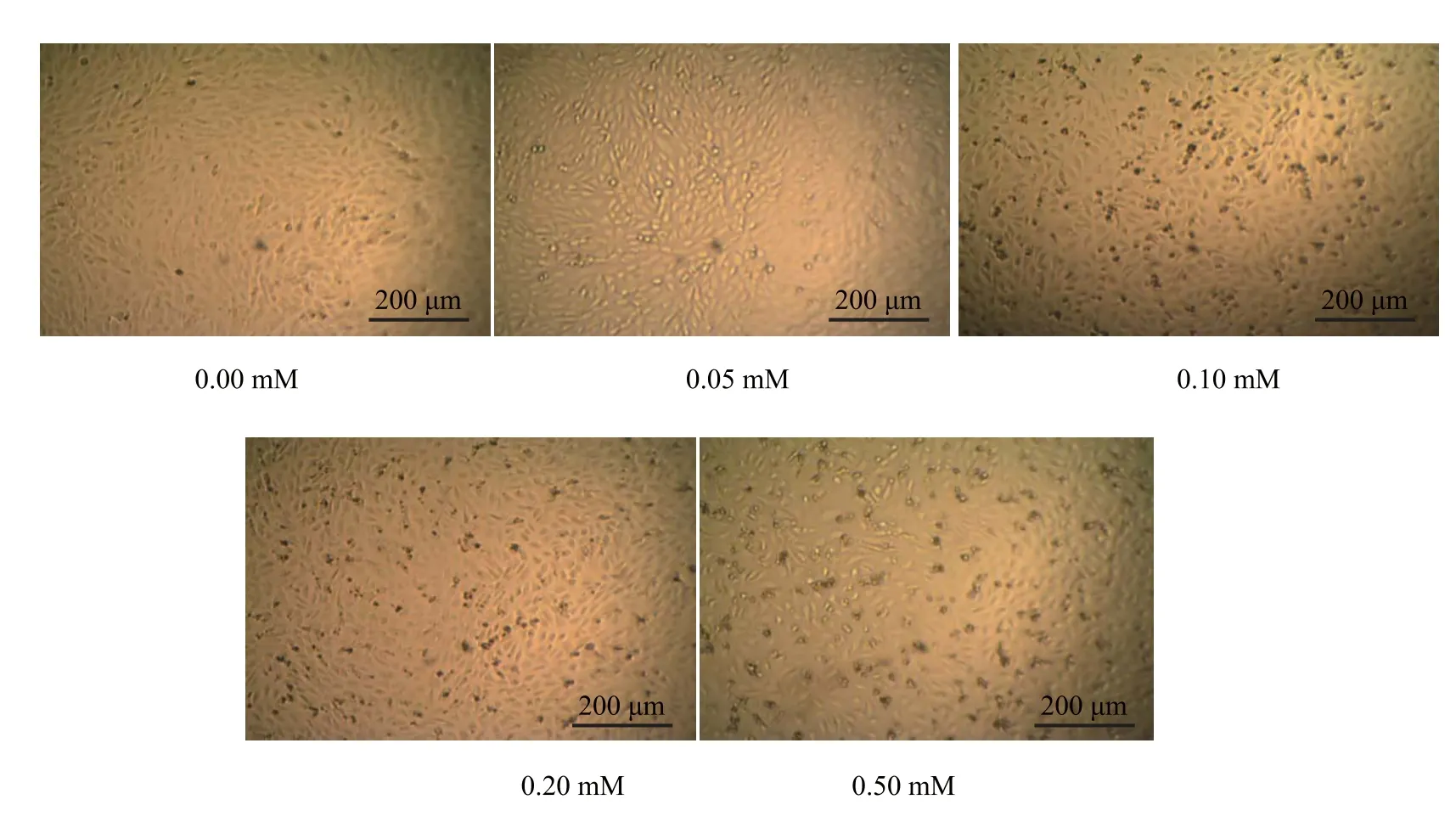
图2 不同浓度H2O2诱导12 h后的EA.hy926细胞(×100)
3.2 补肾抗衰片对EA.hy926细胞活力的影响
CCK-8检测结果(图3)显示,与实验对照组相比,200 μmol·L-1H2O2模型组吸光度(OD)值明显下降(P<0.01);与H2O2模型组相比,补肾抗衰片组吸光度(OD)值增大,但与模型组比较没有显著的统计学意义(P=0.076)。
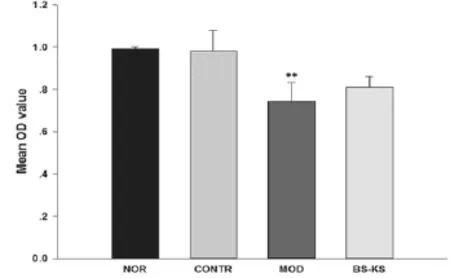
图3 补肾抗衰片对EA.hy926细胞活力的影响
3.3 补肾抗衰片对EA.hy926细胞氧化应激损伤的保护作用
以10%补肾抗衰片含药血清孵育24 h后,再以200 μmol·L-1H2O2干预12 h,以流式细胞术检测各组细胞的总抗氧能力。研究发现,与实验对照组相比,200 μmol·L-1H2O2模型组活性氧荧光强度明显升高(P<0.01);与H2O2模型组相比,补肾抗衰片组保护组荧光强度显著减小(P<0.01),见图4。
3.4 补肾抗衰片对HO-1蛋白水平的影响
由图5可知,免疫荧光法检测各组HO-1蛋白水平检测结果中,正常对照组细胞内见少量HO-1阳性表达,实验对照组与模型对照组没有明显差异,模型组以200 μmol·L-1H2O2干预12 h时后,大量细胞固缩为圆球状,补肾抗衰片含药血清孵育24 h,再以200 μmol·L-1H2O2干预12 h时,视野内大量绿色荧光区域,在胞质内也有少量荧光阳性表达。
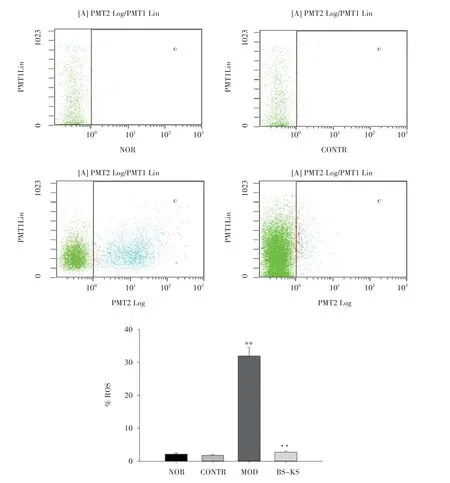
图4 补肾抗衰片对ROS水平的影响
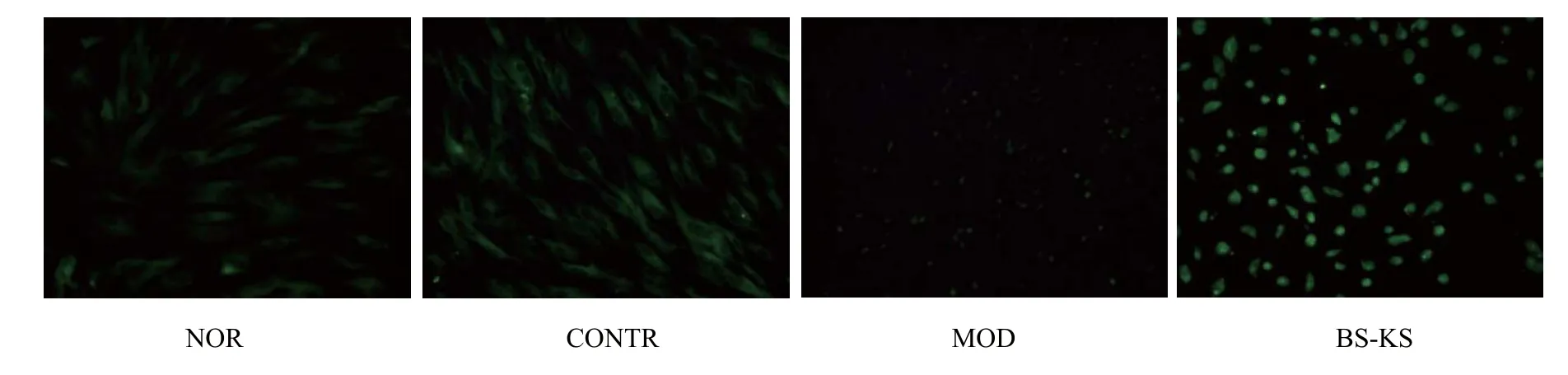
图5 补肾抗衰片对HO-1蛋白水平的影响(荧光共聚焦×200)。
4 讨论
动脉粥样硬化的形成是一个由多因素参与的漫长复杂病理过程,氧化应激在动脉粥样硬化的发生发展中具有重要作用。当体内氧化/抗氧化水平失衡时,活性氧(ROS)增加,引起内皮细胞通透功能障碍以及膜稳定性失衡,粘附分子、炎症因子等活跃表达,继而引发血管舒张功能障碍、血管重构等级联效应[6]。血红素氧合酶(Heme Oxygenase,HO)是热休克蛋白家族中的一个成员,是一种体内广泛存在的抗氧化防御酶,HO-1是HO的一种同工酶。HO-1分解产物的抗氧化和细胞保护作用以及其本身的可诱导性,使得HO-1具有独特的抗氧化生理特性,并在动脉粥样硬化的防治中起到重要作用。在多种心血管疾病如心肌梗死、心肌缺血再灌注损伤和心力衰竭的研究中,采用药理学方法或基因方法促使HO-1蛋白表达增加能抑制心肌细胞损伤[7,8]。Yu J等[9]研究表明,芍药苷可通过激活Nrf-2/ HO-1通路保护伽玛辐射诱导的EA.hy926内皮细胞氧化应激损伤。
补肾抗衰片具有益肾健脾、涤痰散结之功效。该方中以茯苓、石菖蒲祛痰开窍,丹参通络活血,配伍淫羊藿、桑寄生及何首乌等益精填髓、调补肝肾,整方令气血和畅,脾肾健旺,五脏经脉条达,以此达到抗氧化损伤保护血管,延缓动脉粥样硬化进展的作用。前期动物实验显示,中药复方制剂补肾抗衰片在动脉粥样硬化病变中具有抗氧化作用,这种作用可能是通过调控HO-1mRNA基因的表达以及影响HO-1/ CO-cGMP通路中相关酶的活性,同时通过对抗过氧化反应稳定动脉粥样硬化斑块[10]。
本研究发现,补肾抗衰片能够阻抑H2O2诱导的EA.hy926细胞活力下降,通过流式细胞术Annexin-V FITC/PI染色和ROS活性检测,发现补肾抗衰片能够显著抑制H2O2诱导的EA.hy926细胞过氧化损伤,补肾抗衰片的这种细胞保护效应可能由HO-1相关信号通路介导,并通过维持细胞抗氧化防御系统和活性氧之间的平衡状态而调控氧化应激。
1 张光银,李明,许颖智,等. 动脉粥样硬化家兔蛋白质硝基化修饰及补肾抗衰片干预研究. 中国实验方剂学杂志,2014,20(9):179-184.
2 赵志强,王强,赵忱,等. 加载补肾抗衰片治疗肾虚痰瘀型冠心病心绞痛的临床研究. 中西医结合心脑血管病杂志, 2012,10(9):1025-1027.
3 张军平,许颖智,李明,等. 补肾抗衰片对动脉粥样硬化氧化应激状态的干预. 中国中医基础医学杂志, 2009,15(4):279-281.
4 张光银,张军平,李明,等. 补肾抗衰片对实验性动脉粥样硬化家兔海马氧化应激的影响. 中华中医药杂志, 2011,26(5):1228-1231.
5 Li J, Ge R, Zhao C, Tang L, et al. Farrerol regulates occludin expression in hydrogen peroxide-induced EA.hy926 cells by modulating ERK1/2activity. Eur J Pharmacol, 2014, 734: 9-14.
6 Perrotta I, Aquila S. The role of oxidative stress and autophagy in atherosclerosis. Oxid Med Cell Longev, 2015:130315.
7 He X H, Li Q W, Wang Y L, et al. Transduced PEP-1-heme oxygenase-1 fusion protein reduces remote organ injury induced by intestinal ischemia/reperfusion. Med Sci Monit, 2015, 21:1057-1065.
8 Zhang C Y, Li X H, Zhang T, et al. Hydrogen sulfide upregulates heme oxygenase-1 expression in rats with volume overload-induced heart failure. Biomed Rep, 2013,1(3):454-458.
9 Yu J, Zhu X, Qi X, et al. Paeoniflorin protects human EA.hy926 endothelial cells against gamma-radiation induced oxidative injury by activating the NF-E2-related factor 2/heme oxygenase-1 pathway. Toxicol Lett, 2013, 218(3):224-234.
10 张光银,李明,许颖智,等. 补肾抗衰片干预动脉粥样硬化的氧化应激机制研究. 世界科学技术-中医药现代化, 2014,16(5):156-161.
Impacts of Bushen Kangshuai Tablet on its Oxidative Damage to EA.hy 926 Cells
Zhang Guangyin, Ma Huining, Li Nannan, Wang Aidi, Zhang Junping
(First Teaching Hospital of Tianjin University of Traditional Chinese Medicine, Tianjin 300193, China)
This study aimed to observe the impacts of Bushen Kangshuai tablet (BSKS) on its oxidative damage toEA.hy 926 cells. In the study, peroxidation model of EA.hy 926 cells was established by Hydrogen peroxide (H2O2) injury using CCK-8 evaluation models. The cells was divided into the blank control group, the experimental control group, the H2O2group and the oxidative injury model BSKS tablet intervention group. The determination of cell viability with CCK-8 method and flow cytometry were adopted to detect the total oxidation level (ROS) in EA.hy926 cells, while immunofluorescence method was to quantify the protein level of HO-1. It was found that BSKS tablet performed an anti-oxidative damage effect on EA.hy926 cells induced by H2O2, and maintained the cellular redox balance. It was concluded that this effect could be mediated by HO-1 signal pathway.
Bushen Kangshuai Tablets, oxidative stress, EA.hy926 cells, atherosclerosis
10.11842/wst.2016.09.016
R966
A
(责任编辑:马雅静,责任译审:朱黎婷)
2015-05-13
修回日期:2015-11-21
* 国家自然科学基金委面上项目(81173244):基于外膜损伤从Rho/ROCK通路探讨补肾抗衰片干预早期动脉粥样硬化形成的实验研究,负责人:张军平。
** 通讯作者:张军平,本刊编委,教授,主任医师,博士生导师,主要研究方向:中西医结合治疗心脑血管疾病的临床与科研工作。
