川芎赤芍对脑缺血再灌注大鼠模型GFAP、VEGF及Notch1表达的影响*
2016-03-06焦富英崔英海
马 进,甘 雨,袁 媛,黄 赫,焦富英,乔 铁,崔英海
(1. 辽宁中医药大学附属第二医院 沈阳 110034;2. 辽宁中医药大学基础医学院 沈阳 110032)
川芎赤芍对脑缺血再灌注大鼠模型GFAP、VEGF及Notch1表达的影响*
马 进1**,甘 雨1,袁 媛1,黄 赫1,焦富英1,乔 铁2,崔英海1
(1. 辽宁中医药大学附属第二医院 沈阳 110034;2. 辽宁中医药大学基础医学院 沈阳 110032)
目的:本研究主要观察川芎赤芍对大鼠脑梗死再灌注后外周血胶质纤维酸性蛋白(GFAP)、血管内皮生长因子(VEGF)和脑内Notch1表达的影响。方法:采用线栓法制备大鼠脑缺血再灌注模型,将健康SD大鼠按随机数字表法随机分为空白组、模型组、川芎赤芍低剂量组、川芎赤芍高剂量组、银杏叶片组。采用ELISA法测定大鼠外周血GFAP、VEGF含量,采用real-time PCR法检测缺血脑组织Notch1 mRNA表达。结果:与模型组相比,川芎赤芍能够提高外周血GFAP、VEGF水平,上调脑组织Notch1 mRNA的表达。结论:川芎赤芍可升高缺血再灌注大鼠外周血GFAP、VEGF的水平及缺血脑组织Notch1 mRNA的表达。
脑缺血再灌注 川芎 赤芍 胶质纤维酸性蛋白 血管内皮生长因子 Notch1
急性脑血管病是目前导致人类死亡的第二大因素,对老年人的健康危害严重[1]。缺血性脑卒中的病因主要是血管性的,但是脑功能的主要承担者是神经细胞,由缺血造成的神经细胞不可逆损伤一直是人们研究的重点,并诞生了一系列的神经保护策略[2]。川芎赤芍是传统名方及现代经常一起配伍应用的药对,具有行气活血化瘀功效。本研究观察川芎赤芍配伍应用对大鼠脑缺血胶质纤维酸性蛋白(GFAP)、血管内皮生长因子(VEGF)及Notch1的影响,探讨其调控脑缺血损伤脑保护的作用机制。
1 材料与方法
1.1 材料
选用健康雄性SD大鼠120只,体质量240-260 g,购自辽宁长生生物技术有限公司[许可证编号:SYXK(辽)2012-0003]。川芎和赤芍(辽宁中医药大学附属第二医院),银杏叶片(安徽圣鹰药业有限公司,批号:150806。血管内皮生长因子ELISA试剂盒(北京诚林生物科技有限公公司,批号:E-30443)。胶质纤维酸性蛋白ELISA试剂盒(北京诚林生物科技有限公司,批号:E-33093)。MagNA Pure LC RNA Isolation Kit(瑞士罗氏公司,批号:11471300),PrimeScript RT reagent Kit(日本TaKaRa公司,批号:AK3401)。MagNA Lyser Green Beads(瑞士罗氏公司,批号:03358941001)。
1.2 模型制备
采用线栓法制备大鼠大脑中动脉局灶性脑缺血再灌注模型[3],步骤为:3%水合氯醛腹腔注射麻醉后,将SD大鼠仰卧固定于手术台,在颈部正中划开长约3厘米的切口,钝性分离皮下筋膜和肌肉组织,暴露颈前肌群,将肌肉向两侧分开,完全暴露出右侧颈总动脉;接着用眼科镊和眼科剪分离出右侧颈内、外动脉,在颈内外动脉分叉处用4号线结扎颈外动脉,右侧颈总动脉处剪一约0.5 mm小切口,插入头端圆钝直径为0.28 mm 的栓线,进栓线长度约18-19 mm,在大脑中动脉起始端线栓大鼠大脑中动脉。手术区使用少许青霉素粉,逐层缝合手术切口后用碘伏进行皮肤消毒。手术中采用加热毛毯保持大鼠体温直至清醒。术后单笼饲养,栓塞2 h后取出栓线。
动物清醒2 h后参照Longa Z[4]的5分制法进行神经功能评分,分值在1-3分者入组。评分标准为:0分:无神经损伤症状;1分:不能完全伸展对侧前爪;2分:向对侧转圈;3分:向对侧倾倒;4分:不能自发行走,意识丧失。神经功能评分分数越高,神经功能缺损越严重,反之亦然。未到时间点死亡等不足动物随机替补。
1.3 分组与给药
按照随机数字表分为:①空白组:正常大鼠不手术、②模型组、③川芎赤芍低剂量组、④川芎赤芍高剂量组、⑤银杏叶片组,每组24只,②-⑤组根据缺血2 h再灌注后3天、7天、14天各分3个亚组。银杏叶片配制成浓度为0.32 g·mL-1,川芎、赤芍提取液浓度为1.08 g生药/mL,原液稀释后取得1.08 g·mL-1、0.54 g·mL-1的高剂量、低剂量两组。川芎赤芍高、低剂量组按相应剂量给药,银杏叶提取物组予银杏叶提取物,空白组、模型组动物均给予等体积无菌蒸馏水,自由饮食、活动。
1.4 ELISA法测定外周血GFAP和VEGF
各组大鼠于3天、7天、14天取材,每组8只。采用腹主动脉采血法,待血标本静置2 h后,置于4℃离心机内,以3 000 r·min-1离心15 min,取血清置-20℃冰箱待用。按ELISA 试剂盒内说明书进行检测。
1.5 real-time PCR检测Notch1 mRNA的表达
采用罗氏全自动核酸提取系统(MPLC 2.0)提取缺血脑组织总RNA,测定Notch1 RNA 浓度。罗氏cDNA合成试剂盒将RNA反转录成cDNA,在罗氏PCR仪上检测Notch1 mRNA 的吸光度。实验采取3次生物学重复、3次实验学重复取平均值以避免误差。采用2-ΔΔCT的方法计算Notch1 mRNA的相对表达量。引物如下:Notch1:Forward:GTTTGTGCAAGGATGGTGTG,Reverse:CCTTGAGGCATAAGCAGAGG;Actb:Forward:AGCCATGTACGTAGCCATCC,Reverse:CTCTCAGCTGTGGTGGTGAA。PCR反应条件:95℃10 min,95℃ 10 s,55℃ 20 s,72℃ 20 s,共40个循环,95℃ 5s,65℃ 1 min,4℃ 30 s。
1.6 TTC染色观察脑梗死面积
各组大鼠在7天后用3%水合氯醛麻醉,断头取脑。将大鼠大脑置于-20℃冷冻20 min后,去掉嗅球、小脑和低位脑干,冠状切分脑组织成5片。用2%的红四氮唑将脑片染色,37℃培养箱中避光染色30 min,期间不断翻转脑片,使两面染色均匀。正常脑组织呈红色,而梗死脑组织为白色。
1.7 统计学方法
2 结果
2.1 川芎赤芍对大鼠脑梗死面积的影响
如图1所示,除空白组无梗死灶外,其余各组大鼠均出现不同程度的脑梗死。与模型对照组相比,川芎赤芍低、高剂量组,银杏叶片组大鼠脑梗死灶面积明显减少。
2.2 川芎赤芍对各组大鼠外周血GFAP含量的影响
给药3天、7天、14天后,与空白组相比,模型组、川芎赤芍低剂量组、川芎赤芍高剂量组、银杏叶组GFAP水平均明显升高(P<0.05),与模型组相比,川芎赤芍低剂量组、川芎赤芍高剂量组和银杏叶组GFAP水平明显升高(P<0.05)。以上结果提示川芎赤芍可能通过调节与神经再生有关因子的变化,促进了神经功能修复。详见表1。
2.3 川芎赤芍对各组大鼠外周血VEGF表达的影响
给药3天、7天、14天后,与空白组相比,模型组、川芎赤芍低剂量组、川芎赤芍高剂量组、银杏叶组大鼠外周血VEGF水平明显升高(P<0.05);与模型组相比,川芎赤芍低剂量组、川芎赤芍高剂量组、银杏叶组VEGF水平明显升高(P<0.05)。详见表2。
2.4 川芎赤芍对各组大鼠脑组织Notch1 mRNA表达的影响
给药3天、7天、14天后,与空白组相比,模型组、川芎赤芍低剂量组、川芎赤芍高剂量组和银杏叶组大鼠脑组织Notch1 mRNA表达增加(P<0.05);与模型组相比,川芎赤芍低剂量组、川芎赤芍高剂量组和银杏叶组脑组织Notch1 mRNA表达增加(P<0.05)。以上结果提示川芎赤芍对脑缺血损伤后Notch1 mRNA表达水平有影响,提示川芎赤芍可能增加具有血管新生因子作用。详见表3。
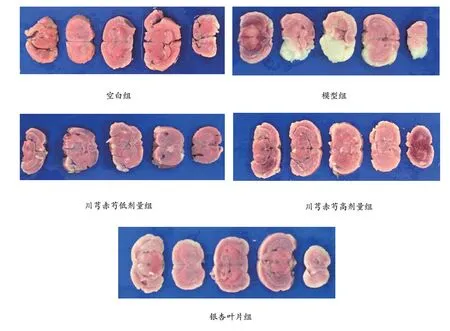
图1 TTC 染色大鼠脑切片
表1 川芎赤芍对各组大鼠外周血GFAP含量的影响/pg·mL-1(±s,n=8)

表1 川芎赤芍对各组大鼠外周血GFAP含量的影响/pg·mL-1(±s,n=8)
注:与空白组相比,*P<0.05;与模型组相比,#P<0.05。
组别 3天 7天 14天空白组 274.00±52.43 283.88±45.46 287.38±54.56模型组 413.25±74.05* 451.75±46.59* 417.25±60.93*川芎赤芍低剂量组 527.00±75.42*# 539.63±67.13*# 527.88±61.42*#川芎赤芍高剂量组 503.50±57.92*# 525.88±44.42*# 505.63±46.70*#银杏叶组 489.88±51.25*# 510.00±65.01*# 487.38±61.31*#
表2 川芎赤芍对各组大鼠外周血VEGF表达的影响/pg·mL-1(±s,n=8)
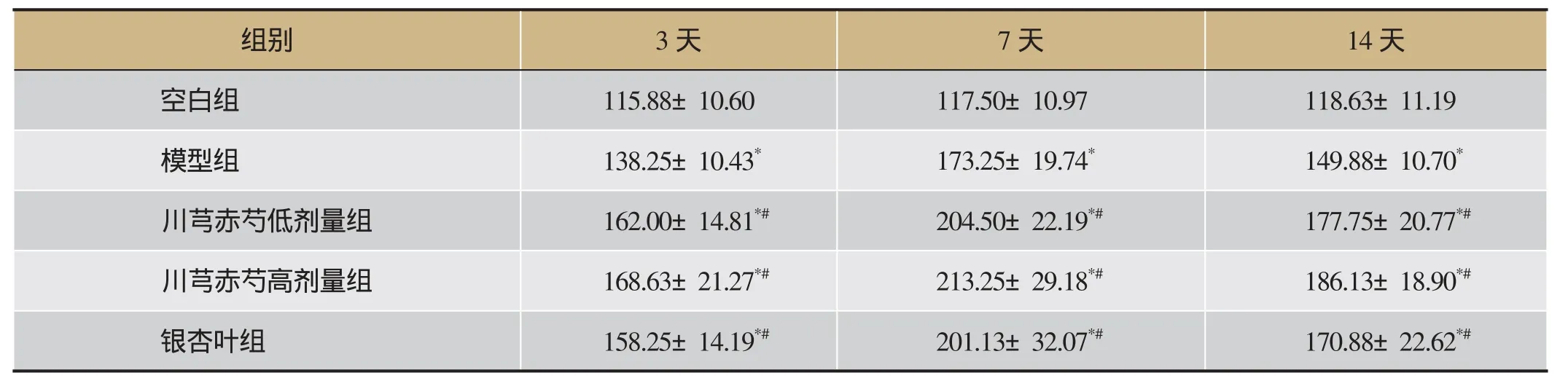
表2 川芎赤芍对各组大鼠外周血VEGF表达的影响/pg·mL-1(±s,n=8)
注:与空白组相比,*P<0.05;与模型组相比,#P<0.05。
?
表3 川芎赤芍对各组大鼠脑组织Notch1 mRNA表达的影响(-±s,n=8)
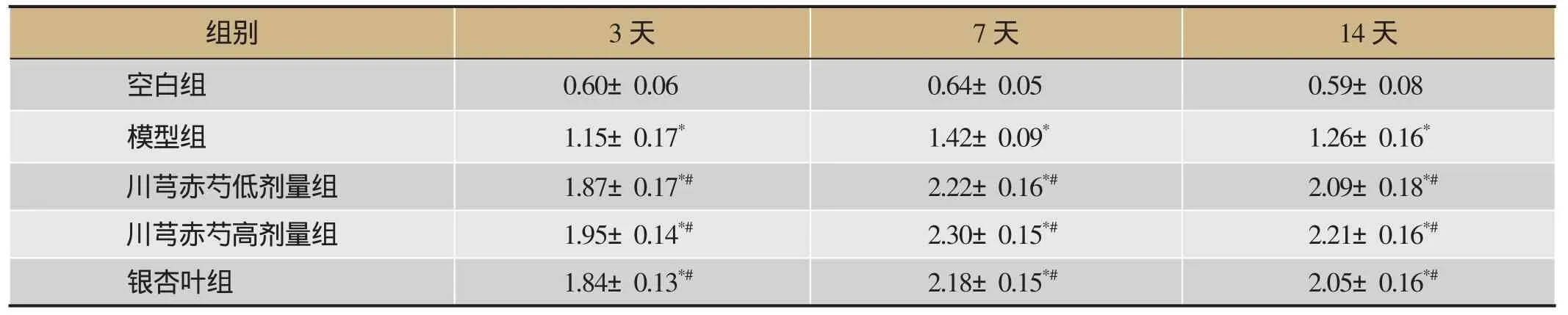
表3 川芎赤芍对各组大鼠脑组织Notch1 mRNA表达的影响(-±s,n=8)
注:与空白组相比,*P<0.05;与模型组相比,#P<0.05。
组别 3天 7天 14天空白组 0.60±0.06 0.64±0.05 0.59±0.08模型组 1.15±0.17* 1.42±0.09* 1.26±0.16*川芎赤芍低剂量组 1.87±0.17*# 2.22±0.16*# 2.09±0.18*#川芎赤芍高剂量组 1.95±0.14*# 2.30±0.15*# 2.21±0.16*#银杏叶组 1.84±0.13*# 2.18±0.15*# 2.05±0.16*#
3 讨论
GFAP 是中枢神经系统中特有的细胞骨架蛋白,是星形胶质细胞主要的中间丝蛋白,公认为是星形细胞的特征性标志蛋白。GFAP对于维持星形胶质细胞细胞形态结构的稳定是至关重要的,并决定着星形胶质细胞对损伤反应的程度。在正常情况下,星形胶质细胞是中枢神经系统的主要胶质细胞,对于神经细胞起到保护、支持及参与其代谢的作用[5]。有研究发现[6]通过对血清胶质纤维酸性蛋白浓度变化的动态观察,可为颅脑损伤程度的判断提供较为实用的指标;监测血清胶质纤维酸性蛋白浓度,联合CT影像学改变,可更准确地判断病情。有研究报道,血清胶质纤维酸性蛋白在维持星形胶质细胞形态和功能上都有作用,它在细胞核和细胞膜之间形成连接,参与了细胞内骨架重建、细胞黏附、维持脑内髓鞘形成和神经元结构完整以及作为细胞信号转导通路等[7]。
VEGF是最早用于脑缺血疾病研究的血管生长因子,是血管生成的关键性因子之一,VEGF表达可在脑缺血缺氧的诱导下迅速增多,启动血管生成,改善脑循环,促进神经功能恢复。有研究表明[8],VEGF 在病理过程中参与神经和血管的重塑。Silvare等[9]通过向脑缺血的大鼠模型脑内注射VEGF,发现具有一定神经保护功能。有研究者[10]发现脑梗死患者血清 VEGF 浓度与新生血管形成及脑神经功能恢复有关,但目前其浓度还不能作为评判神经功能康复程度的指标。有研究显示[11],急性脑梗死患者血清VEGF和VEGFR 水平于发病后至第 14 天呈现持续高表达状态。VEGF可在血管新生及神经保护等方面发挥生物学保护作用,改善预后。VEGF 在血管生成方面作用最强,已经成为治疗性血管形成的研究重点。
Notch1是细胞膜上的跨膜受体分子蛋白,通过细胞分子间的相互作用,介导体内多种重要的生物学功能,包括器官发生、干细胞的自我更新、细胞分化和死亡等。从人的出生到死亡的生命过程,Notch1 对神经系统的发育和功能发挥都起到了至关重要的作用。在神经系统的整个发育过程中,Notch1维持了神经干细胞的未分化状态,调控着神经干细胞的自我更新和分化过程;亦有研究表明血管内皮生长因子与Notch信号通路交互对话对动静脉分化起着举足轻重的调控作用。在缺少血管内皮生长因子信号的斑马鱼胚胎,背大动脉内皮Notch信号通路不会激活,但是在这些胚胎中过表达胞内结构域,可以维持动脉表型,提示Notch信号通路处于血管内皮生长因子下游介导动脉分化行为[12-15]。有研究表明,GFAP 表达与Notch1 呈正相关, 神经元特异性烯醇化酶与GFAP均可以作用于Notch1 受体,进而调控下游基因的表达[16]。
中药治疗缺血性脑血管病的疗效确切,是通过多途径、多靶点的作用机制而实现的。
脑缺血后促进神经元的修复和完整性是至关重要的。川芎赤芍为经典名方血府逐瘀汤的主要组成药物,在临床上两药常作为药对配伍运用,具有行气活血的作用。经检索《普济方》数据库管理系统,同时含川芎赤芍的方剂多达3 546首,现代药理研究表明,两药合用对脑缺血有改善作用[17]。本研究显示,川芎赤芍能提高 GFAP水平及Notch1 mRNA的表达。GFAP能产生神经营养因子,有利于神经元的修复,Notch信号通路与神经增殖与分化有密切关系,可见川芎赤芍配伍应用对脑缺血后神经元的修复新生起作用,进而起到脑保护作用。
参考文献
1 罗祖明,丁新生.缺血性脑血管病学.北京: 人民卫生出版社,2011: 99.
2 Del Zoppo G J. The neurovascular unit in the setting of stroke. J Intern Med,2010,267(2): 156-171.
3 仲爱芹,徐士欣,张军平,等.改良法制备、评价大鼠局灶性脑缺血模型的实验研究.辽宁中医杂志,2012,39(6): 1176-1178.
4 Wang W,Xu J,Li L,et al. Neuroprotective effect of morroniside on focal cerebral ischemia in rats. Brain Res Bull,2010,83(5): 196-201.
5 汝丽娟,裴海涛,郭云良. BMP-7 对大鼠脑缺血/再灌注损伤后nestin和GFAP表达的影响.中国药理学通报,2011,27(12): 1718-1723.
6 刘建平,李洪文,钟瑜华,等.颅脑损伤患者血清胶质纤维酸性蛋白的动态变化及临床意义.海南医学,2012,23(11): 3-6.
7 Mondal S,Dirks P,Rutka J T. Immunolocalization of fascin,an actinbundling protein and glial fibrillary acidic protein in human astrocytoma cells. Brain Pathol,2010,20(1): 190-199.
8 Sims N R,Muyderman H. Mitochondria,oxidative metabolism and cell death in stroke. Biochim Biophys Acta,2010,1802(1): 80-91.
9 Emerich D F,Silva E,Ali O,et al. Injectable VEGF hydrogels produce near complete neurological and anatomical protection following cerebral ischemia in rats. Cell Transplant,2010,19(9): 1063-1071.
10 官俏兵,张晓玲.血清血管生长因子浓度变化与急性脑梗死后神经功能康复的关系.实用医学杂志,2013,29(5): 726-728.
11 黄宁芳,唐国传,余祖辉,等.三七总皂苷对急性脑梗死患者血清 VEGF 和 VEGF含量的影响.神经损伤与功能重建,2014,9(5): 388-390.
12 Jovi evi M,Divjak I,Slankamenac P,et al. The most frequent causes of ischemic strok in young adults. Med Pregl,2011,64(5-6): 331-335.
13 Meyers P M,Schumacher H C,Connolly E S,et al. Current status of endovascular stroke tereatment. Circulation,2011,123(22): 2591-2601.
14 Wechsler L R. Intravenous thrombolytic therapy for acute ischemic stroke. N Engl J Med,2011,364(22): 2138-2146.
15 Fish J E,Wythe J D. The molecular regulation of arteriovenous specification and maintenance. Dev Dyn,2015,244(3): 391-409.
16 王志伟,冯为民. NSE、GFAP 及Notch1 在大黄三七散改善急性脑出血大鼠神经功能缺损中的表达及其意义.中华中医药学刊,2011,29(7): 1658-1661.
17 梁日欣,黄璐琦,刘菊福,等.药对川芎和赤芍对高脂血症大鼠降脂、抗氧化及血管内皮功能的实验观察.中国实验方剂学杂志,2002,8(1): 43-45..
Effects of Ligusticum Chuanxiong and Radix Paeoniae Rubra on the Expressions of GFAP,VEGF and Notch1 in Rats with Cerebral Ischemia-Reperfusion
Ma Jin1,Gan Yu1,Yuan Yuan1,Huang He1,Jiao Fuying1,Qiao Tie2,Cui Yinghai1
(1. Second Affiliated Hospital of Liaoning University of Traditional Chinese Medicine,Shenyang 110034,China; 2.School of Basic Medicine,Liaoning University of Traditional Chinese Medicine,Shenyang 110032,China)
This study aimed to elucidate the effects of Ligusticum Chuanxiong and Radix Paeoniae Rubra on plasma glial fibrillary acidic protein (GFAP) and vascular endothelial growth factor (VEGF),and Notch1 expression in the brain in rats with cerebral ischemia-reperfusion. The model of cerebral ischemia-reperfusion was established with suture-occluded method. SD rats were randomly divided into the control group,the model group,and low dose of Ligusticum Chuanxiong and Radix Paeoniae Rubra group (the low dose group),the high dose of Ligusticum Chuanxiong and Radix Paeoniae Rubra group,and the ginkgo leaf group. Levels of plasma GFAP and VEGF were detected by ELISA,while the Notch1 mRNA expression in the brain was quantified by real-time PCR. It was found that plasma GFAP and VEGF levels were increased in rats administered with Ligusticum Chuanxiong and Radix Paeoniae Rubra,while Notch1 mRNA expression was also up-regulated compared with the model tgroup. In conclusion,it was demonstrated that Ligusticum Chuanxiong and Radix Paeoniae Rubra enhanced the plasma GRAP and VEGF and cerebral Notch1 mRNA expressions in rats with cerebral ischemia-reperfusion.
Cerebral ischemia-reperfusion,Ligusticum Chuanxiong,Radix Paeoniae Rubra,glial fibrillary acidic protein,vascular endothelial growth factor,Notch1
10.11842/wst.2016.05.017
R2-031
A
(责任编辑:朱黎婷,责任译审:朱黎婷)
2016-05-02
修回日期:2016-05-11
* 辽宁省教育厅科学技术研究项目(L2013362):益气活血法干预脑缺血再灌注损伤大鼠神经保护实验研究,负责人:马进。
** 通讯作者:马进,博士后,副主任医师,硕士研究生导师,主要研究方向:中医药防治疾病的理论和临床研究。
