喜树碱类药物的研究与开发*
2016-03-06陈梦涵杨鸣华孔令义
陈梦涵,杨鸣华,孔令义
(中国药科大学中药学院 南京 210009)
喜树碱类药物的研究与开发*
陈梦涵,杨鸣华,孔令义**
(中国药科大学中药学院 南京 210009)
喜树碱是从中药喜树中分离得到的单体成分,作为世界上第三大植物抗癌药,喜树碱及其多种衍生物是临床常用的广谱抗癌药物。自20世纪70年代发现喜树碱后,科学家们对喜树碱类化合物的构效关系、结构修饰、药效药理等方面开展了大量研究工作,并开发出拓扑替康、依立替康、贝洛替康等喜树碱类抗癌药。直到40多年后的今天,科学家们对于喜树碱类药物的研究依然活跃,对其生物合成、新剂型开发等方面的关注也成为研究的新方向。作为源于中药单体成分而开发成药的成功典范,喜树碱类化合物的研发历程对我们当前开发中药单体活性成分新药无疑是有益的借鉴。本文对喜树碱类药物的研发及其新进展进行综述,与同行一起回顾喜树碱的开发历程和相关研究,以期对源于中药的新药开发带来一些思考。
喜树碱 中药单体成分 研究进展
近年来恶性肿瘤发病率居高不下,人们对肿瘤的关注度不断提升,抗肿瘤药物的临床需求越来越大,这对抗肿瘤药物的研发提出了更高的要求。从中药有效成分中寻找新的抗肿瘤药物无疑是一条可行的途径,喜树碱类化合物的开发便是极好的实例。喜树碱(Camptothecin, CPT)是从中药喜树(Camptotheca acuminata Decne. var. acuminata)中分离得到的一种单体有效成分,以喜树碱为基础研制的喜树碱类药物是临床上常用的广谱抗癌药,经久不衰。当然,从喜树碱这一中药单体有效成分的成功发现到喜树碱类抗癌药物的广泛临床应用历经20余年,无数科学家们从化学到生物活性多个领域的大量研究工作才成就了这“第三大植物抗癌药”。喜树碱类药物的成功开发可以说是中药单体成分开发的典范,但也同时告诉我们这一工作的艰辛和困难。本文回顾喜树碱的研究,以期为新的中药单体成分的深入研究及新药创制提供参考和思路。
1 喜树碱类化合物的发现历程
中医药临床实践中常以中国特有珙桐科植物喜树的果实或根入药治疗某些疾病[1],如《浙江民间常用草药》中记载[2],喜树的根皮具有清热解毒,散结消肿之功效,果实具有活血化瘀之功效,常用来煎汤内服或者是研末吞服,治疗牛皮癣、疮肿等症。
但喜树真正被广为人知则是由于1966年Wall等[3]首次从喜树茎皮中分离得到了喜树碱这一天然成分,且这一成分显示出了良好的细胞毒活性[3]。随后的研究工作表明喜树碱对恶性肿瘤具有极好的抑制作用,从而在20世纪70年代掀起了对植物喜树和喜树碱类化合物的研究热潮,更多的喜树碱类化合物也因此被发现和研究。中国科学家林隆泽、徐任生等人在当时紧随国际研究热点开展喜树化学成分的研究,成功地从喜树中发现了11-甲氧基喜树碱,20-脱氧喜树碱[4],10-羟基脱氧喜树碱[5]和18-羟基喜树碱[6]等天然成分。其它科学家们也陆续地从喜树中分离得到了10-甲氧基喜树碱[7],11-羟基喜树碱[8]等喜树碱类天然化合物,包括现已成药的10-羟基喜树碱。目前从喜树中分离得到的天然生物碱约有27个[9],其中喜树碱类约18个,以喜树碱和10-羟基喜树碱的抗癌活性最为显著。
2 喜树碱的抗癌机制及临床应用
2.1 喜树碱的抗癌机制
在喜树碱发现之前,很多抗癌药物都是通过抑制拓扑异构酶Ⅱ(TopoⅡ)而发挥抗癌作用。喜树碱能够独特的作用于拓扑异构酶Ⅰ(TopoⅠ),这一发现在当时很快便引起了药学界的轰动[10]。拓扑异构酶Ⅰ能够以非共价键的形式与DNA形成一个暂时的络合中间体,以打开缺口/重新封口的机理松弛DNA的超螺旋结构[11,12]。喜树碱类药物与TopoⅠ-DNA复合物可逆性地结合,形成稳定的DNA-TopoⅠ-DNA三元结合体,对可裂解复合物起到稳定作用[13]。该三元结合体与复制酶作用,产生双链DNA的损伤,导致复制叉与结合体“ 碰壁”,形成不可修复的缺口,使DNA合成受到抑制,进而诱导细胞的凋亡[14]。同时,喜树碱类衍生药物诱导凋亡常伴有细胞周期阻滞。细胞周期阻滞是细胞的一种响应机制,其主要是为了防止将错误的遗传信息传递给子细胞。如果出现的DNA缺口过多,超过细胞自身的修复能力,就会启动凋亡程序[15]。喜树碱类药物主要针对S期肿瘤细胞,对G1、G2和M期细胞有轻微杀伤力,对于G0期细胞无明显作用[16]。遗憾的是, 虽然对TopoⅠ的结构和功能已有较深入了解,但至今尚未得到喜树碱、DNA 和TopoⅠ的三元复合物的晶体结构[14],喜树碱类衍生物抗癌作用的分子机制尚未完全阐明,有待于科学家的继续努力。

图1 几种常用于临床的喜树碱类药物
2.2 喜树碱类药物的临床应用
目前用于临床治疗的喜树碱类药物主要有拓扑替康(Topotecan,TPT)、依立替康(Irinotecan, CPT-11)、贝洛替康(Belotecan,CDK-602)、10-羟基喜树碱(HCPT)等[17](图1)。其中HCPT是从喜树中直接分离得到的天然产物,其余几种药物皆为喜树碱结构修饰后的衍生物。HCPT是上世纪70年代中国自主研制的抗肿瘤药物,由于其可靠的临床疗效而受到人们的广泛关注。大量研究表明,HCPT对胰腺癌、前列腺癌、膀胱癌、胃癌等均有较好疗效[18],具有抗瘤谱广且无交叉耐药性等优势。药物代谢动力学研究表明,HCPT主要从胆汁中排泄,与CPT相比,显著降低了泌尿系统的副作用[19]。在此基础上,科学家们不断的努力尝试改进其水溶性差、半衰期短、生物利用度低的缺点,在20世纪90年代,成功的研制出新一代抗癌药物TPT和CPT-11。TPT首先在日本上市[20],1996年正式被美国 FDA 批准作为临床抗肿瘤药物,用作卵巢癌及小细胞肺癌治疗的二线用药[21]。2007年,TPT的一种口服制剂被FDA批准用于临床上复发性小细胞肺癌的治疗。目前TPT多用于神经细胞瘤、乳腺癌、结肠癌、小细胞肺癌以及卵巢癌的化疗[22],同时作为放射增敏剂应用在头颈部肿瘤、卵巢癌等治疗中。与很多抗癌药物相似,TPT的副作用主要体现在白细胞和中性粒细胞下降、呕吐、腹泻等方面[23]。同样在1996年美国FDA批准了另一个喜树碱类抗癌药物CPT-11,用于晚期大肠癌的治疗[24],与5-氟尿嘧啶(5-Fu)联合作为一线用药,此后共有7个国家陆续批准CPT-11用于治疗对5-Fu标准治疗无效的晚期结肠直肠癌。CPT-11的局限性主要表现在对体内羧酸酯酶-2的依赖,CPT-11进入体内后,在羧酸酯酶-2作用下水解生成SN-38 (7-乙基-10-羟基喜树碱)[25],SN-38是该药在体内的主要活性成分,发挥主要的抗肿瘤作用。但是羧酸酯酶-2在血液中的含量很低,只有一小部分药物能被水解,因此对CPT-11的治疗效果造成了一定的限制。此外,研究发现CPT-11有中性粒细胞减少、迟发性腹泻和乙酰胆碱能综合征等毒副作用[26]。最新的喜树碱类抗癌药CDK-602于2004年在韩国被批准上市,主要用于卵巢癌以及肺癌的临床治疗[27],对铂敏感和耐受的卵巢癌患者也具有治疗作用[28],但会伴随有中性白细胞减少[29]的副作用。
除了抗癌活性研究以外,喜树碱类化合物还具有抗HIV及抑制青光眼滤过性手术后瘢痕形成的作用[30]。Liu等[31]研究发现部分喜树碱类化合物的单体具有抗HSV-2 病毒的作用[31]。Li等[32]曾经研究了喜树碱对Alternaria alternata,Epicoccum nigrum和Pestalotia guepinii等真菌的体外抑制活性,结果表明喜树碱对以上真菌菌丝体生长的半数有效抑制浓度在10-30 μg·mL-1之间[32]。
3 喜树碱类化合物的全合成及结构修饰
3.1 喜树碱的全合成
自喜树碱的抗癌活性证实之后,众多的有机化学家和药物化学家便开始进行喜树碱类似物全合成研究的探索[33]。早期合成方法得到的喜树碱多为消旋体[34],中国科学院上海药物研究所在20世纪70年代也成功制备得到喜树碱消旋体。需要指出的是,只有20(S)构型的喜树碱类化合物才具有显著的抗肿瘤活性,20(R)喜树碱类化合物的抗肿瘤活性大大降低,甚至完全消失。1975年Coery首次报道手性全合成喜树碱的方法,此后更加简单快速的喜树碱全合成的方法不断被报道。中国科学家也进行了许多喜树碱类化合物全合成的研究工作[35],雷英杰等[36]在A环氮氧化法的基础上,就光化重排反应机理作了探讨,大大提高了10-羟基喜树碱的产率[36]。Wei等[37]提出了一种新的4步合成喜树碱的反应路线,该反应建立在简单的环化化学基础上,克服了喜树碱全合成步骤长,产率低的缺点,反应原料经济易得,最终产率高达73%,且在实验室成功的进行了放大化的试验[37]。
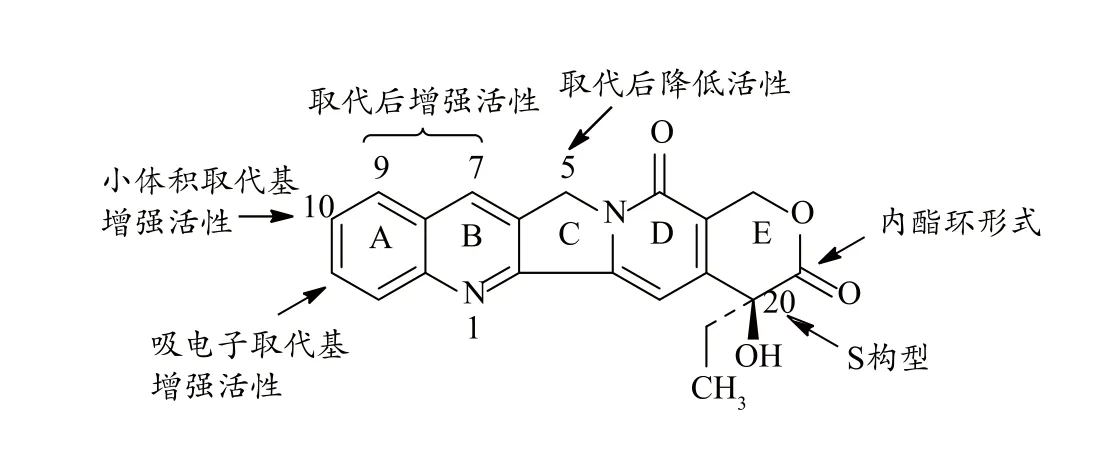
图2 喜树碱衍生物的主要构效关系
3.2 喜树碱的结构修饰
喜树碱曾因其对消化系统及泌尿系统强烈的毒副作用,引发腹泻,出血性膀胱炎,严重的骨髓抑制等[38],研究一度停滞不前。该类化合物临床应用的主要缺陷在于药物本身的毒性、非特异性、水溶性差及在人体血浆中内酯环开裂导致的失活。因此,人们通过对喜树碱结构的五环骨架上某些活性位点进行修饰[39],期望获得一系列高效低毒水溶性好的喜树碱衍生物。目前多数的研究集中在A、B、E环的修饰上面,以改善喜树碱的水溶性,降低毒副作用,增加内酯环的稳定性,其中7、9、10和20位碳是研究最多的修饰位点[20]。
3.2.1 喜树碱的构效关系研究
构效关系研究发现,喜树碱类衍生物分子中的20(S)构型、E环的α-羟基内酯和D环的氢化吡啶酮是必需活性结构[40]。试验证明C环的5位取代将会导致活性降低[13],因此后续便很少有此报道。7、9位极性或非极性取代基取代后活性增加,7和10位双取代可提高代谢稳定性[41]。10位上小体积取代基取代后活性增加,11位上引入吸电子取代基同样能使活性增加[13]。E环羟基的酯化,能够大大减小喜树碱的毒性,但是也伴随着抗癌活性的降低[41](图2)。
3.2.1 A环的取代
为了确定高效低毒衍生物的最佳取代基和取代位,研究者们合成了大量A环取代衍生物。拓扑替康在9、10位上进行了取代,是A环取代衍生物的典型代表,临床上使用的HCPT也是在10位上进行了羟基取代[36]。盐酸拓扑替康与硫醇在DMSO或氯仿加热条件下反应可以得到一系列的9位取代的盐酸拓扑替康,当9位上取代基为大的疏水基团(乙基、正丙基及异丙基等)时显示出比拓扑替康更强的活性[42]。喜树碱的9位经硝基取代后[43],显示出良好的抗癌活性,目前正在接受临床试验[12]。研究者对A环上不同取代位置的化合物活性进行比较,发现细胞毒活性大小依次为9=10>11>12位取代[44],证明A环9、10位取代的化合物抗肿瘤效果最佳。
3.2.2 B环的取代
根据构效关系研究的结果,B环修饰主要集中在对7位的取代上,研究者们尝试合成了具有不同取代基类型的7位修饰产物,例如7-乙基-10-羟基喜树碱[45]。在CPT 的7位引入-Et,-COOEt,-CH2OCOR,-CHO,-CN等基团,均能增加其活性[41]。为了得到有良好抗肿瘤活性同时具有低的白蛋白结合力的喜树碱类衍生物,研究者们将双环氨基酮与三环酮进行Friedlander缩合,设计合成了一系列喜树碱六元环衍生物,在7位和9位之间形成了一个新的六元环,其抗肿瘤活性明显强于CPT-11水解后得到的SN-38,且显示出与人血清白蛋白较低的结合力[46]。除了对7位的修饰之外,研究者们也将B环氮原子氧化生成氮氧化物,发现会降低其活性[41],因而后续很少有关这方面的研究。
3.2.3 E环的研究
为了改善现有药物中E环内酯结构在血浆中不稳定的弊端[47],中国科学家Wang等人设计合成了一类同样具有拓扑异构酶Ⅰ抑制作用的含七元内酯环的喜树碱衍生物,显示出比SN-38更强的生物活性[48]。Patrick等人在前人全合成喜树碱路线的基础上,于2003年进行了五元E环的喜树碱类化合物的合成,同样显示出良好的抗肿瘤活性[49]。另有研究将E环20位羟基用氯或者是溴原子取代,破坏了羟基与内酯环的氢键作用,稳定了内酯环,同时由于卤素的可极化性,使得其可以和酶形成较稳定的复合物,显示出一定的抗肿瘤活性[50]。除此之外,中国科学家还合成了不具E环内酯结构的22-羟基喜树碱,彻底打破了传统喜树碱内酯环的限制,该化合物同样具有一定的细胞毒活性[51]。
4 喜树碱研究的新进展
4.1 喜树碱新来源的拓展
从喜树中提取分离获取喜树碱的方法对喜树的依赖性大,同时带来了对环境的破坏,为了寻找喜树的替代品,经过不懈的努力,科学家们目前已从3个不同的科属中发现了含有喜树碱的植物,分别是夹竹桃科(Apocynaceae)狗牙花属的海木狗牙花(Ervatamia heyneana T. Cooke)、茶茱萸科(Icacinaceae)假柴龙树属臭假柴龙树(臭马比木)(Nothapody tes foetida),以及茜草科(Rubiaceae)蛇根草属的硬毛蛇根草(Ophiorrhiza mungos L .)。
除此之外,利用离体培养技术也是获得喜树碱类化合物资源的重要途径,以组织培养作为喜树碱类化合物的来源,具有传统植物来源不可比拟的优势,不仅能够弥补喜树资源匮乏的现状且不受自然条件限制。常用的组织培养技术有悬浮细胞和发根培养,二者都是积累植物二次代谢产物非常有效的途径。研究发现利用UV-B照射喜树茎悬浮细胞,能够大幅度增加悬浮细胞中喜树碱的产量[52];利用发根生产喜树碱,产量能够达到1.0 mg·mL-1DW,羟基喜树碱的产量可以达到0.15 mg·mL-1DW[53];以A. rhizogenes TISTR 1450侵染O. alata发根,其产生的喜树碱是喜树根中喜树碱含量的2倍[54];在O.pumila发根体系中,用UV-B处理能够使喜树碱含量增加11倍,用水杨酸处理能够使10-羟基喜树碱含量增加25倍[55]。
植物内生菌的研究近年来已经成为中国微生物学研究和寻找活性化合物的热点,利用喜树内生菌生产喜树碱的研究也逐渐走进大家的视野,研究者们先后发现了多种能够产生喜树碱类化合物的内生菌,从印度Apodytes dimidiata(Icacinaceae)中分离得到的内生菌Fusarium solani能够产生喜树碱和10-羟基喜树碱[56],同时从Apodytes dimidiata(Icacinaceae)中发现了能够产生9-甲氧基喜树碱的内生真菌菌株。Kusari等人从喜树树皮中分离出了能够产生喜树碱、9-甲氧基喜树碱、10-羟基喜树碱的内生菌[57]。但是,研究表明内生菌发酵得到喜树碱类化合物的产量要远低于植物体内喜树碱的产量,而且菌株具有遗传不稳定性,继代培养后菌株中喜树碱的产量可能会出现下降甚至是消失的现象,这是利用内生菌进行大规模生产喜树碱亟待解决的问题[58]。
4.2 喜树碱新剂型的研究
针对喜树碱类药物临床应用发现的问题,研究者们期望能够提高喜树碱类药物的稳定性,解决其在溶解度和生物利用度方面存在的不足,提高靶向性,减少不良反应,因此对喜树碱类药物的剂型不断地进行改进。众所周知脂质体和纳米粒/毫微粒的实用价值较好,因此有关喜树碱的该类剂型研究最受关注。将HCPT制成脂质体,不仅具有缓释的效果,增加药物有效浓度的维持时间而且能够大大增加内酯环的稳定性,保证药物的活性,同时增加了药物的肝靶向性[59]。另有研究将喜树碱制成固体脂质纳米粒,增加了药物的稳定性,在小鼠体内药动学试验表明,该脂质体能够有效的延长药物的半衰期,对于淋巴癌的治疗有较好的效果[60]。
5 启示
新药研发是一项长期且又艰巨的工作,需要每位药学工作者持之以恒的努力,更需我们团结协作共克难关。科学家们通过20多年细致耐心的研究,历经喜树碱的发现、活性测试、作用机理研究、结构修饰等过程,才成就了这一类抗癌药物;与此同时科学家们不断的进行药物剂型改进,以及积极进行喜树碱类化合物新来源的拓展,以期获得更好的发展。从喜树碱的首次发现到临床应用,国外的喜树碱研发始终走在前列,这对我们现今的研究是一个警示。加快我们的研究步伐,不仅需要提高我们的仪器设备条件,更需培养我们的创新思维,提高原始创新能力,不断开拓我们的新药研发道路;喜树是中国特有植物,其药用功效和应用也多有记载,从传统中药典籍和中药应用中汲取灵感,将传统中药与现代科学技术相结合,有助于拓宽中药研发领域和研究思路,开发下一个源于中药单体有效成分的“喜树碱”药物;当然,我们的目光也不应局限在发现新的活性天然产物上,对现有或新发现的活性有效成分进行合理的结构改造和修饰,获得成药性更好的化学结构也应当是我们重点关注的研究内容。
1 中国科学院中国植物志编辑委员会. 中国植物志. 北京科学出版社,1982, 52(2): 144-145.
2 浙江省卫生局. 浙江民间常用草药. 浙江人民出版社,1972: 204-205.
3 Wall M E,Wani M,Cook C,et al. Plant antitumor agents. I. The isolation and structure of camptothecin,a novel alkaloidal leukemia and tumor inhibitor from Camptotheca acuminata. J Am Chem,1966,: 88(16): 3888-3890.
4 徐任生,赵志远,林隆泽,等. 抗癌植物喜树化学成分的研究Ⅱ.喜树果中的化学成分. 化学学报,1977,35 (3): 193-199.
5 林隆泽,沈积慧.周彤.等. 新生物碱 10-羟基脱氧喜树碱. 化学学报,1989,47 (5): 506-508.
6 林隆泽,沈积慧,贺湘,等. 喜树中的吲哚生物碱. 化学学报,1988,46(12): 1207-1211.
7 Wani M C,Wall M E. Plant antitumor agents. II. Structure of two new alkaloids from Camptotheca acuminata. J Org Chem,1969,34(5): 1364-1367.
8 林隆泽,宋纯清,徐任生. 抗癌植物喜树化学成分的研究Ⅳ. 11-羟基喜树碱等化学成分的分离鉴定. 化学学报,1982,40 (1): 85-89.
9 Wang P,Luo J,Wang X B,et al. New indole glucosides as biosynthetic intermediates of camptothecin from the fruits of Camptotheca acuminata. Fitoterapia,2015,103: 1-8.
10 Hsiang Y H,Hertzberg R,Hecht S,et al. Camptothecin induces protein-linked DNA breaks via mammalian DNA topoisomerase I. J Biol Chem,1985,260(27): 14873-14878.
11 Cheng L,Zhou X. Review on anticancer mechanism of some plant alkloids. Chin Tradit Herbal Drugs,2003,35(2): 216-221.
12 游亮,张万年,张丽君,等. 喜树碱及其衍生物最新研究进展. 中国药物化学杂志,2007,17 (5): 327-332.
13 潘显道,王存英. 天然抗肿瘤药喜树碱衍生物的研究进展. 药学学报,2003,8(9): 715-720.
14 代鲁平,宋春霞,邵先祥,等 抗癌药物喜树碱类衍生物的研究进展.中国药学杂志,2010,(23): 1813-1815.
15 Meng F,Gong L,Tong X. Anti-tumor drug research development of camptothecin derivatives. Chem Life,2002,22(3): 265-267.
16 Li CJ,Gu Y,Han Y X,Zhou K. Research progress in camptothecin and its analogues. Chinese Journal of Medicinal Chemistry,2003,13(5): 306-310.
17 郭晓鹏,思良,金辉,等. 扑异构酶I其喜树碱类抑制剂的临床研究进展. 国际药学研究杂志,2013,40(4): 405-414.
18 Jin GH,Chen S,Yang L. Hydroxycamptothecin induced human prostate cancer Line PC-3M cell apoptosis. Chinese Journal of Laboratory Diagnosis,2010,1: 4.
19 刘丹,张龙,达飞,等. 新型喜树碱类抗癌药物的研究进展. 现代生物医学进展,2016,16(5): 990-992.
20 夏凤娟,李士坤,康蕾,等. 涉及喜树碱结构改进的专利申请现状分析. 中国发明与专利,2012,11:18.
21 张秀国,雍政,张谦,等. 拓扑替康在临床应用的研究进展. 中国新药与临床杂志,2003,22(11): 691-696.
22 冯奉仪,何晓慧,石远凯,等. 拓扑替康治疗小细胞肺癌和复发性卵巢癌的临床研究. 中华肿瘤杂志,2001,23(2): 155-158.
23 Patel S H,Ajlouni M,Chapman R,et al. A prospective phase II study of induction carboplatin and vinorelbine followed by concomitant topotecan and accelerated radiotherapy (ART) in locally advanced nonsmall cell lung cancer (NSCLC). J Thorac Oncol,2007,2(9): 831-837.
24 张频. 抗肿瘤新药伊立替康临床研究进展. 国外医学:肿瘤学分册,1998, 25(6): 344-346.
25 林克江,李玉艳,尤启冬,等. 喜树碱代谢活性产物 SN-38 类似物的抗肿瘤构效关系研究. 中国药科大学学报,2006,37(3): 218-221.
26 夏晖,王璇,王之彝,等. 1例伊立替康致迟发性腹泻的病例分析.中国药师,2016,(3): 543-545.
27 Ahn S K,Choi N S,Jeong B S,et al. Practical synthesis of (S)-7-(2-isopropylamino) ethylcamptothecin hydrochloride,potent topoisomerase I inhibitor. J Heterocycl Chem,2000,37(5): 1141-1144.
28 Lee H P,Seo S S,Ryu S Y,et al. Phase II evaluation of CKD-602,a camptothecin analog,administered on a 5-day schedule to patients with platinum-sensitive or-resistant ovarian cancer. Gynecol Oncol,2008,109(3): 359-363.
29 Lee D H,Kim S W,Bae K S,et al. A phase I and pharmacologic study of belotecan in combination with cisplatin in patients with previously untreated extensive-stage disease small cell lung cancer. Clin Cancer Res,2007,13(20): 6182-6186.
30 郭茜如,董仰曾. 喜树碱抑制滤过泡瘢痕化的临床研究. 眼科研究,1995, 13(4): 262-264.
31 Liu Y Q,Liu Z L,Tian X,et al. Anti-HSV activity of camptothecin analogues. Nat Prod Res,2010,24(6): 509-514.
32 Li S,Zhang Z,Cain A,et al. Antifungal activity of camptothecin,trifolin,and hyperoside isolated from Camptotheca acuminata. J Agric Food,2005,53(1):32-37.
33 Stork G,Schultz A G. Total synthesis of dl-camptothecin. J Am Chem,1971,93(16): 4074-4075.
34 Tang C,Rapoport H. Total synthesis of (+)-camptothecin. J Am Chem,1972,94(24): 8615-8616.
35 Liu F,Li C. Total synthesis of 14(S)-azacamptothecin. Org Biomol Chem,2014,12(4): 637-642.
36 雷英杰,王作全. 10-羟基喜树碱的制备及机理探讨. 陕西化工,1999,28(4): 10-11.
37 Wei C,Jiang Z,Tian S,et al. Highly facile approach to the formal total synthesis of camptothecin. Tetrahedron Lett,2013,54(34): 4515-4517.
38 Creaven P,Allen L. Renal clearance of camptothecin (NSC-100880): effect of urine volume. Cancer Chemotherapy Reports. Part 1,1973,57(2): 175.
39 Thomas C J,Rahier N J,Hecht S M. Camptothecin:current perspectives. Bioorg Med Chem,2004,12(7): 1585-1604.
40 Sawada S,Yokokura T,Miyasaka T. Synthesis of CPT-11 (Irinotecan Hydrochloride Trihydrate). Ann Ny Acad Sci,1996,803(1): 13-28.
41 Wall M E,Wani M C. Camptothecin and taxol: discovery to clinicthirteenth Bruce F. Cain Memorial Award Lecture. Cancer Res,1995,55(4): 753-760.
42 Tan H,Wang G,Li J,et al. Synthesis of novel 10-hydroxycamptothecin derivatives utilizing topotecan hydrochloride as ortho-quinonemethide precursor. Bioorg Med Chem,2015,23(1): 118-25.
43 Cao Z,Harris N,Kozielski A,et al. Alkyl esters of camptothecin and 9-nitrocamptothecin: synthesis,in vitro pharmacokinetics,toxicity,and antitumor activity. J Med Chem,1998,41(1): 31-37.
44 蔡俊超,殷孟光,闵爱珠,等. dl-10-羟基喜树碱及dl-10-甲氧基喜树碱的全合成. 化学学报,1981,39(2): 171-178.
45 Shen W,Coburn C A,Bornmann W G,et al. Concise total syntheses of dl-camptothecin and related anticancer drugs. J Org Chem,1993,58(3): 611-617.
46 Sugimori M,Ejima A,Ohsuki S,et al. Synthesis and Antitumor Activity of Ring A-and F-Modified Hexacyclic Camptothecin Analogues 1. J Med Chem,1998,41(13): 2308-2318.
47 Boyd G,Smyth J F,Jodrell D I,et al. High-performance liquid chromatographic technique for the simultaneous determination of lactone and hydroxy acid forms of camptothecin and SN-38 in tissue culture media and cancer cells. Anal Chem,2001,297(1): 15-24.
48 Wang L,Xie S,Ma L,et al. Design,synthesis and biological evaluation of novel homocamptothecin analogues as potent antitumor agents. Bioorg Med Chem,2015,23(9): 1950-62.
49 Hautefaye P,Cimetière B,Pierré A,et al. Synthesis and pharmacological evaluation of novel non-lactone analogues of camptothecin. Bioorg Med Chem Lett,2003,13(16): 2731-2735.
50 Kohn K W,Pommier Y. Molecular and biological determinants of the cytotoxic actions of camptothecins: perspective for the development of new topoisomerase I inhibitors. Ann Ny Acad Sci,2000,922(1): 11-26.
51 Xiao X,Antony S,Pommier Y,et al.Total synthesis and biological evaluation of 22-hydroxyacuminatine. J Med Chem,2006,49(4): 1408-1412.
52 Ruan J,Zhang J,Li M,et al. Dependence of UV-B-induced camptothecin production on nitrate reductase-mediated nitric oxide signaling in Camptotheca acuminata suspension cell cultures. Plant Cell Tiss Org,2014,118(2): 269-278.
53 Lorence A,Nessler C L. Camptothecin,over four decades of surprising findings. Phytochemistry,2004,65(20): 2735-2749.
54 Ya-ut P,Chareonsap P,Sukrong S. Micropropagation and hairy root culture of Ophiorrhiza alata Craib for camptothecin production. Biotechnol Lett,2011,33(12): 2519-2526.
55 Pi Y,Jiang K,Hou R,et al. Examination of camptothecin and 10-hydroxycamptothecin in Camptotheca acuminata plant and cell culture,and the affected yields under several cell culture treatments. Biocell,2010,34(3): 139-143.
56 Shweta S,Zuehlke S,Ramesha B,et al.Endophytic fungal strains of Fusarium solani,from Apodytes dimidiata E. Mey. ex Arn (Icacinaceae) produce camptothecin,10-hydroxycamptothecin and 9-methoxycamptothecin. Phytochemistry,2010,71(1): 117-122.
57 Kusari S,Zü hlke S,Spiteller M. An endophytic fungus from Camptotheca acuminata that produces camptothecin and analogues. J Nat Prod,2009,72(1): 2-7.
58 Pu X,Qu X,Chen F,Bao J,et al. Camptothecin-producing endophytic fungus Trichoderma atroviride LY357:isolation,identification,and fermentation conditions optimization for camptothecin production. Appl Microbiol Biot,2013,97(21): 9365-9375.
59 黄毅,刘松青,林彩,等. 羟基喜树碱脂自制质体注射液与市售注射液家兔体内药代动力学行为的比较. 第三军医大学学报,2004,26(6): 517-519.
60 杨时成,朱家壁. 喜树碱固体脂质纳米粒的研究. 药学学报,1999,34(2): 146-150.
Research Progress and Development of Camptothecin Derivatives
Chen Menghan,Yang Minghua,Kong Lingyi
(College of Traditional Chinese Medicine,China Pharmaceutical University,Nanjing 210009,China)
As the third anticancer-drug from plants in the world,camptothecin is an effective monomer composition isolated from the traditional herb,Camptotheca Acuminata,which is planted only in China with its derivatives commonly used in clinical as broad spectrum anticancer drugs. Since its discovery in 1970s,many researches had emerged,mainly focusing on the modification,structure activity relationship and pharmacological activity of camptothecin. These great successes pressed ahead the development of a series of camptothecin-like drugs,such as Topotecan,Irinotecan and Belotecan. Nowdays,studies of camptothecins are still the hotspots,which also broaden to the cultivation of tissue and the development of new forms. As the representative of drugs origined from effective monomer compositions of Chinese materia medica (CMM),the process of camptothecin research is worth the learning of CMM’s drug discovery. This review summerized the history,ongoing development of camptothecins and the drug development of CMM,in hope of retrospecting with readers and bringing some new thoughts to them.
Camptothecin,effective monomer compositions,research progress
10.11842/wst.2016.05.002
R284
A
(责任编辑:马雅静,责任译审:朱黎婷)
2016-05-02
修回日期:2016-05-11
* 基于中药有效单体成分的新药研究系列讨论-II。
** 通讯作者:孔令义,本刊编委,教授,博士生导师,主要研究方向:中药和天然药物活性成分研究及在此基础上的新药开发。
