翼茧形藻培养基的筛选及优化
2016-03-04宋邦兴陈国华杨金华许炳亮
宋邦兴,王 珺,2,3,陈国华,2,杨金华,许炳亮
(1.海南大学海洋学院,海口 570228;2.热带生物资源教育部重点实验室,海南大学,海口 570228;3.海南大学海洋生物实验教学中心,海口 570228)
翼茧形藻培养基的筛选及优化
宋邦兴1,王 珺1,2,3,陈国华1,2,杨金华1,许炳亮1
(1.海南大学海洋学院,海口 570228;2.热带生物资源教育部重点实验室,海南大学,海口 570228;3.海南大学海洋生物实验教学中心,海口 570228)
在“宁波大学3#培养液”配方的基础上,通过单因子和正交试验,研究了氮、磷、铁、硅、维生素B1和B12等主要营养元素对翼茧形藻(Amphiprora alata)生长繁殖的影响。获得了以天然海水为基础的翼茧形藻优化培养基:40 mg·L-1NaNO3-N、8 mg·L-1KH2PO4-P、0.5 mg·L-1FeSO4-Fe、20 mg·L-1Na2SiO3-Si、0.1 mg·L-1Vitamin B1和0.05 mg·L-1Vitamin B12。用优化培养基与“宁波大学3#培养液”对比培养翼茧形藻,结果表明,培养第2~7天,优化培养基比“宁波大学3#培养液”收获翼茧形藻的生物量(细胞密度)每天分别提高了1.45、1.83、2.12、2.26、2.32和2.40倍。
翼茧形藻;培养基;优化;生长
翼茧形藻(Amphiprora alata)是一种褐色的海洋底栖硅藻,属羽纹硅藻纲(Pennnatae),有壳缝硅藻目(Raphidinales),舟形藻科(Naviculaceae kützing),茧形藻属。有关茧形藻的研究很少,JUAN等[1]研究了8种底栖硅藻为饵料,分析不同饵料对红鲍鱼(Haliotis rufescens)后期幼体生长的影响,结果发现同时投喂茧形藻(Amphiprorasp.)和菱形藻(Nitzschiasp.)的红鲍鱼后期幼体生长最快。胡蓓娟等[2]研究了8种微藻的保存方法,提出茧形藻较适合弱光低温保存,同时指出无论是其生态分类、生长优化还是大分子化合物的提取都鲜有相关研究性报道,这种藻类更具有研究的潜力。由于翼茧形藻含有丰富的蛋白质、脂肪酸等营养物质,是水产动物苗种的优良饵料。为了更好地研究利用翼茧形藻,首先要获得大量的藻体,因而如何实现高密度规模培养是生产性应用关键,合适的培养基是实现翼茧形藻高密度培养的重要因素。王珺等[3]曾研究了翼茧形藻的培养条件,得出培养该藻最佳的生态因子(温度、光照、盐度和pH值)。本文研究了不同种类及浓度的氮、磷、铁、硅、维生素B1及B12等主要营养元素对翼茧形藻生长繁殖的影响,优化翼茧形藻的培养基配方,以期为翼茧形藻的大规模培养提供基础性资料。
1 材料和方法
1.1 实验材料
翼茧形藻取自海南大学海洋学院藻种室。该硅藻取自海南省文昌市翁田镇海区,经微吸管分离、纯化得到的新藻株。藻体单个生活,壳环面双凹的椭圆形,长60~160μm,宽36~60μm。中央凹缢处宽度26~38μm;壳面棱形,两端渐大,至顶端圆钝,色素体大,1个,呈板状[4]。实验前接种到1 000 mL三角烧瓶中进行活化纯培养,不充气,每天摇动2~3次,取指数生长期的藻液进行实验。
1.2 方法
1.2.1 藻体培养条件
培养用的海水取自海口白沙门海区,经黑暗沉淀,再经脱脂棉过滤、煮沸、自然冷却后使用。海水pH 8.03,盐度30。实验培养瓶选用250 mL齿轮牌三角瓶,经洗液洗涤、晾干,130℃恒温消毒2 h。除温度实验外,其余试验组温度控制在(26±1)℃,光照强度3 000 lx,光周期为全天日光灯照明,培养时间为4~5 d。每天摇瓶3次,并随机交换位置,以减少照度差异。
本实验的培养液均采用添加10 mg·L-1Na2SiO3的“宁波大学3#培养液”配方[5]。
1.2.2 实验设计
1.2.2.1 单因子实验
根据“宁波大学3#培养液”配方,分别配制缺氮、缺磷、缺铁、缺硅培养液。氮源种类及质量浓度的筛选:分别以硫酸铵[(NH4)2SO4]、硝酸钠(NaNO3)、尿素(NH2CONH2)为营养盐,其氮的质量浓度梯度分别为0、10、20、30、40、50、60 mg· L-1;磷源种类及质量浓度的筛选:分别以磷酸二氢钾(KH2PO4)、磷酸二氢钠(NaH2PO4)为营养盐,磷的质量浓度梯度分别为0、1、2、3、4、5、6、7、8、9、10 mg·L-1;铁源种类及质量浓度的筛选:以硫酸亚铁(FeSO4)及柠檬酸铁(C6H5O7Fe)为铁盐,设置铁质量浓度梯度为0、0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1.0 mg·L-1;硅盐质量浓度的筛选:以硅酸钠(Na2SiO3)为营养盐,设置硅质量浓度梯度为0、5、10、15、20、25、30 mg· L-1。各实验均设置2个水平实验。
1.2.2.2 维生素B1和B12正交实验
针对微藻对维生素B1(VB1)和维生素B12(VB12)的需求,分别以4个浓度梯度水平,选用L16(42)设计2因子4水平的正交实验(表1)。
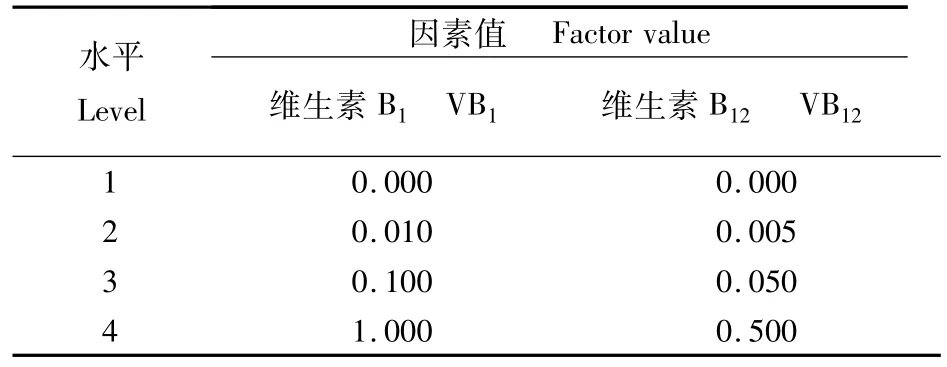
表1 正交实验因素水平表Tab.1 Factors and levels of orthogonal experiments(mg·L-1)
1.2.2.3 培养基对比实验
选取单因子实验中翼茧形藻生长繁殖最优的氮、磷、铁、硅等营养盐种类及质量浓度和正交实验中VB1和VB12的最佳配比,作为优化后的培养液配方;对照组培养液采用添加10 mg·L-1Na2SiO3的“宁波大学3#培养液”配方,接种密度及培养条件一致,每天定时计数,共培养7 d,各实验均设计2个水平。
1.2.3 藻细胞计数
先做藻细胞密度与藻液光密度OD值(A420,不加藻种培养液为空白)的相关曲线。将实验用藻液稀释成5个相关浓度梯度,分别用722S可见分光光度计在420 nm处测定浓度组OD值,并用XB-K-25血球计数板分别计数藻细胞密度(甲醛固定,1 d完成计数,每瓶重复计数2次,取平均值),确定藻细胞密度与藻液OD值的线性关系;测定实验藻液的吸光值,根据藻细胞密度与OD值的线性关系换算出藻细胞密度。
1.2.4 比生长速率
藻细胞的比生长速率(K)由公式计算:

式中,N0:起始藻细胞密度;Nt:经过T时间培养后的藻细胞密度;T:培养时间(d)。
1.2.5 统计分析
运用Excel软件进行数据处理,并使用DPS数据处理系统进行数据分析。
2 结果与分析
2.1 单因子实验
2.1.1 氮
氮的单因子实验结果见图1,从图1可知,硝酸钠、硫酸铵和尿素均可作为氮源,最适合翼茧形藻生长的氮盐为硝酸钠,以40 mg·L-1的质量浓度为最佳。经单因素方差分析得知,3种氮盐对翼茧形藻生长的影响均极显著(P<0.01)。
2.1.2 磷
磷的单因子实验结果见图2,由图2可知,磷酸二氢钠和磷酸二氢钾均可做为翼茧形藻的磷盐,最适合生长的磷浓度为8~9 mg·L-1。经方差分析,不同浓度的磷盐对翼茧形藻的生长影响存在极显著差异(P<0.01)。

图1 氮盐及其浓度对翼茧形藻生长的影响Fig.1 Effects of different N concentrations on the grow th of Amphiprora alata
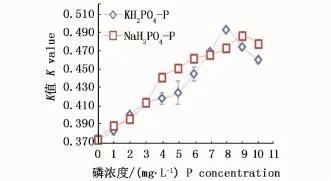
图2 磷盐及其浓度对翼茧形藻生长的影响Fig.2 Effects of different P concentrations on the grow th of Amphiprora alata
2.1.3 铁
铁的单因子实验结果见图3,由图3可知,硫酸亚铁和柠檬酸铁均可作为翼茧形藻的铁盐,最佳的铁浓度为0.5~0.6 mg·L-1,当铁浓度大于0.6 mg·L-1时,抑制翼茧形藻的生长。经单因素方差分析得知,铁盐对翼茧形藻的生长有显著影响(P<0.05)。
2.1.4 硅
硅的单因子实验结果见图4,从图4可知,在Na2SiO3-Si的质量浓度为5~30 mg·L-1的范围内均可促进翼茧形藻的生长,其最适生长的质量浓度范围为10~25 mg·L-1,经单因素方差分析得知,Na2SiO3对翼茧形藻生长的影响极显著(P<0.01)。
2.2 维生素B1和B12正交实验
正交实验结果见表2,从表2可知,3号组合培养翼茧形藻的效果最好,即VB1和VB12最佳的质量浓度分别为0.100、0.050 mg·L-1。对实验结果进行方差分析(表3),由表3可知,维生素B1、B12单独使用对翼茧形藻的生长无显著影响,而维生素B1、B12混合作用对翼茧形藻生长有极显著影响(P<0.01)。

图3 铁盐及其浓度对翼茧形藻生长的影响Fig.3 Effects of different Fe concentrations on the grow th of Amphiprora alata

图4 硅浓度对翼茧形藻生长的影响Fig.4 Effects of different Si concentrations on the grow th of Am phiprora alata

表2 维生素的正交实验结果Tab.2 Orthogonal experimental results of vitam ins
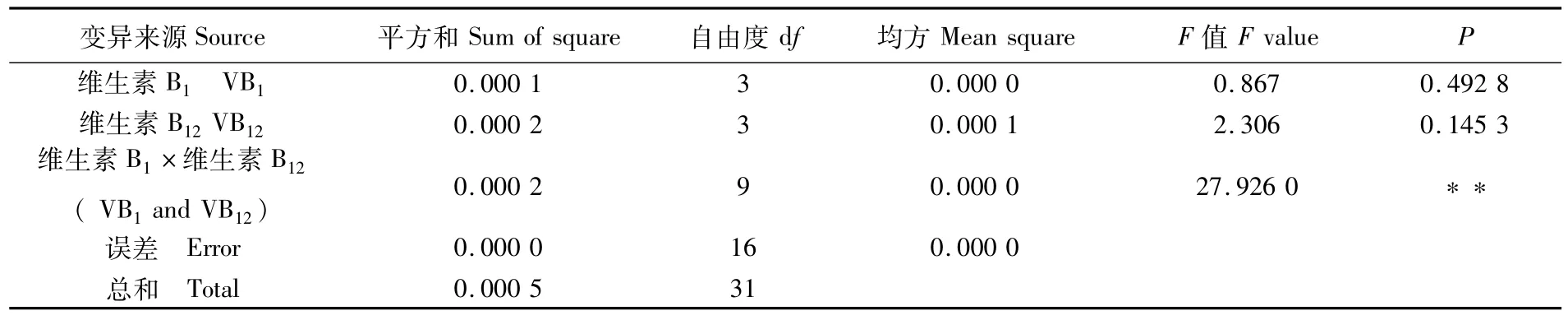
表3 正交实验方差分析结果Tab.3 Variance analysis of orthogonal experim ent
2.3 优化培养基的验证
为了验证优化培养基的效果,将优化培养基与“宁波大学3#培养液”进行了对比培养实验,每天定时测定藻细胞密度,共培养7天,设置2个平行组,取平均值。培养结果见图5。由图5可知,接种第1天,翼茧形藻在2种培养基中的生长速率差别不大,优化培养基稍微优于“宁波大学3#培养液”,而从第2天开始至第7天,优化培养基的藻细胞密度每天分别为“宁波大学3#培养液”的1.45、1.83、2.12、2.26、2.32、2.40倍,可见优化培养基的培养效果极显著优于“宁波大学3#培养液”配方(P<0.01)。
3 讨论
不同种类的微藻,对营养盐的需求不一样,即每一种微藻都有适合各自生长繁殖的培养基,培养基中营养盐的种类和浓度影响着微藻的生长率、营养成分及终产量,因此,选择合适的培养基是获得最佳培养效果的前提条件。本实验以常用的“宁波大学3#培养液”配方为基础,通过单因子及正交实验,对翼茧形藻培养基进行了优化,得到了优化培养基。
3.1 氮盐
氮被称为生命的元素,在植物体中,氮是蛋白质、核酸、磷脂的主要成分,而这三者又是原生质、细胞核和生物膜的重要组成部分,它们在生命活动中有着特殊作用[6]。通常认为,氮和磷是淡水和海洋生态系统中限制藻类生长的最普通的营养盐[7-8]。已有实验表明,不同种类的单细胞藻能利用不同种类的氮源,对氮盐的质量浓度要求也不一样[9]。本实验结果表明,硝酸钠、尿素、硫酸铵均能被翼茧形藻利用。在实验设置的质量浓度范围内,NaNO3-N最佳的质量浓度为40 mg·L-1,质量浓度范围在10~40 mg·L-1时,翼茧形藻的K值随着氮盐质量浓度的升高而升高,质量浓度范围在40~60 mg·L-1时,翼茧形藻的K值随着氮盐质量浓度的升高而降低;NH2CONH2-N最佳的质量浓度为40 mg·L-1,质量浓度范围在0~40 mg·L-1时,翼茧形藻的K值随着氮盐质量浓度的升高而升高,而质量浓度范围在40~60 mg·L-1时,翼茧形藻的生长速率随着氮质量浓度的升高而降低;(NH4)2SO4-N的最佳质量浓度为20 mg·L-1,质量浓度范围在0~20 mg·L-1时,翼茧形藻的K值随着氮盐质量浓度的升高而升高,而质量浓度范围在20~60 mg·L-1时,翼茧形藻的K值随着氨氮质量浓度的升高而降低,这是由于在单细胞藻类的培养过程中,CO2被藻类吸收而导致培养液的pH值升高,从而使NH4+易变为NH3,并使藻类受到毒害的缘故。有研究表明,直链藻(Melosioasp.)最佳氮盐质量浓度为20~40 mg·L-1[10];小环藻(Cyclotella caspiaunder)最佳的氮盐质量浓度为30 mg·L-1[11];日本星杆藻(Asterionella japonica)最佳的(NH2)2CO-N质量浓度为20 mg ·L-1[12]。可见,翼茧形藻对氮元素的需求量相对较大。
3.2 磷盐
磷元素是藻类叶绿体双层膜、DNA与ATP的构成成分,它在光合作用的物质转化中起着重要的作用,是藻类营养中仅次于氮的元素。实验结果表明,磷是翼茧形藻的一个重要因子,2种不同磷盐对翼茧形藻生长繁殖的影响差异不大,其中KH2PO4-P的最佳质量浓度为8 mg·L-1,NaH2PO4-P以9 mg·L-1为最佳。KH2PO4在P浓度范围为1~8 mg·L-1时随着P浓度增高,K值逐渐增大,而在P浓度范围为8~10 mg·L-1时,随着其质量浓度增加,K值逐渐减小;NaH2PO4-P在P浓度范围为1~9 mg·L-1时随着浓度增高,K值逐渐增大,而在P浓度范围为9~10 mg·L-1时,随着其质量浓度的增加,该藻的K值越来越小,说明高质量浓度的磷盐对翼茧形藻的生长有抑制作用。有研究表明,直链藻最佳的KH2PO4-P浓度为1 mg·L-1[10];小环藻最佳的KH2PO4-P浓度为1 mg·L-1[11];日本星杆藻最佳的NaH2PO4-P浓度为0.5 mg·L-1[12];牟氏角毛藻(Cheatocerosmuelleri)最佳KH2PO-P浓度为3 mg·L-1[13]。可见,翼茧形藻对磷元素的需求量相对较大。

图5 翼茧形藻在不同培养基中的生长速率比较Fig.5 Grow th rates of Amphiprora alata in differentmedia
3.3 铁盐
铁是藻类细胞内某些氧化-还原的载体和辅酶的组成成分,缺铁会影响多种代谢过程,甚至会抑制藻细胞的生长[14]。实验结果表明,加铁试验组的K值明显比对照组的K值大,这说明铁是翼茧形藻生长繁殖的重要微量元素。其中FeSO4的效果稍优于FeC6H5O7。FeSO4-Fe质量浓度范围在0~0.5 mg·L-1时,随着其质量浓度的增加K值呈上升趋势,以质量浓度0.5 mg· L-1为最佳;FeC6H5O7-Fe质量浓度范围在0~0.6 mg·L-1时,随着其质量浓度的增加K值呈上升趋势,以质量浓度0.6 mg·L-1为最佳,当浓度大于0.7 mg·L-1时,抑制翼茧形藻的生长。有研究表明,小环藻最佳的铁盐质量浓度为0.1 mg·L-1[11];牟氏角毛藻最佳铁盐质量浓度为1 mg·L-1[13];四爿藻(Tetraselmis chui)最佳的铁盐质量浓度为0.4 mg·L-1[15]。
3.4 硅盐
硅是硅藻生长繁殖的必需营养元素,它除了作为细胞壁结构成分外,还参与蛋白质、光合色素、DNA合成及细胞分裂等多种代谢和生长过程[16]。实验结果表明,加硅试验组藻细胞K值均显著大于缺硅对照组的藻细胞K值,翼茧形藻在Na2SiO3-Si质量浓度为0~30 mg·L-1的范围内均能生长繁殖,质量浓度在0~5 mg·L-1的范围时,随着其质量浓度的增加K值呈直线上升,质量浓度在5~20 mg·L-1的范围时,随着其质量浓度的增加K值呈缓慢上升趋势,质量浓度为20 mg·L-1时,K值达最大;质量浓度在20~30 mg·L-1的范围时,随着其质量浓度的增加,藻细胞的K值越来越小,但仍显著高于对照组。硅盐质量浓度范围在5~30 mg·L-1时均可促进翼茧形藻的生长,其最适生长的质量浓度为20 mg·L-1,经单因素方差分析得知,Na2SiO3对翼茧形藻生长的影响极显著(P<0.01)。直链藻最佳的硅盐质量浓度25 mg·L-1[10];小环藻最佳的硅盐质量浓度为25 mg·L-1[11];日本星杆藻最佳的硅盐质量浓度为10 mg·L-1[12]。
3.5 维生素B1、B12正交实验
已有研究表明,维生素对微藻生长的影响因种类而异。王正方等[17]认为VB1、VB12和复合维生素是海洋原甲藻增殖的重要因素;胡桂坤等[18]指出VB1促小球藻分裂作用极显著,VB12和VH无显著影响。本实验中维生素B1、B12对翼茧形藻生长影响的研究结果表明,维生素B1、B12单独使用对翼茧形藻的生长无显著影响,而维生素B1、B12混合使用对翼茧形藻的生长有极显著影响(P<0.01)。3号组合培养翼茧形藻的效果最好,即维生素B1、维生素B12最佳的质量浓度分别为0.100、0.050 mg·L-1。
3.6 优化培养基的验证
优化培养基与“宁波大学3#培养液”的对比培养实验结果表明,翼茧形藻在优化培养基中显示出较大的生长优势,从接种的第2天至第7天,优化培养基培养的藻细胞密度均极显著优于“宁波大学3#培养液”培养的藻细胞密度(P<0.01)。
4 小结
通过本实验可知,翼茧形藻在人工培养时对各种营养盐的需求如下:1)硝酸钠、尿素和硫酸铵均可作为氮盐,最适翼茧形藻生长的氮盐为硝酸钠,当培养液中氮质量浓度低于20 mg·L-1时硫酸铵培养效果最好,3种氮盐对翼茧形藻生长的影响均极显著;磷酸二氢钾和磷酸二氢钠均可作为磷盐,培养效果相差不大,2种磷盐对翼茧形藻生长均存在极显著影响;柠檬酸铁和硫酸亚铁均可作为翼茧形藻的铁盐,2种铁盐对翼茧形藻生长均存在显著影响;硅在翼茧形藻的培养中是必须的,培养液中加入硅盐后能极显著地促进翼茧形藻的生长;维生素B1、B12混合使用对翼茧形藻的生长有极显著影响;优化培养基的培养效果极显著优于“宁波大学3#培养液”的培养效果。2)翼茧形藻的优化培养基:在天然海水中添加40 mg·L-1NaNO3-N、8 mg·L-1KH2PO4-P、0.5 mg ·L-1FeSO4-Fe、20 mg·L-1Na2SiO3-Si、0.1 mg ·L-1VB1和0.05 mg·L-1VB12。
[1] JUAN G CR,MAIADEL PSS,MARíA TV,etal.Effect of eight benthic diatoms as feed on the growth of red abalone(Haliotis rufescens)postlarvae[J].Journal of Applied Phycology,2009,21(4):387-393.
[2] 胡蓓娟,王雪青,吴晶晶,等.8种微藻的保存方法研究[J].海洋湖沼通报,2008(1):58-65.
HU B J,WANG X Q,WU J J,et al.The study on preservation methods of eight kinds of microalgae[J].Transactions of Oceanology and Limnology,2008(1):58-65.
[3] 王 珺,符丽梅,陈国华,等.翼茧形藻培养条件的研究[J].海洋渔业,2012,34(2):235-240.
WANG J,FU L M,CHEN G H,et al.The culture conditions ofAmphiproraalata[J].Marine Fisheries,2012,34(2):235-240.
[4] 钱树本,刘东艳,孙军.海藻学[M].青岛:中国海洋大学出版社,2005:384-397.
QIAN S B,LIU D Y,SUN J.Marine Phycology[M].Qingdao:China Ocean University Press,2005:384-397.
[5] 成永旭.生物饵料培养学(第二版)[M].北京:中国农业出版社,2005:70-75.
CHENG Y X.Culture of Living Feeds(The second edition)[M].Beijing:China Agriculture Press,2005:70-75.
[6] 王 忠.植物生理学[M].北京:中国农业出版社,2000:80-90.WANG Z.Plant Physiology[M].Beijing:China Agriculture Press,2000:80-90.
[7] LEAN D R S,PICK F R.Photosynthetic response of lake plankton to nutrient enrichment:A test for nutrient limitation[J].Limnology and Oceanography,1981,26(6):1001-1019.
[8] WYNNE D,BERMAN T.Hot water extractable phosphorus-an indicator of nutritional status ofPeridinium cinctum(Dinophyceae)from Lake Kinneret(Israel)[J].Journal of Phycology,1980,16(1):40-46.
[9] 马志珍.氮源及其浓度对三角褐指藻生长的影响[J].海洋湖沼通报,1983(2):45-50.MA Z Z.Effects of nitrogen sources and their different concentrations on the growth ofPhaeodactylum tricornutumBohlin[J].Transactions of Oceanology and Limnology,1983(2):45-50.
[10] 王 珺,王爱雯,陈国华,等.几种主要营养元素对直链藻生长速率的影响[J].海南大学学报(自然科学版),2013,31(3):218-223.
WANG J,WANG A W,CHEN G H,et al.Effects of several main nutrient elements on growth rates ofMelosirasp.[J].Natural Science Journal of Hainan University,2013,31(3):218-223.
[11] 王 珺,赖秋明,姚发壮,等.人工培养条件下环境因子对微小小环藻生长繁殖的影响[J].海洋渔业,2013,35(2):195-201.
WANG J,LAI Q M,YAO F Z,et al.Effects of ecological factors on the growth ofCyclotella caspiaundercultivated conditions[J].Marine Fisheries,2013,35(2):195-201.
[12] 王 珺,王永强,陈国华,等.生态和营养条件对日本星杆藻生长的影响[J].海洋渔业,2014,36(4):329-334.
WANG J,WANG Y Q,CHEN G H,et al.Effects of ecological and nutritional factors on growth ofAsterionella japonica[J].Marine Fisheries,2014,36(4):329-334.
[13] 王扬才.氮磷铁营养盐浓度对牟氏角毛藻生长的影响[J].海洋渔业,2006,28(2):173-176.
WANG Y C.Effects of nitrogen,phosphorus and iron on the growth ofChaetoceros muelleri[J].Marine Fisheries,2006,28(2):173-176.
[14] OPKELLEY JC.Inorganic Nutrients[M].London:Black Well Scientific Publications,1974:610-633.
[15] 王 珺,王永波,陈国华,等.四爿藻培养条件的研究[J].海洋渔业,2008,30(2):189-194.WANG J,WANG Y B,CHEN G H,et al.Studies on the culture conditions of Tetraselmis chui[J].Marine Fisheries,2008,30(2):189-194.
[16] WERNER D.Silicate Metabolism[M].London:Black Well Scientific Publications,1977:110-149.
[17] 王正方,张 庆,卢 勇,等.氮、磷、维生素和微量元素对赤潮生物海洋原甲藻的增殖效应[J].东海海洋,1996,14(3):33-38.
WANG Z F,ZHANG Q,LU Y,et al.The effects of nutrients,vitamins and trace metalson the growth of the red tide organismProrocentrum micans[J].Dongahi Marine Science,1996,14(3):33-38.
[18] 胡桂坤,张青田,庞金鑫.三种维生素对小球藻的增殖效应研究[J].海湖盐与化工,2005,34(4):22-25.
HU G K,ZHANG Q T,PANG JX,et al.Effects of three kinds of vitamin on growth ofChlorella[J].Sealake Saltand Chemical Industry,2005,34(4):22-25.
Screening and optim izing of the culturemedium of Amphiprora alata
SONG Bang-xing1,WANG Jun1,2,3,CHEN Guo-hua1,2,3,YANG Jin-hua1,XU Bing-liang1
(1.Ocean College,Hainan University,Haikou570228,China;2.Key Laboratory of Tropic Biological Resources,Ministry of Education,Haikou570228,China;3.Experimental Teaching Center of Marine Biology,Haikou570228,China)
Based on the Ningbo 3#medium,a one-factor experiment and an orthogonal experiment were performed to analyze the effects of different nutrient sources and concentrations on the growth ofAmphiprora alata.The nutrient sources were(NH4)2SO4,NaNO3,and(NH2)2CO for nitrogen(N),KH2PO4and NaH2PO4for phosphorus(P),FeSO4and FeC6H5O7for iron(Fe),Na2SiO3for silicon(Si),VB1and VB12.The results showed that the optimum culturemedium based in naturemarine water was formulated as follows:40 mg·L-1NaNO3-N,8 mg·L-1KH2PO4-P,0.5 mg·L-1FeSO4-Fe,20 mg·L-1Na2SiO3-Si,0.1 mg ·L-1Vitamin B1and 0.05 mg·L-1Vitamin B12.The optimum culture medium was compared with the Ningbo 3#culture medium,the results showed that this optimized medium could increase cell biomass productivity.Cultured from the second to the seventh day,the cell biomass ofAmphiprora alataincreased by 1.45,1.83,2.12,2.26,2.32 and 2.40 times respectively.
Amphiprora alata;culturemedium;optimization;growth
Q 949.270.5
A
1004-2490(2016)03-0297-07
2015-12-28
海南省科技项目(ZDYF2016087);海南省重大科技项目(ZDZX2013009)
宋邦兴(1991-),男,海南文昌人,水产养殖专业大学本科生。E-mail:389956767@qq.com
王 珺,高级实验师。E-mail:72206wj@163.com
