原癌基因c-jun在毒胡萝卜素内酯诱导小鼠胚胎成纤维细胞凋亡中的作用
2016-03-04周方舟曹新冉任宏生楚玉峰王爱红
张 洁 周方舟 曹新冉 任宏生 楚玉峰 王爱红 董 波 赵 鹏
(山东大学附属省立医院营养科,山东 济南 250021)
原癌基因c-jun在毒胡萝卜素内酯诱导小鼠胚胎成纤维细胞凋亡中的作用
张洁周方舟1曹新冉1任宏生2楚玉峰2王爱红1董波1赵鹏1
(山东大学附属省立医院营养科,山东济南250021)
〔摘要〕目的探讨原癌基因c-jun在毒胡萝卜素内酯(TG)诱导的小鼠胚胎成纤维细胞凋亡中的作用及机制。方法应用TG处理野生型(c-jun+/+),基因敲除型(c-jun-/-)和基因重组型(c-jun Re)小鼠胚胎成纤维细胞后观察细胞生存率;流式细胞术(FACS)和DNA染色进行细胞凋亡分析;蛋白免疫印迹技术分析蛋白c-jun、caspase-12及内质网应激反应分子伴侣Grp78、 Gadd153和α-tubulin的表达;共聚焦显微镜观察内质网染色及形态。结果不同浓度TG处理3组细胞4 h后观察细胞生存率,TG在50 nmol/L及100 nmol/L时3组细胞生存率出现差异,c-jun+/+与c-jun-/-组较 c-jun Re组生存率减低(P<0.05);TG未处理与处理均未影响c-jun蛋白的表达,c-jun-/-无c-jun蛋白表达,c-jun Re高表达c-jun蛋白;FACS与DNA染色结果显示,TG处理后c-jun-/-组较c-jun Re组DNA含量增高(P<0.05),并在c-jun-/-组出现典型的凋亡细胞亚二倍体DNA;荧光显微镜下观察细胞DAPI染色,与c-jun Re组比较c-jun-/-组DNA染色弱且模糊紊乱;在c-jun+/+与 c-jun-/-组中12 h比24 h caspase-12蛋白表达低(P<0.05),与c-jun+/+组比较,c-jun-/-组caspase-12蛋白表达明显增高(P<0.05),而在c-jun Re组几乎无caspase-12蛋白表达;经TG处理后,内质网应激反应分子伴侣Grp78和Gadd153,c-jun Re组此两种标识物的表达明显低于其在c-jun-/-组中的表达,并发现了内质网构造在两种细胞中的不同样式,c-jun Re组相比c-jun-/-组内质网结构更加完整丰富宽广。结论TG可以引起小鼠成纤维细胞出现细胞凋亡。c-jun基因表达的不同改变了细胞凋亡的程度,这种改变是通过细胞对内质网应激反应的介导。c-jun基因的表达在TG诱导的小鼠成纤维细胞凋亡中起保护作用。
〔关键词〕c-jun基因;毒胡萝卜素内酯;内质网应激;细胞凋亡
1心内科2ICU
第一作者:张洁(1985-),女,硕士,主治医师,主要从事心脏病的临床与基础研究。
c-jun是一种核内原癌基因,c-jun氨基末端激酶(JNK)的活化是通过c-jun氨基末端残基磷酸化实现的,一旦被激活,胞质中的JNK移位到细胞核中〔1〕。激活的JNK可进一步使核内c-jun等转录因子活性增强,主要以c-jun为底物并提高激活蛋白(AP)-1的转录活性。内质网应激是调节细胞生存和死亡的重要过程,内质网中的分子伴侣提供有利于蛋白质折叠的特殊环境。起主导作用的内质网伴侣结合蛋白/葡萄糖相关蛋白质78 kD蛋白(BiP/Grp78)在储存内质网Ca2+中起着重要作用,各种刺激因子如毒胡萝卜素内酯(TG)、肌浆/内质网Ca2+/ATP酶抑制剂促进有效的未折叠蛋白质应答(UPR)〔2〕发生时,内质网激活某些UPR靶基因,如促凋亡基因生长停滞DNA损伤基因(Gadd153)的表达〔3〕。本研究应用c-jun基因敲除的小鼠胚胎成纤维细胞(c-jun-/-)、c-jun重组表达细胞(c-jun Re)和野生型小鼠成纤维细胞(c-jun+/+),探讨内质网应激的改变,明确原癌基因c-jun在TG诱导的细胞凋亡中的作用及机制。
1材料与方法
1.1细胞培养处理和存活率检测c-jun-/-细胞和c-jun Re细胞由美国Michael Karin博士的实验室提供,c-jun+/+细胞由中国典型培养物保藏中心(CCTCC)提供。培养基为加入了10%小牛血清(Life Technologies.Inc)的DulBecco改良Eagle培养基。利用台酚蓝染料排除法评估细胞存活率。
1.2流式细胞术(FACS)和DNA染色进行细胞凋亡分析小鼠成纤维细胞从TG处理24 h后的60 mm组织培养皿中取出。上清液收集在15 ml锥形管中,用0.05%的胰蛋白酶对贴壁细胞处理10 min使其分散开,然后用血清培养基终止消化。将两种成分混合,2 500 r/min离心5 min。再悬浮细胞,在4 ml 1%多聚甲醛磷酸缓冲盐水(PBS)中固定30 min,4℃再次离心,并再悬浮于1 ml PBS中。用血细胞计数器对细胞进行计数,确保在随后的每一步中细胞浓度为1×106个/ml。以0.1% 的Triton X-100 PBS在4℃条件下将细胞通透3 min。再次离心后,将细胞重新悬浮在DNA 染色溶液(50 mg/ml,碘化丙啶,PI)中30 min。应用FACScan系统完成细胞周期分析。
利用DAPI对DNA染色。用PBS冲洗细胞并用胰蛋白酶-EDTA消化。将约5万个细胞重悬浮在50 μl PBS中,然后将100 μl的22%牛血清白蛋白(BSA)溶液加入到样品中。将这种悬浮液放入CYTO离心机中以500 r/min离心5 min。室温下载玻片风干30 min后用PBS洗涤。在室温条件下用DAPI(200 μl 2.5 μg/ml PBS)处理30 min,然后用PBS洗涤,将样品存储在4℃避光环境中,利用荧光显微镜进行观察。
1.3内质网染色及共聚焦显微镜观察细胞在100 nmol/L Dioc6染料内质网荧光探针(Invitrogen,Carlsbad,CA)中孵育30 min,然后将载有细胞的共聚焦显微镜专用盖玻片转移到BioRad MRC-1024共聚焦显微镜(Hercules,CA),使用63×1.4数值孔径(N.A.)的物镜观察。内质网荧光探针在波长790 nm处由双光子激发,然后用特定的外部探测器在500~540 nm波长处进行荧光观察。
1.4蛋白免疫印迹分析用蛋白免疫印迹技术分析蛋白c-jun、caspase-12及内质网应激反应分子伴侣Grp78、 Gadd153和α-tubulin的表达。多克隆抗c-jun抗体及单克隆抗caspase-12抗体购自Cell Signaling公司(Beverly,MA),多克隆抗Grp78抗体及多克隆抗Gadd153 抗体和多克隆抗α-tubulin抗体购自Santa Cruz Biotechnology 公司(CA)。将小鼠成纤维细胞在冷PBS中洗涤2次后再在1 ml裂解缓冲液〔1%Triton X-100,20 mmol/L HEPES(pH7.4),50 mmol/L β-甘油磷酸盐,2 mmol/L EGTA,1 mmol/L DTT,10 mmol/L氟化钠,1 mmol/L原钒酸钠,10%甘油和蛋白酶抑制剂混合物〕中溶解。 将细胞裂解物在14 000 r/min离心10 min后澄清。用布拉德福德蛋白测定法定量蛋白浓度。通过电泳将蛋白标本在直或梯度的NuPAGE Bis-Tris凝胶(10或4%~12%)(Invitrogen,Carlsbad,CA)进行解析,然后转移到聚偏二氟乙烯膜(Millipore,Bedford,MA)上。用增强化学发光试剂检测免疫反应带(Amersham Biosciences,Piscataway,NJ)。用含50 mmol/L Tris-HCl(pH6.8),2%十二烷基硫酸钠(SDS)和0.1 mol/L β-巯基乙醇对印迹进行清除,然后重新标记,免疫反应带的浓度用扫描密度仪和酶标仪联合测量。
2结果
2.1不同浓度TG处理后细胞生存率及TG处理细胞后c-jun蛋白的表达应用不同浓度TG(0、10、50、100 nmol/L)处理c-jun+/+组、c-jun-/-组和c-jun Re组细胞4 h,发现TG在50及100 nmol/L浓度时3组细胞生存率出现差异,c-jun+/+与c-jun-/-组较 c-jun Re组生存率减低(图1A)。c-jun+/+、c-jun-/-和c-jun Re 3组细胞用TG(100 nmol/L)未处理与处理4 h后c-jun-/-细胞无c-jun蛋白表达,c-jun Re细胞高表达c-jun蛋白(图1B)。
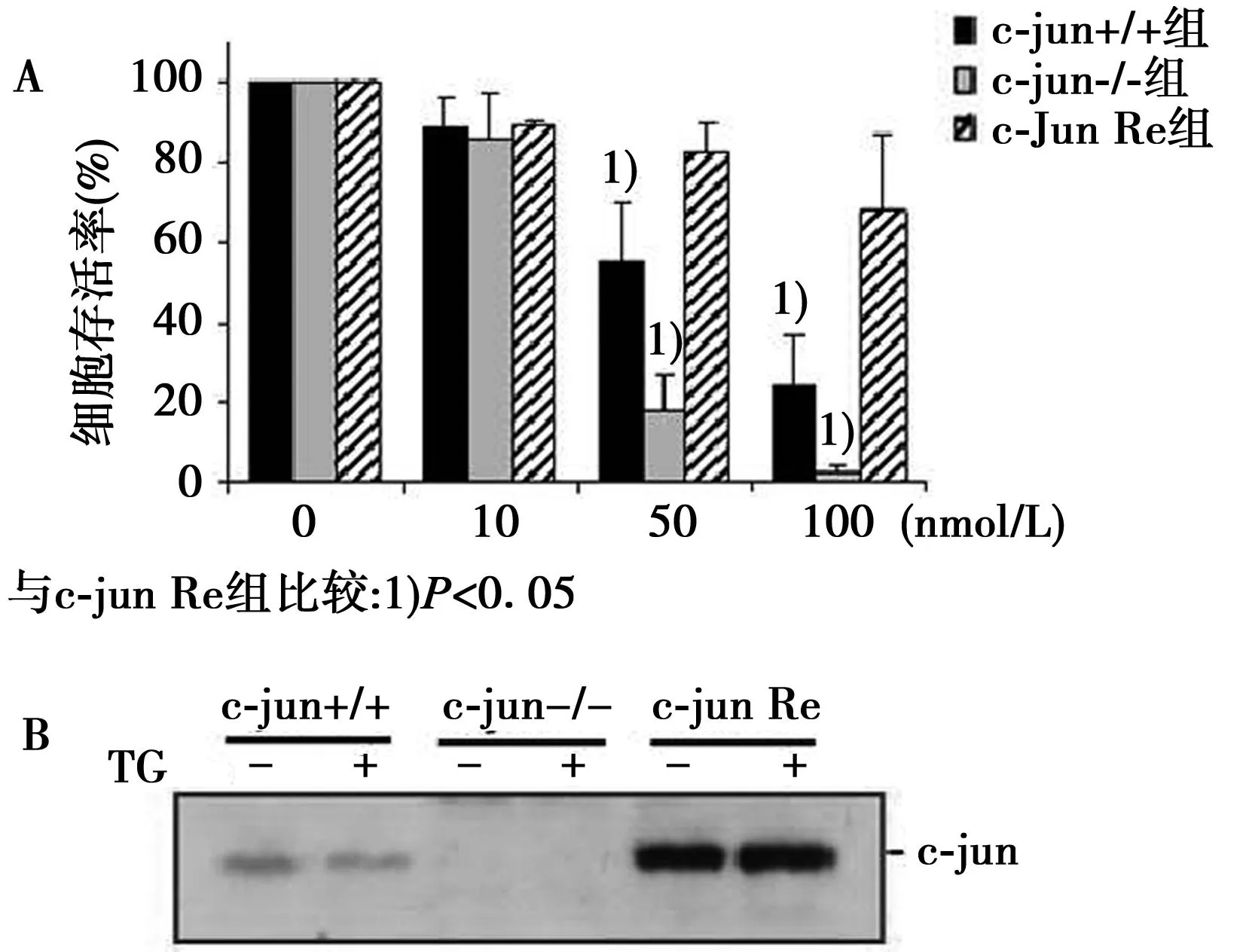
图1 不同浓度TG处理后细胞生存率(A)及TG处理与未处理3组小鼠成纤维细胞c-jun表达(B)
2.2TG处理细胞后检测细胞凋亡将c-jun-/-和c-jun Re两组细胞用TG(100 nmol/L)处理与未处理4 h,c-jun-/-组较c-jun Re组DNA含量增高(28.9%±3.6% vs.2.6%±0.3%,P<0.05),并在c-jun-/-组出现典型的凋亡细胞亚二倍体DNA(图2A)。荧光显微镜下观察细胞DAPI染色,与c-jun Re组比较c-jun-/-组DNA染色弱且模糊紊乱(图2B)。
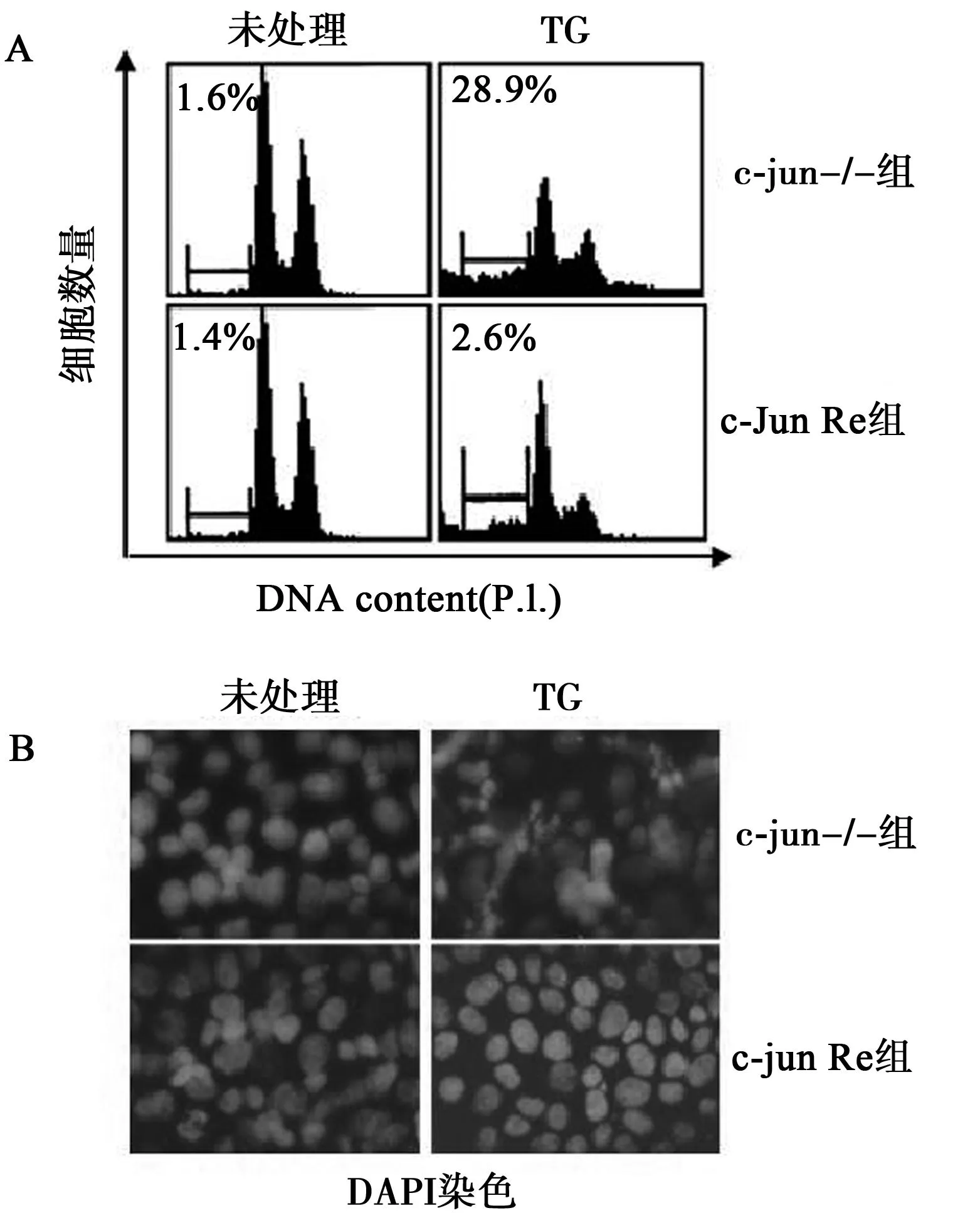
图2 TG处理c-jun-/-和c-jun Re细胞4 h后凋亡结果
2.3TG诱导细胞凋亡蛋白caspase-12的表达经TG(100 nmol/L)处理4 h后,c-jun+/+与 c-jun-/-组12 h比24 h caspase-12蛋白表达低(1.4±0.1 vs.2.2±0.3;2.8±0.3 vs.10.1±2.7;P<0.05),与c-jun+/+比较,c-jun-/-组caspase-12蛋白表达明显增高(P<0.05),而在c-jun Re组几乎无caspase-12蛋白表达。见图3。

图3 TG(100 nmol/L)诱导3组小鼠成纤维细胞caspase-12的表达
2.4TG处理细胞后内质网应激蛋白的表达及内质网形态改变经TG(100 nmol/L)处理后,c-jun Re细胞的Grp78和Gadd153表达明显低于c-jun-/-细胞(图4A)。内质网荧光探针检查发现内质网构造在两种细胞中不同,c-jun Re细胞相比c-jun-/-细胞内质网结构更加完整丰富宽广(图4B)。
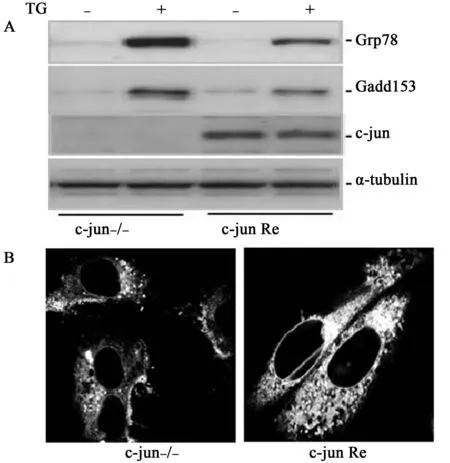
(A)免疫印迹技术检测内质网应激标记蛋白Grp78和Gadd153及c-jun的表达;(B)激光共聚焦显微镜观察内质网形态图4 TG处理c-jun-/-和c-jun Re细胞4 h后内质网应激标记蛋白、c-jun及内质网形态观察
3讨论
UPR增加了内质网固有的分子伴侣的表达,以适应内质网中因蛋白折叠的需求。内质网在细胞功能和存活方面起着重要的作用。细胞应对内质网应激的基础反应便是包括JNK信号通路在内的多种应激活化的激酶途径。c-jun作为一种JNK的下游靶分子,在许多刺激下如生长因子、紫外照射和细胞因子的刺激下c-jun的表达都会增强〔4〕。c-jun在细胞内质网应激中具有保护作用,c-jun-/-小鼠胚胎成纤维细胞在TG刺激后有部分发生了细胞凋亡,然而转染重组c-jun基因的小鼠胚胎成纤维细胞却对TG有一定的抵抗作用。本文结果说明了c-jun的重组再表达明显地增加了细胞对于TG所致的内质网应激的耐受性,而且内质网相关的caspase-12参与了细胞凋亡的局部调节。在c-jun-/-细胞中TG刺激引起了caspase-12的活化,正如caspase-12前体裂解一样,并具有一定的时间依赖性。与此相反,在野生型和转染重组c-jun基因的小鼠细胞,对于TG引起的caspase-12激活具有一定抵抗性。我们应用内质网荧光探针测试两种细胞中的内质网构造,发现了内质网构造在两种细胞中的不同样式,表明c-jun的结构性再表达能增加细胞对于TG诱导的内质网应激的耐受性。
内质网是多数细胞内、细胞表面和细胞外蛋白质合成、加工和转运的主要场所。内质网非常敏感,Ca2+耗竭、葡萄糖或营养缺乏、蛋白质糖基化抑制、二硫键形成障碍、蛋白质转运异常等刺激均可导致内质网功能失调,即内质网应激。内质网应激发生后,腔内大量蛋白质堆积引发了真核生物进化中高度保守的UPR。内质网应激可促进内质网对蓄积在网腔内的错误折叠或未折叠蛋白的处理,而有利于维持细胞的正常功能并使之存活,但是时间过长的内质网应激可引起细胞的凋亡。内质网应激时的UPR信号通路通过三个分子介导:肌醇内质网跨膜激酶IRElα、蛋白激酶样内质网激酶(PERK)和活化转录因子6(ATF6)。生理条件下,它们与内质网腔中的Grp78牢牢结合;当内质网应激时,大量未折叠蛋白质被释放活化并发挥作用。UPR引起IRE1α、PERK和ATF6 活化,分别产生了b-ZIP 转录因子XBP-1、ATF4 和p50ATF6,调控促凋亡基因CHOP的转录〔5〕,介导调整转录和翻译水平。未折叠蛋白在细胞内的聚集对细胞是一种损害,如果上述的PERK,ATF6和IRE1α三种调节途径不能抑制内质网应激,内质网应激介导的凋亡途径将被激活。Gadd153,即C/EBP同源蛋白(CHOP),是一种转录因,通过ERS的ATF6和PERK途径诱导表达的。Gadd153可以激活Gadd34,DR5等基因的表达。DR5是一种细胞表面的死亡受体,可以激活caspase的级联反应。caspases-12参与了内质网应激诱导的细胞凋亡,caspase-12位于内质网膜,内质网应激时可被激活〔6〕。内质网应激时IRE1α能活化c-jun-N-末端抑制性激酶,进而激活JNK。JNK可使TNAF-2磷酸化,磷酸化TNAF-2与IRE1α形成复合物使TNAF-2与caspase-12前体解离,导致caspase-12活化,诱导细胞的凋亡〔7〕。齐晓丹等〔8〕的研究发现抗氧化剂肌肽拮抗高糖诱导的心肌细胞凋亡与抑制p-JNK/p-c-jun 表达有关系。
综上所述,本研究表明TG可以引起小鼠成纤维细胞凋亡,c-jun基因表达的不同改变了细胞凋亡的程度,这种改变是通过细胞对内质网应激反应的介导,c-jun基因的表达在TG诱导的小鼠成纤维细胞内质网应激反应中起保护作用。
4参考文献
1Maki Y,Bos TJ,Davis C,etal.Avian sarcoma virus 17 carries the jun oncogene〔J〕.Proc Natl Acad Sci USA,1987;84(9):2848-52.
2Ma Y,Hendershot LM.The unfolding tale of the unfolded protein response〔J〕.Cell,2001;107(7):827-30.
3Van Huizen R,Martindale JL,Gorospe M,etal.P58IPK,a novel endoplasmic reticulum stress-inducible protein and potential negative regulator of eIF2alpha signaling〔J〕.J Biol Chem,2003;278(18):15558-64.
4Mechta-Grigoriou F,Gerald D,Yaniv M.The mammalian Jun proteins:redundancy and specificity〔J〕.Oncogene,2001;20(19):2378-89.
5Heath-Engel HM,Chang NC,Shore GC.The endoplasmic reticulum in apoptosis and autophagy:role of the BCL-2 protein family〔J〕.Oncogene,2008;27(50):6419-33.
6Kogler H,Schott P,Toischer K,etal.Relevance of brain nature tic peptide in preload-dependent regulation of cardiac sareoplasmic reticulum Ca2+ATPase expression〔J〕.Circulation,2006;113(23):2724-32.
7Oono K,Yoneda T,Manabe T,etal.JAB1participates in unfolded protein responses by association and dissociation with IRE1〔J〕.Neurochem Int,2004;45(5):765-72.
8齐晓丹,张春晶,师岩,等.肌肽通过调节JNK 和NF-kappaB通路抑制高糖诱导的心肌细胞凋亡〔J〕.中国生物化学与分子生物学报,2014;30(2):156-62.
〔2016-05-11修回〕
(编辑李相军)
The role of c-jun in thapsigargin-induced mouse fibroblast cell apoptosis
ZHANG Jie,ZHOU Fang-Zhou,CAO Xin-Ran,etal.
Department of Cardiology,Provincial Hospital Affiliated to Shandong University,Jinan 250021,Shandong,China
【Abstract】ObjectiveTo examine the impact of c-jun on thapsigargin-induced fibroblast cell apoptosis and address the mechanisms.MethodsThe thapsigargin was used to treat c-jun-/- mouse fibroblast cells,wild-type mouse fibroblasts and reconstitution of c-jun expression in c-jun-/- cells(c-jun Re).Cell viability was evaluated by trypan blue dye exclusion.Apoptosis was detected by fluorescence activated cell sorting(FACS)and DNA staining.c-jun,caspase-12,Grp78,Gadd153 and α-tubulin were analyzed by immunoblotting.Confocal images of cells loaded with the ER-Tracker and visualized by two-photon microscopy.ResultsWild type(c-jun+/+),c-jun-/- and c-jun Re cells exhibited dramatic differences in sensitivity to TG.The c-jun-/- cells were the most sensitive,while c-jun Re cells were relatively resistant,to TG-induced cell death(P<0.05).TG treatment led to the activation of caspase-12,as indicated by the cleavage of procaspase-12,in c-jun-/- cells in a time-dependent manner.In contrast,caspase-12 activation was significantly attenuated in wild type fibroblast cells and abrogated in c-jun Re cells in response to TG treatment(P<0.05).c-jun-/- cells exhibited a large degree of apoptosis after treatment with TG,while c-jun Re cells demonstrated relative resistance to TG-induced apoptosis.c-jun-/- mouse fibroblast cells were more sensitive to TG-induced cell death compared to wild-type mouse fibroblasts,while reconstitution of c-jun expression in c-jun-/- cells(c-Jun Re)enhanced resistance to TG-induced cell death(P<0.05).The expression levels of ER chaperones Grp78 and Gadd153 induced by TG were lower in c-jun Re than those in c-jun-/- cells.ER-tracker found different patterns in the ER structure between c-jun-/- and c-jun Re cells.ConclusionsThapsigargin could cause mouse fibroblast cells apoptosis.c-jun gene expression changes of apoptosis degree,this change is mediated by endoplasmic reticulum stress.c-jun gene expression plays a protective role in thapsigargin-induced fibroblast cell apoptosis.
【Key words】c-jun;Thapsigargin;Endoplasmic reticulum stress;Apoptosis
通讯作者:赵鹏(1979-),男,副主任医师,硕士生导师,主要从事心脏病的临床与基础研究。
基金项目:国家自然科学基金青年科学基金项目(81200176,81200238);山东省科技发展计划重点研发计划(2015GSF118180);山东省自然科学基金(ZR2013HM062)
〔中图分类号〕R73
〔文献标识码〕A
〔文章编号〕1005-9202(2016)04-0772-04;doi:10.3969/j.issn.1005-9202.2016.04.002
