乳腺癌组织中HER-2、TOPOIIα、Ki-67的表达及临床意义
2016-03-02马士辉凌飞海
马士辉 凌飞海
(广东省中山市人民医院乳腺外科,广东中山528403)
乳腺癌组织中HER-2、TOPOIIα、Ki-67的表达及临床意义
马士辉 凌飞海
(广东省中山市人民医院乳腺外科,广东中山528403)
目的 探讨人表皮生长因子受体2(HER-2)、DNA拓扑异构酶Ⅱα(TOPOIIα)、Ki-67在乳腺癌组织中的表达及临床意义。方法 回顾性分析我科2012年1月至2012年12月共212例乳腺癌患者的临床病理资料,分别采用荧光原位杂交(FISH)法及SP免疫组化法检测乳腺癌组织标本中HER-2、TOPOIIα及Ki-67的表达,并分析其与临床病理特征的相关性。结果 212例乳腺癌组织中,HER-2、TOPOIIα、Ki-67阳性表达率分别为25%(53/212)、9.4%(20/212)、60.4%(128/212),HER-2基因扩增中TOPOIIα同步扩增17例,HER-2、TOPOIIα、Ki-67基因的扩增或高表达与肿瘤大小、淋巴结转移及病理组织学分级有关。结论 乳腺癌组织中HER-2、TOPOIIα、Ki-67的联合检测对乳腺癌预后评估及提供个体化治疗有重要意义。
乳腺癌;HER-2;TOPOIIα;Ki-67
随着分子生物学的不断发展,乳腺癌的生物学指标越来越受到人们的重视,相关生物学指标已成为乳腺癌分子分型的依据,而不同亚型的乳腺癌对治疗的反应及预后都不尽相同[1],乳腺癌相关生物标记物的检测在临床上越来越重要。目前乳腺癌的常规检测指标如ER、PR、P53及HER-2等,对于乳腺癌治疗方法的选择以及判断预后具有重要意义,但仍缺乏完全反映乳腺癌生物学特性的临床指标。本研究分别采用FISH法及SP免疫组化法检测乳腺癌组织中HER-2、TOPOIIα及Ki-67的表达,并分析各指标之间与乳腺癌临床病理特征的关系,为指导临床治疗及判断预后提供依据。
1 资料与方法
1.1 一般资料:选取2012年1月至2012年12月在我科就诊的女性乳腺癌患者手术标本共212例,年龄26~73岁,中位年龄49.7岁。所有患者术前均未接受放疗或化疗等治疗,病理诊断明确,根据2003年乳腺肿瘤WHO组织学分类标准[2],其中174例浸润性导管癌、2例浸润性小叶癌、21例原位癌、8例黏液腺癌、其他类型7例。其中有淋巴结转移58例,未见淋巴结转移154例。
1.2 病理检测方法、试剂及仪器:全部标本经常规10%中性福尔马林固定,常规石蜡包埋、切片。采用FISH法检测乳腺癌组织中HER-2、TOPOIIα的基因表达,FISH法检测基因试剂盒均购自北京金菩嘉医疗科技有限公司,包含2种混合探针:橘红色荧光代表HER-2/TOPOIIα基因,绿色荧光代表17号染色体着丝粒,所有操作按照试剂盒说明及要求完成。免疫荧光显微镜使用日本奥林帕斯公司(型号:BX51)的产品。SP免疫组化法检测乳腺癌组织中Ki-67的表达,所有SP试剂盒均购自上海长嘉生物科技有限公司。
1.3 结果判定:HER-2/TOP2A基因扩增的判读参考文献[3],Ki-67阳性的判断标准参考文献[4],根据2011年 St.Gallen国际乳腺癌共识会议定义Ki-67≤14%为低表达,Ki-67>14%为高表达[6]。
1.4 统计学处理:采用SPSS 19.0软件对计数资料进行χ2检验,HER-2、TOPOIIα和Ki-67各组间相关性采用Spearman相关性分析,P<0.05为差异有统计学意义。
2 结果
2.1 乳腺癌组织中HER-2、TOPOIIα、Ki-67的表达:212例乳腺癌组织标本中HER-2基因扩增53例,阳性率为25%(53/212);TOPOIIα基因扩增20例,阳性率为9.4%(20/212);Ki-67高表达128例,阳性率为60.4%(128/212)。
2.2 乳腺癌组织中HER-2、TOPOIIα、Ki-67阳性表达与临床病理因素间关系:HER-2、TOPOIIα及Ki-67在肿瘤>2 cm的乳腺癌组织中高表达或基因扩增率明显高于肿瘤≤2 cm(P<0.05);HER-2、TOPOIIα及Ki-67的高表达或基因扩增率在有淋巴结转移的乳腺癌组织中明显高于无淋巴结转移(P<0.05);HER-2、TOPOIIα及Ki-67在组织学分级高的乳腺癌组织中高表达或基因扩增率明显高于组织学分级低的组织(P<0.05),详见表1。
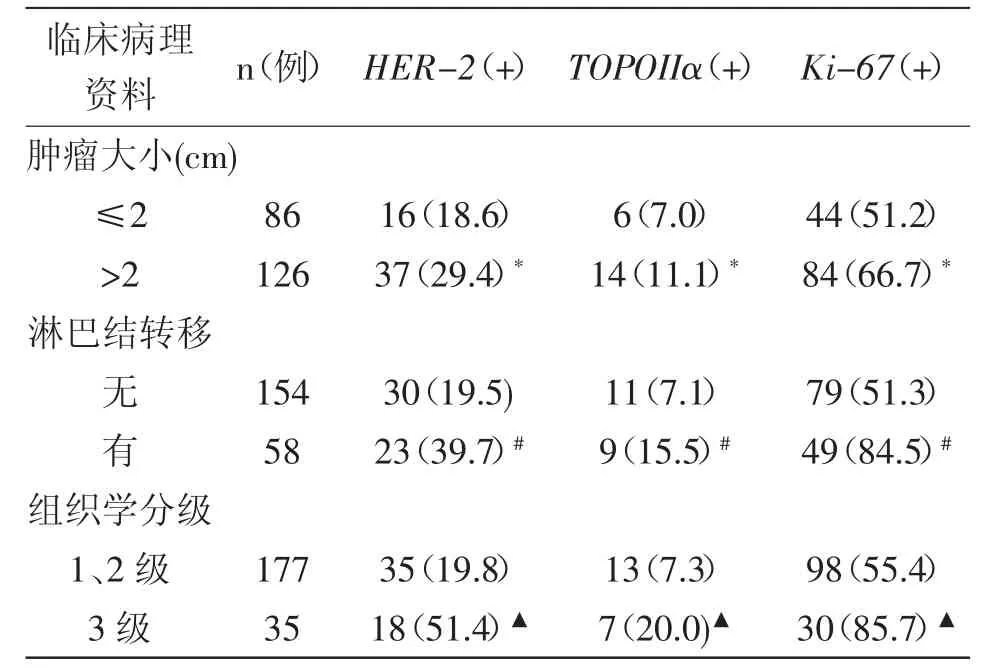
表1 HER-2,TOPOIIα,Ki-67阳性表达与临床病理因素间关系 [n(%)]
2.3 乳腺癌组织中HER-2与Ki-67、TOPOIIα的相互关系:53例HER-2基因扩增的乳腺癌患者中Ki-67高表达的有42例,说明HER-2基因扩增往往伴随着Ki-67的高表达。有17例TOPOIIα基因与HER-2基因同步扩增,概率32.1%(17/53),而HER-2基因不扩增的患者中TOPOIIα的基因扩增率仅为 1.9%(3/159)。乳腺癌患者 TOPOIIα和HER-2的表达存在显著相关性,差异有统计学意义(P<0.05)。
3 结论
乳腺癌的预后除了与肿瘤大小、组织学类型、淋巴结转移等情况有关外,可能与其分子生物学行为关系更大。同时乳腺癌又是一种高度异质性的恶性肿瘤,癌细胞可以表达多种不同的生物学标志物,单一因素往往难以确定其与乳腺癌生物学行为的关系,因此多种标志物的联合检测可以更准确地为乳腺癌治疗方案的选择及预后的判断提供临床依据。
HER-2原癌基因又称c-erbB-2,是表皮生长因子受体家族成员之一,参与细胞生长、分化的调节。现有证据表明HER-2基因与乳腺癌的发生、发展及预后关系紧密,并且是评价乳腺癌预后不良的独立指标[5],对制定合理的靶向治疗及化疗方案具有重要的参考意义。目前检测HER-2状态常用的方法有免疫组化法及FISH法,其中FISH法因其检测结果准确,被一致推荐为检测HER-2基因是否扩增的金标准。本组212例乳腺癌中HER-2的检测均采用FISH法,其阳性表达率为25%,HER-2基因扩增的患者,肿瘤大小、腋窝淋巴结阳性率及组织学分级均较HER-2基因不扩增患者高,与文献报道一致。
拓扑异构酶是DNA复制过程中的关键酶,在DNA的合成、转录、核分裂等过程中发挥着重要作用。拓扑异构酶分为Ⅰ、Ⅱ两型,其中TOPOII又分为α和β两个亚型。TOPOIIα基因与HER-2基因都位于17q 21-22上,在基因定位上非常靠近,有文献报道,在HER2基因扩增的原发性乳腺癌中,TOPOIIα基因出现扩增的概率为24.3%~55%[11],因此两者在基因表达和变化上可能存在某种联系。在本研究中,53例HER-2阳性乳腺癌患者中有17例TOPOIIα基因同步扩增,概率为32.1%,与文献报道结果相似。本研究结果说明TOPOIIα与HER-2的表达存相关性,有共同高表达趋势。另有研究表明,TOPOIIα是蒽环类化疗药物的特定靶点,其可能可以作为蒽环类药物化疗敏感性的预测因子[12]。但是,目前TOPOIIα基因的检测不是临床常规检查项目,并且没有纳入乳腺癌分子分型的评判指标,因此其在预测预后及指导治疗的临床价值上并未得到重视。
细胞增殖活性是反映肿瘤发生、发展的一个重要指标,而Ki-67是一种全面反映细胞增殖活性的可靠指标[9-10],Ki-67高表达往往代表着肿瘤细胞增殖活跃,提示预后不佳。St.Gallen国际乳腺癌共识会议在2011年将Ki-67纳入乳腺癌分子分型判读标准,Ki-67的临床意义越来越得到重视。文献[11]报道,乳腺癌患者Ki-67表达率为60%~80%,本组病例为67.8%,结果相近。并且Ki-67高表达的情况下肿瘤较大,肿瘤组织学分级更高,发生腋窝淋巴结转移的比例大。
乳腺癌的发生、发展是一个多因素、多基因改变的长期过程,与许多生物学指标联系紧密。本研究通过对临床上常用的多种生物学指标进行检测,并初步探讨了它们与乳腺癌临床病理因素之间的关系,发现联合检测HER-2、TOPOIIα及Ki-67对临床上乳腺癌患者制定综合治
[1] Phipps AI,Buist DS,Malone KE,et al.Reproductive history and risk of three breast cancer subtypes defined by three biomarkers[J].Cancer Causes Control,2011,22(3):399-405.
[2] Tavassoli EF,Devilee.WHO:Pathology&genetics,tumours of the breast and female genital organs[M].Lyon:IARC Press,2008:111-113.
[3] 马士辉,凌飞海.ER、PR、HER-2、TOPOIIα在乳腺癌组织中的表达及临床意义[J].医学信息,2013,26(11):117.
[4] Bukholm IR,Bukholm G,Holm R,et al.Association betw een histology grade,expression of Hs MCM2,and cyclin A in human invasive breast carcinomas[J].J Clin Pathol,2003,56(5):368-373.
[5] 汤小江,周瑜辉,张伟,等.TOP2A基因表达与乳腺癌HER2通路的相关性[J].西安交通大学学报(医学版),2015,(4):519-522,557.
[6] Ross JS,Fletcher JA,Bloom KJ,et al.HER-2/neu testing in breast cancer[J].Am J Clin Pathol,2003,120:S53-71.
[7] Slamon DJ,Press MF.Alterations in the TOP2A and HER2 Genes:Association With Adjuvant Anthracycline Sensitivity in Human Breast Cancers[J].J Natl Cancer Inst.2009,101(9):615-618.
[8] 张松,刘相萍,聂刚,等.TopⅡα蛋白与Top2A基因在Her2阳性乳腺癌中的表达及临床意义[J].青岛医药卫生,2014,(4):241-245.
[9] 夏红强,何建蓉.Ki-67、EGFR、HER-2和P53在乳腺癌中的表达及其相关[J].临床肿瘤学杂志,2011,16(2):139-142.
[10]王忆丽,熊秋云.乳腺癌蒽环类新辅助化疗疗效与ER、PR、HER2表达的关系[J].中国医学创新,2011,8(31):8-10.
[11]张丽,曾梅,田林,等.Cyclin D1、Ki-67及PTEN在乳腺癌中的表达及意义[J].现代肿瘤医学,2013,21(8):1772-1774.
Expression and Clinical Significance of HER-2,TOPOIIα,Ki-67 in Breast Cancer Tissues
Ma ShihuiLing Feihai
(Zhongshan People's Hospital of Guangdong Province of Department of Breast Surgery,Zhongshan 528403,China)
ObjectiveTo probe into the expression and clinical significance of human epidermal growth factor receptor 2(HER-2),DNA topoisomerase II alpha(TOPOIIα),Ki-67 in breast cancer.MethodsClinical pathological data of 212 patients with breast cancer in our department from January,2012 to December,2012 were retrospective analyzed.Then,the expression of HER-2,TOPOIIα and Ki-67 in breast cancer tissues were detected by fluorescence in situ hybridization(FISH)and SP immunohistochemical method respectively,and its correlation with clinical pathological characteristics was analyzed.Results In 212 cases of breast cancer,the HER-2,TOPOII,Ki-67 positive expression rate were respectively 25%(53/212),9.4%(20/212),60.4%(128/ 212),and the simultaneous amplification of TOPOII gene in 17 cases of HER-2 gene amplification,Amplification or high expression of HER-2,TOPOII,Ki-67 gene was associated with tumor size,lymph node metastasis and histological grading.ConclusionThe joint detection of HER-2,TOPOII,and Ki-67 in breast cancer tissues which it is of great significance to evaluate the prognosis of breast cancer and provide individualized treatment.
Breast cancer;HER-2;TOPOIIα;Ki-67
R730.2
A 学科分类代码: 32027
1001-8131(2016)05-0504-03
2016-06-12
2011年广东省中山市卫生局项目(J2011043)
