白藜芦醇对胆道梗阻再通大鼠肝功能的保护作用
2016-03-01许朝龙邬善敏苗志钊赵凯亮范迪欢
许朝龙,邬善敏,苗志钊,赵凯亮,陈 飞,范迪欢
(武汉大学人民医院肝胆腔镜外科,湖北 武汉 430060)
白藜芦醇对胆道梗阻再通大鼠肝功能的保护作用
许朝龙,邬善敏,苗志钊,赵凯亮,陈飞,范迪欢
(武汉大学人民医院肝胆腔镜外科,湖北 武汉430060)
摘要:目的研究白藜芦醇(Res)对胆道梗阻再通大鼠肝损害的保护作用及机制。方法雄性Wistar大鼠60只,随机分为4组,即A组:假手术组,B组:梗阻性黄疸模型组,C组:梗阻性黄疸模型+胆道再通组,D组:梗阻性黄疸+胆道再通 +Res干预组。连续给药7 d,实验结束后检测各组大鼠血清中总胆红素(TBIL)、直接胆红素(DBIL)、丙氨酸氨基转氨酶(ALT)水平;RT-PCR检测肝组织沉默信息调控因子1(SIRT1)mRNA的表达,Western blot检测肝组织SIRT1蛋白和核因子-κB(NF-κB)蛋白表达,免疫组化检测过氧化物酶体增殖物激活受体α(PPARα)蛋白在肝脏中的表达,原位末端标记(TUNEL)法检测肝细胞凋亡。结果与假手术组比较,模型组血清ALT水平升高,SIRT1 mRNA及蛋白、PPARα蛋白表达降低,NF-κB蛋白表达升高,细胞凋亡率升高(P<0.05);而造模后胆道再通组与模型组比较,血清ALT水平降低,SIRT1 mRNA及蛋白、PPARα蛋白表达增加,NF-κBp蛋白表达降低,细胞凋亡率降低(P<0.05);白藜芦醇组与C组比较:血清ALT水平降低,SIRT1 mRNA及蛋白、PPARα蛋白表达增加,NF-κBp蛋白表达降低,细胞凋亡率降低(P<0.05)。结论Res可能通过激活SIRT1抑制NF-κB,发挥抗炎、抗凋亡作用,通过促进PPARα的表达发挥抗氧化作用,从而减轻胆道梗阻再通大鼠的肝损害,促进肝功能恢复。
关键词:白藜芦醇;梗阻性黄疸;再通;沉默信息调控因子;过氧化物酶体增殖物剂激活受体α;核因子-κB
白藜芦醇是广泛存在于多种植物中的一种多酚类化合物,具有抗氧化、抗炎、抗肿瘤、抗心脑血管疾病、抗糖尿病等多种生物活性[1-2]。近年来研究发现,白藜芦醇对化学性肝损伤、酒精性肝损伤具有保护作用[3-4],但其对胆道梗阻再通大鼠肝损伤的保护作用报道尚少。本研究旨在通过白藜芦醇干预胆道梗阻再通大鼠,通过检测SIRT1、PPARα、NF-κB等蛋白的表达,探究白藜芦醇对胆道梗阻再通大鼠肝损害的保护作用及机制。
1材料与方法
1.1材料Res购自阿拉丁公司,纯度≥99%;兔抗大鼠SIRT1抗体购于santa cruz公司,兔抗大鼠NF-κB抗体、免疫组织化学染色用PPARα抗体购于abcam公司,DAB显色试剂盒(黄)及二抗均购自武汉博士德生物工程有限公司,TUNEL细胞凋亡检测试剂盒购于Roche Applied Science;总RNA提取试剂盒购自Invitrogen公司,cDNA第一链合成试剂盒购自Fermentas公司,引物由金斯瑞科技有限公司合成,实时荧光定量PCR仪ABI 7900。
1.2动物分组及模型建立、标本取材健康雄性Wistar大鼠60只,体质量220~250 g,由湖北省疾控中心提供,动物许可证号:SCXK(鄂)2003-0005,随机分为4组,每组15只:A组(假手术组)、B组(梗阻性黄疸组1周组)、C组(梗阻性黄疸1周,胆道再通1周+生理盐水组)、D组(梗阻性黄疸1周,胆道再通1周+Res组);模型建立:大鼠麻醉后,取上腹部正中纵行切口,A组:暴露胆总管但不结扎不横断,关腹,B、C、D组分别暴露胆总管,以4到0号丝线双重结扎,于两结扎丝线间离断,确定无胆瘘后关腹,C、D组分别于胆总管结扎1周后取原切口入腹,显露胆总管,穿刺抽吸出胆汁,取长约1 cm细硅胶管于胆总管和距离幽门2 cm处的十二指肠处分别做荷包缝合、固定,确定无胆瘘后关腹,制成梗阻性黄疸胆道再通模型,D组于再通术后12 h开始每天10 mg·kg-1·d-1Res腹腔注射,C组予以等量生理盐水腹腔注射;建模后第7天取血后处死,取部分肝组织经4%多聚甲醛固定,其余肝组织冻存,进行后续检测。
1.3肝功能检测及病理学观察各组小鼠血液标本静置、离心后收集血清,采用全自动生化分析仪检测ALT、TBIL、DBIL,肝组织石蜡切片苏木精-伊红(HE)染色,光镜下观察肝脏形态学变化。
1.4 RT-PCR检测肝组织SIRT1 mRNA表达取肝组织100 mg,用Trizol试剂提取mRNA,按照cDNA合成试剂盒说明,以所提取的mRNA为模板合成cDNA,进行PCR循环。以3-磷酸甘油醛脱氢酶(GAPDH)为内参照,上游引物:5‘-ACAGCAACAGGGTGGTGGAC-3’,下游引物:5‘-TTTGAGGGTGCAGCGAACTT-3’,大小为252 bp;SIRT1上游引物:5‘-GGCCTCAAAGTACCTGGGAT-3’,下游引物:5‘-AGTCACTAGAGCTTGCGTGT-3’,大小约180 bp。反应条件:第一个循环50°C 2 min,95°C 10 min,然后40个循环95°C 30 s,60°C 30 s,作扩增曲线观察各样本扩增效率是否一致,于扩增后作熔解曲线以检测产物的均一性;mRNA含量用相对值法即2-△△Ct进行统计学分析。
1.5Western blot检测肝组织SIRT1蛋白、NF-κB蛋白的表达取各组肝组织,加入预冷的组织裂解液(RIPA)匀浆组织,置冰上裂解20 min,12 000 r·min-1离心10 min,取上清液测蛋白浓度后,各样品取50 μg总蛋白上样电泳,根据蛋白分子量配制10%的PAGE胶电泳,根据预染Marker显示,判断目的蛋白得到充分分离后,停止电泳。取出凝胶根据Marker切下目的条带,转至经甲醇处理的聚偏氟乙烯(PVDF)膜,转膜条件为:SIRT1先200 mA 120 min,后300 mA 50 min;NF-κB 200 mA 120 min。用含5%脱脂奶粉的封闭液(TBST)浸泡PVDF膜,室温摇床封闭2 h。用封闭液稀释相应的一抗(SIRTl 1∶300稀释,NF-κB 1∶400稀释),使PVDF膜浸泡于一抗孵育液中,4℃孵育过夜。TBST充分洗涤PVDF膜5~6次,每次5 min。用封闭液稀释相应的HRP标记二抗1∶50 000稀释,使PVDF膜浸泡于二抗孵育液中,室温摇床孵育2 h。用TBST充分洗涤PVDF膜5~6次,每次5 min。每张膜滴加适量增强型化学发光试剂(ECL)底物液,孵育数分钟,行显影、定影处理,图像分析蛋白条带。
1.6免疫组化检测肝组织PPARα蛋白表达肝组织石蜡切片脱蜡、抗原修复,加一抗4℃湿盒中孵育过夜,滴加聚合物辅助剂,37℃孵育20 min,滴加辣根过氧化物酶标记二抗IgG多聚体,37℃孵育30 min,滴加DAB液显色,依次进行复染、脱水、封片,每张切片随机选取5个视野,在显微成像系统400倍下摄片,所有照片均用Image Pro Plus图像处理软件分析测定累积光密度及面积,计算阳性表达的平均光密度。
1.7TUNEL法检测细胞凋亡肝组织石蜡切片脱蜡,滴加蛋白酶K工作液常温反应20 min,PBS洗涤后加50 μL TUNEL反应混合液(阴性对照组仅加50 μL荧光素标记溶液),37℃避光孵育60 min,PBS洗涤3次,每次5 min,加50 μL converter-POD于标本上,37℃避光孵育30 min。PBS洗涤,4次,每次5 min,滴加DAB液显色5~10 min,用自来水冲洗后,苏木素复染,脱水透明,封片。以细胞呈棕褐色为阳性判定标准。每张切片随机选取5个视野计数,计算凋亡指数(凋亡指数=凋亡阳性细胞数/总细胞数×100%)。
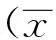
2结果
2.1各组大鼠血清TBIL、DBIL、ALT检测结果B组的TBIL、DBIL、ALT水平明显高于A组,差异有统计学意义(P<0.05),C、D组的TBIL、DBIL、ALT水平低于B组(P<0.05),D组的ALT水平低于C组(P<0.05),C、D组的TBIL、DBIL水平差异无明显统计学意义(P>0.05),见表1。


组别TBIL/μmol·L-1DBIL/μmol·L-1ALT/U·L-1A5.07±0.812.86±0.4639.47±5.23B166.32±10.41a113.27±9.85a209.53±12.14aC6.11±1.48b3.36±0.72b76.42±9.05bD5.81±1.03bd3.04±0.57bd53.75±8.26bc
注:与A组比较,aP<0.05;与B组比较,bP<0.05;与C组比较,cP<0.05、dP>0.05。
2.2各组大鼠肝脏SIRT1 mRNA表达水平B组SIRT1 mRNA水平低于A组,差异有统计学意义(P<0.05),C组SIRT1 mRNA水平高于B组(P<0.05),D组SIRT1 mRNA水平高于C组(P<0.05),见图1、2。
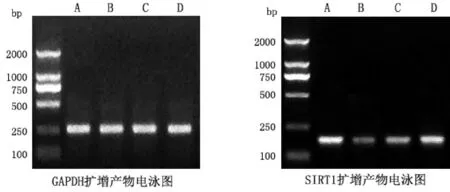
图1 各组大鼠肝脏SIRT1 mRNA的RT-PCR扩增
图2 各组肝脏SIRT1 mRNA RT-PCR半定量

注:与A组比较,*P<0.05,与B组比较,#P<0.05,与C组比较,△P<0.05。
2.3各组大鼠肝脏SIRT1蛋白、NF-κB蛋白表达水平B组与A组比较,SIRT1蛋白水平降低,NF-κB蛋白水平升高,差异有统计学意义(P<0.05);C组与B组比较,SIRT1蛋白水平升高,NF-κB蛋白水平降低(P<0.05);D组与C组比较,SIRT1蛋白水平升高,NF-κB蛋白水平降低(P<0.05),见图3。
注:与A组比较,*P<0.05,与B组比较,#P<0.05,与C组比较,△P<0.05。
2.4各组大鼠肝脏PPARα蛋白表达A组细胞核染色呈明显棕黄色,PPARα蛋白表达呈阳性,B组细胞核染色较A组明显减弱,C组细胞核染色较B组增强,D组细胞核染色较C组增强(如图4)。A、B、C、D组PPARα蛋白表达半定量结果如图5。
图4 各组大鼠肝脏PPARα蛋白表达的
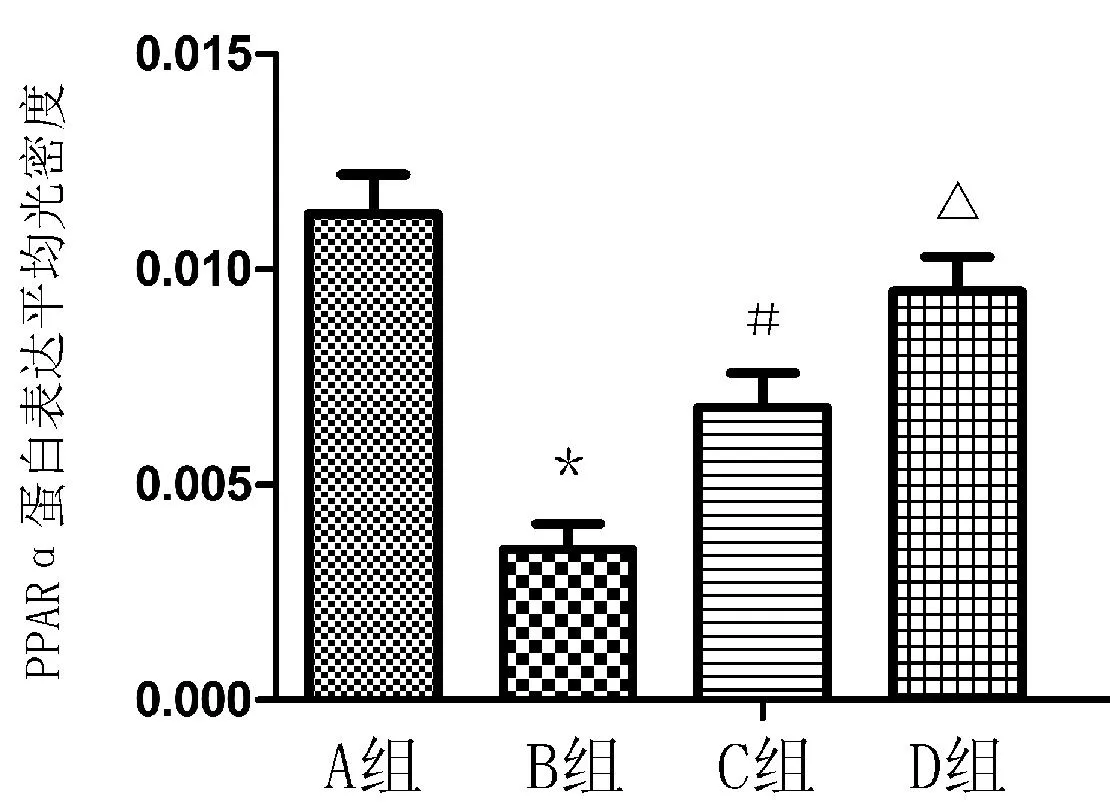

图5 各组大鼠肝脏PPARα蛋白表达半定量结果 图6 各组大鼠肝细胞凋亡率
注:与A组比较,*P<0.05,与B组比较,#P<0.05,与C组比较,△P<0.05。

图7 各组大鼠肝组织TUNEL染色结果(×400)
2.5各组肝细胞凋亡率B组肝细胞凋亡率较A组明显升高,差异有统计学意义(P<0.05),C组肝细胞凋亡率较B组降低(P<0.05),D组肝细胞凋亡率较C组降低(P<0.05),如图6、7。
2.6SIRT1蛋白与NF-κB蛋白表达水平的相关性分析SIRT1蛋白表达水平与NF-κB蛋白表达水平呈负相关(r=-0.86、P<0.01)。
3讨论
梗阻性黄疸(obstructive jaundice)是临床常见疾病,可导致机体各器官系统损害及相应的病理生理改变,其中最主要为肝脏损伤。梗阻性黄疸肝脏损伤的机制主要为脂质过氧化损伤、肠源性内毒性血症、肝脏血流动力学紊乱和各种炎症因子介导的损伤[5-6]。
SIRT1是一种依赖NAD+的组蛋白去乙酰化酶,参与机体许多生理功能的调节,具有促进线粒体能量代谢、维持糖脂代谢平衡、改善心血管功能、抗肿瘤、抗衰老等作用[7]。而白藜芦醇是最广泛使用的SIRT1激活剂[8]。NF-κB是一类具有转录调节功能的核蛋白因子,能调节多种靶基因的表达,与炎症反应、免疫应答、细胞凋亡等病理生理过程密切相关[9]。抑制NF-κB的表达可降低炎性因子IL-1、TNF-α的水平[10]。研究表明[11],SIRT1可使NF-κB去乙酰化,进而抑制NF-κB活性,发挥抗炎作用。本研究发现,胆道梗阻后(B组)SIRT1 mRNA及蛋白表达下降、NF-κB表达增加、肝细胞凋亡增加,胆道再通后(C组)SIRT1 mRNA及蛋白表达升高、NF-κB表达降低、肝细胞凋亡降低,胆道再通同时予以白藜芦醇干预后(D组)SIRT1 mRNA及蛋白表达进一步升高、NF-κB表达进一步降低、肝细胞凋亡进一步降低。对SIRT1蛋白与NF-κB蛋白的相对表达量进行分析发现,两者之间存在明显的负相关。说明白藜芦醇能通过激活SIRT1表达,抑制NF-κB表达,减轻胆道梗阻再通大鼠的肝细胞损害,减少细胞凋亡。
过氧化物酶体增殖物激活受体(PPARs)是配体激活的的转录因子核受体超家族成员之一,有多种生物学作用,如参与糖类和脂质的代谢,提高胰岛素的敏感性,抑制炎症反应,调节细胞生长和分化等[12]。它存在3种亚型:PPARα、PPARβ/δ、PPARγ,其中PPARα主要分布于脂肪酸氧化活跃的组织,如肝、肾和心肌等。实验发现,白藜芦醇能增强PPARα表达[13],PPARα被激活后,与过氧化物酶体增殖物反应元件(PPREs)结合,能增强多个抗氧化基因如过氧化氢酶(CAT)、铜锌超氧化物歧化酶(Cu/Zn-SOD)的表达,从而减轻氧化损伤[14]。本实验结果显示,胆道梗阻后(B组)PPARα蛋白表达下降、ALT水平升高,胆道再通后(C组)PPARα蛋白表达升高、ALT水平降低,胆道再通同时予以白藜芦醇干预后(D组)PPARα蛋白表达进一步升高、ALT水平进一步降低。说明白藜芦醇能激活PPARα表达,减轻胆道再通大鼠肝脏氧化损伤,保护肝功能。
综上所述,白藜芦醇可能通过激活SIRT1抑制NF-κB,发挥抗炎、抗凋亡作用,通过促进PPARα的表达发挥抗氧化作用,从而减轻胆道梗阻再通大鼠的肝脏损害,促进肝功能恢复。
参考文献:
[1]Pangeni R,Sahni JK,Ali J,et al.Resveratrol:review on therapeutic potential and recent advances in drug delivery[J].Expert Opin Drug Deliv,2014,11(8):1285-1298.
[2]Szkudelski T,Szkudelska K. Resveratrol and diabetes: from animal to human studies[J].Biochim Biophys Acta,2015,1852(6):1145-1154.
[3] Wang Y, Jiang Y, Fan X, et al. Hepato-protective effect of resveratrol against acetaminophen-induced liver injury is associated with inhibition of CYP-mediated bioactivation and regulation of SIRT1-p53 signaling pathways[J].Toxicol Lett,2015,236(2):82-89.
[4]Liu LQ, Fan ZQ, Tang YF, et al. The resveratrol attenuates ethanol-induced hepatocyte apoptosis via inhibiting ER-related caspase-12 activation and PDE activity in vitro[J].Alcohol Clin Exp Res,2014,38(3):683-693.
[5]Hong JY, Sato E, Hiramoto K, et al. Mechanism of liver injury during obstructive jaundice: Role of nitric oxide, splenic cytokines, and intestinal flora[J].J Clin Biochem Nutr,2007,40(3):184-193.
[6]张喜平,黄鑫梅,沈延飞,等.梗阻性黄疸并发肝损伤机制研究概况[J].医学研究杂志,2008,37(11):8-12.
[7]Chang HC, Guarente L. SIRT1 and other sirtuins in metabolism[J].Trends Endocrinol Metab,2014,25(3):138-145.
[8]Villalba JM, de Cabo R, Alcain FJ. A patent review of sirtuin activators: an update[J].Expert Opin Ther Pat,2012,22(4):355-367.
[9]Pateras I,GiaginisC, Tsigris C,et al.NF-κB signaling at the crossroads of inflammation and atherogenesis: searching for new therapeutic links[J].Expert Opin Ther Targets,2014,18(9):1089-1101.
[10] 史志强,沈敬华.三氧化二砷治疗鸡卵蛋白诱导日本大耳白兔类风湿关节炎的初步观察[J].安徽医药,2015,19(5):850-854.
[11] Jung YJ,Lee JE,Lee AS,et al.SIRT1 overexpression decreases cisplatin-induced acetylation of NF-κB p65 subunit and cytotoxicity in renal proximal tubule cells[J].Biochem Biophys Res Commun,2012,419(2):206-210.
[12] Pirat C,Farce A,Lebègue N,et al.Targeting peroxisome proliferator-activated receptors (PPARs):development of modulators[J].J Med Chem,2012,55(9):4027-4061.
[13] Jiang L,Gu Y,Ye J,et al.Resveratrol prevents hepatic steatosis induced by hepatitis C virus core protein[J].Biotechnol Lett,2012,34(12):2205-2212.
[14] Nan YM,Wang RQ,Fu N.Peroxisome proliferator-activated receptor α, a potential therapeutic target for alcoholic liver disease[J].World J Gastroenterol,2014,20(25):8055-8060.
Protective effect of resveratrol on liver injury in rats after
recanalization of biliary obstruction
XU Chao-long,WU Shan-min,MIAO Zhi-zhao,et al
(DepartmentofHepatobiliarySurgery,RenminHospitalofWuhanUniversity,Wuhan,Hubei430060,China)
Abstract:ObjectiveTo explore the protective effect of resveratrol (Res) on liver injury in rats after recanalization of biliary obstruction. Methods Sixty healthy male Wistar rats were randomized into four groups: sham group (group A), obstructive jaundice one week group (group B), obstructive jaundice one week and recanalization one week+NS group (group C), obstructive jaundice one week and recanalization one week+Res group (group D). The levels of total bilirubin(TBIL),direct bilirubin(DBIL) and serum alanine aminotransferase(ALT) were measured. Real-time polymerase chain reaction (RT-PCR) was performed to determine the mRNA expression of silent information regulator 1(SIRT1). The expression of the SIRT1 and nuclear factor-κB (NF-κB) proteins were detected by Western blot. Immunocytochemical assay was performed to examine peroxisome proliferator activated receptor-alpha (PPARα) protein. Hepatocellular apoptosis was examined by terminal deoxynucleotidyl transferase mediated nick end labeling (TUNEL) method. Results Compared with group A, in group B the level of ALT was higher, the expressions of SIRT1 mRNA and protein and the PPARα protein were lower, and the NF-κB protein and the rate of hepatocellular apoptosis were higher(P<0.05). Compared with group B, in group C the level of ALT was lower, the expression of SIRT1 mRNA and protein and the PPARα protein were higher, and the NF-κB protein and the rate of hepatocellular apoptosis were lower(P<0.05). Compared with group C, in group D the level of ALT was lower, the expressions of SIRT1 mRNA and protein and the PPARα protein were higher, and the NF-κB protein and the rate of hepatocellular apoptosis were lower(P<0.05).Conclusion The Res could resist inflammation and apoptosis by activating the SIRT1 which probably inhibits the expression of NF-κB protein, and palys an antioxidant role by promoting the expression of PPARα in rats after recanalization of biliary obstruction, so that it could alleviate liver damage.
Key words:resveratrol;obstructive jaundice;recanalization;SIRT1;PPARα;NF-κB
收稿日期:(2015-09-09,修回日期:2015-10-23)
doi:10.3969/j.issn.1009-6469.2016.01.008
通信作者:邬善敏,男,教授,硕士生导师,研究方向:肝胆外科基础与临床,E-mail:15327278328@163.com
