黄体酮的合成工艺改进
2016-03-01吴庆安徐志超
吴庆安, 徐志超, 柏 挺
(1. 浙江工业大学 化学工程学院,浙江 杭州 310014; 2. 上海新华联制药有限公司,上海 201419)
·制药技术·
黄体酮的合成工艺改进
吴庆安1,2, 徐志超1*, 柏挺2
(1. 浙江工业大学 化学工程学院,浙江 杭州310014; 2. 上海新华联制药有限公司,上海201419)
摘要:以植物甾醇为原料,分离得豆甾醇(1); 1经沃氏氧化和臭氧化制得中间体孕甾-4-烯-3-酮-22-醛(3); 3经加成缩合并在CuCl催化下经空气氧化合成了黄体酮,总产率69.1%,其结构经1H NMR和ESI-MS确证。
关键词:植物甾醇; 黄体酮; 氧化; 药物合成; 工艺改进
通信联系人: 徐志超,硕士研究生, E-mail: xzcshowtime@126.com
黄体酮是由卵巢黄体分泌的一种天然孕激素,对人和家畜都具有很高的医用价值。近年来,黄体酮的临床应用范围不断扩大,需求量呈现不断上升的趋势[1-2]。
黄体酮的传统合成路线主要是以薯蓣皂素为原料,先经过侧链降解、氧化及水解等步骤合成中间体醋酸妊娠双烯醇酮(俗称双烯),再经加氢还原、酯基水解和氧化合成黄体酮[3-4]。该合成路线(俗称双烯合成法)主要存在三大问题[5-6]:(1)薯蓣皂素是从大量的天然植物黄姜中提取而来的,而黄姜生产周期需2年以上,并且每生产1吨皂素耗用黄姜达160吨之多,由于资源日趋枯竭,因此很难满足市场及规模化生产的需求;(2)由黄姜生产皂素,一般每生产1吨皂素会产生含酸废水500吨左右和废渣8吨,环保压力极大;(3)由皂素合成黄体酮时还需用到重金属铬盐,对环境污染严重。因此,研究人员一直在寻找黄体酮新的合成路线。
考虑到豆甾醇(1)的分子结构与黄体酮的分子结构比较相似,本文设计以1为原料合成黄体酮。以植物甾醇为原料,分离得1[7]; 1经沃氏氧化和臭氧化制得中间体孕甾-4-烯-3-酮-22-醛(3); 3经加成缩合并在氯化亚酮催化下经空气氧化合成了黄体酮(Scheme 1),总产率69.1%,其结构经1H NMR和ESI-MS确证。
1实验部分
1.1仪器与试剂
WRS-1B型熔点仪(温度未校正);Bruker-400MHz型核磁共振仪(CDCl3为溶剂,TMS内标);Mariner ESI-TOF型质谱仪;Agilent 1100型液相色谱仪(流动相:甲醇/乙腈/水= 65/45/10; 流速:1 mL·min-1; 紫外检测波长:205 nm;时间:40 min); WSX-10 G型臭氧发生器。
1按文献[7]方法合成;植物甾醇(β-谷甾醇43.38%,豆甾醇25.60%,菜油甾醇23.90%,菜籽甾醇2.22%),湖北远成药业有限公司;其余所用试剂均为分析纯。
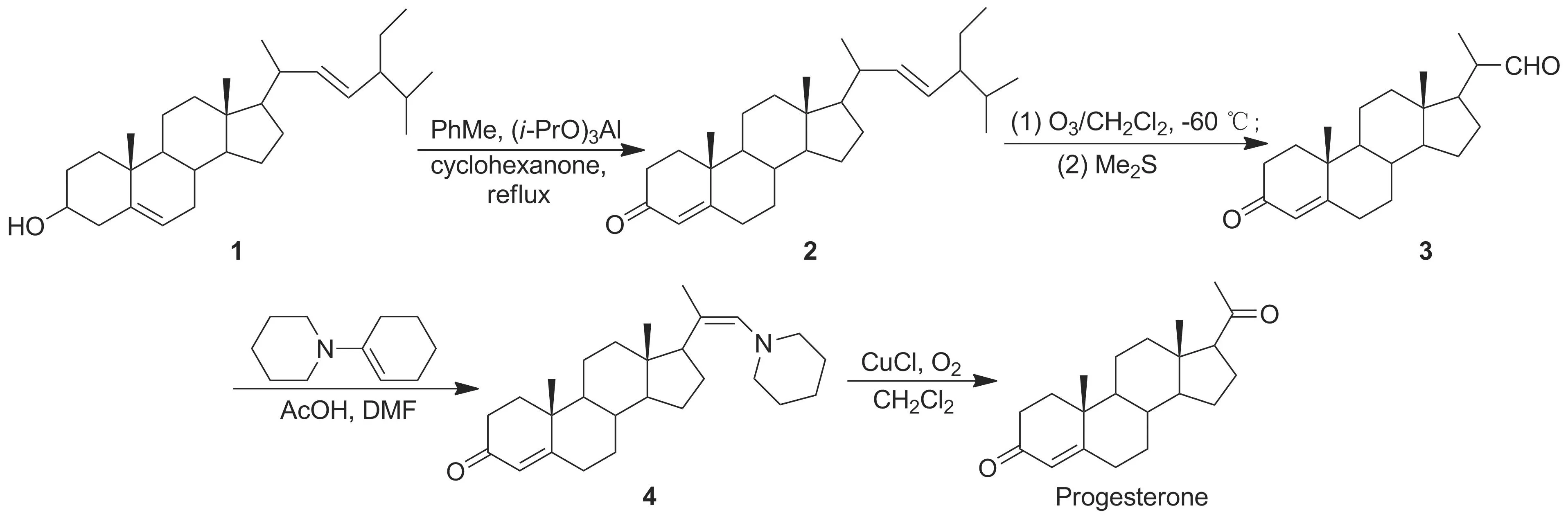
Scheme 1
1.2合成
(1) 2的合成
在反应瓶中加入1 11.8 g(28.6 mmol),环己酮20.7 mL(200.2 mmol)和甲苯100 mL,于70 ℃搅拌使其溶解;迅速加入异丙醇铝9.83 g,于110 ℃反应2 h(TLC跟踪)。缓慢冷却至25 ℃,用5%盐酸洗涤,分液,有机层用饱和碳酸钠溶液洗涤后用水洗至中性,无水硫酸钠干燥,减压蒸除溶剂得白色固体,用丙酮/二氯甲烷重结晶得白色针状固体2 9.93 g,产率84.7%,纯度99.5%(HPLC), m.p.127~129 ℃;1H NMRδ: 5.74 ~ 5.61(m, 1H), 5.10(ddd,J=23.3 Hz, 11.9 Hz, 7.4 Hz, 1H), 5.01(dd,J=13.6 Hz, 6.9 Hz, 1H), 2.50~2.12(m, 4H), 2.13~1.85(m, 3H), 1.89~1.31(m, 10H), 1.14(ddd,J=31.5 Hz, 26.6 Hz, 20.3 Hz, 9H), 1.07~0.87(m, 6H), 0.89~0.61(m, 11H); ESI-MSm/z: 411.4{[M+H]+}。
(2) 3的合成
在反应瓶中加入2 9.60 g (23.4 mmol)和二氯甲烷50 mL,搅拌使其溶解;冷却至-60 ℃,缓慢通入O3/O2混合物,反应至终点(TLC跟踪);停止通入O3/O2,通入氮气15 min(防止过量臭氧溶解在反应液中影响后续分解反应),加入二甲硫醚0.2 mL,反应30 min。减压蒸除溶剂,残余物用甲醇重结晶得淡黄色粉末3 6.94 g,产率90.2%,纯度99.6%[HPLC(流动相:A=乙腈/水/三氟乙酸=70/30/0.1)], m.p.153~156 ℃;1H NMRδ: 9.50 (d,J=3.2 Hz, 1H), 5.65(s, 1H), 2.40~2.26(m, 4H), 2.27~2.16(m, 2H), 2.01~1.88(m, 2H), 1.87~1.74(m, 2H), 1.70~1.57(m, 2H), 1.55~1.26(m, 6H), 1.19(dt,J=13.3 Hz, 4.5 Hz, 1H), 1.17~1.10(m, 4H), 1.06(d,J=6.9 Hz, 3H), 0.99(ddd,J=12.5 Hz, 9.1 Hz, 5.3 Hz, 2H), 0.93~0.83(m, 1H), 0.69(d,J=12.3 Hz, 3H); ESI-MSm/z: 329.4{[M+H]+}。
(3) 4的合成
在反应瓶中加入3 6.57 g(20.0 mmol), DMF 40 mL和1-(1-环己烯基)-哌啶 4.4 mL(26.2 mmol),搅拌下升温至60 ℃使其溶解;降温至40 ℃,加入冰醋酸1.0 mL,氮气保护下保温反应6 h(TLC跟踪)。冷却至-5 ℃(析出淡黄色固体),搅拌10 min,过滤,滤饼用5 mL冰乙腈洗涤,用甲苯重结晶得淡黄色粉末4 7.69 g,产率97.2%,纯度99.6%[HPLC(流动相:A=70/30/0.1)], m.p.118~123 ℃;1H NMRδ: 5.64(s, 1H), 5.35(s, 1H), 2.49(dd,J=10.3 Hz, 4.8 Hz, 4H), 2.40~2.13(m, 5H), 2.01~1.91(m, 1H), 1.92~1.82(m, 1H), 1.82~1.70(m, 3H), 1.61(s, 5H), 1.50(dd,J=10.5 Hz, 5.7 Hz, 6H), 1.43~1.27(m, 4H), 1.11(s, 4H), 1.01~0.93(m, 2H), 0.87(d,J=2.8 Hz, 1H), 0.51(s, 3H); ESI-MSm/z: 396.6{[M+H]+}。
(4) 黄体酮的合成
在反应瓶中加入4 7.4 g (18.7 mmol)和二氯甲烷60 mL,搅拌使其溶解;加入CuCl 38 mg (0.39 mmol),于5 ℃通入空气(流速:0.4~0.6 mmol·min-1),反应6 h(TLC跟踪)。停止通入空气,静置片刻,加入异辛烷20 mL和20%硫酸10 mL,分液,水相用异辛烷(20 mL)萃取,合并有机相,用无水硫酸钠干燥,减压蒸除溶剂,用丙酮重结晶得白色固体黄体酮5.48 g,产率93.1%,纯度99.7%[HPLC(流动相:A=70/30/0.1)], m.p.124~128 ℃;1H NMRδ: 5.74(s, 1H), 2.54(t,J=9.0 Hz, 1H), 2.50~2.25(m, 4H), 2.19(dt,J=12.6 Hz, 5.8 Hz, 1H), 2.13(s, 3H), 2.06(ddd,J=13.2 Hz, 9.4 Hz, 3.0 Hz, 2H), 1.93~1.83 (m, 1H), 1.77~1.62(m, 4H), 1.57(ddd,J=22.1 Hz, 11.1 Hz, 3.2 Hz, 1H), 1.50~1.38(m, 2H), 1.36~1.22(m, 1H), 1.23~1.13(m, 4H), 1.13~0.92(m, 2H), 0.67(s, 3H); ESI-MSm/z: 314.9{[M+H]+}。
2结果与讨论
2.1合成4的反应条件优化
4是一个烯胺类化合物,其合成在酸性条件下由亲核试剂进攻醛基发生亲核加成后再脱水而得。本文分别以哌啶和1-(1-环己烯基)-哌啶为亲核试剂,考察了两种不同的酸对反应的影响,结果见表1。从表1可以看出,在亲核试剂相同的条件下,以对甲基苯磺酸为催化剂时,产率较低。这是因为亲核试剂是仲胺或者叔胺,具有一定的碱性,如果催化剂酸性过强,可能会与亲核试剂结合生成铵盐,从而抑制亲核反应的进行。而在相同的酸性试剂作用下,以1-(1-环己烯基)-哌啶为亲核试剂合成4时产率较高。这是因为哌啶在发生加成缩合反应时会生成一分子水,影响反应继续向产物方向进行,而1-(1-环己烯基)-哌啶在发生加成缩合反应后得到的非水而是环己酮,因为加成过程中产生的水在烯胺正离子水解过程中被消耗了,这大大降低了反应的可逆度,使反应更易于向4的方向进行。另外,1-(1-环己烯基)-哌啶的空间位阻比哌啶大,不易于在3-位上发生加成副反应,增加了亲核加成反应的选择性。综上所述,合成4的较佳反应条件为:以1-(1-环己烯基)-哌啶为亲核试剂,冰醋酸为催化剂,产率97.2%。
表 1不同亲核试剂和酸对4产率的影响
Table 1Effects of different nucleophilic reagents

and acid on the yield of 4
2.2合成黄体酮的反应条件优化
4在铜盐催化下可被空气氧化为黄体酮,该反应主要受催化剂和空气流速的影响。考察了不同铜盐催化剂和不同空气流速对反应的影响,对黄体酮的合成条件进行优化,结果见表 2。
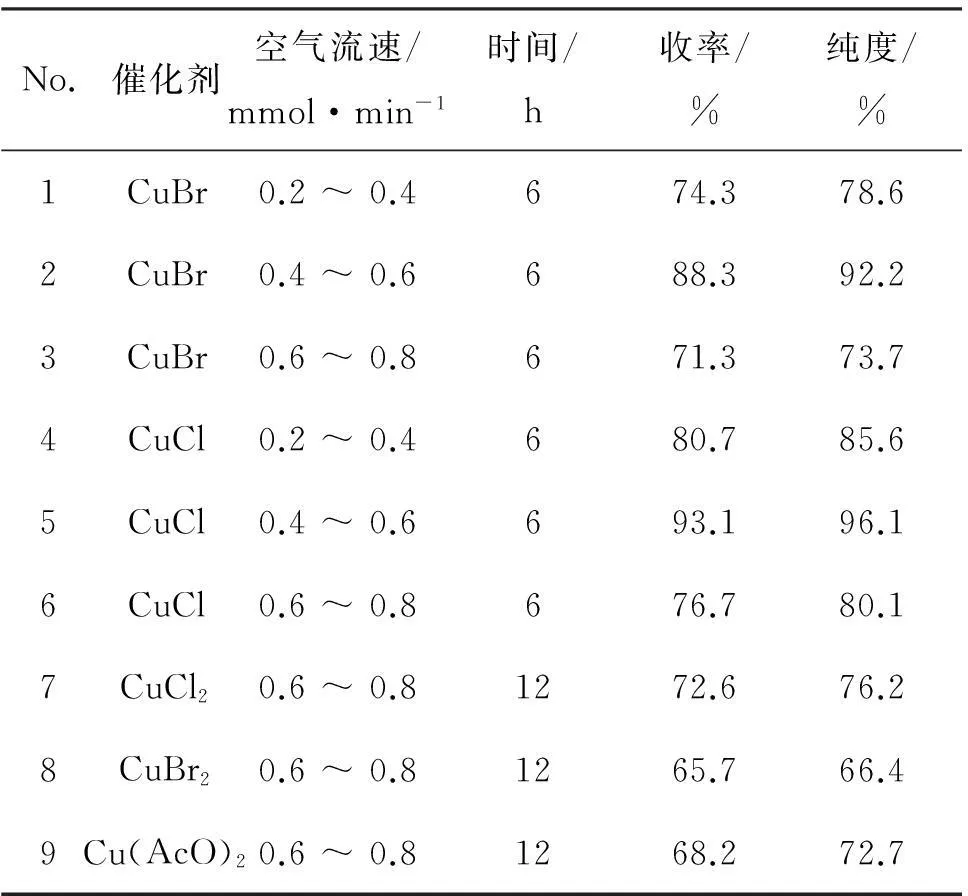
表 2 催化剂和空气流速对黄体酮产率的影响
由表 2可见,不同类型的铜盐作为催化剂,均有一定的催化作用,但是采用二价铜盐作催化剂时(No.7~No.9),反应时间明显比一价铜盐时间要长,且产率和纯度不高,不适合作为该反应的催化剂;而采用一价铜盐作催化剂时,产率和纯度有了明显提高。但是,一价的亚铜盐在空气中容易被氧化,从而导致催化剂失活,因此,需要小心控制空气流速,才能确保反应正常进行。当空气流速为0.4~0.6 mmol·min-1时(No.2),催化效果最好;当空气流速为0.2~0.4 mmol·min-1时(No.1, No.4),反应不完全,产率不高;当空气流速为0.6~0.8 mmol·min-1时,一价铜盐易被氧化,导致催化剂部分失活,产率下降。在比较CuCl和CuBr作催化剂时发现,前者的催化效果略好于后者,产率和纯度更高一些。因此,该反应的最佳反应条件为:以CuCl为催化剂,空气流速为0.4~0.6 mmol·min-1时,于5 ℃反应6 h,产率93.1%。
3结论
以植物甾醇为原料分离得豆甾醇,后经沃氏氧化、臭氧化、加成缩合和CuCl催化氧化合成黄体酮,总收率69.1%。
该合成路线具有以下优点:(1)植物甾醇是从各种食用植物油的下脚料中分离提取的,属于各种食用油副产物的综合利用且来源广泛,资源充足;(2)从源头上避免了如薯蓣皂素提取过程中产生的废水、废渣的环境污染问题;(3)采用清洁的空气作为氧化剂代替重金属铬试剂进行氧化,大大减少了污染物的排放,有利于环境保护。
参考文献
[1]周维善, 庄治平. 甾体化学进展[M].北京:科学出版社,2002:204.
[2]Irving M S. Progesterone antagonists and progesterone receptor modulators:An overview[J].Steroids,2003,68:981-993.
[3]Dess D B, Martin J C. A useful 12-I-5 triacetoxyperiodinane(the Dess-Martin periodinane) for the selective oxidation of primary or secondary alcohol and a variety of related 12-I-5 species[J].J Am Chem Soc,1991,113(19):7277-7287.
[4]林吉文. 甾体化学基础[M].北京:化学工业出版社,1989.
[5]聂凌鸿,林淑英,宁正祥. 薯蓣属植物中薯蓣皂苷元的研究的研究进展[J].中国生化药物杂志,2004,25(5):318-320.
[6]陈学文,胡晓帆. 南水北调中线工程核心水源区水环境安全分析与对策[J].中国环境管理,2005,(3):9-12.
[7]Poulos A, Greiner J W, Fevig G A. Separation of sterols by countercurrent crystallization[J].Ind Eng Chem,1961,53(12):949-962.
[8]Sundararama P, Djerassi C. A convenient synthesis of progesterone from stigmasterol[J]. J Org Chem,1977,42(22):3633-3644.
[9]Heyl F W, Herr, M E. Progesterone from 3-acetoxybisnor-5-cholenaldehydle and 3-ketobisnor-4-cholenaldehyde[J].J Am Chem Soc,1950,72:2617-2619.
[10]Shepherd, D A, Donia R A, Campbell J A,etal. A synthesis of progesterone from ergosterol[J].J Am Chem Soc,1955,77:1212-1215.
[11]John M B, Portage M. Bisnoraldehyde-22-enamine process:US 4 257 949[P].1981.
[12]Roman P H, Kalamazoo M. Oxidation of 22-tertiary amino steroids:US 2 752 368[P].1956.
[13]Rheenen V V. Copper-catalysed oxygenation of enamines[J].Chem Commun,1969,314-315.
[14]Verlan H V, Portage M. Novel chemical process:US 3 661 942[P].1972.
Process Improvement on the Synthesis of Progesterone
WU Qing-an1,2,XU Zhi-chao1*,BAI Ting2
(1. College of Chemical Engineering, Zhejiang University of Technology, Hangzhou 310014, China;
2. Shanghai New Hualian Pharmaceutical Co. Ltd., Shanghai 201419, China)
Abstract:Stigmasterol(1) was separated from phytosterol. The intermediate, 3-ketobisnor-4-cholenaldehyde(3) was prepared through oppenauer oxidation and ozonation from 1. Progesterone was synthesized by addition-condensation and oxygenation catalyzed by cuprous chloride from 3. The overall yield was 69.1%. The structure was confirmed by1H NMR and ESI-MS.
Keywords:phytosterol; progesterone; oxygenation; drug synthesis; process improvement
作者简介:吴庆安(1962-),男,汉族,湖南新田人,博士,副研究员,硕士生导师,主要从事有机合成和天然生物活性物质的化学修饰研究。 E-mail: wuqa@nhl-pharm.com
收稿日期:2015-01-28;
修订日期:2015-11-03
中图分类号:O629.23; R914.5
文献标志码:A
DOI:10.15952/j.cnki.cjsc.1005-1511.2016.02.15036
