丹参酮ⅡA对脂质运载蛋白2诱导人脐静脉内皮细胞损伤的影响研究
2016-03-01刘中勇
万 强,刘中勇
·论著·
·中医·中西医结合研究·
丹参酮ⅡA对脂质运载蛋白2诱导人脐静脉内皮细胞损伤的影响研究
万 强,刘中勇
目的 探讨丹参酮ⅡA对脂质运载蛋白2(LCN-2)诱导人脐静脉内皮细胞(HUVEC)损伤的保护作用及其与细胞外信号调节蛋白激酶1/2(ERK1/2)信号转导通路的关系。方法 2015年3—5月将HUVEC分为不同浓度组:分别以0、5、10、20 μmol/L LCN-2作用HUVEC 48 h;不同作用时间组:分别以10 μmol/L LCN-2作用HUVEC 0、12、24、48 h;不同药物干预组:对照组(未做任何处理)、LCN-2组(LCN-2 10 μmol/L刺激48 h)、LCN-2+丹参酮ⅡA组(10 μmol/L丹参酮ⅡA预处理HUVEC 1 h后再加10 μmol/L LCN-2刺激48 h)、LCN-2+PD98059组〔PD98059(终浓度20 μmol/L)预处理HUVEC 30 min后再加10 μmol/L LCN-2刺激48 h〕。采用四甲基偶氮唑盐比色法(MTT法)检测细胞增殖〔吸光度(A值)〕,流式细胞术检测细胞凋亡,酶联免疫吸附试验(ELISA)法检测上清液中白介素6(IL-6)、单核细胞趋化蛋白1(MCP-1)表达水平,Western blotting法检测HUVEC中B淋巴细胞癌2(Bcl-2)、Bcl-2相关X蛋白(Bax)、磷酸化细胞外信号调节蛋白激酶1/2(p-ERK1/2)表达水平。结果 与0 μmol/L组和5 μmol/L组比较,10 μmol/L组、20 μmol/L组A值、Bcl-2表达水平下降,细胞凋亡率、IL-6、MCP-1、Bax、p-ERK1/2表达水平升高(P<0.05);与10 μmol/L组比较,20 μmol/L组IL-6、MCP-1表达水平升高(P<0.05)。与0 h组比较,24 h组MCP-1表达水平升高(P<0.05);与0 h组和24 h组比较,48 h组、72 h组A值、Bcl-2表达水平下降,细胞凋亡率、IL-6、MCP-1、Bax、p-ERK1/2表达水平升高(P<0.05);与48 h组比较,72 h组IL-6表达水平升高,Bcl-2、p-ERK1/2表达水平下降(P<0.05)。与对照组比较,LCN-2组、LCN-2+丹参酮ⅡA组、LCN-2+PD98059组A值、Bcl-2表达水平下降,细胞凋亡率、IL-6、MCP-1、Bax表达水平升高,LCN-2组及LCN-2+丹参酮ⅡA组p-ERK1/2表达水平升高(P<0.05);与LCN-2组比较,LCN-2+丹参酮ⅡA组、LCN-2+PD98059组A值、Bcl-2表达水平升高,细胞凋亡率、IL-6、MCP-1、Bax、p-ERK1/2表达水平下降(P<0.05);与LCN-2+丹参酮ⅡA组比较,LCN-2+PD98059组A值、p-ERK1/2表达水平下降,细胞凋亡率、IL-6、MCP-1、Bcl-2、Bax表达水平升高(P<0.05)。结论 丹参酮ⅡA可通过抑制ERK1/2信号转导通路,减轻LCN-2诱导的HUVEC损伤。
丹参酮ⅡA;脂笼蛋白质类;细胞外信号调节MAP激酶类;人脐静脉内皮细胞
万强,刘中勇.丹参酮ⅡA对脂质运载蛋白2诱导人脐静脉内皮细胞损伤的影响研究[J].中国全科医学,2016,19(9):1086-1090.[www.chinagp.net]
Wan Q,Liu ZY.Effect of tanshinone ⅡA on human umbilical vein endothelial cell injury induced by lipocalin-2[J].Chinese General Practice,2016,19(9):1086-1090.
脂质运载蛋白2(lipocalin-2,LCN-2)又名中性粒细胞明胶酶脂质运载蛋白(neutrophil gelatinase-associated lipocalin,NGAL),是一种新型脂肪细胞因子。内皮细胞损伤、凋亡是动脉粥样硬化(atherosclerosis,AS)进程的起始阶段[1]。研究表明,LCN-2可引起内皮细胞损伤从而促进AS形成[2]。丹参酮ⅡA(tanshinone ⅡA)为唇形科植物丹参的主要脂溶性成分,研究表明,丹参酮ⅡA可从多种途径发挥抗AS效应[3],但其机制尚未完全阐明。本实验以人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVEC)为模型,加用丹参酮ⅡA及细胞外信号调节蛋白激酶1/2(extracellular signal-regulated protein kinase 1/2,ERK1/2)信号转导通路特异性阻滞剂PD98059,观察丹参酮ⅡA对LCN-2诱导HUVEC损伤的影响,并探讨其抗AS机制。
1 材料与方法
1.1 细胞与主要试剂 2015年3—5月,HUVEC购于Cascade Biologics公司,丹参酮ⅡA(纯度≥98%)、二甲基亚砜(DMSO)购于美国Sigma公司,胎牛血清购于杭州四季青生物工程材料有限公司,DMEM培养基购于美国Gibco公司,LCN-2购于美国Acrobiosystems公司,PD98059购于美国Tocris Bioscience公司,Annexin V-FITC试剂盒购于美国Bio Vision公司,白介素6(IL-6)、单核细胞趋化蛋白1(MCP-1)酶联免疫吸附试验(ELISA)试剂盒购于美国eBioscience公司,B淋巴细胞癌2(Bcl-2)抗体、Bcl-2相关X蛋白(Bax)抗体、磷酸化细胞外信号调节蛋白激酶1/2(p-ERK1/2)抗体购于美国Cell Signal Technology公司。
1.2 主要仪器 恒温细胞培养箱、超净台、低温高速离心机、酶标仪购于美国Thermo公司,全自动生化仪购于美国Beckman公司,荧光倒置显微镜购于日本奥林巴斯公司,流式细胞仪购于美国ACEA Biosciences公司,电泳仪购于美国Bio-Rad公司。
1.3 研究方法
1.3.1 细胞分组及处理 将HUVEC分为不同浓度组:分别以0、5、10、20 μmol/L LCN-2作用HUVEC 48 h[4]。不同作用时间组:分别以10 μmol/L LCN-2作用HUVEC 0、12、24、48 h。不同药物干预组:(1)对照组(未做任何处理);(2)LCN-2组:LCN-2 10 μmol/L刺激48 h;(3)LCN-2+丹参酮ⅡA组:10 μmol/L丹参酮ⅡA[5]预处理HUVEC 1 h后再加10 μmol/L LCN-2刺激48 h;(4)LCN-2+PD98059组:PD98059(终浓度20 μmol/L[5])预处理HUVEC 30 min后再加10 μmol/L LCN-2刺激48 h。
1.3.2 四甲基偶氮唑盐比色法(MTT法)检测细胞增殖 HUVEC以1×104/孔接种于96孔板,24 h后撤去血清,分组见1.3.1,每组设6个复孔。干预完成后以20 μl MTT (5 g/L)37 ℃孵育4 h,每孔加DMSO 150 μl低速振荡10 min使结晶物溶解,酶标仪测570 nm处吸光度(A值)。
1.3.3 流式细胞术检测细胞凋亡 HUVEC以2×105/孔接种于12孔板,24 h后换无血清培养液,培养24 h,分组见1.3.1,每组设6个复孔。收集细胞,加Annexin V-FITC及碘化丙啶(PI)双染,流式细胞术检测细胞凋亡率。
1.3.4 ELISA法检测IL-6、MCP-1表达水平 取对数生长期的HUVEC以1×105/ml接种于培养皿,分组见1.3.1,每组设6个复孔。收集上清液,ELISA法检测上清液中IL-6、MCP-1表达水平,操作步骤参照说明书。
1.3.5 Western blotting法检测Bcl-2、Bax、p-ERK1/2表达水平 分组见1.3.1,每组设6个复孔,提取HUVEC总蛋白,BCA法测定蛋白浓度,每孔取上清液20 μl加上样缓冲液,100 ℃加热5 min。凝胶电泳转膜至聚偏氟乙烯(PVDF)膜,5%脱脂奶粉室温封闭1 h,一抗(1∶1 000)4 ℃过夜,二抗(1∶2 000)室温孵育1 h,ECL系统显色,以β-actin为内参,采用Image Tool 3.0进行灰度值分析。
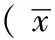
2 结果
2.1 不同浓度及不同作用时间LCN-2对HUVEC的作用 不同浓度组A值、细胞凋亡率、IL-6、MCP-1、Bcl-2、Bax、p-ERK1/2表达水平比较,差异均有统计学意义(P<0.05);其中与0 μmol/L组和5 μmol/L组比较,10 μmol/L组、20 μmol/L组A值、Bcl-2表达水平下降,细胞凋亡率、IL-6、MCP-1、Bax、p-ERK1/2表达水平升高,差异均有统计学意义(P<0.05);与10 μmol/L组比较,20 μmol/L组IL-6、MCP-1表达水平升高,差异均有统计学意义(P<0.05,见表1、图1)。
不同作用时间组A值、细胞凋亡率、IL-6、MCP-1、Bcl-2、Bax、p-ERK1/2表达水平比较,差异均有统计学意义(P<0.05);其中与0 h组比较,24 h组MCP-1表达水平升高,差异有统计学意义(P<0.05);与0 h组和24 h组比较,48 h组、72 h组A值、Bcl-2表达水平下降,细胞凋亡率、IL-6、MCP-1、Bax、p-ERK1/2表达水平升高,差异均有统计学意义(P<0.05);与48 h组比较,72 h组IL-6表达水平升高,Bcl-2、p-ERK1/2表达水平下降,差异均有统计学意义(P<0.05,见表2、图2)。
2.2 不同药物干预对HUVEC的作用 不同药物干预组A值、细胞凋亡率、IL-6、MCP-1、Bcl-2、Bax、p-ERK1/2表达水平比较,差异均有统计学意义(P<0.05);其中与对照组比较,LCN-2组、LCN-2+丹参酮ⅡA组、LCN-2+PD98059组A值、Bcl-2表达水平下降,细胞凋亡率、IL-6、MCP-1、Bax表达水平升高,LCN-2组和LCN-2+丹参酮ⅡA组p-ERK1/2表达水平升高,差异均有统计学意义(P<0.05);与LCN-2组比较,LCN-2+丹参酮ⅡA组、LCN-2+PD98059组A值、Bcl-2表达水平升高,细胞凋亡率、IL-6、MCP-1、Bax、p-ERK1/2表达水平下降,差异均有统计学意义(P<0.05);与LCN-2+丹参酮ⅡA组比较,LCN-2+PD98059组A值、p-ERE1/2表达水平下降,细胞凋亡率、IL-6、MCP-1、Bcl-2、Bax表达水平升高,差异均有统计学意义(P<0.05,见表3、图3)。

表1 不同浓度组A值、细胞凋亡率、IL-6、MCP-1、Bcl-2、p-ERK1/2、Bax表达水平比较
注:A值=吸光度,IL-6=白介素6,MCP-1=单核细胞趋化蛋白1,Bcl-2=B淋巴细胞癌2,Bax=Bcl-2相关X蛋白,p-ERK1/2=磷酸化细胞外信号调节蛋白激酶1/2;与0 μmol/L组比较,aP<0.05;与5 μmol/L组比较,bP<0.05;与10 μmol/L组比较,cP<0.05

表2 不同作用时间组A值、细胞凋亡率、IL-6、MCP-1、Bcl-2、p-ERK1/2、Bax表达水平比较
注:与0 h组比较,aP<0.05;与24 h组比较,bP<0.05;与48 h组比较,cP<0.05

表3 不同药物干预组A值、细胞凋亡率、IL-6、MCP-1、Bcl-2、p-ERK1/2、Bax表达水平比较
注:LCN-2=脂质运载蛋白2;与对照组比较,aP<0.05;与LCN-2组比较,bP<0.05;与LCN-2+丹参酮ⅡA组比较,cP<0.05

注:p-ERK1/2=磷酸化细胞外信号调节蛋白激酶1/2,Bax=Bcl-2相关X蛋白,Bcl-2=B淋巴细胞癌2
图1 Western blotting法检测不同浓度组Bcl-2、Bax、p-ERK1/2的表达水平
Figure 1 Levels of Bcl-2,Bax and p-ERK1/2 expression among different concentration groups detected by Western blotting

图2 Western blotting法检测不同作用时间组Bcl-2、Bax、p-ERK1/2的表达水平
Figure 2 Levels of Bcl-2,Bax and p-ERK1/2 expression among different time groups detected by Western blotting

注:LCN-2=脂质运载蛋白2
图3 Western blotting法检测不同药物干预组Bcl-2、Bax、p-ERK1/2的表达水平
Figure 3 Levels of Bcl-2,Bax and p-ERK1/2 expression among different drugintervention groups detected by Western blotting
3 讨论
LCN-2于中性粒细胞中被发现并分离,是脂质运载蛋白家族的2号成员,相对分子量约25 kDa,广泛分布于肾脏、肺脏、肝脏及小肠等多种组织器官中,具有多种生物学功能,在细胞的增殖与凋亡及炎性反应过程中起调节作用[6]。既往对LCN-2的研究主要集中在肾脏病、感染性疾病及肿瘤等方面,近年来研究表明,LCN-2可作为心血管疾病生物标志物,独立预测心血管事件的发生[7]。AS患者血清LCN-2水平显著升高,且与AS严重程度呈正相关[8],LCN-2水平在AS患者不稳定粥样斑块中亦升高[9],均提示LCN-2与AS形成密切相关。内皮细胞损伤后释放的炎性因子可致单核细胞黏附迁移、中膜平滑肌细胞增生、泡沫细胞堆积形成脂质斑块,最终促进AS形成[1]。IL-6及MCP-1在AS慢性炎症中扮演重要角色,对巨噬细胞、单核细胞的迁移和激活起调控作用,并能促进血管平滑肌细胞(vascular smooth muscle cells,VSMC)增殖,参与AS形成过程[10]。Bcl-2基因家族蛋白中的促凋亡蛋白Bax和抑凋亡蛋白Bcl-2的比例对细胞凋亡起直接调控作用[11]。Bax可通过与细胞外膜的电压依赖性阴离子通道(voltage dependent anion channel,VDAC)或细胞内膜的腺苷转位因子(adenine nucleotide translocator,ANT)的结合,介导线粒体膜上的膜通透性孔道的开放,促进细胞凋亡,而Bcl-2可通过与Bax竞争性结合ANT,或直接阻止Bax与VDAC、ANT结合以发挥其抗凋亡效应[12]。本研究结果显示,LCN-2可抑制HUVEC增殖、上调HUVEC内Bax/Bcl-2比例,以促进HUVEC凋亡、诱导分泌IL-6及MCP-1等从而加重HUVEC损伤。
ERK1/2信号转导通路是丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPKs)家族分支之一,ERK1/2可通过一系列级联磷酸化将细胞外信号转导至细胞核内,调控HUVEC的多种基因转录,在构建细胞骨架、维持细胞形态、调节细胞增殖及凋亡等生物学进程中起重要作用[13],该信号转导通路的激活可通过促进VSMC增殖、炎性细胞浸润等促进AS形成[14]。既往研究证实,p-ERK1/2参与了HUVEC中炎性因子表达的调控[15]。本研究结果显示,LCN-2可呈浓度及作用时间依赖性诱导HUVEC中p-ERK1/2表达水平的增加,并诱导分泌炎性因子IL-6及MCP-1,加重HUVEC损伤,提示LCN-2对HUVEC的损伤作用可能与激活ERK1/2信号转导通路有关。
丹参酮ⅡA能通过抗氧化应激、抗炎、调节血脂、抑制平滑肌细胞增殖和迁移、减少巨噬细胞浸润等多种途径发挥抗AS效应[3,16-17]。研究表明,丹参酮ⅡA的抗AS机制与抑制ERK1/2信号转导通路密切相关,丹参酮ⅡA可通过抑制ERK1/2信号转导通路下调c-fos表达水平,显著抑制颈动脉球囊损伤大鼠VSMC增殖并减少血管内膜增生,从而延缓AS进程[18]。但丹参酮ⅡA是否可通过抑制ERK1/2信号转导通路,减轻LCN-2诱导的HUVEC损伤而抗AS尚不清楚。本研究结果证实,丹参酮ⅡA及PD98059均可显著降低HUVEC中p-ERK1/2表达水平、减轻LCN-2诱导的HUVEC增殖抑制、下调Bax/Bcl-2比例以抑制HUVEC凋亡、降低IL-6及MCP-1表达水平,提示丹参酮ⅡA的抗AS机制可能通过抑制ERK1/2信号转导通路,减轻LCN-2诱导的HUVEC损伤得以实现,此发现有望为丹参酮ⅡA在AS防治中的应用提供新依据。丹参酮ⅡA对LCN-2抑制HUVEC增殖、诱导HUVEC凋亡、促进分泌IL-6及MCP-1、调节Bax表达水平的作用强于PD98059,这可能是HUVEC内存在其他信号转导通路,且各信号转导通路间相互作用的结果。丹参酮ⅡA可能也通过其他信号转导通路参与了减轻LCN-2诱导的HUVEC损伤过程。丹参酮ⅡA的抗AS作用机制和临床应用仍需大量基础实验及临床试验研究加以明确。
作者贡献:万强进行实验实施、评估、资料收集、撰写论文、成文、进行质量控制及审校;刘中勇进行实验设计与实施、资料收集整理、并对文章负责。
本文无利益冲突。
[1]Vanhoutte PM.Endothelial dysfunction:the first step toward coronary arteriosclerosis[J].Circ J,2009,73(4):595-601.
[2]Liu JT,Song E,Xu A,et al.Lipocalin-2 deficiency prevents endothelial dysfunction associated with dietary obesity:role of cytochrome P450 2C inhibition[J].Br J Pharmacol,2012,165(2):520-531.
[3]Chen FY,Guo R,Zhang BK,et al.Advances in cardiovascular effects of tanshinone ⅡA[J].China Journal of Chinese Materia Medica,2015,40(9):1649-1653.(in Chinese) 陈芬燕,郭韧,张毕奎,等.丹参酮ⅡA的心血管药理作用研究进展[J].中国中药杂志,2015,40(9):1649-1653.
[4]Lin HH,Liao CJ,Lee YC,et al.Lipocalin-2-induced cytokine production enhances endometrial carcinoma cell survival and migration[J].Int J Biol Sci,2011,7(1):74-86.
[5]Liu Z,Wang J,Huang E,et al.Tanshinone ⅡA suppresses cholesterol accumulation in human macrophages:role of heme oxygenase-1[J].J Lipid Res,2014,55(2):201-213.
[6]Bolignano D,Coppolino G,Lacquaniti A,et al.From kidney to cardiovascular diseases:NGAL as a biomarker beyond the confines of nephrology[J].Eur J Clin Invest,2010,40(3):273-276.
[7]Wu G,Li H,Fang Q,et al.Elevated circulating lipocalin-2 levels independently predict incident cardiovascular events in men in a population-based cohort[J].Arterioscler Thromb Vasc Biol,2014,34(11):2457-2464.
[8]Lee YH,Lee SH,Jung ES,et al.Visceral adiposity and the severity of coronary artery disease in middle-aged subjects with normal waist circumference and its relation with lipocalin-2 and MCP-1[J].Atherosclerosis,2010,213(2):592-597.
[9]te Boekhorst BC,Bovens SM,Hellings WE,et al.Molecular MRI of murine atherosclerotic plaque targeting NGAL:a protein associated with unstable human plaque characteristics[J].Cardiovasc Res,2011,89(3):680-688.
[10]Ahearn J,Shields KJ,Liu CC,et al.Cardiovascular disease biomarkers across autoimmune diseases[J].Clin Immunol,2015,161(1):59-63.
[11]Besbes S,Mirshahi M,Pocard M,et al.New dimension in therapeutic targeting of Bcl-2 family proteins[J].Oncotarget,2015,6(15):12862-12871.
[12]Czabotar PE,Lessene G,Strasser A,et al.Control of apoptosis by the Bcl-2 protein family:implications for physiology and therapy[J].Nat Rev Mol Cell Biol,2014,15(1):49-63.
[13]Sun LF,An DQ.Research progress on mechanism of inflammatory signaling pathway in atherosclerosis and the intervention of traditional Chinese medicine[J].Chinese Journal of Arteriosclerosis,2015,23(11):1177-1181.(in Chinese) 孙龙飞,安冬青.炎性信号通路在动脉粥样硬化中的机制与中医药干预作用研究进展[J].中国动脉硬化杂志,2015,23(11):1177-1181.
[14]Wang J,Razuvaev A,Folkersen L,et al.The expression of IGFs and IGF binding proteins in human carotid atherosclerosis,and the possible role of IGF binding protein-1 in the regulation of smooth muscle cell proliferation[J].Atherosclerosis,2012,220(1):102-109.
[15]Duan J,Yang Y,Liu H,et al.Osthole ameliorates acute myocardial infarction in rats by decreasing the expression of inflammatory-related cytokines,diminishing MMP-2 expression and activating p-ERK[J].Int J Mol Med,2016,37(1):207-216.
[16]尹金泉,李宝生,朱春鹏,等.丹参酮ⅡA对48例急性期脑出血患者疗效和安全性研究[J].中国煤炭工业医学杂志,2014,17(1):132-134.
[17]肖辉,宁倩,李乐军.丹参酮ⅡA磺酸钠注射液治疗急性脑梗死的临床观察[J].中国临床医生,2013,41(12): 39.
[18]Li X,Du JR,Yu Y,et al.Tanshinone ⅡA inhibits smooth muscle proliferation and intimal hyperplasia in the rat carotid balloon-injured model through inhibition of MAPK signaling pathway[J].J Ethnopharmacol,2010,129(2):273-279.
(本文编辑:陈素芳)
Effect of Tanshinone ⅡA on Human Umbilical Vein Endothelial Cell Injury Induced by Lipocalin-2
WANQiang,LIUZhong-yong.DepartmentofMedicalCardiology,AffiliatedHospitalofJiangxiUniversityofTraditionalChineseMedicine,Nanchang330006,China
Objective To investigate the protective effect of tanshinone ⅡA on human umbilical vein endothelial cell (HUVEC) injury induced by lipocalin-2 (LCN-2) and its relation with ERK1/2 signal transduction pathway.Methods From March to May in 2015,HUVEC were divided into different concentration groups:(0,5,10 and 20 μmol/L LCN-2 for 48 h),different time groups:(10 μmol/L LCN-2 for 0,12,24 and 48 h) and different drug intervention groups:control group,LCN-2 group (10 μmol/L LCN-2 for 48 h),LCN-2+tanshinone ⅡA group (10 μmol/L tanshinone ⅡA for 1 h then 10 μmol/L LCN-2 for 48 h) and LCN-2+PD98059 group (20 μmol/L PD98059 for 30 min then 10 μmol/L LCN-2 for 48 h).MTT assay was used to detect cell proliferation and flow cytometry was used to detect cell apoptosis;the levels of interleukin-6(IL-6) and monocyte chemotactic protein-1 (MCP-1) were determined by enzyme-linked immuno-sorbent assay (ELISA),and the levels of Bcl-2,Bax and p-ERK1/2 in HUVEC were determined by Western blotting.Results Compared with 0 μmol/L group and 5 μmol/L gruop,10 μmol/L group and 20 μmol/L group were significantly lower in A value and the level of Bcl-2 but were significantly higher in apoptosis rate,the levels of IL-6,MCP-1,Bax and p-ERK1/2(P<0.05).Compared 10 μmol/L group,20 μmol/L group was higher in the levels of IL-6 and MCP-1 (P<0.05).Compared with 0 h group,24 h group was higher in the level of MCP-1 (P<0.05).Compared with 0 h group and 24 h group,48 h group and 72 h group were lower in A value and the level of Bcl-2 but were higher in apoptosis rate and the levels of IL-6,MCP-1,Bax and p-ERK1/2 (P<0.05).Compared with 48 h group,72 h group was higher in the level of IL-6 but was lower in the levels of Bcl-2 and p-ERK1/2 (P<0.05).Compared with control group,LCN-2 group,LCN-2+tanshinone ⅡA group and LCN-2+PD98059 group were lower in A value and the level of Bcl-2 but were higher in apoptosis rate and the levels of IL-6,MCP-1,Bax and LCN-2 group,LCN-2+tanshinone ⅡA group were higher in the level of p-ERK1/2 (P<0.05).Compared with LCN-2 group,LCN-2+tanshinone ⅡA group and LCN-2+PD98059 group were higher in A value and the level of Bcl-2 but were lower in apoptosis rate and the levels of IL-6,MCP-1,Bax and p-ERK1/2 (P<0.05).Compared with LCN-2+tanshinone ⅡA group,LCN-2+PD98059 group was lower in A value and the level of p-ERK1/2 but was higher in apoptosis rate and the levels of IL-6,MCP-1,Bcl-2 and Bax(P<0.05).Conclusion Tanshinone ⅡA attenuates HUVEC injury induced by LCN-2 and its mechanism may be related to the inhibition of ERK1/2 signal transduction pathway.
Tanshinone ⅡA;Lipocalins;Extracellular signal-regulated MAP kinases;Human umbilical vein endothelial cells
国家自然科学基金资助项目(81460680);江西省科技计划资助项目(20135BBG70002)
330006 江西省南昌市,江西中医药大学附属医院心血管病科
刘中勇,330006 江西省南昌市,江西中医药大学附属医院心血管病科;E-mail:liuzhongyong2014@163.com
R 363
A
10.3969/j.issn.1007-9572.2016.09.021
2015-06-14;
2016-01-12)
