博斯腾湖河鲈早期发育阶段关键生境特征的调查
2016-02-26马燕武陈牧霞谢春刚
陈 朋,马燕武,祁 峰,陈牧霞,谢春刚,李 红
(新疆维吾尔自治区水产科学研究所,乌鲁木齐 830000)
博斯腾湖河鲈早期发育阶段关键生境特征的调查
陈朋,马燕武,祁峰,陈牧霞,谢春刚,李红
(新疆维吾尔自治区水产科学研究所,乌鲁木齐830000)
摘要:为研究博斯腾湖河鲈(Percafluviatilis)早期发育阶段繁殖水域的生境特征,于2014年3 -4月对白海子及相邻水域的水体理化因子、鱼类组成、高等水生植物、底栖动物群落结构进行了调查。结果表明:河鲈在3月进入繁殖期,4月结束;虽然鱼类种类组成相似,但繁殖期白海子河鲈优势度明显高于相邻水域,白海子是河鲈主要繁殖水域;繁殖期水温8~17 ℃,繁殖盛期水温11~14 ℃,繁殖水深(1.4±0.2) m,DO(6.8±0.1) mg/L,pH 7.9,电导率(46.5±0.4) ms/m,矿化度(351.7±2.4) mg/L,总磷(0.02±0.00) mg/L,总氮(1.18±0.07) mg/L,氨氮(0.98±0.00) mg/L,叶绿素a(0.32±0.01) μg/L;白海子高等水生植物由臭轮藻(Charafoetida)单一群落构成,覆盖率约88.1%,密度和生物量分别为6154.7 ind/m2和8346.4 g/m2,相邻水域则由金鱼藻(Ceratophyllumdemersum)、狐尾藻(Myriophyllum)、竹叶眼子菜(Potamogetonmalaimus)和白睡莲(NymphaeaalbaLinn)等群落构成,覆盖率约66.7%,密度和生物量分别为171.7 ind/m2和2 097.8 g/m2。白海子采集底栖动物5种,为羽摇蚊(ChironomusplumosusLarve)幼虫、小斑蜻(Libellulaquadrimaculata)幼虫、长叶瘦蟌(Ischnuraelegans)幼虫、耳萝卜螺(Radixauricularia)和扁旋螺(Gyrauluscomperssus),总密度和总生物量分别为23 150 ind/m2、76.663 g/m2;其中,栖于底泥的底栖动物仅羽摇蚊幼虫,密度和生物量分别为(736.0±117.2)ind/m2、(7.478±1.320)g/m2,附着于臭轮藻茎叶表面的底栖动物有羽摇蚊幼虫、小斑蜻幼虫、长叶瘦蟌幼虫、耳萝卜螺和扁旋螺,密度和生物量分别为22 414 ind/m2、69.185 g/m2。相邻水域底泥及水生植物茎叶表面均未采集到底栖动物。水温、透明度及水深是影响河鲈繁殖水域分布的主要水环境因素,而附卵基质则是主要的生物因素;河鲈选择臭轮藻作为附卵基质有着明显的倾向性,其在避害、栖息、摄食等方面发挥重要功能。
关键词:博斯腾湖,河鲈(Percafluviatilis),繁殖期,产卵场
1材料与方法
1.1调查时间及范围
调查时间:河湖解冻后不久,河鲈开始繁殖[8]。因此,根据博斯腾湖解冻日期,调查时间设定为2014年3月30日~4月30日。
调查范围:根据口碑资料,博斯腾湖河鲈产卵场主要分布于西南小湖区的白海子,因此,将白海子作为河鲈产卵场的重点调查水域。同时调查白海子邻近水域阿洪口及过渡水域(连接阿洪口与白海子的航道)(图1)。白海子水面约1.916 km2,阿洪口水面约1.624 km2。
点位设置:如图1所示,水体理化环境和底栖动物调查点位设置9个,其中,白海子设置为B1、B2、B3,阿洪口设置为A1、A2、A3,过渡水域设置为G1、G2、G3;淹没区水生植物的调查采用网状布点,原则上点与点之间的距离0.2 km;鱼类标本取自调查水域箔网渔获物,其中,白海子设置箔网95个网兜,阿洪口设置箔网100个网兜,过渡水域未设置网具。

图1 博斯腾湖河鲈产卵场位置及调查点位设置图
1.2调查方法
产卵场位置的确定:依据口碑资料,结合现场调查,确定产卵场位置。产卵场位置的确定符合以下条件:在繁殖期,进入产卵场的产卵群体数量处于优势种群或相对较多的状态;进入产卵场的产卵群体雌性性腺发育至Ⅳ~Ⅵ期,雄鱼基本处于流精状态[11]。
爱德华不是一个好的讲解员,他只会指着一间间教室说:这里是食品技术教室,那里是舞蹈教室……总是他先开个头,校长再做详细介绍,弄得爱德华十分难为情。
产卵场环境调查:依据《内陆水域渔业自然资源调查手册》对调查水域水体理化因子、底栖动物、高等水生植物、鱼类资源进行采样及定性、定量研究[12]。通过产卵场与非产卵场生境要素的对比,分析河鲈关键生境生态要素的基本特征。河鲈产卵群体性腺发育的研究仅针对性腺发育分期进行。
繁殖期的确定:通过繁殖期进入产卵场产卵群体资源量及其排空率时间变化规律的分析,确定繁殖期的重要时间节点。本研究以性腺发育至Ⅵ期或Ⅵ期转Ⅱ期雌性群体定义为产空群体,渔获物中产空群体数量占产卵群体数量的比重定义为排空率,以百分数表示。
数据收集与分析:河鲈产卵群体及其它鱼类材料来源于2014年3月30日至4月30日调查水域唯一捕捞网具——箔网渔获物(2 a=3 cm)的抽样;产卵场的准确位置用GPS定位;透明度使用透明度盘测量;水深、水温及水化因子使用便携式多功能水质分析仪(Hydrolab ds5)测定。鱼类群落优势种成分分析选用Pinkas的相对重要性指数IRI[13]。IRIi=Fi/M(Ni/N+Wi/W)×100,式中,N为群落中所有物种数量,Ni为第i个物种数量,W为群落中所有物种生物量,Wi为第i种物种生物量,M为取样次数,Fi为第i种鱼在M次取样中出现次数。将相对重要性指数IRI值>10的定为优势种[14]。数据采用Excel 2007和SPSS17.0进行处理。
2结果与分析
2.1鱼类群落结构特征

显然,白海子与阿洪口鱼类物种组成差异较小,但群落优势种结构明显不同。就河鲈优势度而言,白海子明显高于阿洪口,说明调查期间河鲈聚集于白海子,印证了白海子是河鲈的产卵场。

表1 调查水域箔网渔获物物种组成及优势度
2.2河鲈繁殖群体特征
白海子河鲈渔获量具有明显的时间变化规律,反映了进入产卵场产卵群体数量的变化(图2)。河鲈日渔获量的变化经历了逐渐递增期、迅速增加期、迅速减少期和逐渐减少期4个阶段。逐渐递增期(3月30日~4月8日)日渔获量由0.6 kg增加至10.0 kg;迅速增加期(4月9日~11日)日渔获量由23.0 kg增加至45.0 kg;迅速减少期(4月13日~17日)日渔获量由18.0 kg减少至4.0 kg;逐渐减少期(4月21日~29日),日渔获量由4.0 kg减少至0.2 kg。
白海子渔获物河鲈排空率具有明显的时间变化规律,反映了繁殖期各阶段的时间节点(图3)。河鲈排空率经历了逐渐升高期、迅速升高期和缓慢升高期3个阶段。逐渐升高期(3月30日~4月8日)排空率由12.5%升至31.5% kg;迅速升高期(4月9日~17日)排空率由54.1%迅速升至95.2%;逐渐升高期(4月21日~29日)排空率由96.3%升至100%。
由此可见,3月底,博斯腾湖解冻后不久(水温约8 ℃),河鲈进入繁殖期;10 d后进入繁殖盛期,繁殖盛期持续约1周(本阶段水温约11-14 ℃);4月底繁殖期结束(水温约17 ℃);繁殖期约持续1个月。

图2 白海子河鲈日渔获量变化规律
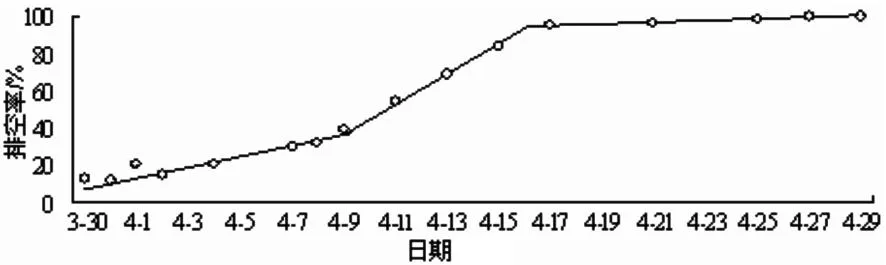
图3 白海子渔获物中河鲈排空率变化规律
2.3水体理化因子
由表2可知,白海子叶绿素a明显低于过渡水域和阿洪口;DO和氨氮明显低于过渡水域、高于阿洪口;水温、矿化度、总磷、总氮与过渡水域无显著差异,但明显高于阿洪口。

表2 水体理化因子特征
注:调查时间为2014年4月14日11时。
2.4高等水生植物群落结构
白海子仅有臭轮藻(Charafoetida)分布(表3)。臭轮藻株间交错缠绕,匍匐于湖底;片状分布,覆盖率约88.1%,密度和生物量分别为6 154.7 ind/m2和8 346.4 g/m2。阿洪口分布有金鱼藻(Ceratophyllumdemersum)、穗状狐尾藻(Myriophyllumspicatum)、竹叶眼子菜(Potamogetonmalaimus)和白睡莲(Nymphaeaalba)。植株株间距大,直立浮于水中;具有白睡莲群落、竹叶眼子菜群落、金鱼藻+穗状狐尾藻群落、金鱼藻+竹叶眼子菜群落和金鱼藻+穗状狐尾藻+竹叶眼子菜群落多个群落类别;片状或斑块状分布,覆盖率约66.7%,密度和生物量分别为171.7 ind/m2和2 097.8 g/m2。
显然,白海子高等水生植物的种类组成及种群形态明显不同于阿洪口,覆盖率、密度和生物量亦明显高于阿洪口。

表3 高等水生植物种类组成、分布特征及现存量
2.5大型底栖动物群落结构
白海子共采集到大型底栖动物5种,有羽摇蚊(Ch.gr.plumosus)幼虫、小斑蜻(Libellulaquadrimaculata)幼虫、长叶瘦蟌(Ischnuraelegans)幼虫、耳萝卜螺(Radixauricularia)和扁旋螺(G.compressus),总密度和总生物量分别为23 150 ind/m2、76.663 g/m2(表4)。底栖动物栖息于底泥或附着于臭轮藻茎叶表面。底泥中仅采集到羽摇蚊幼虫,密度和生物量分别为(736.0±117.2) ind/m2、(7.478±1.320) g/m2。臭轮藻茎叶表面附着有羽摇蚊幼虫、小斑蜻幼虫、长叶瘦蟌幼虫、耳萝卜螺和扁旋螺。其中,羽摇蚊幼虫现存量最高,其次为耳萝卜螺、小斑蜻幼虫、长叶瘦螅幼虫、扁旋螺。阿洪口和过渡水域未采集到大型底栖动物。

表4 白海子大型底栖动物种类组成及现存量
3讨论
3.1河鲈产卵场水体理化环境特性
Snickars等[15]认为水温和透明度是影响基质产卵型鱼类产卵场分布的重要理化因子。对于深水湖泊,水温可以影响河鲈产卵场的分布水深[16]。Lake Höytiäinen表层水温高于14 ℃时,河鲈产卵场主要分布于水深4 m以上的水域,表层水温低于12 ℃时,产卵场主要分布于12 m以下的水域[16]。白海子、过渡水域和阿洪口是水深小于3 m的浅水湖泊,水温在13.4-13.9间小幅变化,尚不足以影响博斯腾湖西南小湖区河鲈产卵场的分布。
Cech等[17]认为,水体的透明度可以限制河鲈产卵场的分布水深。透明度是光照透入水中的程度。不同鱼类受精卵发育要求的光照条件不同,有些鱼类的卵适应在光线较差的深水层,抑或在极黑暗的底质内避光发育,有些在光线充足的条件下才能正常发育[18]。自然水体,河鲈产卵场多分布于水深3 m以上的水域[17,19-21 ];但为躲避风浪,亦可分布于有合适附卵基质的深水区,不过这些水体的透明度高于河鲈产卵场的分布水深[17,22-24]。本次调查水域,白海子清澈见底,而阿洪口和过渡水域透明度则小于水深。表明河鲈受精卵的发育需要一定的光照强度,产卵场主要分布于透明度以内的水域。
3.2河鲈对附卵基质的选择特性
对沉性或沉粘性卵鱼类来说,卵和仔鱼期最大的潜在危险是缺氧,被淤泥掩盖以及微生物和捕食者捕食等,附卵基质往往成为这些鱼类产卵场重要的生态要素,亦是这些鱼类资源增殖效率的重要影响因素[18]。朱邦科等[25]认为缺乏良好的附卵基质是限制保安湖鲤资源增殖的主要因素。关于河鲈产卵场的生境特征,凌去非等[8]认为河鲈天然产卵场应是有水草的区域,以便卵带附着。Snickars等[15]认为,基质产卵型鱼类产卵场分布最重要的影响因素是附卵基质类型的选择。水生植物以及枯死的树枝、灌木均可作为河鲈的附卵基质[9,16,17,23,26]。本次调查的3个水域,仅在白海子臭轮藻表面采集到了河鲈卵带。可见,臭轮藻可以作为河鲈的附卵基质。河鲈附卵基质通常由植被的类型决定,坚固程度高、结构复杂的植被更易于卵带的附着[15]。臭轮藻株间距狭小,株间交错缠绕,匍匐于湖底,种群厚度10-30 cm,河鲈卵带漂浮或嵌于其表面,避免风浪扰动而沉于湖底。而分布于阿洪口的白睡莲、金鱼藻、狐尾藻和竹叶眼子菜株间距大,植株直立浮于水中,河鲈卵带因粘性弱而无法牢固附着于这类植株。可见,河鲈对附卵基质具有明显的选择性,以卵易附着且能够远离水底为先,臭轮藻是河鲈理想的附卵基质。
3.3河鲈附卵基质的功能
臭轮藻不仅可以作为河鲈的附卵基质,也是天然饵料的培养场所、幼鱼的避敌栖息场所。调查发现,白海子水域臭轮藻茎叶表面附着有丰富的底栖动物和水生昆虫,生物量高达69.185 g/m2,而阿洪口未采集到底栖动物和水生昆虫。河鲈幼鱼阶段具有自残行为,这一阶段幼鱼可以捕食小型底栖动物和水生昆虫[4,9]。充足的饵料资源一定程度上可以弱化河鲈幼鱼的自残,同时交错缠绕和广泛分布的臭轮藻亦为其提供了良好的避敌和栖息场所。此外,白海子臭轮藻茎叶表面附着了丰富的有机碎屑。有机碎屑是大弹涂鱼、七鳃鳗等鱼类的重要开口饵料[27,28]。有机碎屑是否是白海子河鲈鱼苗阶段的饵料资源还有待于进一步研究。综上所述,博斯腾湖白海子水域河鲈的附卵基质是河鲈受精卵发育场所、天然饵料培育场所及幼鱼避敌、栖息场所,起到了“一基三场”的作用,是河鲈早期发育阶段重要的生态要素。
3.4河鲈资源保护建议
长期以来,白海子是博斯腾湖河鲈的主要捕捞水域,且主要在繁殖期进行。这种捕捞方式无疑加剧了河鲈资源的衰退。2004年9月1日起施行的《新疆维吾尔自治区实施〈渔业法〉办法(修订草案)》明确规定,博斯腾湖自3月1日起全湖进入禁渔期,至6月20日结束,为期112天,而地方渔业行政主管部门及生产单位尚未严格执行该规定。为了保护博斯腾湖河鲈资源,建议一是要严格执行关于博斯腾湖禁渔期的规定,坚决取缔白海子3-4月一切渔业生产活动;二是积极采取措施保护白海子水域臭轮藻资源;三是根据附卵基质的特质及水温、透明度等非生物环境要素甄别、寻找博斯腾湖可能存在的河鲈其它的产卵场,并加以保护。
致谢:博湖县博斯腾湖管理局张立局长为本研究的采样、渔业生产资料的收集工作提供了帮助,在此表示由衷的感谢。
参考文献:
[1]严安生.额尔齐斯河、乌伦古湖、博斯腾湖的主要经济鱼类[C].新疆动物学会论文选集,1964:1-20.
[2]郭焱,张人铭,蔡林刚,等.博斯腾湖鱼类资源及渔业[M].乌鲁木齐:新疆科学出版社,2005,154.
[3]陈朋,马燕武,谢春刚,等.博斯腾湖鱼类群落结构的初步研究[J].淡水渔业,2014,44(2):33-39.
[4]唐富江,姜作发,阿达可白克·可尔江,等.新疆乌伦古湖河鲈食性变化的研究[J].水产学杂志,2005,21(1):49-52.
[5]唐富江,姜作发,阿达可白克·可尔江,等.新疆乌伦古湖河鲈二十年来种群生长变化及原因[J].湖泊科学,2009,21(1):117-122.
[6]黄诚.新疆乌伦古湖河鲈(Percafluviatilis)种群的生长模型及生态参数的研究[J].南京大学学报,1993,129(2):271-277.
[7]黄诚,葛家春,刘仁华.新疆河鲈繁殖生态学参数的解析[J].水产养殖,1996,(3):16-18.
[8]凌去非,姚化章.河鲈人工繁育[J].科学养鱼,1998,12:1-20.
[9]张育霖,王合全.河鲈鱼苗(水花)培育试验[J].河北渔业,2011,(10):37-38.
[10]Cech M,Peterka J,Riha M,et al.Extremely shallow spawning of perch (PercafluviatilisL.):the roles of sheltered bays,dense semi-terrestrial vegetation and low visibility in deeper water Reproduction de la perche en eau très peu profonde (PercafluviatilisL.):rle des baies abritées,de la végétation semi-terrestre dense et de la faible visibilité dans les eaux plus profondes[J].Knowl Manag Aquat Ecosyst,2012,406:9.
[11]蔡林钢,牛建功,李红,等.巩乃斯河新疆裸重唇鱼和斑重唇鱼产卵场微环境研究[J].干旱区研究,2013,30(1):6-8.
[12]张觉民,何志辉.内陆水域渔业自然资源调查手册[M].北京:农业出版社,1991:50-80.
[13]钱迎倩,马克平.生物多样性研究的原理与方法[M].北京:中国科学技术出版社,1994:141-165.
[14]张涛,庄平,刘健,等.长江口崇明东滩鱼类群落组成和生物多样性[J].生态学杂志,2009,28(10):2056-2062.
[15]Snickars M,Sundblad G,Sandström A,et al.Habitat selectivity of substrate-spawning fish:modelling requirements for the Eurasian perchPercafluviatilis.[J].Mar Ecol Prog Ser,2010,398(6):235-243.
[16]Gillet C,Dubois J.A survey of the spawning of perch (Percafluviatilis),pike (Esoxlucius),and roach (Rutilusrutilus),using artificial spawning substrates in lakes[J].Hydrobiologia,1995,300-301(1):409-415.
[17]Cech M,Peterka J,Riha M,et al.Deep spawning of perch (PercafluviatilisL.) in the newly created Chabarovice Lake,Czech Republic[J].Hydrobiologia,2010,649(1):375.
[18]殷名称.鱼类生态学[M].北京:中国农业出版社,2005:105-145.
[19]Thorpe J.Synopsis of biological data on the perchPercafluviatilisLinnaeus,1758 and Perca flavescens Mitchill,1874 [M].FAO Fisheries Synopsis,1977,113:138.
[20]Viljanen M,Holopainen I.Population density of perch (PercafluviatilisL.) at egg,larval and adult stages in the dys-oligotrophic Lake Suomunja rvi,Finland [J].Ann Zool Fenn,1982,19:39-46.
[21]Treasurer J W.Estimates of egg and viable embryo production in a lacustrine perchPercafluviatilis[J].Environm Biol Fish,1983,8(1):3-16.
[22]Dubois J,Gillet S,Bonnet Y,et al.Correlation between the size of mature female perch (PercafluviatilisL.) and the width of their egg strands in Lake Geneva [J].Ann Zool Fenn,1996,33:417-420.
[23]Cech M,Peterka J,Riha M,et al.Distribution of egg strands of perch (PercafluviatilisL.) with respect to depth and spawning substrate[J].Hydrobiologia,2009,630(1):105-114.
[24]Probst W,Stoll S,Hofmann H,et al.Spawning site selection by Eurasian perch (PercafluviatilisL.) in relation to temperature and wave exposure[J].Ecol Freshwat Fish,2009,18(1):1-7.
[25]朱邦科,谢从新,阳会军,等.保安湖主要经济鱼类产卵场调查[J].水利渔业,1998,(4):6-8.
[26]Thorpe J.Bimodal distribution of length of juvenile Atlantic salmon (SalmosalarL.) under artificial rearing conditions[J].J Fish Biol,1977,11(2):175-184.
[27]张其永,张杰.大弹涂鱼仔鱼的摄食、生长和成活的研究[J].水产学报,1988,12(3):203-211.
[28]Trent M,Sutton S.Significance of organic detritus in the diet oflarvalLampreysin the Great Lakes Basin[J].Can J Fish Aquat Sci,1994,51(11):2380-2387.
(责任编辑:张红林)
Survey on habitat characteristics of key perch in
early developmental stage of Perca fluviatilis in Bositeng Lake
CHEN Peng,MA Yan-wu,QI Feng,CHEN Mu-xia,XIE Chun-gang,LI Hong
(XinjiangFisheryResearchInstitute,Urumqi830000,China)
Abstract:To find out breeding area ofPercafluviatilisand master habitat characteristics of its early developmental stage,physical and chemical factor of water,fish composition,and community structure of aquatic higher plant and benthic animal in Baihaizi and adjacent waters were investigated during March to April,2014.The Results showed thatP.fluviatilisstarted breeding in March and ended in April.Although fish composition was similar,Baihaizi had a higher degree of dominance than adjacent waters in breeding season;Baihaizi was the principal breeding site ofP.fluviatilis.Water temperature was at 8-17 ℃ during breeding stage,and was at 11~14 ℃ during peak period.Water depth of breeding area was (1.4±0.2) m,DO was (6.8±0.1) mg/L,pH was 7.9,conductivity was (46.5±0.4) ms/m,salinity was 351.7±2.4 mg/L,total phosphorus was (0.02±0.00) mg/L,total nitrogen was (1.18±0.07) mg/L,ammonia nitrogen was(0.98±0.00) mg/L,and chlorophyll a was (0.32±0.01) μg/L.The single community ofCharafoetidaconstituted the aquatic higher plant of Baihaizi,its fraction of coverage was about 88.1%,density was 6 154.7 ind/m2,and biomass was 8 346.4 g/m2.The plants of adjacent waters were composed ofCeratophyllumdemersum,Myriophyllum,PotamogetonmalaimusandNymphaeaalbaLinn communities,with coverage rate of 66.7%,density of 171.7 ind/m2,and biomass of 2 097.8 g/m2.Five benthic animals were collected in Baihaizi,it wasChironomusplumosusLarve,Libellulaquadrimaculata,Ischnuraelegans,RadixauriculariaandGyrauluscomperssu,total density and biomass was 23 150 ind/m2and 76.663 g/m2,respectively.Chironomusplumosuslarve inhabited in bottom sediment,its density and biomass was (736.0±117.2)ind/m2and (7.478±1.320) g/m2;all five species inhabited in stem leaf surface ofC.foetida,its density and biomass was 22 414 ind/m2and 69.185 g/m2.No benthic animals were collected from bottom sediment and stem leaf surface in adjacent waters.Water temperature,transparency and depth were main water environment factors impacting the distribution of breeding area,and adhesive material was the principal biological factor.P.fluviatilisshowed an obvious tendency to chooseC.foetidaas adhesive material;the materials played an important role in avoiding disadvantages,inhabiting and feeding.
Key words:Percafluviatilis,Bositeng Lake,breeding period,spawning ground
中图分类号:S931.1
文献标识码:A
文章编号:1000-6907-(2016)01-0039-07
作者简介:第一陈朋(1983-),男,工程师,主要从事渔业生态与鱼类资源保育。E-mail:cpeng11@sina.com通讯作者:马燕武。E-mail:myw0012@126.com
收稿日期:2015-04-09;
修订日期:2015-07-24
资助项目:公益性行业农业科研专项(201303056-8)
