新型丙烯海松酸基双噻二唑化合物的合成及其抗真菌活性
2016-02-25韦有杰段文贵林桂汕刘陆智杨章旗
岑 波, 韦有杰, 段文贵*, 林桂汕, 刘陆智, 杨章旗
(1. 广西大学 化学化工学院,广西 南宁 530004; 2. 广西林业科学研究院,广西 南宁 530002)
·研究论文·

通信联系人: 段文贵,教授,博士生导师, E-mail: wgduan@gxu.edu.cn
新型丙烯海松酸基双噻二唑化合物的合成及其抗真菌活性
岑波1, 韦有杰1, 段文贵1*, 林桂汕1, 刘陆智1, 杨章旗2
(1. 广西大学 化学化工学院,广西 南宁530004; 2. 广西林业科学研究院,广西 南宁530002)
摘要:松香与丙烯酸经Diels-Alder环加成反应制得丙烯海松酸(1); 将1转化为双酰氯后与2-氨基-5-取代苯基-1,3,4-噻二唑经N-酰化反应合成了8个新型的丙烯海松酸基双噻二唑化合物(4a~4h),其结构经1H NMR,13C NMR, IR和元素分析表征。抗真菌活性测试结果表明,在用药量为50 μg·mL-1时,4d(R=m-Cl)对苹果轮纹病菌、花生褐斑病菌和小麦赤霉病菌的抑制率分别为66.9%, 57.8%和52.9%。
关键词:松香; 丙烯海松酸; 双噻二唑; 合成; 抗真菌活性
Synthesis and Antifungal Activities of
松香是我国的天然优势生物质资源。丙烯海松酸(1)是松香中的枞酸型树脂酸与丙烯酸发生Diels-Alder加成反应得到的二元羧酸,多元酸和稠合多脂环刚性结构的特征使其在聚酯树脂[1]、环氧树脂[2]和聚氨酯树脂[3]等高分子材料的制备中得到广泛应用。显然,若对其两个羧基进行改性,可能合成多种新型松香基功能性衍生物。1,3,4-噻二唑是由两个氮原子和一个硫原子构成的五元杂环,其衍生物具有抗菌[4]、除草[5]、杀虫[6]、抗肿瘤[7]、抗病毒[8]及植物生长调节[9]等广泛的生物活性,已成为农药和医药领域的研究热点。
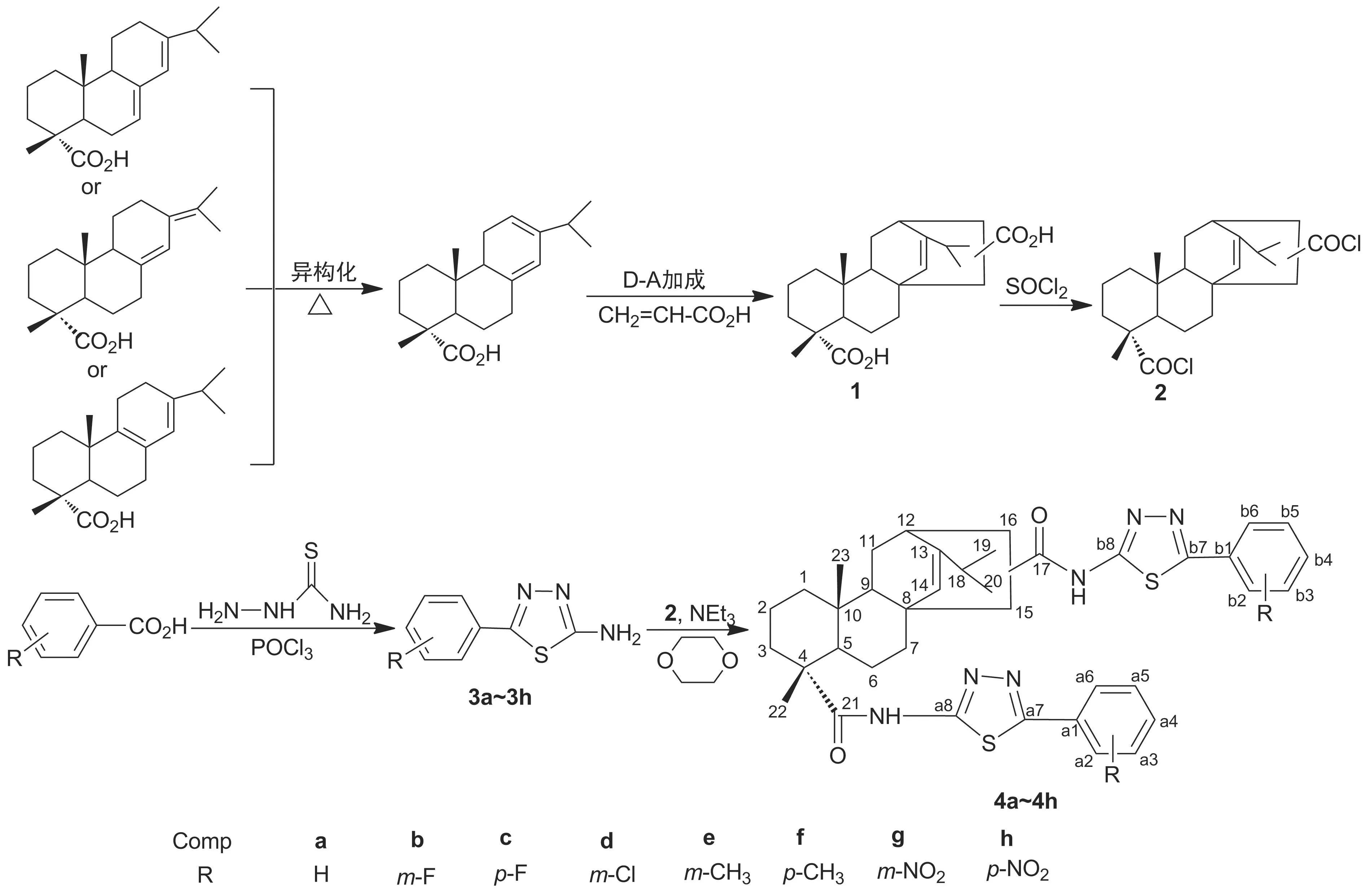
Scheme 1
近年来,本课题组对松香松节油基生物活性化合物开展了大量研究,取得了系列研究成果[5-6,9-18]。在此基础上,本文进一步对松香树脂酸进行改性研究。将1转化为其双酰氯(2),再与2-氨基-5-取代苯基-1,3,4-噻二唑(3a~3h)经N-酰化反应合成了8个新型的丙烯海松酸基双噻二唑化合物(4a~4h,Scheme 1),其结构经1H NMR,13C NMR, IR和元素分析表征。并初步测试了其抗真菌活性,以期为松香的深加工利用提供新的途径。
1实验部分
1.1 仪器与试剂
X-4型数字显微熔点仪(温度未校正);Bruker AV 600MHz型核磁共振仪(DMSO-d6为溶剂,TMS为内标);Nicolet Nexus 470 FT-IR型红外光谱仪(KBr压片);PE 2400Ⅱ型元素分析仪。
1[14], 2[15]和3a~3h[19-20]按文献方法合成;特级松香(酸值177 mg KOH·g-1),广西梧州松脂股份有限公司;其余所用试剂均为分析纯。
1.2 合成
(1) 4a~4h的合成(以4a为例)
在双口瓶中加入2-氨基-5-苯基-1,3,4-噻二唑(3a)1.77 g(5 mmol),二氧六环20 mL和三乙胺2 mL,回流搅拌使其溶解;缓慢滴加2 1.03 g(2.5 mmol)的二氯甲烷(15 mL)溶液,滴毕;反应至终点(TLC跟踪)。倒入100 mL去离子水中(析出大量固体),抽滤,滤饼干燥后经硅胶柱层析[洗脱剂:V(二氯甲烷) ∶V(乙酸乙酯)=1 ∶1]纯化得白色固体4a,收率41%。
用类似方法合成白色或淡黄色固体4b~4h。
1.3 抗真菌活性测试
采用琼脂稀释法测。将供试化合物溶解在丙酮中,用200 μg·mL-1sorporl-144乳化剂稀释为500 μg·mL-1药液。取药液1 mL,注入培养皿内,然后加入9 mL PSA培养基,最终制成浓度为50 μg·mL-1含供试药平板。将培养好的供试菌用打孔器打取直径5 mm菌饼,置于含药平板内,每皿3块呈等边三角形排放。以不加药剂的平板做空白对照。置(24±1) ℃培养箱内培养48 h,计量各处理菌丝扩展直径,并与对照平板直径相比较,计算相对抑制百分率。活性分级指标:A级:≥90%; B级:70~90%; C级:50~70%; D级:<50%。
2结果与讨论
2.1 合成与表征
在4的合成中,因3不溶于二氯甲烷等溶剂,但可溶于DMF及高温的二氧六环。实验结果表明,以DMF为溶剂时反应收率很低,甚至没有产物生成。二氧六环为溶剂,在升温至90 ℃以上时3能较好地溶解,在反应体系中加入三乙胺作为缚酸剂,以39%~44%的收率合成4。
4的实验结果,IR和元素分析数据见表1, NMR数据见表2。
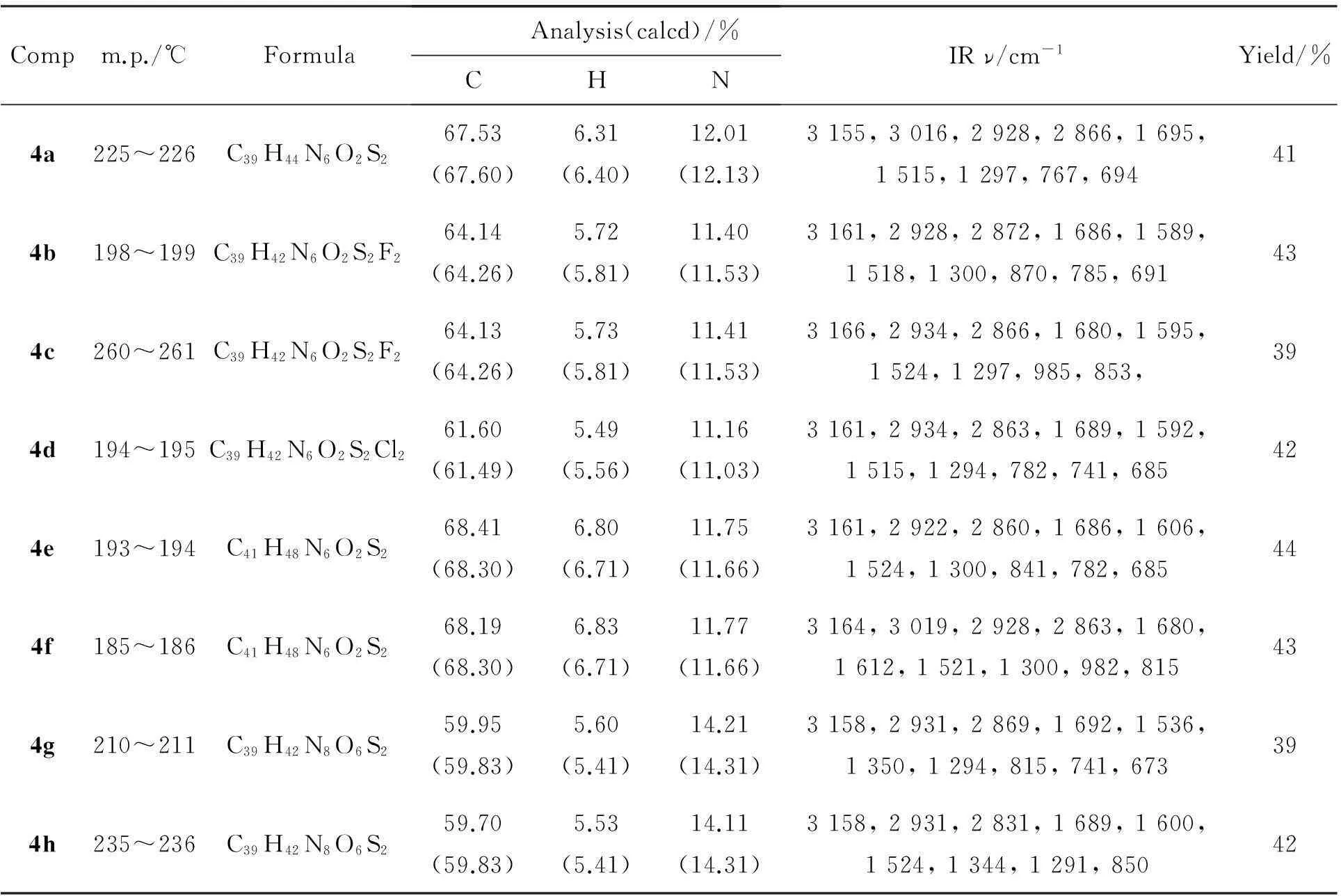
表1 4的实验数据和IR数据

表2 4的NMR数据
续表2

Comp1HNMRδ(J/Hz)13CNMRδ4c8.00~7.29(m,8H,ArH),5.27(s,1H,14-H),3.50(brs,2H,NH),2.34~2.32(m,1H,18-H),1.80(d,J=11.5,1H,16-H),1.74(d,J=11.3,1H,12-H),1.67~1.23(m,16H,1,2,3,5,6,7,9,11,15-H),1.13(s,3H,22-H),1.01(d,J=9.1,6H,19,20-H),0.54(s,3H,23-H)173.65,163.99,162.34,160.04,158.80,154.22,147.54,129.06,129.00,127.14,123.15,116.39,116.25,56.01,55.34,51.83,49.43,46.08,40.90,40.05,37.86,36.68,34.28,33.01,32.29,26.97,21.3920.40,20.38,18.53,16.91,15.744d12.66~12.44(m,2H,NH),7.99~7.55(m,8H,ArH),5.27(s,1H,14-H),2.32(dt,J=11.4,5.6,1H,18-H),1.81~1.79(m,1H,16-H),1.69(d,1H,12-H),1.63~1.29(m,16H,1,2,3,5,6,7,9,11,15-H),1.20(s,3H,22-H),1.02(dd,J=4.9,1.7,6H,19,20-H),0.56(s,3H,23-H)179.66,173.27,160.28,160.60,158.60,158.47,147.80,133.98,132.20,131.24,130.17,126.09,125.63,122.80,55.19,54.83,51.82,51.62,49.24,48.01,47.10,45.96,40.91,40.05,37.67,36.46,34.15,32.88,20.42,20.37,16.67,16.33,15.704e12.50~12.30(m,2H,N-H),7.76~7.30(m,8H,ArH),5.27(s,1H,14-H),2.38~2.32(m,6H,CH3),2.17(dd,J=13.2,7.6,1H,18-H),1.93~1.91(m,1H,16-H),1.81~1.30(m,17H,1,2,3,5,6,7,9,11,12,15-H),1.92(s,3H,22-H),0.95~1.06(m,6H,19,20-H),0.58(s,3H,23-H)175.84,173.17,161.83,161.57,159.48,158.06,147.22,138.74,131.08,130.24,129.21,127.29,124.07,123.02,54.85,54.74,51.85,48.62,48.05,47.09,46.92,40.90,40.80,40.05,37.63,36.53,34.77,37.18,27.18,20.87,20.85,16.83,16.41,15.844f12.49~12.28(m,2H,NH),7.83~7.29(m,8H,ArH),5.27(s,1H,14-H),2.38~2.34(m,6H,CH3),2.29(dd,J=13.6,6.7,1H,18-H),2.16(dd,J=9.6,5.6,1H,16-H),1.80(m,J=13.2,1H,12-H),1.20~1.61(m,16H,1,2,3,5,6,7,9,11,15-H),1.18(s,3H,22-H),0.99(dd,J=11.9,5.3,6H,19,20-H),0.59(s,3H,23-H)175.75,173.12,163.89,161.80,159.24,157.83,147.82,142.15,129.96,129.87,127.63,126.85,126.78,123.02,55.25,51.84,49.27,48.62,48.04,47.08,46.90,45.98,40.89,40.11,37.62,36.47,35.20,34.72,32.28,20.95,20.44,16.81,16.36,15.834g12.79~12.53(m,2H,NH),8.70~7.78(m,8H,ArH),5.27(s,1H,14-H),2.34(dd,J=13.0,6.4,1H,18-H),1.82(d,J=9.6,1H,16-H),1.70(d,J=13.4,1H,12-H),1.63~1.30(m,16H,1,2,3,5,6,7,9,11,15-H),1.21(s,3H,22-H),1.03(dd,J=6.5,1.6,6H,19,20-H),0.55(s,3H,23-H)179.72,173.38,159.42,158.95,148.30,147.91,133.16,131.78,131.08,124.71,122.84,120.80,55.19,51.65,49.24,47.15,46.99,45.96,40.93,40.83,40.05,37.67,37.25,36.46,34.17,32.88,32.28,20.30,16.52,15.694h12.78~12.54(m,2H,NH),8.37~8.18(m,8H,ArH),5.28(s,1H,14-H),2.30~2.35(m,1H,18-H),1.79~1.90(m,2H,12,16-H),1.30~1.62(m,16H,1,2,3,5,6,7,9,11,15-H),1.22(s,3H,22-H),1.03(dd,J=5.3,3.5,6H,19,20-H),0.62(s,3H,23-H)179.71,173.36,160.72,159.41,148.16,147.63,136.16,127.87,124.47,123.00,55.19,54.71,51.85,49.25,48.60,46.99,45.96,40.82,40.05,37.63,36.45,32.21,28.42,26.99,20.33,16.35,15.93,11.21
由表1可知,3 150~3 170 cm-1处为N-H吸收峰;3 010 cm-1处为苯环上C-H伸缩振动吸收峰;2 950 cm-1和2 860 cm-1处分别为甲基和亚甲基上C-H伸缩振动吸收峰;1 680~1 690 cm-1处为C=O伸缩振动吸收峰;1 520 cm-1附近吸收峰为苯环骨架和噻二唑环中C=N伸缩振动吸收峰;1 300 cm-1处为羰基C-N伸缩振动吸收峰;680~900 cm-1为苯环上取代基位置的吸收峰。
由表2中1H NMR分析可看出,由于N-H处于羰基和噻二唑环之间,同时受两个基团诱导效应的影响,H上的电子云密度大大降低,其吸收峰向低场移动,化学位移变大,出现在δ12.12~12.79。由于苯环与噻二唑环形成共轭,苯环上的取代基也会对N-H的化学位移产生影响,当苯环上连有吸电子基(如F, Cl和NO2)时, N-H的化学位移较苯环上连有推电子基(如CH3)时较大。苯环上H位于去屏蔽区,其化学位移较大,吸收峰出现在δ7.29~8.70。苯环上氢质子的化学位移同样会受到苯环上取代基电子效应的影响,连有吸电子基时化学位移变大,反之则变小。菲环骨架上的氢质子吸收峰出现在δ5.30~0.60。
由表2中13C NMR分析可知,羰基碳吸收峰
出现在δ173左右,4a~4h中新生成的N=C碳吸收峰在δ163左右,苯环上碳的化学位移由于受到不同取代基的影响波动较大,吸收峰出现在δ115~150,具体由取代基及其位置而定。菲环骨架上饱和碳的化学位移在δ65以下(包括苯环上的甲基)。
2.2 抗真菌活性
4对黄瓜枯萎病菌(Fusariumoxysporumf.cucumerinum),苹果轮纹病菌(Physalosporapiricola),番茄早疫病菌(Alternariasolani),花生褐斑病菌(Cercosporaarachidicola)和小麦赤霉病菌(Fusariumgraminearum)的抗菌活性结果见表3。由表3可见,在用药量为50 μg·mL-1时, 4对苹果轮纹病菌显示一定的抑制活性,有5个化合物的抑制率大于50.0%,其中4c(R=p-F), 4d(R=m-Cl)和4e(m-CH3)的抑制活性最好,抑制率均为66.9%。4对其他四种植物病原菌只有弱的抑制活性,其中4d(R=m-Cl) 对花生褐斑病菌和小麦赤霉病菌的抑制率分别为57.8%和52.9%。显然,4d(R=m-Cl)对苹果轮纹病菌、花生褐斑病菌和小麦赤霉病菌的抑制作用均为最好,抑制率分别为66.9%, 57.8%和52.9%,值得进一步研究。

表3 4的抗菌活性*
*c(4)= 50 μg·mL-1
3结论
以松香为原料,设计并合成了8个新型的丙烯海松酸基双噻二唑化合物(4a~4h)。初步抗真菌活性测试结果表明:用药量为50 μg·mL-1时, 4d(R=m-Cl)对苹果轮纹病菌、花生褐斑病菌和小麦赤霉病菌的抑制作用最好,抑制率分别为66.9%, 57.8%和52.9%,值得进一步研究。
参考文献致谢:杀菌活性由南开大学元素有机化学研究所生测室完成,谨表谢意!
[1]谢晖,商士斌,王定选. 水溶性丙烯海松酸聚酯的合成及性能研究[J].林产化学与工业,2001,21(1):51-55.
[2]夏建陵,商士斌,谢晖,等. 丙烯酸改性松香基环氧树脂的合成研究[J].林产化学与工业,2002,22(3):15-18.
[3]谢晖,程芝. 丙烯海松酸聚氨酯涂料的研制[J].林产化学与工业,1998,18(3):67-73.
[4]Foroumadi A, Soltani F, Moshafi M H,etal. Synthesis andinvitroantibacterial activity of someN-(5-aryl-1,3,4-thiad-iazole-2-yl) piperazinyl quinolone derivatives[J].Il Farmaco,2003,58:1023-1028.
[5]Duan W G, Li X R, Ma X L,etal. Synthesis and herbicidal activity of 5-dehydroabiety-1,3,4-thiadiazole derivatives[J]. Chemistry and Industry of Forest Products,2011,31(1):1-8.
[6]Li F Y, Mo Q J, Duan W G,etal. Synthesis and insecticidal activities ofN-(5-dehydroabietyl-1,3,4-thiadiazol-2-yl)-benzenesulfonamides[J].Medicinal Chemistry Research,2014,23(10):4420-4426.
[7]郑开波,何俊,张杰. 含1,3,4-噻二唑的5-氟尿嘧啶衍生物的合成及其抗肿瘤活性[J].华西药学杂志,2008,23(5):528-530.
[8]薛伟,宋宝安,汪华,等. 2-[5-(3,4,5-三甲氧基苯基)-1,3,4-噻二唑-2-基硫代]-1-(2,3,4-三甲氧基)苯乙酮肟醚合成与抗烟草花叶病毒活性研究[J].有机化学,2006,26(5):702-706.
[9]Lin G S, Ma C H, Duan W G,etal. Synthesis and biological activities ofα-pinene-based dithiadiazoles[J].Holzforschung,2014,68(1):75-82.
[10]Lin G S, Dong S Q, Duan W G,etal. Synthesis and biological activities of maleated rosin-based dithiourea compounds[J].Holzforschung,2014,68(5):549-554.
[11]马献力,陈丽,段文贵,等. 脂肪族二酸二烷基双去氢枞基双噁二唑的合成及除草活性[J].有机化学,2011,31(7):1069-1075.
[12]许雪棠,冷芳,段文贵,等. 马来松香酸酰腙类化合物的合成及杀菌活性[J].农药学学报,2012,14(3):253-259.
[13]莫启进,段文贵,马献力,等. 2-取代酰胺基-5-去氢枞基-1,3,4-噻二唑衍生物的合成及杀菌活性[J].化学通报,2012,75(2):160-165.
[14]李宇彬,段文贵,陈秋菊,等. 丙烯海松酸基双酰胺类化合物的合成及生物活性的研究[J].化学试剂,2012,34(1):9-5,54.
[15]韦有杰,段文贵,李宇彬,等. 丙烯海松酸基双酰腙类化合物的合成及生物活性研究[J].化学试剂,2012,34(9):797-805.
[16]闵方倩,段文贵,林桂汕,等. 新型去氢枞酸基磺酰胺化合物的合成及其生物活性[J].合成化学,2014,22(3):281-287.
[17]林桂汕,邹荣霞,段文贵,等. 新型蒎酸基双酰腙类化合物的合成及其除草活性[J].合成化学,2013,21(5):513-517.
[18]石贤春,许雪棠,段文贵,等. 马来松香基双磺酰胺化合物的合成及杀菌活性初探[J].林产化学与工业,2014,34(1):62-72.
[19]Tu G G, Li S H, Huang H M. Novel aminopeptidase N inhibitors derived from 1,3,4-thiadiazole scaffold[J].Bioorganic & Medicinal Chemistry,2008,16(14):6663-6688.
[20]王子云,詹秀环. 5-(4-甲氧基苯基)-2-芳酰胺基-1,3,4-噻二唑的合成[J].周口师范学院学报,2008,25(5):66-80.
Novel Acrylpimaric Acid-based Dithiadiazole Compounds
CEN Bo1,WEI You-jie1,DUAN Wen-gui1*,
LIN Gui-shan1,LIU Lu-zhi1, YANG Zhang-qi2
(1. College of Chemistry and Chemical Engineering, Guangxi University, Nanning 530004, China;
2. Guangxi Academy of Forestry, Nanning 530002, China)
Abstract:Acrylpimaric acid(1) was synthesized by Diels-Alder cycloaddition reaction of rosin with acrylic acid, then converted to its dichloride(2). Eight novel acrylpimaric acid-based dithiadiazole compounds(4a~4h) were synthesized by N-acylation reaction of 2 with 2-amino-5-substituted phenyl-1,3,4-thiadiazoles. The structures were characterized by1H NMR,13C NMR, IR and elemental analysis. Antifungal activities tests showed that inhibition rates of 4d(R=m-Cl) against Physalospora piricola, Cercospora arachidicola and Fusarium graminearum were 66.9%, 57.8% and 52.9%, respectively, at 50 μg·mL-1.
Keywords:rosin; acrylpimaric acid; dithiadiazole; synthesis; antifungal activity
中图分类号:O621.3
文献标志码:A
DOI:10.15952/j.cnki.cjsc.1005-1511.2016.01.15046
作者简介:岑波(1964-),男,汉族,广西岑溪人,副教授,主要从事天然资源化学和有机合成研究。
基金项目:国家自然科学基金资助项目(31060100); 广西自然科学基金重点资助项目(2010GXNSFD013013); 八桂学者专项资助(松树资源培育及产业化关键技术创新)
收稿日期:2015-02-03;
修订日期:2015-10-15
