听觉诱发中潜伏期反应研究进展*
2016-02-23彭贤,符秋养,王涛
听觉诱发中潜伏期反应研究进展*
彭贤1综述符秋养2王涛1审校
网络出版时间:2015-12-2815:13
网络出版地址:http://www.cnki.net/kcms/detail/42.1391.R.20151228.1513.022.html
听觉诱发中潜伏期反应(middle latency response, MLR)是较早发现的听觉诱发电位(auditory evoked potential, AEP)成分,常用于中枢听觉通路的功能评估。通过研究MLR的主要成分,可以了解MLR的参数、形态、起源、作用和应用范围,进一步探讨其与听觉通路生理变化的关系,并可以检测中枢神经病变和功能改变。但是由于MLR产生机理尚未明确,加上听觉系统神经活动复杂,容易受到多种因素的影响,因此在临床应用方面不如听性脑干反应(auditory brainstem response, ABR)普及,很多临床医生对它的了解和重视程度也不够。本文综述了MLR的主要特性和若干具有前景的应用,主要介绍MLR主要成分的起源和近年来兴起的高刺激率技术对MLR的影响,以及MLR在麻醉、听觉系统发育成熟及老化等研究中的应用。
1MLR的特性
1.1MLR的成分记录AEP的中潜伏期一般定义为刺激后10~50 ms,如果仅限于研究MLR的成分,也可采用10~80 ms。MLR出现在ABR之后,可分为早期和晚期两个部分,包括四个主波成分(图1),其中早期部分包括16 ms左右出现的负波Na和25 ms左右出现的正波Pa;晚期部分包括36 ms左右出现的负波Nb和50 ms左右出现的正波Pb,Pb也可以归于晚潜伏期反应的P1波,或者称为颅顶反应的P50,其特性较不稳定,有时甚至缺失。MLR电生理特性受很多因素影响,包括刺激声参数、记录参数及受试者状态等。在临床应用时,实验参数的标准化设置十分重要。典型MLR的记录电极在顶部Fz位。由于刺激声引起的头皮肌肉反射也在记录期间出现,故需特别注意排除肌电位的干扰,尤其是采用乳突参考电极时,耳后肌反射导致的肌源性反应可能十分突出,其潜伏期主要与Na重叠,强度可以达到MLR的十多倍,为避免干扰,参考电极可以选择侧颈部或乳突下。MLR记录设备的带宽可选择5~1 000 Hz,后处理阶段再采用10~500 Hz的数字滤波。常规方式记录MLR的刺激率10 Hz左右,具体数值需要根据所在地使用的工频数值(指采用交流电源的频率)调整,以避免平均时出现工频同相增强。
*国家自然科学基金基金资助(61172033,61271154)
1南方医科大学生物医学工程学院(广州510515);2广东省第二人民医院耳鼻咽喉-头颈外科
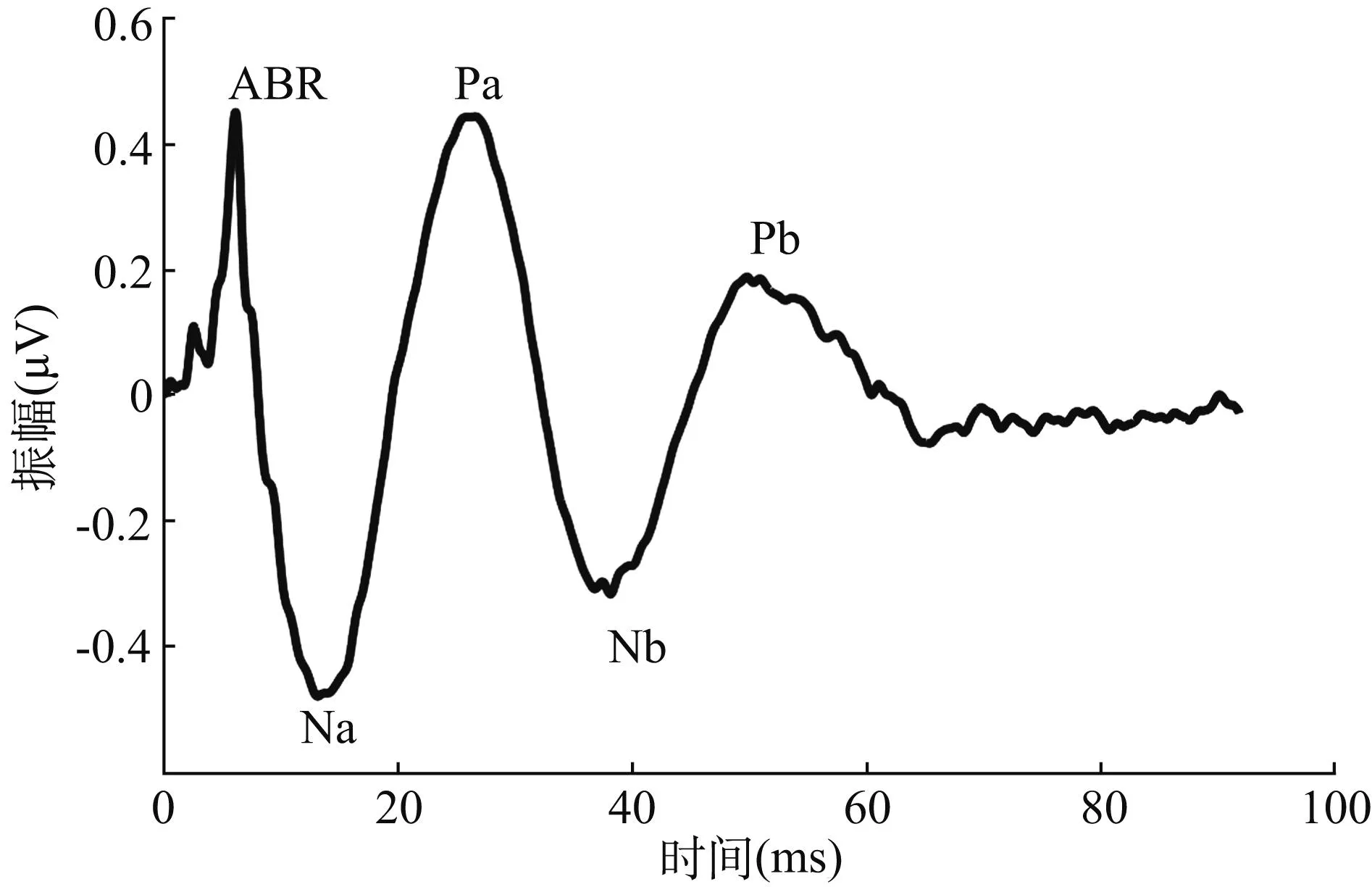
图1 听觉诱发电位中潜伏反应主要成分示意图
1.2MLR的起源目前关于MLR主要成分的起源依然没有形成共识。一般认为潜伏期小于20 ms的神经活动来源于丘脑皮层投射区,但是采用头皮方式记录难以分辨这些成分。大体来说MLR成分主要发生在大脑的听觉皮层区域,其中Na可能部分起源于中脑结构以及包括下丘和丘脑的皮层下结构,但也不排除来源于颞叶皮层及听皮层的颞上回[1~3]。一般被认为Pa波源于初级听觉皮层,也有可能与丘脑内侧膝状体核或丘脑皮层投射有关[2]。Nb和Pb的不确定性更强,有研究认为Nb-Pb成分可能来自于网状激活系统,包括颞平面、海马和丘脑皮层投射部位[4, 5]。
MLR还包括主要来自耳后肌(postauricular muscle, PAM)的肌源性反应成分,这部分反应会干扰皮层神经的MLR。而另一方面,PAM反应如果有意操控加强(比如特意侧视)也可辅助用于听力检查[6]。
1.3常规设置下刺激率对MLR的影响刺激率对MLR影响较为复杂,早期和晚期成分表现不尽相同。在常规MLR实验设置下(即常用短声刺激,带通滤波10~500 Hz,颅顶为记录电极,乳突为参考电极等),Pa的刺激率效应还没有一致结论。早期有研究表明Pa的幅度随刺激率递减,但也有实验提示在刺激率小于10~16 Hz时这种变化并不明显[7]。近期有研究报道,在从1.1 到11.3之间递增的四种刺激率下, Pa和Pb的幅度显著减小;而Pa潜伏期显著延长,Pb潜伏期则没有显著差别[4]。该研究同时发现性别可能对Pa的幅度和潜伏期都有显著影响,男性表现出Pa波潜伏期增加而幅度减小,但Pb并没有类似的表现,因此性别对Pb可能没有显著性影响[4]。而Nb-Pb由于不稳定,在正常人群中引出率也较低,关于其刺激率效应的研究很少,一般认为记录Pb的刺激率要小于1 Hz,因为较高的刺激率不利于其引出[8]。
1.4高刺激率MLR常规设置方式下MLR刺激声的刺激间隔必须大于MLR的反应潜伏期,如果刺激间隔小于MLR的持续时间,则会出现相邻MLR相互重叠,瞬态MLR失真,此时形成的反应是一种周期性反应,被称为听觉稳态反应,这种现象在工程学上可以用一种线性卷积模型描述,即把多个刺激形成的刺激序列看作一个二值的脉冲序列,观察到的稳态反应就是瞬态AEP成分和刺激序列经过线性卷积计算的结果。在这种高刺激率下如果要恢复MLR成分,需要对刺激序列做某种改变,以便适合去卷积计算的约束条件。通过去卷积计算可以从相互重叠的AEP中恢复出单个刺激引发的瞬态反应。去卷积技术的基本要求是采用不均匀的刺激序列,即非等间隔的刺激方式,称为刺激序列的抖动。最早引入的是一种基于最大长序列的去卷积技术[9],这种方法计算简单,性能稳定,但其主要问题是刺激序列的刺激间隔必须存在较大抖动。近年来学者提出了一些新的去卷积方法,如连续循环平均去卷积(continuous loop averaving deconvolution,CLAD)方法[10],以及多刺激率稳态平均去卷积(multi-rate steady-state average deconvolution,MSAD)方法[11]等,这些方法能够更加灵活选择低抖动随机序列实现瞬态AEP的提取。
Nagle等[12]利用最大长序列方法比较了常规刺激率(9.7 Hz)和高刺激率(平均65 Hz,最高瞬时刺激率125.1 Hz)的MLR:在相同记录时间条件下,高刺激率MLR的波形比常规刺激率更加清晰,而两种刺激率MLR各成分潜伏期(除Pb外)具有显著差异,其中Na和Nb的潜伏期较短,而Pa的潜伏期较长;高刺激率MLR各主波的幅度都显著减小。由于高刺激率MLR的波形清晰,因此各成分波的检出率较高,特别有助于提高Nb和Pb波的检出率。表明刺激率增加会显著降低MLR所有成分的幅值,而刺激率对潜伏期的影响较为复杂,但Pa的潜伏期在常规设置和高刺激率下都比较稳定。
1.5稳态反应的MLR叠加原理利用去卷积方法得到的高刺激率MLR成分是研究听觉的40 Hz稳态反应形成机制的一个有力工具。听觉稳态反应的线性叠加理论认为,在40 Hz刺激率情况下,MLR主要成分重叠时出现相位同相增强是产生40 Hz稳态反应的主要原因[13]。但是采用常规方式AEP经过线性叠加预测40 Hz稳态反应,预测误差较大,会出现过估计现象[14]。这种差别可能是由于稳态刺激时神经通路的适应性所致,MLR(也包括ABR中部分贡献)的主要成分在40 Hz刺激率下与常规MLR有一定区别。因此,Bohoquez等[15]利用CLAD方法在平均刺激率为40 Hz时,较好地预测了40 Hz稳态反应,预测误差小于用常规刺激率MLR的预测结果。
2MLR的应用研究
2.1评估麻醉深度现代麻醉方式可以采用多种药物,使用肌松剂后,麻醉师无法通过直接观察判断患者是否恢复了意识,因此需引入一些客观检测评估麻醉效果和深度。目前有三种较简单的方法判断麻醉深度:一种是测量体内麻醉剂水平,但是当多种麻醉剂混合实施时,药物浓度和麻醉深度的关系对个体差异较大;第二,脑电图(electroencephalogram, EEG)中一些指标可以用来表征大脑意识活动状态,然而EEG的改变也和麻醉剂有关,衡量麻醉效果也不够准确;第三,与EEG不同的是,AEP观测的是大脑对外部刺激的反应而不是一般的皮层活动状况,并且AEP对各种麻醉剂的使用均不敏感,因此作为麻醉深度的评估指标具有一定的优势。由于MLR成分与人的感知和意识密切相关,大量证据表明MLR提供了麻醉深度的信息。麻醉过程与MLR主要成分的幅度减少和潜伏期延长有关,并且麻醉对MLR的晚期成分(Nb和Pb)比早期成分的影响更明显[16,17]。具有这类特性的麻醉药物很多,如氟烷、安氟醚、异氟烷、地氟烷、七氟烷、异丙酚和依托咪酯等[18,19]。然而有些药物,如一氧化二氮和氯胺酮对MLR的主波则基本没有影响[20]。有些麻醉剂,如氟烷和异氟烷/N2O,手术中的伤害刺激(如切口或导管插入)可能影响MLR,引起主波幅度的增加,但该伤害对潜伏期没有影响[21,22]。因此MLR可能反映了麻醉的抑制作用和伤害性刺激导致大脑激活之间的一种平衡。
MLR的特性与年龄相关,反映了中枢听觉通路的成熟过程与电生理的关联。初步报道提示,儿童麻醉时MLR也存在与成人类似的变化。Kuhnle 等[23]报道异丙酚用于儿童麻醉时,异丙酚可使所有MLR成分的潜伏期延长,并与剂量相关。但是,儿童MLR的信号质量可能减弱MLR评估麻醉深度的效果[24]。但目前这方面研究较为缺乏,因此,需要进一步研究MLR在儿童麻醉方面的特性。
2.2评估听觉系统发育与成熟程度人类的外周听觉系统在出生时就已完全发育,但是听觉通路中神经纤维的髓鞘形成需要持续若干年,这个过程在脑干诱发反应、中/晚潜伏期反应中都有表现,因此AEP也是研究听觉系统发育的重要手段,并且与行为学检测相结合作为中枢听觉系统功能以及处理声音能力的评估指标。早期的研究报道认为,Na和Pb的出现与年龄有关,大约20%的儿童在一岁前出现Pa波,而65%有Na波。随年龄增加,MLR的出现率递增,在10~12岁时达到成人水平,这些证据说明了听觉系统发育的长期性[25]。在Pb可以明确引出条件下(如刺激率小于1 Hz),儿童的Pb幅度比成年人更大,潜伏期也更长,这种现象可能与儿童发育期间,听神经通路髓鞘发育不完整以及神经树突分支和突触联系丰富有关[26,27]。
除了MLR外,AEP的早期和晚期成分等也都在儿童的听觉系统成熟和发育研究中发挥重要作用[28]。Ponton等[29]通过比较AEP主波的成熟程度发现,晚期波P2比N1b成熟更早,提示AEP的这些主波来自位于丘脑-皮层通路的并行子系统,并且对某个AEP成分有贡献的源或通路存在多个,且成熟程度不同。
AEP成分的多源性和发育速率的差别表现在AEP活动区域的变化,如果采用电磁场计算技术,利用多电极偶极子模型表示产生AEP的起源可对AEP单个成分的产生源进行单独评估。如Pa和Pb表达在头部的矢状中线,如一个在C7位置,一个在Cz或Fz位置[26]。基于这个思想,Ponton等[29]利用BESA(Brain Electric Source Analysis)软件的偶极子模型,采用30个电极记录了118例(3~20岁)受试者的中/晚潜伏期AEP,根据该模型,矢状偶极子源表示Pa和Pb成分。在5~6岁儿童,该成分具有和成年人Pa、Pb类似的潜伏期。晚潜伏期成分的空间分布模式随着年龄变化改变显著,也表现出N1b成分较P1(Pb)成熟更晚[29]。
2.3评估衰老与老年认知障碍中老年受试者的MLR波形会出现较大变化,主要表现为Pa潜伏期延长以及幅度增加,其原因推测与衰老导致的中枢神经抑制能力衰退有关,这种衰退不仅影响听觉神经系统也包括视觉神经系统[30]。脑磁场研究发现,老年人群P50m成分(即脑磁图的P50成分)在同侧刺激和对侧刺激情况下表现不对称,其对侧P50m的幅度较大且与年龄相关,提示年龄对同侧和对侧听觉通路的影响可能存在差别[31]。
老年人的轻度认知功能障碍(mild cognitive impairment, MCI)是一种选择性的情景记忆缺陷,以后发展为阿尔茨海默病风险较大。从神经病理学原因来看,MCI和阿尔茨海默病都与β-淀粉体的堆积或神经纤维缠结有关,这些神经病理因素可能影响听觉神经通路并导致AEP成分的改变[32]。Irimajiri等[33]研究了MCI组和健康对照组不同AEP成分的影响,他们分析了三种刺激率(2 Hz、1/1.5 Hz和1/3 Hz)条件下AEP的中晚期成分,结果发现,与对照组相比,MCI组P50的幅度显著增加,晚潜伏期成分N100在较低的刺激率下幅度显著增加,但在较高刺激率条件下(2 Hz)没有显著增加。一般认为刺激率对MLR幅度的影响与神经元兴奋的不应期特性有关,而MCI中服用多奈哌齐药物患者引起Pb幅度的变化是否也与这种不应期特性有关,值得进一步研究。
2.4吸烟对MLR的影响烟草中的尼古丁经快速吸收传输到靶受体,这些靶受体位于中枢神经所在的网状结构、脑干、中脑、丘脑和皮层,这些区域也是产生或调制AEP的部位,因此MLR也被尝试用来评估可能会影响中枢神经的尼古丁胆碱能机制[34]。例如,年轻吸烟者的Na和Pa的潜伏期显著缩短而MLR的幅度显著增加[35]。最近一项调查显示,年轻吸烟者V-Na以及Nb-Pb幅度显著增加,Nb的潜伏期显著缩短,由于年龄所致神经化学性质的影响,老年吸烟者主要表现为Pb潜伏期显著增加;另外,刺激类型(短声或短音)以及电极位置也对分析结果造成影响[36]。
3小结
中潜伏期反应是听觉诱发电位的一个重要组成部分,主要反映了听觉通路中从脑干进入皮层阶段的听觉系统的信息整合能力和完整性,受到内因和外因影响。主要记录位置在前/顶部中线部位,其主要标志性成分为较为稳定的Pa波,应用范围广。负波Na和Nb一般幅度较小,可结合和参考相邻正波提供基准和参考。Pb的起源和特性较为复杂,和早期成分关联度小,在常规刺激方式下引出率低,未来需要结合颅内测量或脑磁图以及高刺激率技术等方式进行综合研究。根据MLR的这些特性,通过考察MLR主要成分的改变,MLR可在很多方面具有应用前景,主要包括:听觉系统功能,发育成熟,感知和意识程度评估,听觉神经系统信息处理机制,各种因素导致的相关中枢神经受损引起MLR主要参数改变等。中潜伏反应成分还受到受试者的精神状态、配合度、注意力和清醒程度等影响,导致测试结果差异性大、稳定性差。因此在应用过程中需要特别注意实验条件和状态的控制,比如要求受试者做出一定的行为动作判断其状态控制情况,另外还可以考虑采用重复测试法以减少这些因素的影响。
参考文献4
1McGee T, Kraus N, Comperatore C, et al. Subcortical and cortical components of the MLR generating system[J]. Brain Res, 1991, 54: 211.
2Ligeois-Chauvel C, Musolino A, Badier JM, et al. Evoked potentials recorded from the auditory cortex in man: evaluation and topography of the middle latency components[J]. Electroencephalogr Clin Neurophysiol, 1994, 94: 204.
3Fischer C, Bognar L, Turjman F, et al. Auditory evoked potentials in a patient with a unilateral lesion of the inferior colliculus and medial geniculate body[J]. Electroencephalogr Clin Neurophysiol, 1995, 96: 261.
4Tucker DA, Dietrich S, Harris S, et al. Effects of stimulus rate and gender on the auditory middle latency response[J]. J Am Acad Audiol, 2002, 13: 146.
5Pratt H. Middle latency response[M]. In: Burkard RF, Eggermont JJ, Don M, eds. Auditory evoked potentials: basic principles and applications. New York: Lippincott Williams and Wilkins, 2007.463~481.
6Purdy SC, Agung KB, Hartley D, et al. The post-auricular muscle response: an objective electrophysiological method for evaluating hearing sensitivity[J]. International Journal of Audiology, 2005, 44: 625.
7Tucker DA, Ruth RA. Effects of age, signal level, and signal rate on the auditory middle latency response[J]. J Am Acad Audiol, 1996, 7: 83 .
8Erwin RJ, Buchwald JS. Midlatency auditory evoked responses: differential recovery cycle characteristics[J]. Electroenceph Clin Neurophysiol, 1986, 64:417.
9Eysholdt U, Schreiner C. Maximum length sequences - a fast method for measuring brainstem-evoked responses[J]. Audiology, 1982, 21: 242.
10Özdamar , Bohrquez J. Signal to noise ratio and frequency analysis of continuous loop averaging deconvolution (CLAD) of overlapping evoked potentials[J]. Acoust Soc Am, 2006, 119: 429.
11Wang T, Zhan C, Yan G, et al. A preliminary investigation of the deconvolution of auditory evoked potentials using a session jittering paradigm[J]. J Neural Eng, 2013, 10: 26023.
12Nagle S, Musiek FE. Morphological changes in the middle latency response using maximum length sequence stimuli[J]. J Am Acad Audiol, 2009, 20: 492.
13Stapells DR, Linden D, Suffield JB, et al. Human auditory steady state potentials[J]. Ear Hear, 1984, 5:105.
14Azzena GB, Conti G, Santarelli R, et al. Generation of human auditory steady-state responses (SSRs). I: stimulus rate effects[J]. Hear Res,1995,83:1.
16Thornton C , Sharpe RM . Evoked responses in anaesthesia[J]. Br J Anaesth, 1998, 81: 771.
17Davies FW, Mantzaridis H, Fisher AC, et al. Middle latency auditory evoked potentials during repeated transitions from consciousness to unconsciousness[J]. Anaesthesia,1996,51:107.
18Goto T, Nakata Y, Saito H, et al. The midlatency auditory evoked potentials predict responsiveness to verbal commands in patients emerging from anesthesia with xenon, isoflurane, and sevoflurane but not with nitrous oxide[J]. Anesthesiology, 2001, 94: 782.
19Plourde G. Auditory evoked potentials[J]. Best Pract Res Clin Anaesthesiol, 2006, 20:129.
20Schwender D, Klasing S, Madler C, et al. Mid-latency auditory evoked potentials during ketamine anaesthesia in humans[J]. Br J Anaesth, 1993, 71: 629.
21Nishiyama T, Matsukawa T, Hanaoka K. Is the ARX index a more sensitive indicator of anesthetic depth than the bispectral index during sevoflurane/nitrous oxide anesthesia[J]? Acta Anaesthesiologica Scandinavica, 2004, 48: 1028.
22Urhonen E, Jensen EW, Lund J. Changes in rapidly extracted auditory evoked potentials during tracheal intubation[J]. Acta Anaesthesiol Scand, 2000, 44:743.
23Kuhnle GE, Hornuss C, Daunderer M, et al. Impact of propofol on mid-latency auditory-evoked potentials in children[J]. Br J Anaesth, 2013, 110 :1001.
24Munoz HR, Leon PJ, Fuentes RS, et al. Prospective evaluation of the time to peak effect of propofol to target the effect site in children[J]. Acta Anaesthesiol Scand, 2009, 53: 883.
25Suzuki T, Hirabayashi M. Age-related morphological changes in auditory middle-latency response[J]. Audiology, 1987, 26: 312.
26Nelson MD , Hall JW 3rd , Jacobson GP. Factors affecting the recordability of auditory evoked response Pb (P1)[J]. J Am Acad Audiol, 1997, 8: 89.
27Schochat E, Musiek FE. Maturation of outcomes of behavioral and electrophysiologic tests of central auditory function[J]. J Commun Disord, 2006, 39: 78.
28Shafer VL, Morr ML, Kreuzer JA, et al. Maturation of mismatch negativity in school age children[J]. Ear Hear, 2000, 21:242.
29Ponton C, Eggermont JJ, Khosla D, et al. Maturation of human central auditory system activity: separating auditory evoked potentials by dipole source modeling[J]. Clin Neurophysiol, 2002, 113: 407.
30Dustman RE, Shearer DE, Emmerson RY. EEG and event-related potentials in normal aging[J]. Prog Neurobiol, 1993, 41:369.
31Yamadaa T, Nakamurab A, Horibe K, et al. Asymmetrical enhancement of middle-latency auditory evoked fields with aging[J]. Neurosci Lett, 2003, 30:21.
32Golob EJ, Johnson JK, Starr A. Auditory event-related potentials during target detection are abnormal in mild cognitive impairment[J]. Clin Neurophysiol, 2002, 113:151.
33Irimajiri R, Golob EJ, Starr A. Auditory brain-stem, middle- and long-latency evoked potentials in mild cognitive impairment[J]. Clin Neurophysiol, 2005, 116: 1918.
34Ramkissoon I, Chambers RD. Effects of chronic and acute smoking on AMLRs in older and younger listeners[J]. Int J Audiol, 2008, 47: 715.
35Domino EF. Effects of tobacco smoking on electroencephalographic, auditory evoked and event related potentials[J]. Brain and Cognition, 2003, 53: 66.
36Ramkissoon I, Beverly BL. Auditory middle latency responses in chronic smokers compared to nonsmokers: differential effects of stimulus and age[J]. J Speech Lang Hear Res, 2014, 57:271.
(2015-04-13收稿)
(本文编辑雷培香)

·综述·
通讯作者:王涛(Email: taowang@smu.edu.cn)
【中图分类号】R764.04
【文献标识码】A
【文章编号】1006-7299(2016)01-0100-05
DOI:10.3969/j.issn.1006-7299.2016.01.027
