P-GEMOX方案与CHOP方案一线治疗结外NK/T淋巴瘤的疗效对比*
2016-02-23熊竹娟敬小梅任苑容张智慧
魏 雯, 吴 萍, 李 力, 熊竹娟, 敬小梅, 任苑容, 张智慧
(四川省肿瘤医院·研究所, 四川省癌症防治中心; 电子科技大学医学院 肿瘤内科, 成都 610041)
•临床研究•
P-GEMOX方案与CHOP方案一线治疗结外NK/T淋巴瘤的疗效对比*
魏 雯, 吴 萍, 李 力, 熊竹娟, 敬小梅, 任苑容, 张智慧△
(四川省肿瘤医院·研究所, 四川省癌症防治中心; 电子科技大学医学院 肿瘤内科, 成都 610041)
目的:比较含培门冬酶方案P-GEMOX与传统CHOP方案一线治疗结外NK/T淋巴瘤的近期疗效、远期生存及安全性,并探讨其预后影响因素。方法: 回顾性分析我院2010~2015年45例结外NK/T淋巴瘤患者的临床资料,比较两种治疗方案之间的疗效,并进行预后因素分析。结果: 28例早期结外NK/T淋巴瘤患者治疗以放化疗联合为主,ORR为85.7%(24/28),CR为82.1%,其中CHOP方案联合放疗组ORR为80.0%(12/15) ,CR为73.3%,2年OS率为73.3%,PFS率为66.7%。P-GEMOX方案联合放疗组ORR为92.3%(12/13) ,CR为92.3%,2年OS率为92.3%,PFS率为92.3%,两组的ORR,OS及PFS率差异无统计学意义(P>0.05) 。17例晚期患者治疗以化疗为主,ORR 41.1%(7/17),CR为17.6%,其中CHOP方案治疗组ORR为12.5%(1/8) ,CR为0%,1年OS率为12.5%,PFS率为0%,P-GEMOX方案治疗组ORR为66.7%(6/9) ,CR为33.3%,1年OS率为55.6%,PFS率为11.1%,两组的ORR、OS、 PFS率差异均有统计学意义(P<0.05) 。单因素分析提示:低ECOG评分(0~1)、分期早、不合并B症状、血清LDH正常、低NKIPI评分(0~1)、EB病毒编码的小RNA(the EBV encoded small RNA,EBER)阴性患者有更长生存期,差异有统计学意义(P<0.001)。多因素分析提示:分期是影响患者预后的唯一因素,差异有统计学意义(P<0.05)。结论: 早期患者采用P-GEMOX方案与CHOP方案化疗的疗效相当,晚期患者采用P-GEMOX方案化疗较CHOP方案可明显提高疗效且改善预后。临床分期是影响结外NK/T淋巴瘤预后的独立因素。
培门冬酶; NK/T细胞淋巴瘤; 化疗
结外NK/T淋巴瘤(extranodal natural killer/T-cell lymphoma ,ENKTL)属于非霍奇金淋巴瘤的一种特殊类型,该病主要分布于亚洲及部分南美地区,常侵犯上呼吸消化道,包括鼻腔、鼻咽、鼻窦、喉咽和喉头[1],恶性程度高,预后差。早期患者的治疗以放化疗结合为主[2-3],晚期患者则以化疗为主[4]。然而由于该病发病率较低,难以进行大型随机临床对照试验,故目前化疗方案选择仍有争议[5]。本文总结了2010年1月至2015年9月我科收治的45例ENKTL患者的临床资料,分析其临床特点,不同治疗方案的疗效生存情况及预后影响因素等,为临床治疗方案的选择及判断患者预后等提供依据。
1 资料与方法
1.1 一般资料
本研究共选择四川省肿瘤医院淋巴瘤病区2010年1月至2015年9月的ENKTL患者45例,纳入标准:初治患者;根据WHO标准由免疫组化证实为ENKTL;18~60岁,ECOG评分0~2;例行检查血常规、生化全套、心电图,CT增强扫描,骨髓活检,排除化疗禁忌。排除标准:妊娠或哺乳,以及有任何影响完成试验的合并症的患者。分期按照AnnArbor-Cotswald(1989)临床分期系统分为早期(I~Ⅱ期)及晚期(Ⅲ~Ⅳ期)[6],按化疗方案不同,分为CHOP方案组(环磷酰胺+表柔比星+长春新碱+泼尼松)和含培门冬酶P-GEMOX方案组(培门冬酶+奥沙利铂+吉西他滨),早期患者采用CHOP方案组共15例,采用P-GEMOX方案组共13例,晚期患者采用CHOP方案组共8例,采用P-GEMOX方案组共9例,各组患者的临床特征见表1。
1.2 治疗方案
早期患者均采用放化疗结合方式(先诱导化疗2周期后开始放疗,放疗结束后继续完成剩余化疗)治疗,晚期患者以姑息化疗为主,所有患者化疗疗程为4~6周期,每3周进行一次。化疗方案的选择早年以CHOP方案为主,后期以P-GEMOX方案为主[7],化疗2疗程后评价无效者换二线最佳支持治疗。放疗采用高能电子线,剂量56Gy,照射范围包括瘤床及区域淋巴结引流区,按每天1.8~2Gy常规分割照射。

表1 CHOP方案组和P-GEMOX方案组临床资料比较 (n=45例)
注:NKIPI:NK/T细胞淋巴瘤国际预后评分;
EBER:EB病毒编码的小RNA
1.3 疗效评价及不良反应
所有患者每2个疗程复查CT等影像学检查评价疗效,骨髓受侵者复查骨髓情况。疗效评价标准按2013年非霍奇金淋巴瘤NCCN指南第2版国际淋巴瘤疗效评价标准[8]执行,分为完全缓解(complete remission,CR)、部分缓解(partial remission,PR)、疾病稳定(stable disease,SD)和疾病进展(progressive disease,PD) ,总有效率(overall response rate,ORR) 为(PR+CR)。化疗后常见不良反应采用NCI-CTC 3.0标准分为4级。
1.4 随访
对所有入组患者进行门诊复查或电话随访,每3个月1次,随访截止至2015年9月31日,中位随访时间为24(3~57)个月。主要研究终点总生存期(overall survival,OS) 从患者诊断之日开始,以患者死亡或末次随访日为终点; 无进展生存(progression free survival,PFS) 时间从开始治疗至疾病进展或者发生因为任何原因的死亡之间的时间。次要研究终点为疾病缓解率(CR和PR)。
1.5 统计学处理
应用SPSS19.0软件进行统计学分析,组间率的比较采用卡方检验(样本量较小时采用Fisher确切概率检验) ; 生存分析采用Kaplan-Meier和log-rank检验,单因素分析采用ANOVA方法,多因素分析采用Cox回归模型;P<0.05为差异有统计学意义。
2 结 果
2.1 近期疗效观察
28例早期ENKTL患者治疗以放化疗联合为主,其中CHOP方案CR11例(73.3%),PR 1例,ORR为80.0%(12/15),P-GEMOX方案治疗组CR 12例(92.3%),PR 0例,ORR为92.3%(12/13),两组的ORR率差异无统计学意义(χ2=0.831,P=0.356)。
17例晚期患者治疗以化疗为主,其中CHOP方案治疗组CR 0例(0%),PR 1例,ORR为12.5%(1/8),P-GEMOX方案治疗组CR 3例(33.3%),PR 3例,ORR为66.7%(6/9),两组的ORR率差异有统计学意义(χ2=4.892,P=0.036)。
2.2 生存分析
截止2015年9月,中位随访时间为24(3~57)个月,早期患者中位随访时间为35.5个月,CHOP方案治疗组与P-GEMOX方案治疗组生存曲线见图1,CHOP方案治疗组的2年OS率为73.3%,P-GEMOX方案治疗组的2年OS率为92.3%,两组差异无统计学意义(χ2=1.709,P=0.191),CHOP方案治疗组的2年PFS率为66.7%,P-GEMOX方案治疗组的2年PFS率为92.3%,两组差异无统计学意义(χ2=2.720,P=0.099)。晚期患者中位随访时间为9个月,CHOP方案治疗组与P-GEMOX方案治疗组生存曲线见图2,CHOP方案治疗组的1年OS率为12.5%,P-GEMOX方案治疗组的1年OS率为55.6%,两组差异有统计学意义(χ2=5.883,P=0.015),CHOP方案治疗组的1年PFS率为0%,P-GEMOX方案治疗组的1年PFS率为11.1%,两组差异有统计学意义(χ2=5.029,P=0.025)。
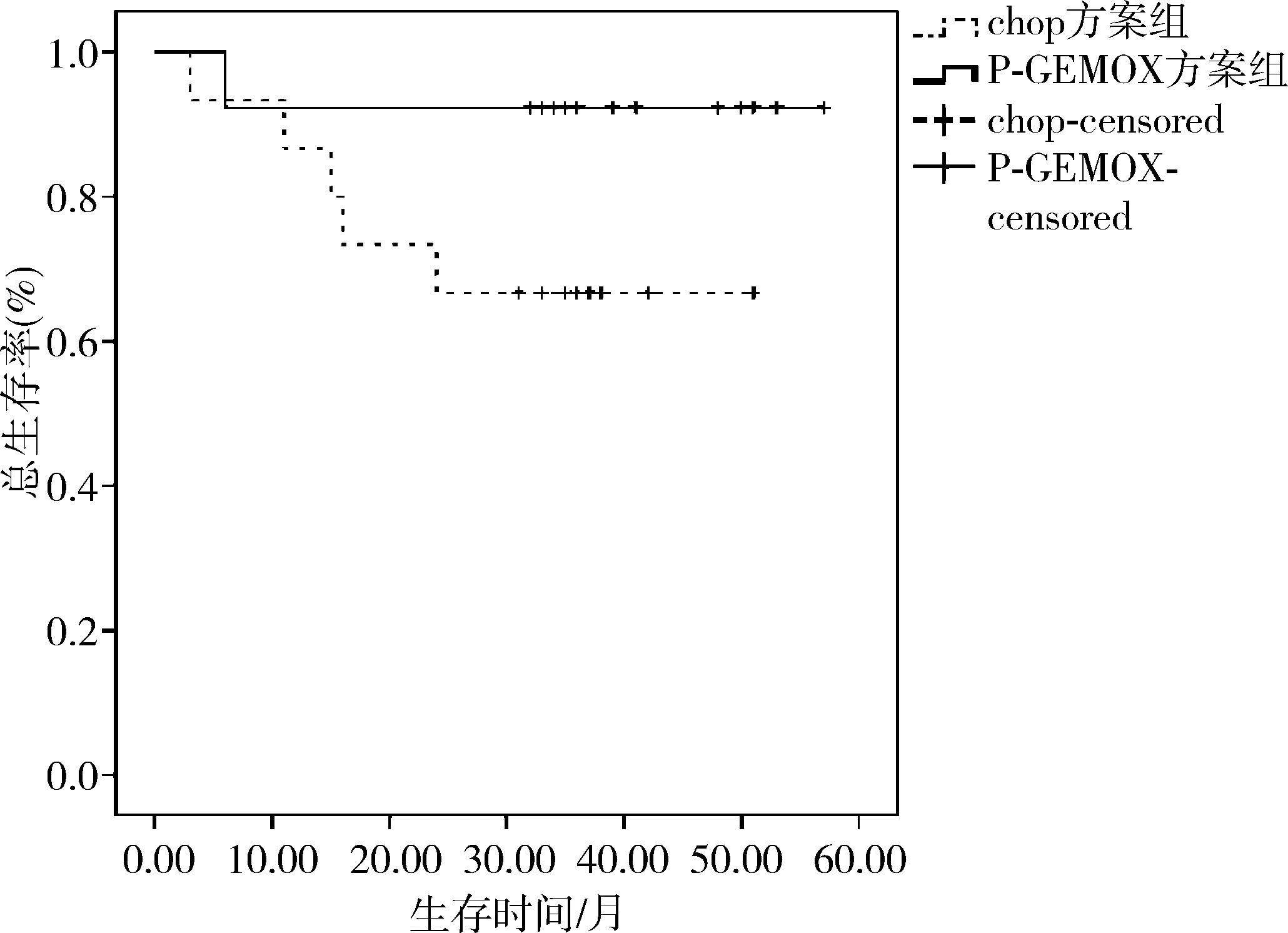

图1早期患者CHOP方案组与P-GEMOX方案组的生存曲线
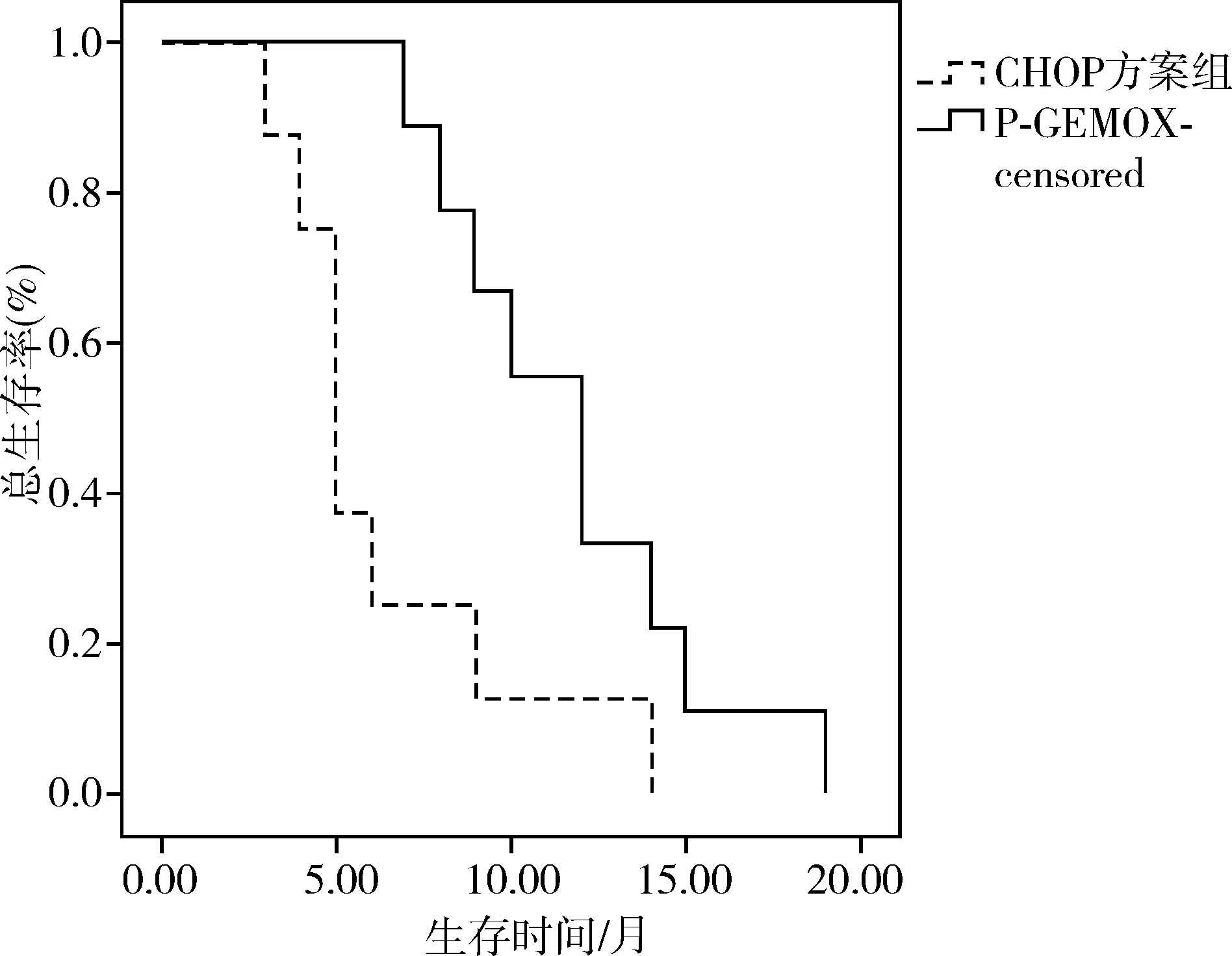

图2晚期患者CHOP方案组与P-GEMOX方案组的生存曲线
2.3 影响预后因素分析
单因素分析提示影响患者预后的因素为:ECOG评分、分期、B症状、血清LDH、NK/T细胞淋巴瘤国际预后评分(Natural killer/T-cell lymphoma International Prognostic Index,NKIPI)评分、EB病毒编码的小RNA(the EBV encoded small RNA,EBER)(表2)。多因素分析显示分期的HR为0.159(0.035~0.725),说明早期患者的疾病进展死亡风险是晚期患者的0.159倍,也说明早期患者预后更好,即分期是影响患者预后的唯一因素(表3)。
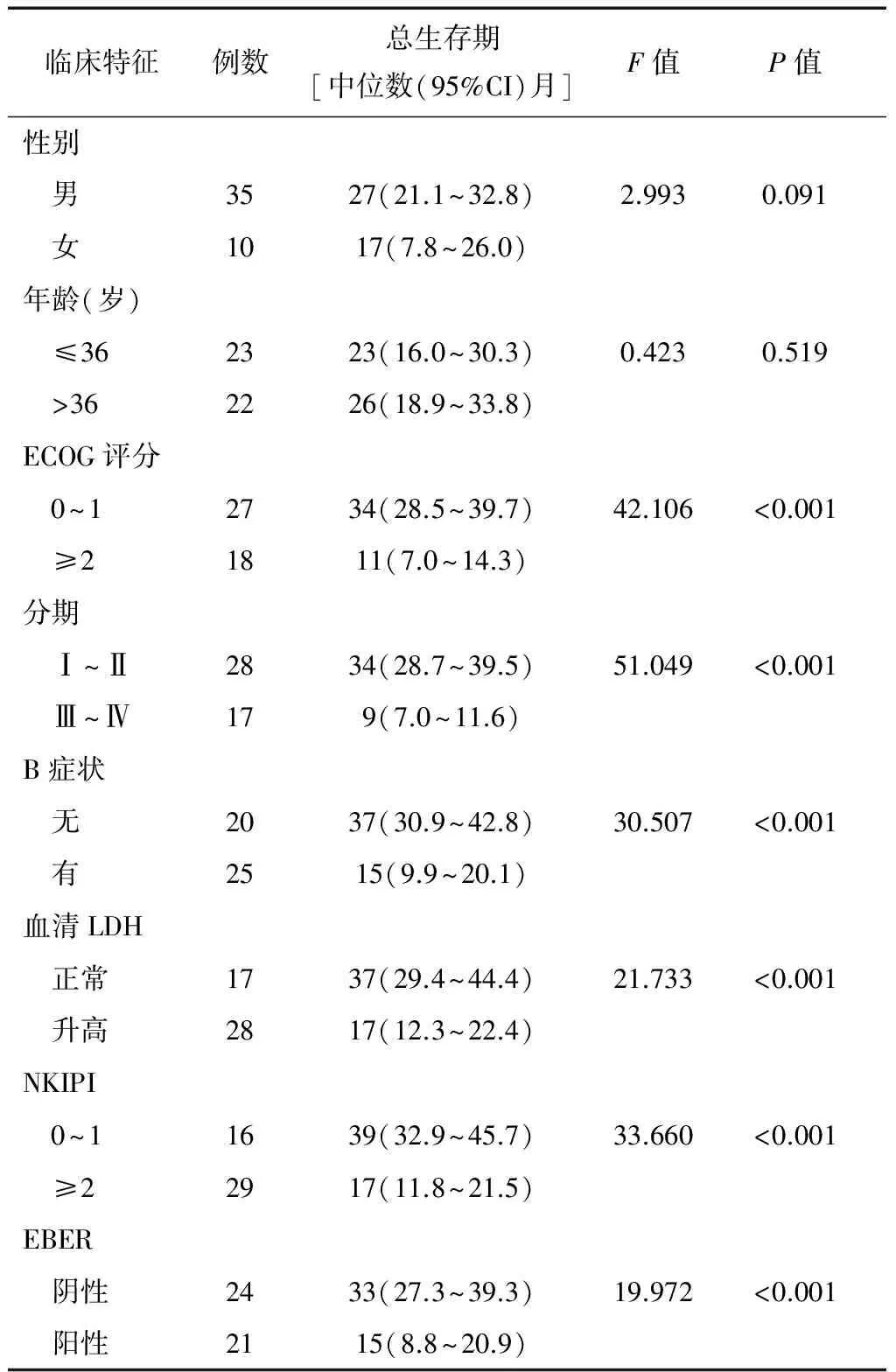
表2 影响患者预后的单因素分析(n=45例)
注:NKIPI:NK/T细胞淋巴瘤国际预后评分; EBER:EB病毒编码的小RNA
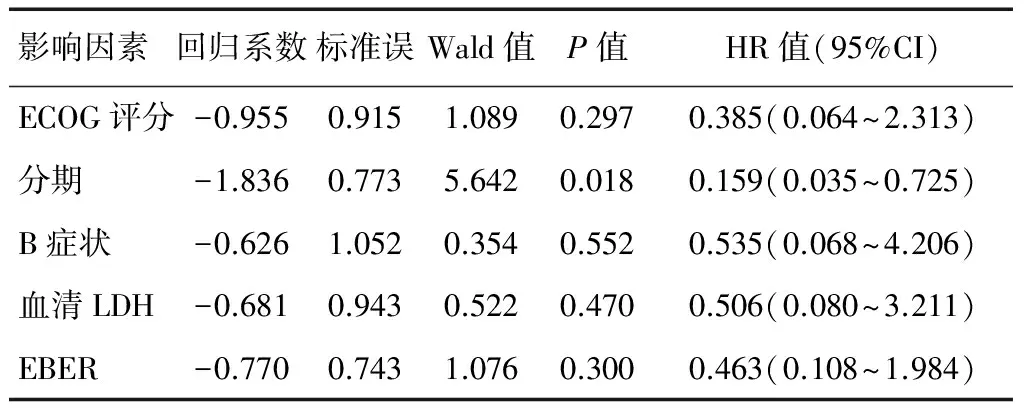
表3 影响患者预后的多因素分析(n=45例)
2.4 毒副反应
CHOP方案及P-GEMOX方案化疗不良反应均较轻,以I~Ⅱ 度多见。主要不良反应为白细胞减少、贫血、血小板减少、胃肠道反应、粘膜炎、肝功异常及胆红素升高。Ⅲ~Ⅳ度不良反应少见。P-GEMOX方案较CHOP方案化疗组更常见可逆性转氨酶及胆红素升高。经对症处理后均可恢复,没有发现胰腺炎、凝血功能紊乱等严重不良反应,亦未发现治疗相关性死亡。统计学分析显示两组间除P-GEMOX方案更易引起I~Ⅱ级高胆红素血症外,其余毒副反应发生率差异无统计学意义。不同化疗方案患者的毒副反应发生率详见表4。
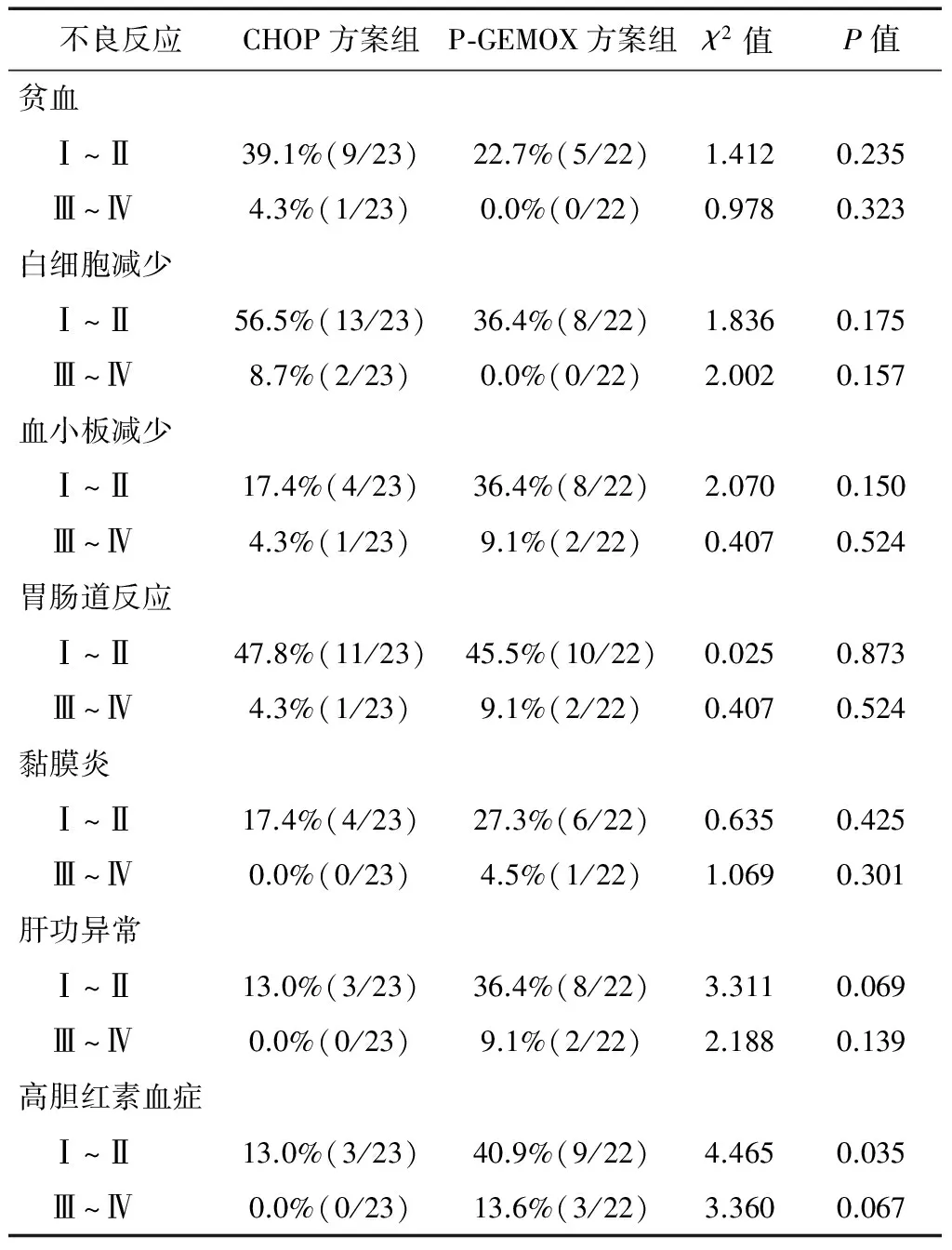
表4 不同化疗方案患者的不良反应
3 讨 论
ENKTL是一种特殊类型的淋巴瘤,占非霍奇金淋巴瘤(Non-Hodking′s lymphoma,NHL)的5%~15%,主要累及上呼吸消化道,该类患者预后相对较好,累及其他部位如胃肠道皮肤睾丸等部位的ENKTL患者通常预后极差[1]。
针对早期ENKTL患者,放疗是初始治疗的重要组成部分,且多项研究显示放疗联合化疗可提高疗效[9-11],日本JCOG0211研究采用放疗联合地塞米松、依托泊苷、异环磷酰胺和卡铂(DeVIC)方案[12]。中位随访32个月,2年OS率为78%,CR率为77%,5年PFS和OS率分别为67%和73%。韩国进行的一项Ⅱ期研究采用顺铂同步放疗继以3个周期的依托泊苷、异环磷酰胺、顺铂和地塞米松(VIPD)化疗,也报告了类似满意的结果[9]。这些研究的结果支持I/Ⅱ期患者采用同步化放疗方案。
晚期ENKTL患者多采用全身化疗,然而最佳方案目前还有争议[13]。既往传统的治疗方案主要采用CHOP,且目前一些新药研究多采用CHOP方案作为对照,然而据多项研究表明其疗效不够理想[4, 14]。原因可能与ENKTL细胞高表达P-糖蛋白引起多药耐药(MDR)有关[15]。近几年多项研究着力于新方案的研究,其中含L-天门冬酰胺酶类方案(SMILE和AspaMetDex)尤为突出[16-19],在包括晚期、复发或难治性疾病患者当中取得很好疗效。培门冬酶是L-天门冬酰胺酶的长效制剂,半衰期约5.5天,具有更低的免疫原性,因此无需皮试,使用更方便[20]。有研究表明该药物对淋巴细胞白血病等疾病安全且有效[21],然而目前该药物对ENKTL疗效的研究仍较少。
本试验结果显示,在晚期患者中,与传统CHOP方案比较,P-GEMOX方案不仅具有较高的近期治疗反应,且从远期疗效来看,可以改善生存结局,其原因可能与培门冬酶的作用机制有关:即淋巴瘤细胞不能自己合成对生长必要的氨基酸门冬酰胺,必须依赖宿主供给。培门冬酶能使门冬酰胺水解,使肿瘤细胞缺乏门冬酰胺,从而起到抑制生长的作用。这种不受P-糖蛋白限制的不同于其他抗癌药物的作用机制使培门冬酶在应用于ENKTL中效果明显。
在早期患者当中,P-GEMOX方案组虽然具有较高的ORR及较长的OS,但和CHOP方案组的患者比较差异并无统计学意义。原因可能为在早期患者中,放疗起决定性作用,早期诊治并及时进行适宜的放疗能使大部分患者取得较好疗效,化疗只起辅助作用。
ENKTL患者中IPI的使用受到限制[22],因为多数患者为早期非老年患者。Lee等人进行的大型回顾性多中心研究提出了NKIPI模型,根据B症状、疾病分期、LDH和局部淋巴结受累情况估计ENKTL的预后[23]。在本研究中,单因素分析显示NKIPI与预后有显著相关性(P<0.001),与既往研究结果相符。NKIPI中所包含的B症状、分期、LDH也分别显示出与疾病预后的显著相关性(P值均<0.001)。另外,ECOG评分在ENKTL中也是估计预后的良好指标(χ2=42.106,P<0.001)。多因素分析中并未纳入NKIPI,因其与B症状、分期、LDH为包含关系。多因素分析结果在调整了多个因素之间的互相影响后,显示仅仅分期是预后的独立影响因素。可能与分期早的患者常常合并较低ECOG评分、无B症状、LDH水平正常及低NKIPI评分有关。
多项研究表明EB病毒的感染状态与ENKTL的发生及预后有高度相关性[24-25]。本研究单因素分析结果也证实EBER 状态与远期生存有明显相关性(P值均<0.001),与既往研究结果相符合。然而,多因素分析中未能显示其与预后的相关性,可能与本实验的检测指标不够精细化有关,即EBER状态不能精确反应患者的EB病毒感染程度。故本试验仍有待改进,进一步检测外周血EBV DNA 浓度作为更精确的量化指标,并进一步验证其与预后的相关性。
在本试验中,无论对早期还是晚期患者,培门冬酶方案除了更易引起Ⅰ~Ⅱ级高胆红素血症外,其余不良反应较CHOP方案差别无统计学意义,且两种方案均较少发生Ⅲ~Ⅳ级严重不良反应,如胰腺炎或严重肝功损害,表明培门冬酶是一种相对安全的药物。
综上,早期ENKTL患者因为具有潜在可治愈性,应采用放化疗联合为主的综合治疗,晚期患者治疗以化疗为主,含培门冬酶方案P-GEMOX无论对早期患者还是晚期患者均是一种安全有效方便的选择,尤其对晚期患者能较传统方案明显改善近期疗效及远期生存。然而,因为该疾病发病率较低,本研究仅为小样本回顾性研究,该结果有待进一步多中心随机对照试验证实。
[1] Liang R. Advances in the management and monitoring of extranodal NK/T-cell lymphoma, nasal type[J]. Br J Haematol, 2009,147(1):13-21.
[2] Huang MJ, Jiang Y, Liu WP, et al. Early or up-front radiotherapy improved survival of localized extranodal NK/T-cell lymphoma, nasal-type in the upper aerodigestive tract[J]. Int J Radiat Oncol Biol Phys, 2008,70(1):166-174.
[3] Li YX, Yao B, Jin J, et al. Radiotherapy as primary treatment for stage IE and IIE nasal natural killer/T-cell lymphoma[J]. J Clin Oncol, 2006,24(1):181-189.
[4] Tse E, Kwong YL. How I treat NK/T-cell lymphomas[J]. Blood, 2013,121(25):4997-5005.
[5] 王潇潇, 黄慧强. 结外NK/T细胞淋巴瘤治疗新进展[J]. 实用医院临床杂志, 2011,8(4):24-27.
[6] Lister TA, Crowther D, Sutcliffe SB, et al. Report of a committee convened to discuss the evaluation and staging of patients with Hodgkin’s disease: Cotswolds meeting[J]. J Clin Oncol, 1989,7(11):1630-1636.
[7] 张佃富, 方瑞艳, 马德亮. 门冬酰胺酶联合CHOP方案治疗结外NK/T细胞淋巴瘤的临床效果研究[J]. 中国实验血液学杂志, 2015,23(4):1034-1038.
[8] Cheson BD, Horning SJ, Coiffier B, et al. Report of an international workshop to standardize response criteria for non-Hodgkin’s lymphomas. NCI Sponsored International Working Group[J]. J Clin Oncol, 1999,17(4):1244.
[9] Kim SJ, Kim K, Kim BS, et al. Phase Ⅱ trial of concurrent radiation and weekly cisplatin followed by VIPD chemotherapy in newly diagnosed, stage IE to IIE, nasal, extranodal NK/T-Cell Lymphoma: Consortium for Improving Survival of Lymphoma Study[J]. J Clin Oncol, 2009,27(35):6027-6032.
[10]Aviles A, Neri N, Fernandez R, et al. Combined therapy in untreated patients improves outcome in nasal NK/T lymphoma: results of a clinical trial[J]. Med Oncol, 2013,30(3):637.
[11]Jiang M, Zhang H, Jiang Y, et al. Phase 2 trial of "sandwich" L-asparaginase, vincristine, and prednisone chemotherapy with radiotherapy in newly diagnosed, stage IE to IIE, nasal type, extranodal natural killer/T-cell lymphoma[J]. Cancer, 2012,118(13):3294-3301.
[12]Yamaguchi M, Tobinai K, Oguchi M, et al. Phase I/Ⅱ study of concurrent chemoradiotherapy for localized nasal natural killer/T-cell lymphoma: Japan Clinical Oncology Group Study JCOG0211[J]. J Clin Oncol, 2009,27(33):5594-5600.
[13]Suzuki R. NK/T-cell lymphomas: pathobiology, prognosis and treatment paradigm[J]. Curr Oncol Rep, 2012,14(5):395-402.
[14]Huang H, Lin Z, Lin X, et al. Long-term outcomes of patients with newly diagnosed extranodal natural killer/T-cell lymphoma treated by etoposide, prednisone, vincristine, cyclophosphamide, and doxorubicin regimen: a single-institution experience[J]. Leuk Lymphoma, 2011,52(6):1041-1048.
[15]Yamaguchi M, Kita K, Miwa H, et al. Frequent expression of P-glycoprotein/MDR1 by nasal T-cell lymphoma cells[J]. Cancer, 1995,76(11):2351-2356.
[16]Jaccard A, Gachard N, Marin B, et al. Efficacy of L-asparaginase with methotrexate and dexamethasone (Aspa Met Dex regimen) in patients with refractory or relapsing extranodal NK/T-cell lymphoma, a phase 2 study[J]. Blood, 2011,117(6):1834-1839.
[17]Kim M, Kim TM, Kim KH, et al. Ifosfamide, methotrexate, etoposide, and prednisolone (IMEP) plus L-asparaginase as a first-line therapy improves outcomes in stage Ⅲ/Ⅳ NK/T cell-lymphoma, nasal type (NTCL)[J]. Ann Hematol, 2015,94(3):437-444.
[18]Kwong YL, Kim WS, Lim ST, et al. SMILE for natural killer/T-cell lymphoma: analysis of safety and efficacy from the Asia Lymphoma Study Group[J]. Blood, 2012,120(15):2973-2980.
[19]Yamaguchi M, Kwong YL, Kim WS, et al. Phase Ⅱ study of SMILE chemotherapy for newly diagnosed stage Ⅳ, relapsed, or refractory extranodal natural killer (NK)/T-cell lymphoma, nasal type: the NK-Cell Tumor Study Group Study[J]. J Clin Oncol, 2011,29(33):4410-4416.
[20]Alfieri DR. Pegaspargase.[J]. Pediatr Nurs, 1995,21(5):471-490.
[21]Dinndorf PA, Gootenberg J, Cohen MH, et al. FDA drug approval summary: pegaspargase (oncaspar) for the first-line treatment of children with acute lymphoblastic leukemia (ALL)[J]. Oncologist, 2007,12(8):991-998.
[22]敬小梅,吴 萍,李 力,等.弥漫大B细胞淋巴瘤194例临床分析[J].肿瘤预防与治疗,2015,28(6):342-346.
[23]Lee J, Suh C, Park YH, et al. Extranodal natural killer T-cell lymphoma, nasal-type: a prognostic model from a retrospective multicenter study[J]. J Clin Oncol, 2006,24(4):612-618.
[24]Suzuki R, Yamaguchi M, Izutsu K, et al. Prospective measurement of Epstein-Barr virus-DNA in plasma and peripheral blood mononuclear cells of extranodal NK/T-cell lymphoma, nasal type[J]. Blood, 2011,118(23):6018-6022.
[25]Kim HS, Kim KH, Kim KH, et al. Whole blood Epstein-Barr virus DNA load as a diagnostic and prognostic surrogate: extranodal natural killer/T-cell lymphoma[J]. Leuk Lymphoma, 2009,50(5):757-763.
Comparison of P-GEMOX and CHOP Regimen as the First-line Treatment for Extranodal Natural Killer/T-cell Lymphoma*
Wei Wen, Wu Ping, Li Li, et al
(DepartmentofChemotherapy,SichuanCancerHospital&Institute,SichuanCancerCenter,SchoolofMedicine,UniversityofElectronicScienceandTechnologyofChina,Chengdu610041,Sichuan,China)
Objective: To compare the efficacy,long-term survival and safety between P-GEMOX and CHOP regimen in patients with extranodal natural killer/T-cell lymphoma(ENKTL), and to explore the influence factors on the prognosis of ENKTL. Methods: Clinical data of 45 patients diagnosed as ENKTL in our hospital between 2010 and 2015 were analyzed retrospectively. The overall response rate(ORR),progression free survival(PFS) and overall survival(OS) were compared between pegaspargase combined group and the conventional chemotherapy group. The prognosis analysis was also carried out.Results: Radiotherapy combined chemotherapy was the main therapeutic strategy for 28 early stage ENKTL, the ORR and CR was 85.7%(24/28) and 82.1%, respectively in total cases. In CHOP group, the ORR, CR, 2-year OS, PFS was 80.0% (12/15), 73.3%, 73.3%,and 66.7%, respectively. In P-GEMOX group, the ORR, CR, 2-year OS, PFS was 92.3% (12/13), 92.3%, 92.3%,and 92.3%, respectively. There was no significant difference of ORR, CR, 2-year OS and PFS between these two groups(P>0.05). Chemotherapy was the main therapeutic strategy for 17 advanced stage ENKTL, the ORR and CR was 41.1 % (7/17) and 17.6%, respectively in total cases. In CHOP group, the ORR, CR, 1-year OS, PFS was 12.5% (1/8), 0%, 12.5% and 0%, respectively. In P-GEMOX group, the ORR, CR, 1-year OS, PFS was 66.7% (6/9), 33.3%, 55.6% and 11.1%, respectively. There was significant difference of ORR, CR, 1-year OS and PFS between these two groups(P<0.05). Univariate analysis showed that the ECOG score of performance status, the clinical stage, B symptom, the serum level of LDH, natural killer/T-cell lymphoma international prognostic index (NKIPI), and EBER were important influence factors for overall survival(P<0.001). Multivariate analysis showed that the clinical stage was an independent predicting factor for overall survival(P<0.05). Conclusion: For early stage ENKTL patients,the efficacy of P-GEMOX regimen is not inferior to the conventional regimens like CHOP. While for the advanced stage ENKTL patients, the P-GEMOX regimen can obviously improve the efficacy and prognosis of patients comparing with the CHOP regimen. The clinical stage is the only independent predicting factor for overall survival.
Pegaspargase; Natural Killer/T-cell Lymphoma; Chemotherapy
2016- 05- 12
2016- 09- 12
*四川省卫生厅科研课题(No.090528)。
魏 雯(1985-) ,女,四川遂宁人,硕士,住院医师,主要从事淋巴瘤及常见肿瘤的临床诊治工作。
△张智慧,主任医师,硕士生导师,E-mail:13881889731@139.com
R733.4; R730.53
A
10.3969/j.issn.1674- 0904.2016.05.003
