晚期NSCLC患者βⅢ—tubulin和Tau表达与紫杉醇敏感性的关系
2016-02-20仲立新张莉范瑞郑香玉
仲立新 张莉 范瑞 郑香玉
【摘要】 目的 观察晚期非小细胞肺癌(NSCLC)患者βⅢ-tubulin和Tau 表达情况与含紫杉醇化疗敏感性的关系。方法 45例病理学确诊的晚期NSCLC患者, 化疗前对肿瘤组织采用免疫组化法检测βⅢ-tubulin和Tau表达情况, 对所有患者采用紫杉醇+铂类(顺铂或卡铂)方案化疗。观察βⅢ-tubulin和Tau表达情况与含紫杉醇化疗方案治疗非小细胞肺癌有效率之间的关系。结果 βⅢ-tubulin和Tau表达与患者性别、年龄、病理类型、临床分期及既往化疗无关。βⅢ-tubulin阴性者紫杉醇化疗有效率明显高于βⅢ-tubulin阳性者(P<0.05);Tau阴性表达者应用紫杉醇化疗的有效率示高于阳性表达者(P<0.05);βⅢ-tubulin阴性及Tau表达阴性患者应用紫杉醇化疗有效率为83.3%。结论 βⅢ-tubulin和Tau可作为晚期NSCLC患者应用紫杉醇联合方案的有效性的预测指标, 为晚期NSCLC患者的个体化治疗提供参考。
【关键词】 晚期非小细胞肺癌;微管蛋白;紫杉醇;化疗敏感性
DOI:10.14163/j.cnki.11-5547/r.2016.05.110
肺癌近年来成为全球癌症发病率最高的肿瘤, 大概有85%的为NSCLC, 因大多数肿瘤被发现时已属晚期, NSCLC总的5年生存率仅为10%~15%。化学治疗仍是NSCLC的主要治疗方法。研究显示, 晚期NSCLC应用铂类为基础联合紫杉醇等化疗方案有效率仅为30%~60%[1], 随着肿瘤分子生物学的进展, 如何精准和个体化的选择化疗药物以期获得更高的有效率, 是目前医学研究的热点。多项研究表明[2], βⅢ-tubulin和Tau 表达可能与微管蛋白结合类化疗药物的敏感性有关。本次研究运用免疫组化法对45例晚期NSCLC患者肿瘤组织内的βⅢ-tubulin和Tau表达情况进行测定, 同时化疗方案为铂类联合紫杉醇的治疗方案, 观察其表达情况与含紫杉醇化疗方案治疗非小细胞肺癌有效率之间的关系, 为临床精准及个体化疗提供依据。现报告如下。
1 资料与方法
1. 1 一般资料 选择2012年6月~2014年6月收治的45例晚期NSCLC患者, 其中男29例, 女16例, 年龄29~75岁, 中位年龄52岁。所有患者符合以下条件:①确诊为腺癌、鳞癌患者, 其中肺鳞癌25例, 肺腺癌20例;②化疗前经过相应的检查, 如胸部CT、全身骨扫描等, 确诊为ⅢB~Ⅳ期患者;③在化疗前均进行肝肾功能、心电图、血常规等常规性检查。
1. 2 治疗方案 化疗前应用免疫组化法检测45例NSCLC患者肿瘤组织中βⅢ-tubulin和Tau表达水平, βⅢ-tubulin抗体试剂盒购自Zyued公司, 阳性组化法检测。肺癌组织βⅢ-tubulin蛋白表达阳性为细胞内出现棕黄色颗粒。根据切片阳性细胞数分为:(-)阳性细胞数<10%;(+)阳性细胞数10%~25%;(++)阳性细胞数25%~75%;(+++)阳性细胞数>75%。
Tau蛋白在肿瘤组织中阴性表达为肿瘤细胞无染色, 阳性产物为棕黄色颗粒, 定位于细胞质。根据阳性细胞染色范围及强度分为4级。0为无明显阳性细胞, 无着色;(+)为阳性细胞≤25%, 着色为淡黄色;(++)为阳性细胞25%~50%, 着色为棕黄色;(+++)为阳性细胞≥50%, 着色为深褐色;(++)~(+++)为阳性;0~(+)为阴性。每张切片由3位医师盲法阅片。
1. 3 疗效评价标准 疗效评定按照实体瘤评价标准(RECIST1.0)分为完全缓解(CR)、部分缓解(PR)、进展(PD)、稳定(SD)。有效率=(CR+PR)/总例数×100%。采用CT测量病灶大小(双径测量)。毒性评价按美国NCT指定的毒性评价通用标准(CTC第3版)评价, 从停止治疗开始随诊, 每隔1~3个月重复1次, 直至患者死亡或失诊。
1. 4 统计学方法 采用SPSS11.0统计学软件对数据进行统计分析。计量资料以均数±标准差( x-±s)表示, 采用t检验;计数资料以率(%)表示, 采用χ2检验。P<0.05表示差异具有统计学意义。
2 结果
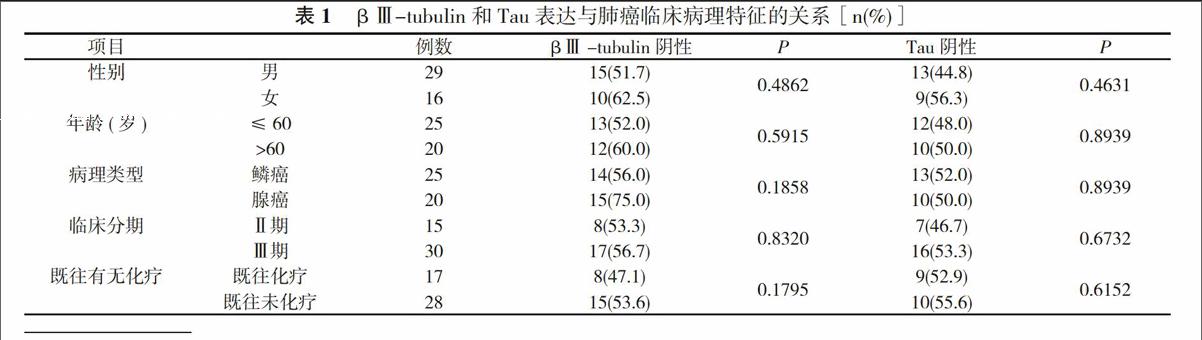
2. 1 βⅢ-tubulin和Tau表达与患者性别、年龄、病理类型、临床分期及既往化疗无关(P>0.05)。见表1。
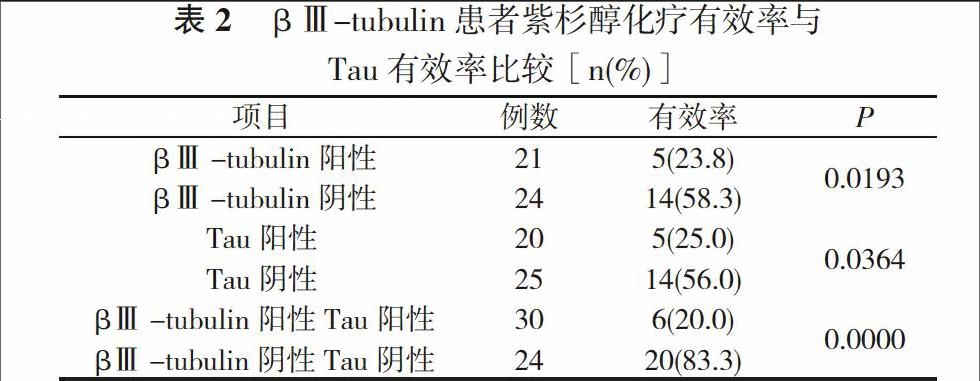
2. 2 疗效评价 βⅢ-tubulin阴性者紫杉醇化疗有效率明显高于βⅢ-tubulin阳性者(P<0.05);Tau阴性表达者紫杉醇化疗有效率高于阳性表达者(P<0.05);βⅢ-tubulin阴性及Tau阴性表达患者应用紫杉醇化疗有效率为83.3%。见表2。
表2 βⅢ-tubulin患者紫杉醇化疗有效率与
Tau有效率比较[n(%)]
项目 例数 有效率 P
βⅢ-tubulin阳性 21 5(23.8) 0.0193
βⅢ-tubulin阴性 24 14(58.3)
Tau阳性 20 5(25.0) 0.0364
Tau阴性 25 14(56.0)
βⅢ-tubulin阳性Tau阳性 30 6(20.0) 0.0000
βⅢ-tubulin阴性Tau阴性 24 20(83.3)
3 讨论
紫杉醇是一种有丝分裂抑制剂, 其可与有丝分裂的纺锤体微管上的微管蛋白有机结合, 通过促使其聚合, 抑制解聚并保持微管蛋白的稳定性, 以此来制约肿瘤细胞的有丝分裂[3]。它是目前最有效的抗肿瘤物质之一, 但并不是对所有的肿瘤有效, 同一肿瘤的不同患者, 有效率也有较大差异。研究表明βⅢ-tubulin表达与作用在微管类化疗药物的敏感性有明显的关系[4], 机制可能如下:①βⅢ-tubulin TuBB突变, 影响tubulin和紫杉醇药物的结合点, 但微管蛋白功能是不会受到影响的;②TuBB基因突变, 将微管蛋白聚合相关的微管蛋白二聚体的重要区域转变, 同时减弱了之间的相互作用, 造成微管的不稳定性。
当前国内、国外很多研究都表明了βⅢ-tubulin高表达NSCLC患者对紫杉类药物耐药, 低表达NSCLC患者对紫杉类药物敏感[5]。Sève等[5]研究发现βⅢ-tnubuli低表达NSCLC患者对紫杉类药物有效率为64.3%~78.6%, 而βⅢ-tnubuli高表达者有效率为16.7%~55.0%。与本研究发现一致, 且βⅢ-tnubulin低表达晚期和局部晚期NSCLC患者使用紫杉类药物后重获手术机会更高。
微管是细胞骨架的重要组成部分, 对细胞的有丝分裂、维持细胞形态等有重要作用。Tau基因是一个微管相关基因, 其主要的生物学作用是促进微管组装和稳定微管。Mimori等[6]发现Tau蛋白低表达的胃癌组织对紫杉醇化疗敏感性良好, 推测低浓度Tau蛋白环境中, 紫衫醇药物分子容易与微管蛋白结合。国内也有多个研究表明Tau基因与紫杉醇的敏感性有关。此次的研究表明, Tau基因表达阴性的晚期NSCLC患者, 应用紫杉醇化疗的敏感性高于Tau基因阳性表达者, 提示Tau基因可作为紫杉醇疗效的预测因子, 为临床肺癌个体化治疗提供依据。
综上所述, 紫杉醇化疗的敏感性与多种因素相关, 多种基因的表达水平不同影响着肿瘤化疗药物的疗效, βⅢ-tubulin和Tau蛋白表达情况可作为预测含紫杉醇化疗方案有效性和指导患者个体化化疗的指标。
参考文献
[1] 吴平平, 李苏宜.紫杉醇耐药与β微管蛋白的研究进展.临床肿瘤学进杂志, 2008, 13(8):45-46.
[2] 杨全良, 将华蔚.紫杉醇耐药与β-微管蛋白Ⅲ研究进展.肿瘤研究与进展, 2001, 23(2):137.
[3] 杨俊泉, 高献书.Ⅵ期非小细胞肺癌组织表达与紫杉醇类化疗耐药.第四军医大学学报, 2008, 29(10):930.
[4] Sève P, Reiman T, Dumontet C. The role of betaIII tubulin in predicting chemoresistance in non-small cell lung cancer. Lung Cancer, 2010, 67(2):136-143.
[5] Sève P, Dumontet C. Is class Ⅲ beta-tubulin a predictive factor in patients receiving tubulin-binding agents? Lancet Oncol, 2008, 9(2):168-175.
[6] Mimori K, Sadanaga N, Yoshikawa Y. et al. Reduced tau expression in gastric cancer can identify candidates for successfal paclitaxel treatment. British Journal of Cancer, 2006, 94(12):1894-1897.
[收稿日期:2015-09-17]
