酵素中一株高产酸醋酸菌的鉴定及其产酸特性
2016-02-18卢梦瑶刘书亮胡凯弟张艾青
卢梦瑶 刘书亮,胡凯弟 张艾青
(1. 四川农业大学食品学院,四川 雅安 625014;2. 四川农业大学食品加工与安全研究所,四川 雅安 625014;3. 山东畜牧兽医职业学院食品与药品科技系,山东 潍坊 261061)
酵素中一株高产酸醋酸菌的鉴定及其产酸特性
卢梦瑶1刘书亮1,2胡凯弟2张艾青3
(1. 四川农业大学食品学院,四川 雅安 625014;2. 四川农业大学食品加工与安全研究所,四川 雅安 625014;3. 山东畜牧兽医职业学院食品与药品科技系,山东 潍坊 261061)
以10种酵素样品为菌源,经分离纯化、产酸定性和定量试验,获得1株高产酸量醋酸菌LMY-1,对其形态学、生理生化指标测定及16S rDNA鉴定,确定其为芝庇侬醋酸杆菌(Acetobactercibinongensis);以苹果、梨、黄瓜作为果蔬培养基,研究菌株LMY-1的产酸特性。结果表明,菌株LMY-1的最适产酸温度为30 ℃;菌株LMY-1在乙醇含量为4 mL/100 mL时,产酸量最高(22.72 g/L),比对照菌株CICC7015 (Acetobacterpasteurianussubsp.pasteurianus) (19.05 g/L)产酸量高;在底酸浓度为1~5 mL/100 mL时,菌株LMY-1和菌株CICC7015的产酸量随发酵时间的变化趋势均先减少后增加再减少;相同条件下,菌株LMY-1产酸速率优于菌株CICC7015;两菌株均产2种有机酸,分别是乙酸和草酸,且乙酸量远高于草酸量。菌株LMY-1更适宜于果蔬酵素的酿造。
酵素;醋酸菌;鉴定;产酸
酵素即指以一种或多种新鲜蔬菜、水果、菌菇、中草药等作为原料,经多种有益菌发酵,得到的具有丰富维生素、酶、矿物质和次生代谢产物等营养成分的功能性发酵产品[1]。一般为高酸性或酸性食品,既能提高发酵底物自身的营养价值,也能作为食品添加剂和功能成分应用于食品加工生产[2]。酵素有改善肠胃功能[3]、抗氧化[4]、消炎、抗菌、促进细胞新生[5-6]、降血压、降血脂[7-8]等功效。
有益菌的种类及其特性对酵素的发酵过程至关重要[9]。有益菌通过自身的中间代谢,使发酵基质产生一系列复杂的生物化学变化,从而实现三大物质(糖类、脂质、蛋白质)之间的相互转化,或为产生新的生理物质(活性维生素和活性酶等)提供前体物质[10]。
目前,已从酵素产品中分离出多种有益菌,如醋酸菌[11]、酵母菌[12-13]、乳酸菌[14]等,而对有益菌在酵素中的特性等的进一步研究基本上都是针对酵母菌的:赵光远等[15]、江忠丽等[16]分别以红枣、大米为主要原料,均研究了酵母菌的接种量、时间和温度3个因素对相应酵素饮料生产的影响。对在酵素中主导产酸的醋酸菌的相关报道却很少,醋酸菌是酵素发酵过程中的一大类产酸细菌,清楚醋酸菌的种类及发酵特性有助于合理控制酵素发酵进程,有效提高酵素的风味品质,因此研究酵素中醋酸菌及其产酸特性十分必要。
本试验旨在从酵素样品中分离出具有高产酸能力的醋酸菌,研究其在果蔬培养基中的产酸特性,为酵素生产提供菌种资源和依据。
1 材料与方法
1.1 菌源
本试验选用了不同蔬菜、水果及中草药等10种酵素样品作为菌种来源,具体见表1,样品1~4号来自四川省泸州市古蔺县的某公司,5~10号来自四川省绵阳市的某公司。
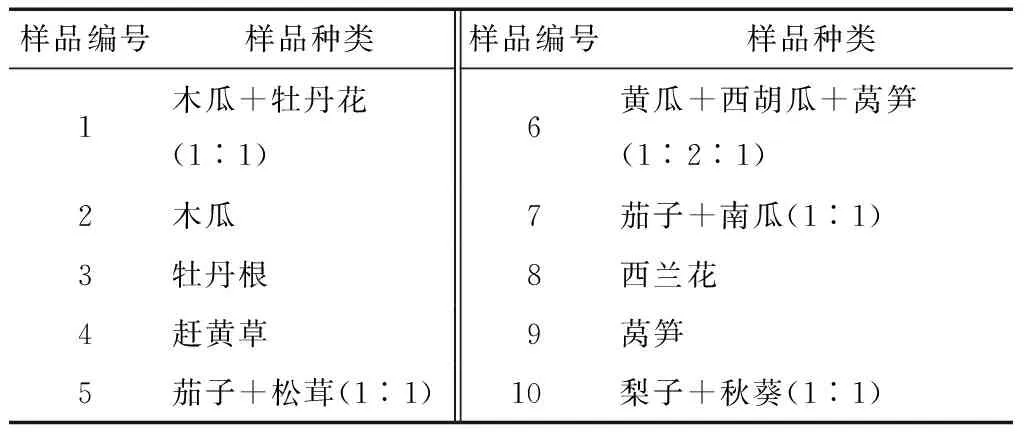
表1 10种不同原料的酵素样品†
† 样品种类一列括号中的数据为质量比。
1.2 菌种
植物乳杆菌(Lactobacillusplantarum) P158:由四川农业大学食品微生物实验室分离鉴定并保藏;
巴氏醋杆菌巴氏亚种(Acetobacterpasteurianussubsp.pasteurianus) CICC7015:中国工业微生物菌种保藏中心。
1.3 培养基
基础培养基(用于醋酸菌的分离纯化及保藏):酵母膏10 g,葡萄糖10 g,水1 000 mL,自然pH,使用前加入无水乙醇3 mL/100 mL;其固体培养基添加CaCO32 g/100 mL,琼脂粉2 g/100 mL,121 ℃灭菌20 min;
产酸培养基:同基础培养基,但使用前改为加无水乙醇5 mL/100 mL,121 ℃灭菌20 min;
Hoyer-Frateur培养基:无水乙醇3 mL/100 mL,(NH4)SO40.1 g/100 mL, K2HPO40.1 g/100 mL,KH2PO40.01 g/100 mL, MgSO4·7H2O 0.025 g/100 mL,FeCl30.000 5 g/100 mL,121 ℃灭菌15 min;
生酮试验培养基:甘油3 mL/100 mL,酵母膏3 g/100 mL,琼脂粉2 g/100 mL,121 ℃灭菌15 min;
产5-酮基葡萄糖酸盐培养基:葡萄糖3 g/100 mL,碳酸钙2 g/100 mL,酵母膏1 g/100 mL,琼脂粉2 g/100 mL,121 ℃ 灭菌15 min;
硝酸盐培养基:KNO30.02 g/100 mL,蛋白胨0.5 g/100 mL,pH 7.4,121 ℃灭菌15 min。
1.4 主要试剂
无水乙醇、FeCl3·6H2O、NaOH、酚酞:分析纯,成都市科龙化工试剂厂;
邻苯二甲酸氢钾:分析纯,成都金山化学试剂有限公司;
过氧化氢、盐酸二甲基对苯二胺、甲萘胺:分析纯,天津市福晨化学试剂厂;
对氨基苯磺酸、乙酸、α-萘酚:分析纯,天津市光复精细化工研究所;
乙酸、乳酸、草酸、柠檬酸、酒石酸、丙酮酸、苹果酸、琥珀酸:色谱纯,Sigma-Aldrich(上海)贸易有限公司;
2×Premix TaqTM、DNA Marker DL2000、琼脂糖:宝生物工程(大连)有限公司;
TIANamp Bacteria DNA Kit试剂盒:天根生化科技(北京)有限公司;
GoldviewTMDNA染料:上海赛百盛基因技术有限公司。
1.5 仪器
液相色谱仪:LC-2010C HT型,配可变波长紫外检测器(UV),LC-Solution工作站,日本Shimazu公司;
PCR仪:T100TMThermal Cycler型,美国Bio-Rad公司;
凝胶成像系统:Gel Doc XR型,美国Bio-Rad公司;
酸度计:PHS-4C+型,成都世纪方舟科技有限公司;
高速台式冷冻离心机:TGL-16G型,上海菲恰尔分析仪器有限公司;
超纯水系统:Milli-Q Gradient型,美国Millipore公司。
1.6 试验方法
1.6.1 高产酸醋酸菌的分离
(1) 醋酸菌的分离纯化:分别取表1中不同种类的样品10 g于液体基础培养基中,分装100 mL/500 mL锥形瓶,振荡培养48 h富集;梯度稀释后涂布,30 ℃培养72 h;选出溶钙圈明显且菌落形态不同的优势菌落,多次划线以纯化;再以植物乳杆菌P158和醋酸菌CICC7015分别作为阳性和阴性对照菌株,进行革兰氏染色反应并镜检,选出符合醋酸菌菌落特征的革兰氏阴性菌株,-20 ℃甘油保藏。除特别说明,试验中振荡培养的条件均为30 ℃、140 r/min。
(2) 菌种活化及种子液的制备:取上述保藏菌株划线于基础培养基斜面,30 ℃培养48 h;用5 mL无菌生理盐水将斜面上的菌苔洗下,调整细胞浓度至108CFU/mL,作为种子液。
(3) 产酸定性试验:将种子液按10 mL/100 mL接种于产酸培养基,分装30 mL/250 mL锥形瓶,振荡培养72 h;取5 mL培养液离心(8 000 r/min,5 min),以1.0 mol/L NaOH 溶液调pH至7.0,滴加5~6滴5 g/100 mL FeC13溶液并摇匀,观察溶液是否变成黄褐色;再置于酒精灯火焰上加热至沸腾,若形成红褐色沉淀,即判定为产酸菌。
(4) 产酸定量试验:同上述1.6.1(3)步骤接种(无水乙醇调整为5%)并分装,振荡培养72 h后测定产酸量,确定产酸量高的菌株。向50 mL蒸馏水中加入2 mL发酵液,以3~5滴酚酞为指示剂,用标定的0.1 mol/L NaOH溶液滴定溶液至呈浅粉色并记录数据。按式(1)计算产酸量P(即净增酸,以醋酸计):
(1)
式中:
P——产酸量,g/L;
V——发酵液样品滴定消耗的 NaOH 量,mL;
V0——以空白培养基为对照滴定消耗的 NaOH 量,mL;
CNaOH——NaOH 标准溶液浓度,mol/L;
60——乙酸的相对分子质量,g/mol;
V样——样品的取样量,mL。
1.6.2 菌株鉴定
(1) 形态学指标:将供试菌株于醋酸菌平板上划线,于30 ℃培养箱培养48 h后,观察并记录其菌落特征;挑取平板上的单菌落(30 ℃,48 h)进行革兰氏染色,在显微镜下观察并记录颜色、形状、大小、排列等特征。
(2) 生理生化指标:以菌株CICC7015作为对照,对菌株LMY-1进行鉴定[17]。
(3) 16S rDNA的扩增和系统发育树的构建:细菌基因组DNA的提取:挑取供试菌株单菌落于20 mL基础培养基中,振荡培养20 h,离心(10 000 r/min,1 min)收集菌体;按TIANamp Bacteria DNA Kit 试剂盒进行提取。16S rDNA基因的PCR扩增:以菌株基因组DNA为模板,选择细菌通用引物(27F:5'-AGAGTTTGATCCTGGCTCAG-3';1492R:5'-TACGGCTACCTTGTTACGACTT-3')扩增16S rDNA基因。25 μL PCR反应体系:模板DNA 1.0 μL,上下游引物(10 μmol/L)各1 μL,2×Premix TaqTM(TaKaRa TaqTMVersion 2.0) 12.5 μL,超纯水9.5 μL。同时进行有模板DNA不加引物和有引物不加模板DNA的处理作为对照。设置PCR反应条件为:94 ℃预变性5 min,然后经30个循环(94 ℃ 变性45 s,56 ℃退火45 s,72 ℃延伸90 s),最后72 ℃ 延伸10 min,4 ℃保存。琼脂糖凝胶电泳:PCR产物经1% (1×TAE)琼脂糖凝胶电泳检测后,观察并成像。扩增产物测序及分析:将PCR产物送成都擎科梓熙生物技术有限公司测序,在Genbank上提交结果,BLAST进行同源性比对,运用MEGA5.2构建系统发育树。
1.6.3 菌株的产酸特性
(1) 果蔬培养基的制备:取苹果、梨、黄瓜3种材料洗净去杂,榨取汁液,称重后分别取等质量汁液混合,加水稀释至葡萄糖含量约为1 g/100 mL,经115 ℃高压灭菌20 min,作为发酵培养基,使用前添加3 mL /100 mL 无水乙醇。
(2) 接种、分装:将目标菌株种子液按10 mL /100 mL 的接种量接入果蔬培养基,除特别说明,按100 mL/300 mL分装于锥形瓶。
(3) 菌株的适应性:主要对温度、乙醇浓度和底酸浓度3个因素对菌株在果蔬培养基中产酸量的影响进行试验。① 菌株对不同温度的适应性:接种,分装,分别于28,30,35,37,40 ℃,置于振荡培养箱,140 r/min培养72 h,按1.6.1(4)测定产酸量。② 菌株对不同浓度乙醇的适应性:接种,分装,无水乙醇含量分别调整为1,2,3,4,5 mL /100 mL,置于振荡培养箱,振荡培养72 h,按1.6.1(4)测定产酸量。③ 菌株对不同浓度底酸的适应性:接种,分装,底酸(乙酸∶乳酸质量比1∶1)总量分别为1,2,3,4,5 mL /100 mL,振荡培养72 h,按1.6.1(4)测定产酸量。
菌株生长曲线的测定:接种,分装,振荡培养72 h,于600 nm 波长下测定OD值,前24 h每2 h测定一次,之后每4 h测定一次。
(4) 菌株的产酸特性:产酸曲线:接种,分装,振荡培养7 d,间隔24 h测定产酸量,以发酵时间、产酸量分别作为横、纵坐标绘制产酸曲线。产有机酸特性:接种,分装,振荡培养7 d后将发酵液离心(12 000 r/min,10 min),取上清液通过0.45 μm水相滤膜,弃去初滤液,取续滤液供高效液相色谱(HPLC)检测用[18-19]。按1 mL溶液中分别含2.5 mg草酸、25 mg乳酸、15 mg柠檬酸、30 mg乙酸、15 mg苹果酸、15 mg 琥珀酸和25 mg酒石酸,配制有机酸标准品混合溶液,分别取标准混合液10,20,50,75,100 μL,定容至1 mL,配制成不同浓度的混合标液,HPLC分析获得各有机酸的线性方程。色谱条件:色谱柱为Sepax HP-C18柱(4.6 mm×250 mm,5 μm);流动相为体积比为5∶95的乙腈—0.05 mol/L KH2PO4溶液(磷酸调节pH至2.5);流速0.6 mL/min;检测波长210 nm;柱温25 ℃;进样体积10 μL。
2 结果与分析
2.1 高产酸醋酸菌的分离
2.1.1 醋酸菌的分离纯化 从10种不同原料的酵素样品中稀释分离与纯化后获得了10株优势菌,其中有革兰氏阴性菌9株。
2.1.2 产醋酸定性试验 经产酸定性试验,确定9株革兰氏阴性菌中有5株菌可以产生明显的红褐色沉淀,判定为产醋酸菌株。
2.1.3 产酸定量试验 从不同原料自然发酵的酵素中分离纯化得到5株产酸菌株,其产酸量分别为:(0.700±0.155),(1.400±0.062),(1.030±0.093),(16.590±0.124),(0.190±0.000) g/L。其中源于梨+秋葵酵素中的菌株编号为LMY-1,产酸量为(16.590±0.124) g/L,具有较高产酸能力,因此选择该菌株作为后续试验的研究对象。
2.2 菌株鉴定
2.2.1 菌株LMY-1的形态学特征 菌株LMY-1在醋酸菌碳酸钙平板上的菌落形态及镜检的个体形态(×1 000)见图1。菌落呈米白色,较小,圆形、光滑、中间隆起、边缘整齐;经革兰氏染色镜检观察,其个体形态呈短杆状、链状排列,呈革兰氏阴性。
2.2.2 菌株的生理生化特性 以菌株CICC7015作为对照,对菌株LMY-1进行了生理生化指标测定,由表2可知,菌株LMY-1和CICC7015均不能在Hoyer-Frateur培养基上生长,接触酶阳性,氧化酶阴性。能利用正丙醇、正丁醇、D-葡萄糖产酸。均不能产5-酮基葡萄糖酸盐和纤维素,但可以产醋酸和2-酮基葡萄糖酸盐。
Table 2 Physiological and biochemical characteristics of two strains of acetic acid bacteria
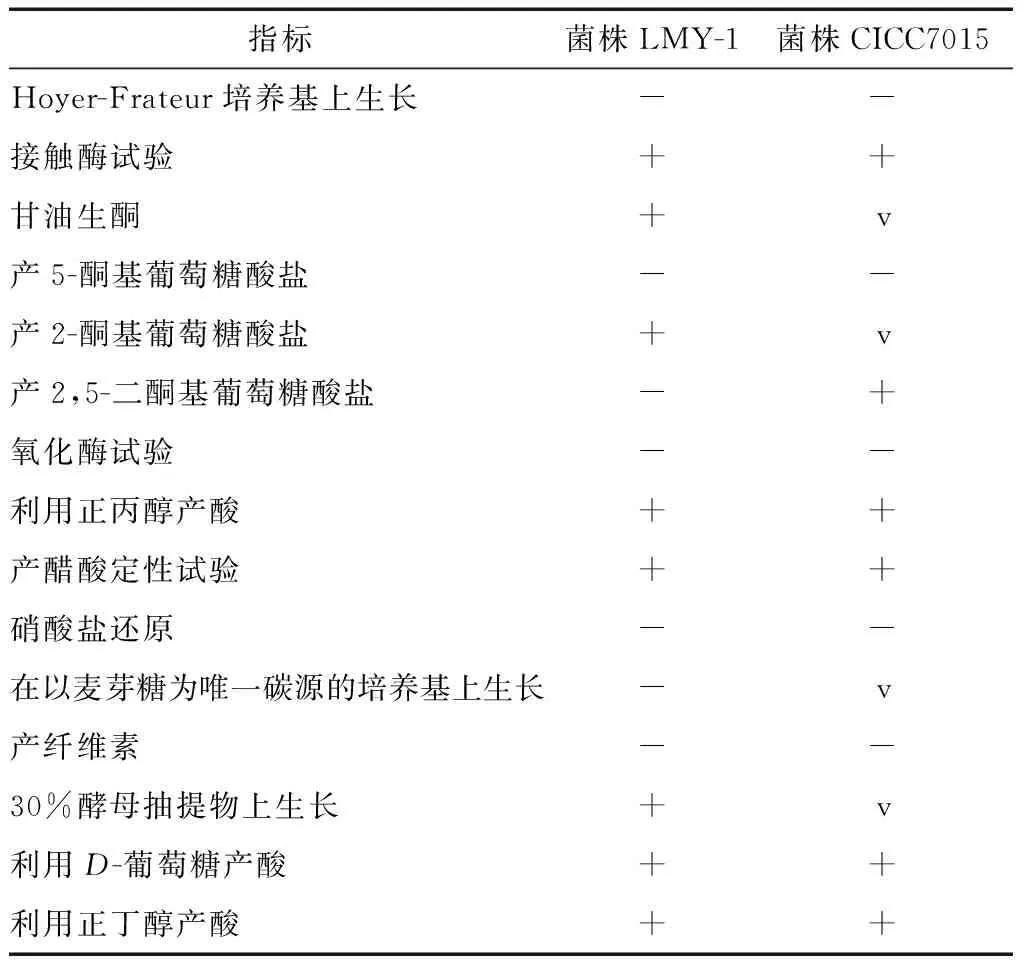
指标菌株LMY-1菌株CICC7015Hoyer-Frateur培养基上生长--接触酶试验++甘油生酮+v产5-酮基葡萄糖酸盐--产2-酮基葡萄糖酸盐+v产2,5-二酮基葡萄糖酸盐-+氧化酶试验--利用正丙醇产酸++产醋酸定性试验++硝酸盐还原--在以麦芽糖为唯一碳源的培养基上生长-v产纤维素--30%酵母抽提物上生长+v利用D-葡萄糖产酸++利用正丁醇产酸++
† “+”为阳性;“-”为阴性,“v”为多变的。
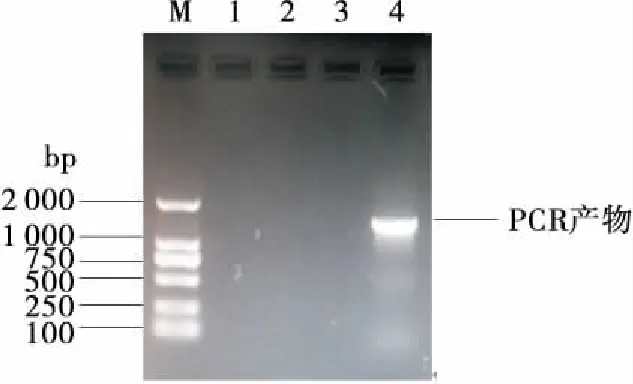
M. Marker 1. 有模板,无引物 2、3. 单侧引物,无模板 4. LMY-1的PCR产物
图2 菌株LMY-1的16S rDNA的PCR产物的琼脂糖凝胶电泳图
Figure 2 Agarose gel electrophoresis of 16S rDNA gene PCR products of strain LMY-1
2.2.3 16S rDNA鉴定 由图2可知,LMY-1菌株16S rDNA 的PCR扩增产物测得的片段大小在1 500 bp左右,其在GenBank上的登录号为KX214607。采用BLAST软件在Genbank数据库中进行序列比对,并对菌株LMY-1构建系统发育树(见图3),分析表明,菌株LMY-1的16S rDNA基因序列与登录号为AB052710.1的Acetobactercibinongensis4H-1高度同源,相似度达99%,与其他芝庇侬醋酸杆菌亦具有相似的系统发育关系[20]。根据形态学、生理生化指标及16S rDNA序列分析可判定菌株LMY-1为芝庇侬醋酸杆菌(Acetobactercibinongensis)。

图3 菌株LMY-1的系统发育树
2.3 菌株LMY-1的产酸特性
2.3.1 菌株的适应性
(1) 菌株对不同温度的适应性:由图4可知,在28~40 ℃ 时,菌株CICC7015、LMY-1的产酸量均呈现先增加后减少的趋势,并在30 ℃达到最高值,与Chen Yang等[21]对醋酸菌可耐受温度的研究结果基本一致,菌株LMY-1的产酸量高于菌株CICC7015的产酸量,同时两菌株的产酸量在28~40 ℃时波动较大,对温度的适应范围窄。
(2) 菌株对不同乙醇浓度的适应性:由图5可知,随着乙醇浓度的升高,菌株的产酸量均呈先增后减的趋势。其中,菌株LMY-1对乙醇的耐受性较好,在乙醇含量4%时,产酸量最高(22.72 g/L),其比对照菌株CICC7015(4%,19.05 g/L)产酸量大,且略优于菌株CICC7015(3%,21.85 g/L),可能与菌株本身氧化乙醇的性能有关;产酸量随乙醇含量的进一步增大逐渐降低,说明菌株的产酸性能受较高含量乙醇的抑制[22]。 (3) 菌株对不同浓度底酸的适应性:为排除在同一总底酸浓度因素下,乙酸和乳酸质量不同产生影响,因此试验保证二者质量比为1∶1,底酸除选用乙酸外还选用了乳酸,原因是:① 酵素中存在乳酸发酵;② 底酸的促进作用来源于醋酸根,而不是pH的降低,一定量的乙酸对醋酸菌的氧化产酸能力有促进作用,而乳酸则抑制醋酸菌产酸[23]。如图6所示,2株菌均能耐受5 mL/100 mL底酸;在底酸浓度为1 mL/100 mL时,产酸量最高,且菌株LMY-1的产酸量略高于菌株CICC7015。因此可解释:底酸浓度为1~2 mL/100 mL时,菌株LMY-1的产酸量大幅度减少,可能是乙酸对醋酸菌氧化产酸能力的促进作用小于乳酸对醋酸菌的抑制作用;底酸浓度为3~4 mL/100 mL时,产酸量略升高,可能是此时乙酸的促进作用大于乳酸的抑制作用;在底酸浓度大于4 mL/100 mL时,因底酸浓度过高反馈抑制醋酸菌的产酸量[24]。两菌株的产酸趋势接近,说明两种菌对底酸浓度的适应性规律相似,此结果表明,在果蔬酵素生产时,可排除底酸浓度对选择不同菌种的限制。
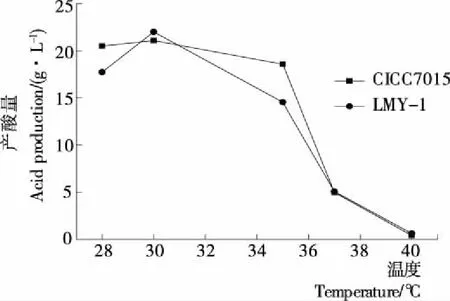
图4 两株醋酸菌对不同温度的适应性
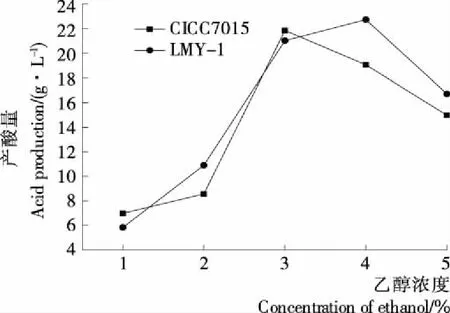
图5 两株醋酸菌对不同乙醇浓度的适应性
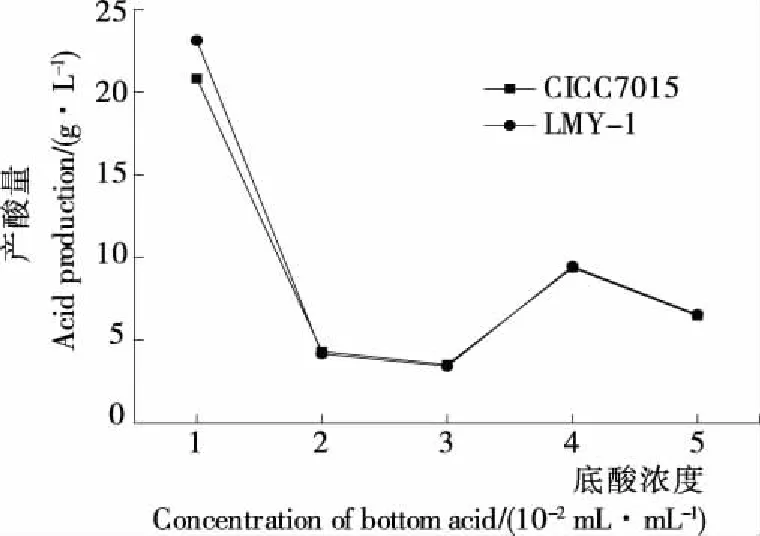
图6 两株醋酸菌对不同浓度底酸的适应性
(4) 菌株的生长曲线:由图7可知,菌株LMY-1的OD值在0~2 h基本不变,2~48 h快速上升,48~72 h基本不变,其对数生长期为2~48 h。菌株LMY-1比菌株CICC7015的生长速率和生长量均大,说明菌株LMY-1更适宜于该条件。
2.3.2 产酸特性
(1) 菌株的产酸曲线:由图8可知,菌株LMY-1的产酸量在0~6 d迅速增加,6~10 d缓慢增加,10~13 d缓慢减少趋势,13~14 d缓慢增加。对照菌株CICC7015在0~7 d迅速增加,7~12 d呈缓慢减少趋势,12~14 d迅速减少。在0~7 d内,菌株CICC7015产酸速率略优于菌株LMY-1,但此后,菌株LMY-1产酸速率处于稳中有升趋势,而菌株CICC7015产酸速率开始不断下降,表明菌株LMY-1的产酸速率及对环境的适应性优于菌株CICC7015。
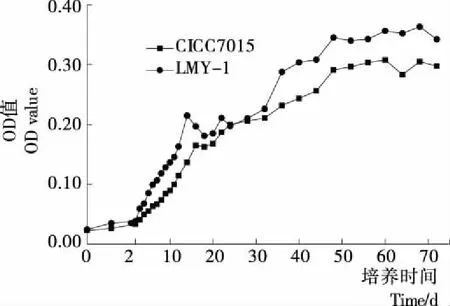
图7 两株醋酸菌的生长曲线
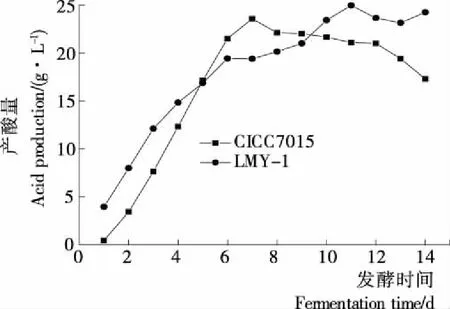
图8 两株醋酸菌的产酸曲线
(2) 菌株产有机酸特性:由表3可知,7种有机酸标准品能够达到较好的分离效果,且其标准曲线相关系数均在0.999 0±0.003 0范围内,表明7种有机酸的峰面积和浓度有较好的线性相关性,此条件下可以确保菌株发酵液中有机酸检测的可靠性。
菌株LMY-1被检出产2种有机酸,即乙酸和草酸,其中产乙酸量最高。与空白相比,发酵液中的酒石酸、苹果酸、柠檬酸含量均降低,可能是醋酸菌在醋酸发酵过程中利用消耗酒石酸、苹果酸、柠檬酸较多,而产生和积累草酸[25]。与朱其瀚等[26]从镇江恒顺醋厂的醋醅中分离出1株巴氏醋杆菌能产生乳酸、乙酸、酒石酸3种有机酸不同,可能与培养基成分、醋酸菌种、发酵方法、生产工艺等因素有关[27]。
3 结论
本研究从多种酵素中分离出一株较高产醋酸菌株LMY-1,确定为芝庇侬醋酸杆菌(Acetobactercibinongensis)。B Haghshenas等[28]对从豆腐中分离出的芝庇侬醋酸杆菌进行了益生菌评估,证实了其可以作为益生菌用于食品工业。本试验结果表明,相同条件下,菌株LMY-1在基础培养基中产酸量(23.21 g/L)小于菌株CICC7015在其中的产酸量(25.96 g/L),但是,在果蔬培养基中,菌株LMY-1的产酸量要高于菌株CICC7015的产酸量,因此,在同等条件下菌株LMY-1更适合于果蔬酵素的酿造。
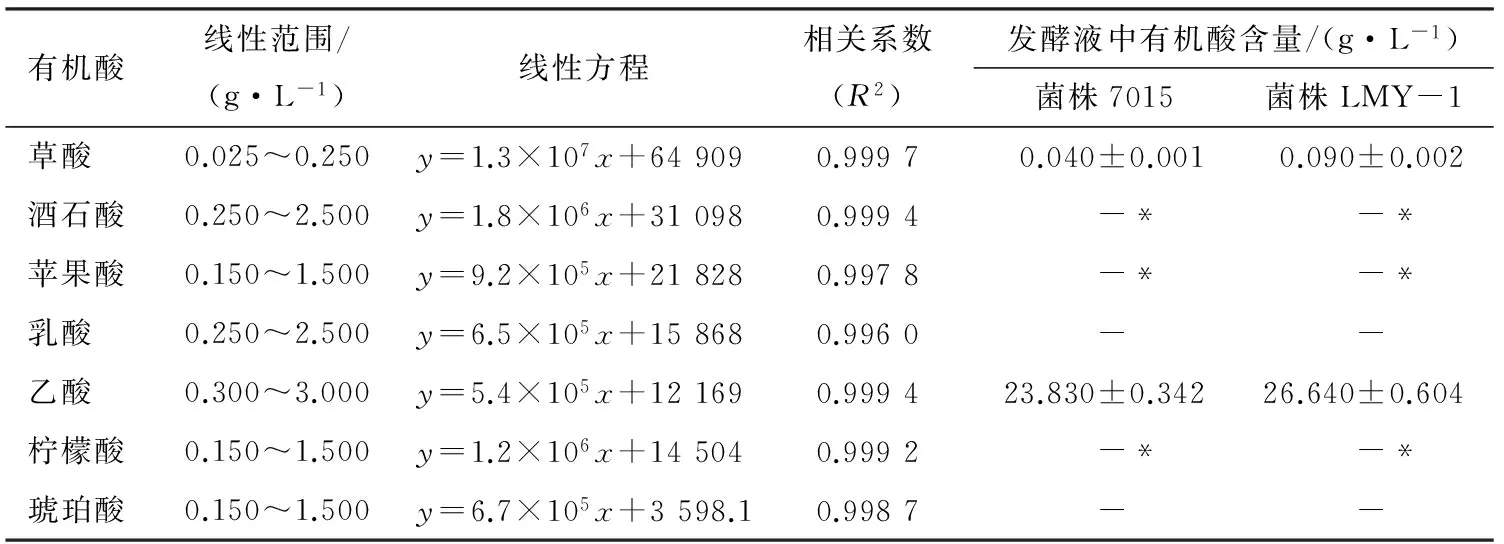
表3 7种有机酸标准曲线线性相关性及菌株发酵液中产有机酸的含量†
† “-*”表示发酵液减去空白值后对应有机酸为负值;“-”表示未检出。
目前,国内外关于芝庇侬醋酸杆菌的专门报道甚少,仅见针对分离出的醋酸菌进行多相分类学研究[29]的同时,提到了芝庇侬醋酸杆菌的生化特性[30-31]。菌株LMY-1在模拟酵素中的产酸特性研究,为其实际应用提供了数据参考。
本试验仅对温度、乙醇浓度和底酸浓度3个因素进行了研究,具有一定局限性,进一步可对醋酸菌的接种量、模拟酵素基质成分等其他因素进行试验。
[1] 毛建卫, 吴元锋, 方晟. 微生物酵素研究进展[J]. 发酵科技通讯, 2010, 39(3): 42-44.
[2] 刘加友, 王振斌. 微生物酵素食品研究进展[J]. 食品与发酵工业, 2016, 42(1): 273-276.
[3] 刘洪. 猕猴桃果汁润肠通便和排铅功能研究[D]. 长沙: 湖南农业大学, 2007: 23-28.
[4] 蒋增良, 毛建卫, 黄俊, 等. 葡萄酵素在天然发酵过程中体外抗氧化性能的变化[J]. 中国食品学报, 2014, 14(10): 29-34.
[5] 曲佳乐, 赵金凤, 皮子凤, 等. 植物酵素解酒护肝保健功能研究[J]. 食品科技, 2013, 38(9): 51-54.
[6] 董银卯, 于晓艳, 潘妍, 等. 生物酵素抑菌功效研究[J]. 香料香精化妆品, 2008, 8(4): 27-29.
[7] 牛广财, 朱丹, 李志江, 等. 我国糙米酵素的研究进展[J]. 中国酿造, 2010(1): 12-14.
[8] 何嘉欣. 台湾酵素营养保健品产业现状分析[J]. 海峡科技与产业, 2013(10): 77-82.
[9] 陈英, 余雄伟, 龚文发, 等. 植物酵素发酵特性及风味物质变化的研究[J]. 饮料工业, 2015, 18(2): 9-12.
[10] LIU C H, HSU W H, LEE F L, et al. The isolation and identification of microbes from a fermented tea beverage, Haipao, and their interations during Haipao fermentation[J]. Food Microbiology, 1996, 13(6): 407-415.
[11] 王硕. 醋酸菌的分离与鉴定以及红茶菌培养的研究[D]. 合肥: 安徽农业大学, 2008: 26-30.
[12] TEOH A L, HEARD G, COX J. Yeast ecology of Kombucha fermentation[J]. Int. J. Food Microbio, 2004, 95(2): l19-126.
[13] 刘灏, 祁建民. 若干果蔬酵素酵母菌菌株的分离与鉴定[J/OL]. 北京: 中国科技论文在线[2015-05-13]. http://www.paper.edu.cn/releasepaper/content/201505-148.
[14] 谭明, 马麦生, 张国平, 等. 酵素菌中乳酸菌的分离鉴定[J]. 潍坊医学院学报, 2002, 24(2): 88-90.
[15] 赵光远, 梁晓童, 陈美丽. 红枣酵素饮料的研制[J]. 食品工业, 2015, 36(9): 124-128.
[16] 江忠丽, 王俊伟, 庞文录, 等. 糙米酵素红曲酒发酵工艺的研究[J]. 粮食与饲料工业, 2013(3): 34-37.
[17] 布坎南, 吉本斯. 伯杰细菌鉴定手册[M]. 北京: 科学出版社, 1984: 362-366.
[18] 田辉, 懿琳, 周元良, 等. 高效液相色谱法测定酸奶中四种有机酸[J]. 食品与机械, 2012, 28(5): 87-90.
[19] 丁仁君, 夏延斌. 葡萄酒中的有机酸及检测方法研究进展[J]. 食品与机械, 2014, 30(1): 243-247.
[20] NANDA K, TANIQUCHI M, UJIKE S, et al. Characteriz-ation of acetic acid bacteria in traditional acetic acid ferment-ation of rice vinegar (komesu) and unpolished rice vinegar (kurosu) produced in Japan[J]. Appl Environ Microbiol, 2001, 67(2): 986-990.
[21] CHEN Yang, BAI Ye, LI Dong-sheng, et al. Screening and characterization of ethanol-tolerant and thermotolerant acetic acid bacteria from Chinese vinegar Pei[J]. World Journal of Microbiology and Biotechnology, 2016, 32(14): 1-9.
[22] 侯小歌, 杜红阳, 李学思. 宋河大曲中醋酸菌的分离鉴定及产酸特性[J]. 中国酿造, 2011, 30(4): 112-115.
[23] 王丽丽, 仪宏, 沙慧琴, 等. 醋酸菌生长的营养需求及产酸的促进作用研究[J]. 中国调味品, 2004, 6(6): 3-6.
[24] 张波, 李明元, 张子沛, 等. 底酸(乙酸)浓度对醋酸菌产酸量的影响[J]. 中国食品工业, 2008, 5(4): 38-39.
[25] 陈义伦, 裘立群, 陈伟, 等. 原汁苹果醋中的有机酸[J]. 食品与发酵工业, 2004, 30(8): 92-95.
[26] 朱其瀚. 镇江香醋发酵过程中微生物分离及其产酸特性[D]. 无锡: 江南大学, 2008: 27-33.
[27] 曹小彦, 夏延斌, 汪辉, 等. 南北方葡萄酒中有机酸的研究[J]. 食品与机械, 2013, 29(1): 45-48.
[28] HAGHSHENAS B, NAMI Y, ABDULLAH N, et al. Potentially probiotic acetic acid bacteria isolation and identification from traditional dairies microbiota[J]. International Journal of Food Science and Technology, 2015, 50(4): 1 056-1 064.
[29] 冯静, 施庆珊, 欧阳友生, 等. 醋酸菌多相分类研究进展[J]. 微生物学通报, 2009, 36(9): 1 390-1 396.
[30] ILSE C, NICHOLAS C, KATRIEN E, et al.Acetobacterghanensissp. nov., a novel acetic acid bacterium isolated from traditional heap fermentations of Ghanaian cocoa beans[J]. International Journal of Systematic and Evolutionary Microbiology, 2007(57): 1 647-1 652.
[31] ILSE C, ANGEL G, NICHOLAS C, et al.Acetobacterfabarumsp. nov., an acetic acid bacterium from a Ghanaian cocoa bean heap fermentation[J]. International Journal of Systematic and Evolutionary Microbiology, 2008(58): 2 180-2 185.
Identification of a strain of high yieldacetic acid bacteria from ferment and its acid-producing characteristics
LU Meng-yao1LIUShu-liang1,2HUKai-di2ZHANGAi-qing3
(1.CollegeofFoodScience,SichuanAgriculturalUniversity,Ya’an,Sichuan625014,China; 2.ResearchInstituteofFoodProcessingandSecurity,SichuanAgriculturalUniversity,Ya’an,Sichuan625014,China; 3.DepartmentofFoodandDrugScienceandTechnology,ShandongVocationalAnimalScienceandVeterinaryCollege,Weifang,Shandong261061,China)
A strain of high yield acetic acid bacteria LMY-1 was isolated from 10 kinds of ferment samples by isolation and purification, the acid qualitative and quantitative screen for producing. The strain was identified asAcetobactercibinongensisby analysis of morphology, physiological and biochemical indicators and identification of 16S rDNA. The growth and acid-producing characteristics of strain LMY-1 was studied by fruit and vegetable culture medium with apple, pear and cucumber. Results, the optimum acid temperature for strain LMY-1 was 30 ℃; In 4 mL/100 mL ethanol content, strain LMY-1 produced the highest acid amount (22.72 g/L), higher than strain CICC7015(Acetobacterpasteurianussubsp.pasteurianus)(19.05 g/L); When the bottom acid concentration of 1~5 mL/100 mL, the acid-producing amount of strain LMY-1 and strain CICC7015 decreased first, then increased and decreased again with the change of fermentation time; In the same condition, the acid-producing rate of strain LMY-1 was better than that of strain CICC7015; Both strains produce 2 kinds of organic acid, which included acetic acid and oxalic acid, and acetic acid content was much higher than oxalic acid. Strain LMY-1 is suitable for fruit and vegetable ferment production.
ferment; acetic acid bacteria; identification; acid production
10.13652/j.issn.1003-5788.2016.12.014
四川省农业科技成果转化资金项目(编号:14NZ0012)
卢梦瑶,女,四川农业大学在读本科生。
刘书亮(1968-),男,四川农业大学教授,博士。 E-mail: lsliang999@163.com
2016—09—26
